优化黑曲霉柠檬酸生产菌株原生质体形成条件及表达系统的建立
殷 娴, 庞冬洽, 韩瑞枝, 李江华, 刘 龙, 堵国成, 陈 坚*
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122)
优化黑曲霉柠檬酸生产菌株原生质体形成条件及表达系统的建立
殷娴1,2,庞冬洽2,韩瑞枝2,李江华1,2,刘龙1,2, 堵国成1,2, 陈坚*1,2
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122)
优化了黑曲霉柠檬酸生产菌株的原生质体形成条件并建立基因表达系统。利用酶解法制备原生质体,最优的酶解液配比为5mg/mL溶壁酶、0.2 U/mL几丁质酶和460 U/mL葡萄糖醛酸酶。最优的渗透压稳定剂为0.7mol/L KCl,菌丝层厚度50μm,菌体量为0.003 g/mL。在培养基中添加1 mmol/LMn2+有助于减少原生质体形成所需的酶量,在培养基中添加葡萄糖醛酸酶有助于得到独立的孢子进行萌发,从而促进原生质体的形成。利用共转化的方式,可以同时将两个表达框整合到基因组上并实现基因表达。
黑曲霉;柠檬酸;原生质体;共转化
黑曲霉 (Aspergillus niger)是重要的工业生产菌,作为生物反应器广泛应用于酶、抗生素、有机酸等物质的生产。随着黑曲霉基因组测序工作的完成以及对黑曲霉基因组表达谱进行挖掘,黑曲霉的代谢网络模型不断得到完善,黑曲霉高产柠檬酸机制和高效分泌蛋白质的机制得到更深层次的阐述[1-2],通过分子改造对黑曲霉的代谢进行调控来实现目的产物的积累已经有诸多成功的报道[3-5]。但是,这些报道所使用的菌株均非柠檬酸生产菌株,目前还没有对柠檬酸生产菌株进行遗传转化来积累目标产物的报道。不同株系的黑曲霉基因组差别巨大[1],基因表达的差异造成其形态差异明显,细胞壁成分也有所不同。因此,需要建立黑曲霉柠檬酸生产菌株的表达系统。
丝状真菌的转化方法主要有4种:电转化法、农杆菌介导法、基因枪法和PEG介导法。电击转化法是以原生质体或者完整的细胞为受体的转化方法。利用短暂的电场脉冲作用,使生物膜的类脂分子层发生瞬时混乱,膜通透性瞬时增大,使DNA进入细胞。由于质膜的可修复性,外加电场造成的膜穿孔在一定时间内可自动修复,使细胞恢复到正常的生理状态,但该方法对黑曲霉的转化效率极低[6]。农杆菌介导法是根瘤农杆菌A.tumefaciens通过类似结合的过程把Ti质粒中的T-DNA转移到受体细胞基因组中。在产酶黑曲霉中,该转化方法获得成功的应用[7],但对产酸黑曲霉转化效率很低。基因枪法作为一种万能基因转化法,可以直接将外源DNA导入可再生的细胞,但缺点是价格昂贵、嵌合体不易排除、不易选择转化体、转化频率低以及转化受体细胞再生困难,目前尚无在黑曲霉中应用的报道。PEG介导法是目前在黑曲霉中应用最广泛的方法,转化材料为原生质体。原生质体作为受体细胞具有群体数量大、容易获得纯合性的转化子等优点,但原生质体具有培养难度大、再生频率低和周期长等缺点。该方法已经在野生菌株 A.niger N400[8-9]、N402[3,5]中应用。在来源于N402的pyrG缺陷型菌株AB4.1[10]、野生型菌株CAD4[11]、NW185的pyrA缺陷型菌株NW186[4]以及糖化酶生产菌株BO-1[12]中获得应用。野生型菌株和产酶菌株可以控制真菌形态,使其长成长丝状菌丝,易于制备原生质体,而本研究使用的黑曲霉柠檬酸生产菌株H915-1未能通过培养基优化得到长丝状菌体,而始终以粗短菌丝存在,故而原生质体制备非常困难。
作者对黑曲霉柠檬酸生产菌株H915-1的原生质体形成条件进行了优化,从酶解液成分与配比、酶解作用条件和菌体生长条件三方面入手,系统探索了PEG介导的原生质体法,建立了遗传转化系统,提供了始终只能以粗短菌丝存在的黑曲霉的原生质体制备的方法,为进一步改造黑曲霉工业生产菌株奠定基础。
1 材料与方法
1.1实验材料
1.1.1菌株和质粒黑曲霉H915-1:江苏国信协联能源有限公司柠檬酸生产菌株;构巢曲霉:南京师范大学陆玲教授惠赠;pUC18和pMD19:TaKaRa公司;E.coli JM109:Stratagene公司;pRS303:作者所在实验室保存。
1.1.2培养基和培养条件
1)LB培养基:胰蛋白胨 10 g/L,酵母提取物5 g/L,NaCl 10 g/L;pH 7.0,固体培养基添加1.5 g/ dL的琼脂粉。筛选培养基需加入100μg/mL氨苄青霉素或硫酸卡那霉素。
2)LB孢子萌发培养基:胰蛋白胨 10 g/L,酵母提取物5 g/L,NaCl 5 g/L;pH 5.0。
3)ME培养基:麦芽提取物 30 g/L,胰蛋白胨5 g/L。
4)上层培养基:麦芽提取物 30 g/L,胰蛋白胨5 g/L,1.2mol/L山梨醇,1 g/dL的琼脂。
5)下层培养基:麦芽提取物 30 g/L,胰蛋白胨5 g/L,1.2mol/L山梨醇,1.5 g/dL的琼脂,加入相应抗生素。
以上培养基均为121℃灭菌15min。
6)MC缓冲液:50 mmol/L CaCl2,20 mmol/L Mes/NaOH,pH 5.8。
7)STC缓冲液:1.2 mol/L山梨醇,50 mmol/LCaCl2,10mmol/L Tris,pH 7.5。
8)PEG缓冲液:25%PEG 6000,50mmol/LCaCl2,10mmol/L Tris,pH 7.5。
1.2实验方法
1.2.1黑曲霉和构巢曲霉基因组的提取在茄子瓶中用ME斜面培养黑曲霉H915-1或构巢曲霉,35℃倒置培养5~7 d至长出浓密孢子,加入5 mL 0.1%Tween-20,用接种铲刮取孢子,用mirocloth过滤除去菌丝体,孢子液经稀释后用血球计数器计数。按3×105CFU/mL接种孢子至ME液体培养基,35℃、200 r/min培养2 d,用mirocloth收集菌球,并挤压干水分。按照DNeasy Plant Mini Kit说明书提取丝状真菌基因组。
1.2.2表达载体的构建
1)pMHT载体的构建:mbf启动子通过引物mbf-F和mbf-R-hph从黑曲霉基因组中克隆得到,hph基因通过引物mbf-F-hph和hph-R-trpC以pRS303为模板得到,trp终止子通过引物hph-F-trpC和trp-R从构巢曲霉基因组中克隆得到,通过融合PCR构建Pmbf-hph-Ttrp表达框,并连接到pMD19上得到pMHT。转化黑曲霉的抗性表达框为通过引物mbf-F和trp-R,以pMHT为模板扩增得到3 300 bp的片段。
2)pGGT载体的构建:gpdA启动子通过引物gpd-F和gpd-R从构巢曲霉基因组中克隆得到,序列的5'和3'端分别加入Sma I和Bam HI位点,sGFP参照文献由全序列合成得到[13],序列5'和3'端分别加入Bam HI和Pst I位点,trp终止子通过trp-F和trp-R以pMHT为模板扩增得到,序列的5'和3'端分别加入Pst I和Hin d III位点。PgpdA-sGFP-Ttrp表达框通过酶切连接构建。Ttrp由Hin dⅢ和 PstⅠ酶切,sGFP由 PstⅠ和 Bam HI酶切,PgpdA由XmaⅠ和Bam HI酶切,3个片段依次连接到pUC18上,得到pGGT。转化黑曲霉的GFP表达框为通过引物gpd-F和trp-R,以pGGT为模板扩增得到3 800 bp的片段。
利用引物hph-F1和hph-R1鉴定hph整合的转化子,利用引物GFP-F1和GFP-R1鉴定sGFP整合的转化子。
载体构建和鉴定重组子整合所用到的引物见表1。

表1 引物序列Table 1 Primer sequences
1.2.3黑曲霉H915-1原生质体的制备按3×105CFU/mL的浓度接种孢子至ME液体培养基,30℃、200 r/min培养过夜。用mirocloth收集菌球,并用无菌水清洗菌球。称取一定量的酶,并用含不同渗透压稳定剂的MC溶解,用无菌滤膜过滤除菌。称取一定量菌球加入到酶解液中,37℃、120 r/min振荡培养2~4 h,4℃、2 000 r/min离心10 min,弃上清液,加入相同体积预冷的STC,4℃、1 000 r/min离心10 min,弃上清液,洗涤2次,加入100μL STC,混匀得到原生质体悬液,可直接用于转化。
1.2.4原生质体再生将原生质体悬液在显微镜下用血球计数板进行计数A,用STC溶液进行适当稀释,涂布于上层培养基上。35℃培养1~2 d至单菌落出现,进行计数B。为消除菌丝体片段形成菌落造成的误差,等量稀释的原生质体涂布于ME固体培养基,菌落计数C。再生率计算公式:原生质体再生率=[(B-C)/A]×100%。
1.2.5PEG介导法转化黑曲霉原生质体100μL黑曲霉原生质体中加入1μg质粒和330μL PEG缓冲液,冰上放置20 min,加入2 mL PEG,室温放置10min,依次加入4mL STC和4mL于48℃预热的上层培养基,铺板于含有180 mg/L潮霉素的下层培养基上。平板在33℃倒置培养3~7 d,直至出现菌落,挑取单菌落传代。
2 结果与讨论
2.1原生质体制备条件的优化
2.1.1黑曲霉H915-1细胞壁消化的酶复合液成分比例的优化黑曲霉的细胞壁成分主要是葡聚糖和几丁质[1,14],此外,β-葡萄糖醛酸酶的酶活作用影响原生质体形成效率[14]。不同株系的黑曲霉细胞壁成分略有差别,黑曲霉CBS 513.88只用溶壁酶一种成分即可消化得到黑曲霉原生质体,黑曲霉K10仅需使用蜗牛酶即可获得原生质体,找到合适的细胞壁裂解酶的配比是制作原生质体的基础[15]。对酶复合液的成分和比例进行了优化。对于黑曲霉H915-1,单独使用蜗牛酶和溶壁酶都无法获得原生质体,当使用复合酶液均可以得到原生质体,但效果不同。当使用溶壁酶、几丁质酶和葡萄糖醛酸酶时,相较于其它种类的酶解液得到的原生质体数最多,进一步优化该酶解液中各酶浓度,发现5 mg/mL溶壁酶、0.2 U/mL几丁质酶和460 U/mL葡萄糖醛酸酶时,得到的原生质体数目最多,为6.7×105个/mL,见表2。对于H915-1,溶壁酶破坏葡聚糖,几丁质酶降解几丁质,β-葡萄糖醛酸酶促进破坏细胞间的粘附作用,这3种酶共同作用得到最优的原生质体酶解条件。消化酶的浓度需要严格的界定,任意一种酶的过量都会造成原生质体浓度下降。一方面,由于原生质体是从细胞壁间隙挤出,需要配合间隙大小(由消化酶活性控制)、胞内外渗透压差和转速来完成原生质体的形成和释放;另一方面,消化酶对细胞膜具有破坏作用,过量的酶会造成细胞的损伤,这也可能与消化酶并非纯酶有关,商品化的酶虽然经过纯化但依然含有大量杂质。

表2 原生质体形成的酶复合液的优化Table 2 Im provement of A.niger protoplasting w ith different digest enzyme
2.1.2酶解作用条件的优化渗透压稳定剂的种类对原生质体形成有重要影响,不仅可以保护原生质体减慢膨胀破裂的速度,而且其中的离子可能会对酶起激活作用。丝状真菌原生质体形成所需的渗透压稳定剂包括无机盐类的 KCl、NH4Cl、MgSO4、(NH4)2SO4[16]等,有机物稳定剂为山梨醇和甘露醇。Arati Das的研究认为,黑曲霉原生质体形成的最适渗透压稳定剂是MgCl2[17],Charissa de Bekker则以山梨醇为渗透压稳定剂来制备黑曲霉原生质体[17]。有机物稳定剂可以提高原生质体制备时离心收集的回收率,因此尽可能选用有机物稳定剂提供渗透压。选择了原生质体制备常用的渗透压稳定剂,由图1(a)可知,H915-1在0.9 mol/L KCl中易形成原生质体,在0.4 mol/LMgSO4和0.8 mol/L山梨醇溶液中,菌丝体很少被消化,只有极少量原生质体形成,而且不同的消化酶成分在这两种渗透压稳定剂下都很难促使原生质体生成,只有以KCl为渗透压稳定剂时,原生质体大量形成。细胞壁本身带负电荷,具有吸附阳离子的功能[19],可能细胞壁成分的差异造成了阳离子吸附量的差异,对酶解液的酶活有影响,从而找到合适的渗透压稳定剂是原生质体制备的关键因素之一。
KCl的浓度与原生质体形成相关,只有胞外渗透压略低于胞内渗透压引起黑曲霉细胞膨胀,才会从被酶解的细胞壁间隙“排”出原生质体,当原生质体渗出到一定程度,适当程度的振动使原生质体脱离菌丝,形成游离的原生质体。渗透压稳定剂浓度越低,原生质体产生的速度越快,但其膨胀速度也快,最终破裂,因此低渗溶液的原生质体稳定性差,为此需要确认最佳的渗透压稳定剂浓度,由图1(b)可知最适的KCl浓度为0.7mol/L,可以得到9×105个/mL原生质体,0.9 mol/L KCl得到的原生质体数略低,而在0.5 mol/L KCl中消化后的得到的原生质体比0.7 mol/L KCl减少了2/3,说明低渗溶液严重影响了原生质体的形成和稳定性。
菌体量是制备原生质体的关键因素,过量的菌体意味着酶的底物增加,会造成被酶解的细胞壁间隙变小,菌丝消化不彻底会导致原生质体制备失败;而菌体量不足会造成原生质体数量的减少。如图1(c)所示,在5 mL酶解液中,制备H915-1原生质体的最适菌体量为15 mg,增加菌体量会导致原生质体量急剧减少,20 mg的菌体量是15 mg菌体量产生的原生质体量的1/5。
温度对原生质体形成的影响在于酶液在不同温度下的酶活及酶的稳定性不同,而原生质体形成需要用到3种酶,葡萄糖醛酸酶和几丁质酶的最适温度为37℃,但几丁质酶在37℃的稳定性较差,因此需要考察它们在不同温度下的协同作用,由图1(d)可见,37℃是比较适合的酶作用温度。


图1 酶解作用条件的优化Fig.1 Optim ization of digestion conditions for protoplasting
酶解时间对获得原生质体的影响在于需要尽可能完全消化掉菌丝体,但维持时间不宜过长,以减少低渗及酶的作用造成的原生质体破裂及活力下降。酶解1 h,菌丝体即被消化成原生质体。酶解2 h时,原生质体被释放到酶解液中,且获得的原生质体活性较好,存活率为95%以上。酶解3 h时,原生质体存活率下降至85%,见图2。

图2 黑曲霉原生质体的形成和释放Fig.2 A.niger protoplasts formed from mycelium
2.1.3菌体生长条件的优化菌丝体的菌龄对原生质体形成有重要影响。在20mLME培养基中接种107个孢子,30℃、200 r/min培养不同时间。由图3可知,孢子由分散的状态逐渐粘附到固形颗粒上;8 h时,固形颗粒上粘附了大量的孢子,且固形颗粒也相互粘连在一起,此时孢子吸胀;12 h时,孢子刚萌发出菌丝,形成菌球;16 h的菌球更大,菌丝层刚好完全包裹住固形颗粒及孢子;20 h的菌丝层更厚,菌球形状更规则,趋于圆形。
制备原生质体需要幼嫩的菌丝,孢子萌发初期的菌丝体更容易被降解。但随着培养时间的缩短,菌丝可能无法完全包裹住菌球,造成ME固形物裸露于酶解液中,被酶解为小碎片。其混杂于原生质体中,不仅影响酶液降解菌丝体,并且无法与原生质体分离,影响后续化学转化;相反,随着菌龄增加,菌球更大,表层疏散的菌丝体被消化后,开始消化内部连接较为紧密的菌丝体,见图3。此时,由于负责降解细胞间的粘连作用的葡萄糖醛酸酶只能作用于表层菌丝,因此形成大量未分散的原生质体团,且粘连在固形颗粒上,为使原生质体团分散,只能延长酶解时间,而酶解时间的延长造成早期形成的原生质体的损失,为此需要确定黑曲霉在ME中培养的时间,即菌丝层厚度对原生质体形成的影响。由图4可知,30℃、200 r/min培养16 h得到的原生质体最多,此时的菌丝层厚度为50μm左右。

图3 黑曲霉H915-1在ME培养基中的生长Fig.3 Grow th of A.niger H 915-1 in ME medium
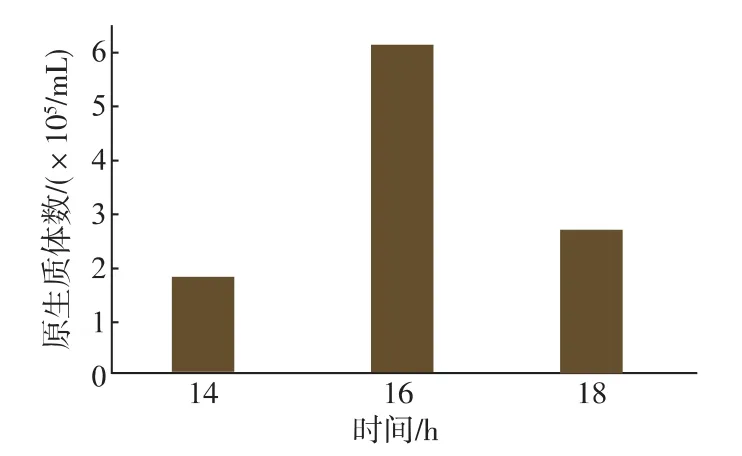
图4 培养时间对原生质体形成的影响Fig.4 Effect of culture time on protoplasting
为减少制备原生质体的成本,需要尽可能减少几丁质酶的用量。通过在菌体生长阶段添加Mn2+,考察最终将等量菌体在相同时间内完全消化成原生质体所需的几丁质酶的用量,见表3。在不添加Mn2+时,几丁质酶浓度需要0.2 U/mL;添加Mn2+至1mg/mL和10 mg/mL,几丁质酶用量可以减少1/2。Mn2+对黑曲霉合成柠檬酸有重要影响[19],同时也反映了它对黑曲霉细胞壁合成、孢子形成和次级代谢产物的合成有重要影响[20]。在缺乏Mn2+时,细胞壁含有更高含量的几丁质,而本研究中添加Mn2+显著减少了制备原生质体所需的几丁质酶的用量。

表3 培养基中添加M nCl2对原生质体形成的影响Table 3 M nCl2addition in ME medium facilitated A. niger protoplasting
黑曲霉在孢子萌发前首先进行聚集,因此黑曲霉是以菌丝聚集体的形式存在于液体培养基中。为增加菌体与酶解液的接触面积,促进消化,期望孢子以单体形式萌发,而不形成菌球。葡萄糖醛酸酶具有减少原生质体间粘附的作用[6],在LB孢子萌发培养基中添加460 U/mL葡萄糖醛酸酶,获得了分散生长的孢子,见图5。以萌发的孢子取代菌球进行酶解,完全消化菌丝体的时间从2 h缩短至1.5 h,获得的原生质体量提升了20%。获得分散的孢子还可以在其它方面进行应用,比如利用流式细胞仪进行转化后筛选已经在动物细胞中获得广泛的应用[21],利用GFP为标记基因,不需要繁杂的抗性筛选,直接用流式细胞仪即可筛选阳性克隆,而且由于筛选的是单个细胞,因此可以避免嵌合体的产生。但这个方法需要获得单个的营养细胞,本研究提供了获得独立的萌发孢子的方法,为后续研究提供技术支撑。
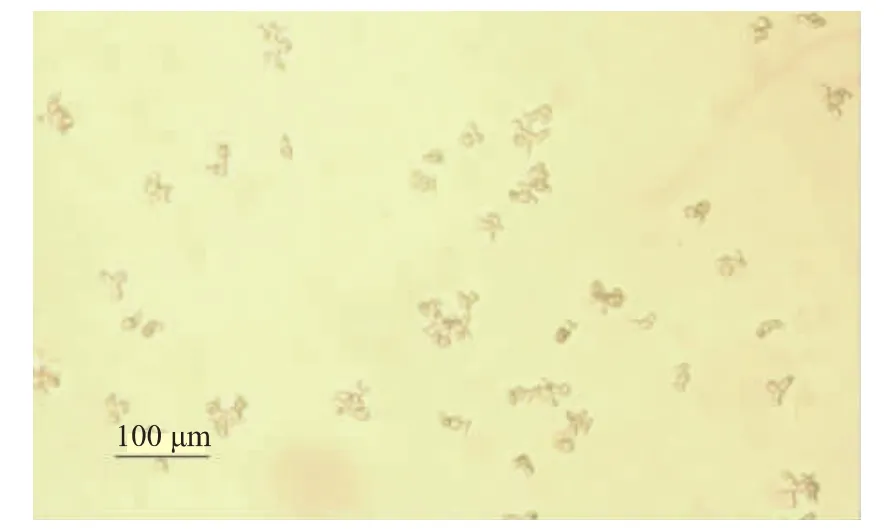
图5 葡萄糖醛酸酶作用下孢子的萌发Fig.5 Conidia grew separated inmediaw ith glucuronidase
2.2sGFP在黑曲霉H 915-1中的整合表达
利用PEG介导法,将线性化的sGFP表达框和hph表达框(图6a)进行共转化(片段比例为10∶1),共得到31个转化子有持续的潮霉素抗性,提取转化子的基因组进行PCR鉴定,所有的潮霉素抗性转化子均能扩增到hph条带(图6b),为整合表达hph的转化子。其中有18个转化子的基因组可以扩增出sGFP条带(图6c),为整合hph和sGFP两个片段的转化子,片段共整合的概率为58%,图7为转化子表达GFP在蓝光激发光下的荧光。在高等生物中,主要利用非同源末端连接进行外源片段对基因组的整合[22-23],利用该方式,可以同时使多个片段整合到基因组上,是目前改造高等生物包括真菌最常用的方式。本研究针对菌丝粗短的黑曲霉柠檬酸生产菌株建立了高效的原生质体制备方法并建立了PEG介导的共转化方法,为后续改造此类黑曲霉奠定了基础。

图6 共转化表达框示意图及转化子基因组的PCR鉴定Fig.6 Structures of cassettes for co-transformation and PCR am plification for gene insertion in genomes of transformants

图7 黑曲霉菌丝体表达sGFP在激发光下产生绿色荧光Fig.7 sGFP expression in A.niger hyphae
3 结语
黑曲霉是重要的工业生产菌,作为丝状真菌,对其进行遗传改造最有效的方法是PEG-介导的原生质体法,实验的关键是制备有活力的原生质体,但一般需要对长丝状菌丝体进行消化来进行原生质体的制备,而柠檬酸生产菌H915-1在培养基中始终以短粗菌丝存在,故需要建立其适用的原生质体制备方法并建立遗传转化方法。本文对酶解液成分与配比、酶解作用条件和菌体生长条件三方面进行系统优化,确定了原生质体制备的最优条件。此外,鉴于Mn2+对黑曲霉细胞壁合成、孢子形成和次级代谢产物的合成有重要影响,本文通过在菌体生长时添加Mn2+可以减少原生质体形成所需的酶量,并通过葡萄糖醛酸酶的添加获得了独立萌发的孢子,对其进行处理可以进一步促进原生质体的形成。最终以PEG介导法实现了两个表达框的共转化,且基因在黑曲霉中可以进行稳定的表达。该方法的建立为代谢改造黑曲霉柠檬酸工业生产菌株奠定基础。
[1]ANDERSEN M R,SALAZARM P,SCHAAPP J,etal.Comparative genomics of citric-acid-producing Aspergillus niger ATCC 1015 versusenzyme-producing CBS 513.88[J].Genome Research,2011,21(6):885-897.
[2]PELH J,deWinde JH,ARCHERD B,etal.Genome sequencing and analysisof the versatile cell factory Aspergillus niger CBS 513.88[J].Nature Biotechnology,2007,25(2):221-231.
[3]de Jongh WA,Nielsen J.Enhanced citrate production through gene insertion in Aspergillus niger[J].M etabolic Engineering,2008,10(2):87-96.
[4]Van der Straat L,Vernooij M,Lammers M,et al.Expression of the Aspergillus terreus itaconic acid biosynthesis cluster in Aspergillus niger[J].M icrobial Cell Factories,2014,13(1):1-9.
[5]MEIJER S,OTERO J,OLIVARESR,et al.Overexpression of isocitrate lyase—glyoxylate bypass influence on metabolism in Aspergillus niger[J].M etabolic Engineering,2009,11(2):107-116.
[6]OZEKIK,KYOYA F,HIZUME K,et al.Transformation of intact Aspergillus niger by electroporation[J].Biosci Biotechnol Biochem,1994,58(12):2224-2227.
[7]LIJ,ZHANG H,ZHANG Y,SHUANG B,etal.Construction of a foodgrade xylanase engineering strain of Aspergillus niger[J]. Journal of Northeast Agricultural University,2013,44(11):7-13.
[8]RUIJTER G,PANNEMAN H,VISSER J.Overexpression of phosphofructokinase and pyruvate kinase in citric acid-producing Aspergillus niger[J].Biochim ica et Biophysica Acta(BBA)-General Subjects,1997,1334(2):317-326.
[9]RUIJTERG J,PANNEMAN H,XU DB,etal.Properties of Aspergillus niger citrate synthase and effects of citA overexpression on citric acid production[J].FEMSM icrobiology Letters,2000,184(1):35-40.
[10]MEIJER S,NIELSEN M L,OLSSON L,et al.Gene deletion of cytosolic ATP:citrate lyase leads to altered organic acid production in Aspergillus niger[J].Journal of IndustrialM icrobiology&Biotechnology,2009,36(10):1275-1280.
[11]Van der Straat L,Tamayo-Ramos JA,Schonew ille T,etal.Overexpression of amodified 6-phosphofructo-1-kinase results in an increased itaconic acid productivity in Aspergillus niger[J].AMB Expres s,2013,3(1):57.
[12]PEDERSEN H,CHRISTENSEN B,HJORT C,etal.Construction and characterization of an oxalic acid nonproducing strain of Aspergillus niger[J].M etabolic Engineering,2000,2(1):34-41.
[13]CHIUW,NIWA Y,ZENGW,etal.Engineered GFPasa vital reporter in plants[J].Current Biology,1996,6(3):325-330.
[14]HAMLYN PF,BRADSHAW R E,MELLON FM,etal.Efficientprotoplast isolation from fungiusing commercial enzymes[J]. Enzyme and M icrobial Technology,1981,3(4):321-325.
[15]姚婷婷,王正祥.黑曲霉原生质体的制备、再生及转化条件[J].食品与生物技术学报,2006,25(4):116-120. YAO Tingting,WANG Zhengxiang.Preparation,regeneration and transformation of Aspergillus niger protoplasts[J].Journal of Food Science and Biotechnology,2006,25(4):116-120.(in Chinese)
[16]PEBERDY J,BUCKLEY C,DALTREY DC,et al.Factors affecting protoplast release in some filamentous fungi[J]. Transactions of the British M ycological Society,1976,67(1):23-26.
[17]DASA,GOKHALED,PEBERDY J.Protoplast fusion and genetic recombination in intra-and interstrain crossing in Aspergillus niger[J].Enzyme and M icrobial Technology,1989,11(1):2-5.
[18]PEREZSilva RM,Abalos Rodriguez A,Gomez Montes De Oca JM,etal.Biosorption of chrom ium,copper,manganese and zinc by Pseudomonas aeruginosa AT18 isolated from a site contam inated w ith petroleum[J].Bioresource Technology,2009,100(4):1533-1538.
[19]NETIKetik A,TORRESN V,RIOL J-M,etal.Uptake and exportof citric acid by Aspergillus niger is reciprocally regulated by manganese ions[J].Biochim ica et Biophysica Acta(BBA)-Biomembranes,1997,1326(2):287-294.
[20]PAPAGIANNIM.Advances in citric acid fermentation by Aspergillus niger:biochemical aspects,membrane transport and modeling[J].Biotechnology Advances,2007,25(3):244-263.
[21]JANSEC J,Franke-Fayard B,WATERSA P.Selection by flow-sorting of genetically transformed,GFP-expressing blood stages of the rodentmalaria parasite,Plasmodium berghei[J].Nature Protocols,2006,1(2):614-623.
[22]ZHANG J,MAO Z,XUEW,etal.Ku80 gene is related to non-homologousend-joining and genome stability in Aspergillus niger[J].Current M icrobiology,2011,62(4):1342-1346.
[23]MEYER V,ARENTSHORST M,El-Ghezal A,et al.Highly efficient gene targeting in the Aspergillus niger kusA mutant[J]. Journal of Biotechnology,2007,128(4):770-775.
Protop lasting Im provement of Industrial Citrate-Producing Aspergillus niger for DNA Transformation
YIN Xian1,2,PANG Dongqia2,HAN Ruizhi2,LIJianghua1,2,LIU Long1,2,DU Guocheng1,2,CHEN Jian1,2
(1.Key Laboratory of Industrial Biotechnology,M inistry of Education,Jiangnan University,Wuxi214122,China;2.School of Biotechnology,Jiangnan University,Wuxi214122,China)
Thisarticleaimedtooptim izeprotoplast formationconditionsof industrial citrate-producing Aspergillus niger to establish genetic transformation system.As protoplasts were formed by enzyme digestion,components of enzyme m ixtures,digestion conditions and hyphae grow th conditionswere studied.The optimized enzymem ixture contained 5mg/m L lysing enzyme,0.2 U/m L chitinase and 460 U/m L glucuronidase.The best conditions for protoplasting were using 0.7 M KCl as osmotic stabilizer,thickness of pellets hyphae for 50μm,cellweight of 0.003 g/m L. Furthermore,addition ofMn2+in culturemedium helped reduce the chitinase concentration necessary for protoplasting.In addition,glucuronidase in culturemedium facilitated conidia separation during germination,further improved protoplast formation.Finally,two cassetteswere inserted into genomesimultaneously.
Aspergillus niger,citric acid,protoplast,co-transformation
Q 93
A
1673—1689(2016)09—0963—08
2015-01-14
江苏省研究生创新工程项目(CXZZ11_0477);江南大学博士研究生科学研究基金(JUDCF11008)。
殷 娴(1982—),女,江苏无锡人,发酵工程博士研究生。E-mail:yinxianshirley@yahoo.com.cn
陈坚(1962—),男,江苏扬州人,工学博士,教授,博士研究生导师,主要从事食品生物技术和生化工程方面的研究。E-mail:jchen@jiangnan.edu.cn
——2017年渗透压相关高考真题赏析

