生物反应器中表达ScFv大肠杆菌细胞自溶的分析
胡卫国, 安展飞, 刘秀霞, 戴晓峰, 杨艳坤*,白仲虎
(1.江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;3.江南大学 糖化学与生物技术教育部重点实验室,江苏 无锡 214122)
生物反应器中表达ScFv大肠杆菌细胞自溶的分析
胡卫国1,2,3,安展飞1,2,3,刘秀霞1,2,3,戴晓峰1,2,3,杨艳坤*1,2,3,白仲虎1,2,3
(1.江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;3.江南大学 糖化学与生物技术教育部重点实验室,江苏 无锡 214122)
表达外源蛋白细菌培养过程中的细胞自溶现象是一个普遍性的过程工程问题。在相同发酵培养条件下,研究生物反应器中大肠杆菌W3110表达全人源化单链抗体片段 (Single chain antibody fragments,ScFv)工程菌和野生菌的外源蛋白表达及细胞活性的差异,发现外源蛋白高效表达并积累在细胞内,大部分活细胞较野生菌提前6 h进入活着但不可培养 (Viable but nonculturable,VBNC)状态,进而发生细胞自溶。分析工程菌与野生菌中胁迫应激和自溶途径基因转录水平表达谱,发现外源蛋白表达过程中热激途径rpoH,dnaK,dnaJ,groEL,groES;酸胁迫途径rpoS,gadE,gadX;氧胁迫途径sodA,katE均出现表达波峰,而发酵罐中细胞自溶过程中外膜蛋白基因ompA,ompC,ompW,ompX表达量显著下降,但rpoE并未出现持续高表达。这些发现为后续ScFv表达宿主细胞抗胁迫和自溶控制策略提供了新思路。
工程菌细胞自溶;活的不可培养状态;σE途径;胁迫应激;生物反应器
随着现代基因工程的发展进步,大肠杆菌(Escherichia coli,E.coli)高效表达ScFv已经实现工业化生产[1]。为了收获高浓度高质量的产品,此类外源蛋白质的工业化生产通常采用分批补料培养方式实现高密度发酵培养并要求外源蛋白质高效表达[2-3]。但由于生物反应器中培养环境复杂多变,以及不同外源蛋白质表达过程中基因和蛋白质层次非常复杂,表达外源蛋白细菌大规模发酵生产过程中常出现不可预测的细胞自溶现象。
众所周知,外源蛋白质表达会导致细胞生理缺陷,在一定程度上对宿主细胞产生毒性和代谢负担,降低细胞活性,有效生物合成代谢所需的能量减少[4-6]。而要进一步了解生物反应器中重组菌细胞遭受的外源蛋白质表达胁迫对细胞自溶的影响,需要了解外源蛋白质表达与大肠杆菌宿主自身的胁迫应激机制和自溶机制之间的关联。
现在已广泛认为大肠杆菌经过长期进化已经形成复杂精确的胁迫应激机制,如热胁迫应激、酸胁迫应激途径、氧胁迫应激途径,它们通过调节蛋白复合物重构相和磷酸化的信号传导系统来适应外界/内部的多种多样的刺激,包括温度、pH、渗透压、营养物质浓度和细胞内产生的次级代谢产物,或者周质空间外源蛋白错误折叠积累等[7-9]。最新的研究发现,大肠杆菌内存在类似于真核组织细胞凋亡的程序性死亡 (Programmed Cell Death,PCD)机制,调控细胞死亡及自溶的发生过程[10]。Murata等[11-12]基于摇瓶培养发现了一条σE引导的大肠杆菌细胞自溶途径,其被认为是细胞应对不利环境或遭受胁迫时的一种内在生存策略。即E.coli细胞由对数生长期进入稳定期后,或细胞受发酵过程中因环境刺激如营养缺乏,或受培养液pH胁迫和氧化胁迫等胁迫时,大部分细胞由“活细胞”转化为VBNC细胞,σE引导的细胞自溶机制的启动用于清除这些VBNC,使得活细胞最大限度利用细胞释放物来应对营养缺乏环境,以保持较长的细菌稳定期。
目前人们对细胞自溶机制的研究主要集中于摇瓶水平,在基因工程菌株表达外源蛋白质的时候,人们往往需要在生物反应器水平对其进行放大培养,以期收获更多的目的蛋白质,所以在生物反应器水平研究生物反应器中特定外源蛋白质的表达对细胞活性和自溶影响的相关机理,其意义重大。
作者以表达人源化ScFv分子的E.coli W 3110(ATCC 39936)工程菌和野生菌为培养模型,在5 L生物反应器水平相同培养条件下,研究了外源蛋白质表达对细胞内胁迫和自溶相关基因表达、细胞活性、细胞自溶现象的影响,为提高大肠杆菌工程菌细胞抗性及培养过程中细胞自溶的控制问题提供基础理论依据,实现重组蛋白生产效率的最大化。
1 材料与方法
1.1材料
1.1.1菌株野生型E.coli W3110:作者所在实验室保存的菌种;表达ScFv的工程菌所用质粒pBW:作者所在实验室保存。
1.1.2主要试剂和仪器总RNA提取试剂、反转录试剂盒、SYBREx TaqTMII定量试剂盒:TaKaLa公司;5-氰基-2,3-二-(p-苄基-四唑氯化物)(5-cyano-2,3-ditolyl tetrazolium chloride,CTC)活细胞染料:美国Polyscience公司;5异丙基-β-D-硫代吡喃半乳糖苷(IPTG)、胰蛋白胨:Sigma公司;酵母提取物:安琪酵母股份有限公司;其他试剂均为国产分析纯;实验所用引物由上海生物工程公司合成。发酵罐实时荧光定量PCR仪:美国产伯乐Bio-RADiCycler CFX96TM;微量紫外分光光度计:美国产Quawell Q5000型;常规分光光度计:美国产MAPADA UV-1800型;台式离心机:美国产Thermo Scientific FRESCOL-7型;荧光显微镜:日本产OLYMPUSBX53F型生物荧光显微镜。
1.1.3培养基
1)LB种子培养基(g/L):蛋白胨 10,酵母粉 5,琼脂糖20;pH 7.0。
2)TB/SB种子培养基(g/L):蛋白胨 10,酵母粉24,KH2PO42.31,K2HPO49.58,甘油10;pH 7.0。
3)TB/SB发酵培养基(g/L):蛋白胨 24,酵母粉48,KH2PO422.31,K2HPO49.58,甘油25;pH 7.0。
4)Booster补料培养基(g/L):甘油 714,酵母粉50,(NH4)2SO425。
1.1.4培养方法E.coli W3110在LB平板上37℃过夜培养后,挑单菌落接种至TB/SB摇瓶培养基于37℃培养至对数期(OD600=4),取100 mL种子液接种至2 L的TB/SB发酵培养基。使用荷兰applikon ez-control-5 L发酵罐进行工作体积为2 L的分批补料发酵,温度恒定控制在(30±0.1)℃,通过补加体积分数17%磷酸或体积分数25%氨水维持pH 7.0±0.05。空气流量维持在2 L/(L·min),必要时通入1 L/(L·min)O2,转速与溶氧联控确保溶氧体积水平达到发酵罐中饱和溶氧的30%左右。在快速生长阶段末期(DO Spiking),开始利用预先校准的蠕动泵以6mL/(h·L)流量补料。稳定期初期添加终浓度100μmol/L的IPTG诱导外源ScFv表达,工程菌培养需要添加四环素至终质量浓度15μg/mL(使用0.2μm醋酸纤维过滤膜过滤除菌)。
1.2检测OD600和细胞干质量(DCW)
使用紫外分光光度计OD600检测菌体浓度。使用台式离心机以12 000 g转速离心1mL发酵上清液10min,弃上清液后在烘箱内以90℃烘干至恒质量,分析天平称量干质量。
1.3VBNC数目测量
1.3.1样品处理在发酵不同阶段收集样品发酵液1 mL,使用0.01 mol/L PBS 10倍梯度稀释发酵液,选取合适稀释倍数稀释液100μL涂布在LB琼脂糖平板上计算CFU。同时,选取合适稀释倍数稀释液100μL,离心机上9 000 g,4℃离心3min后弃去上清液,用0.01mol/L PBS洗涤沉淀两遍。
1.3.2CTC染色CTC染色活细胞计数参照Noor等[12-14]所述并稍微改动。100μLCTC溶液(0.01mol/L PBS溶液配制)加入到样品中至终浓度为3mmol/L,然后在200 r/min、25℃摇床内避光孵育染色 30 min。活细胞通过电子传递可将CTC还原成CTF(CTC formazan,CTF),在细胞膜上形成红色可见荧光沉淀。
1.3.3荧光显微镜计数如Hobbie等[15]描述,细胞随后通过黑色聚碳酸酯膜 (孔径0.2μm,直径13 mm,Sartorius AG)过滤收集。利用生物荧光显微镜100倍油镜(U Plan Semi Apochromat objective 100X/1.3,oil)和10倍目镜(Widefield eyepiece 10X,focusable),随机挑选10个视野计数并求平均值和标准差,视野中30~50细胞为宜,。OLYMPUS系列滤片为BP425-445 exc./FF593/BA628-640 em.。菌数计算

式(1)中:E为样品中细菌总数(个);X为各计数视野细菌总数的平均值(个);S1为滤膜面积(mm2);S2为显微镜油镜的视野面积 (mm2);V为待测VBNC细菌液的体积(mL)。VBNC数目等于同一样品中活菌数减去CFU数目。
1.4RNA提取、cDNA合成和Real Time PCR检测m RNA表达水平
取1 mL发酵液细胞(5×106~107个),立即以8 000 g(4℃,2 min)离心,弃去上清液,RT-PCR分析前沉淀于液氮中保存。按照TaKaRa RNAiso Plus总RNA提取试剂操作说明书提取E.coli细胞样品中总RNA。总RNA的质量和纯度通过测定OD260和OD280吸光度和2 g/dL琼脂糖凝胶电泳检验。根据TaKaRa反转录试剂 (PrimeScriptTMRT reagent Kit with gDNA Eraser)说明书去除基因组DNA后反转成cDNA,反应体系和步骤为:总RNA 500 ng,5×g DNA Eraser Buffer 2.0μL,gDNA Eraser 1.0μL,RNase Free dH2O补足至10μL,42℃反应2 min。反转录反应体系及步骤为:去完基因组后反应液5μL,PrimeScript RT Enzyme Mix I 0.5μL,RT Primer Mix 2.0μL,5×PrimeScript Buffer2(实时)2.0μL,RNase Free dH2O 1.0μL,补足至 10μL,37℃反转录15min,85℃5 s。进行Real Time PCR反应,用到的引物序列见表1。使用TaKaRa SYBR○R Premix Ex TaqTM II(Tli RNaseH Plus)定量试剂反应体系如下:SYBR○R Premix Ex TaqTM II(2x)5μL,PCR Forward Primer(10μmol/L)0.3μL,PCR Reverse Primer(10μmol/L)0.3μL,cDNA模板1μL,Sterile ddH2O 3.4μL。PCR反应条件为:95℃预变性30 s;95℃变性5 s,60℃退火30 s,循环40次。退火温度根据不同引物有所不同。实时荧光定量PCR仪中进行RT-PCR,使用Sigma Plot Software对实验结果分析。用2-△△Ct方法计算基因表达丰度。

表1 RT-PCR实验引物序列Table 1 Sequences of the primers used in RT-PCR
1.5工程菌与野生菌相关胁迫基因与自溶基因表达水平比较方法
工程菌与野生菌平行发酵培养,分别在相同培养时间点3,6,7.5,9,12,15,24 h取样;检测上述自溶基因和胁迫基因表达量。

式(2)中:R为相对表达率,Eg为工程菌基因相对表达量,Ey为野生菌基因相对表达量。
1.6细胞自溶程度定义
工程菌和野生菌在第15 h进入稳定期达到最大生物量,定义其后减少的生物量占最大生物量的比值为自溶程度

1.7酶联免疫分析法(Elisa)检测上清液和菌体中ScFv表达水平
将0.25 mg/mLHSA包被缓冲液加入96孔微孔板,100μL/孔,4℃过夜。去除包被液,每孔用PBST洗涤5次,加入150μL封闭液,37℃孵育1 h。同上洗涤5次,分别加入抗体样品和对照液,50μL/孔,2复孔/样品,37℃孵育1 h。同上每孔洗涤5次,每孔加入50μL酶标抗体HRP-proteinA(武汉博士德生物工程有限公司),37℃孵育1 h。同上每孔洗涤5次,加底物与显色剂(郑州博赛生物技术股份有限公司)混合液 100μL,37℃避光孵育15 min,再加入100μL 2mol/L H2SO4终止反应,在450 nm波长下用酶标仪检测。
2 结果与分析
2.1工程菌与野生菌自溶时间、程度及外源蛋白质表达对比
发酵预实验中DO spiking(说明初始甘油已经耗尽)总是出现在(11.5±1)h,所以第9小时开始补料。1 h后添加IPTG至终浓度为1 mmol/L诱导外源蛋白质表达,此时OD600大于40。如图1所示,工程菌生长状态略差于野生菌,但工程菌和野生菌都大致在发酵15 h后进入稳定期,不同的是野生菌维持稳定期至24 h后开始自溶,而工程菌比不表达外源蛋白质的野生菌细胞自溶提前6 h发生,第24小时自溶程度为18.3%,明显高于野生菌。
本实验中所用工程菌E.coli W3110所包含的质粒为pBW(其中包含scFv基因),ScFv的表达受T7A3强启动子调控,这套表达系统在宿主菌中只有极微弱的基底活动。如图1所示,添加IPTG之前,细胞上清液和发酵液中几乎没有检测到ScFv,说明构建工程菌细胞ScFv分子基因的本底表达水平极低。而当补料1 h后添加IPTG,ScFv基因以0.906 mg/(g·h)的速度被快速诱导表达形成,其在诱导后3.5 h内产量达到最大并积累在胞内后,只有约占总产量1/5的ScFv分泌胞外上清液中。而不带ScFv分子基因的野生菌几乎没有ScFv表达。可以看出,带有外源基因质粒的导入对细胞生长产生轻微抑制作用,外源蛋白质的大量诱导表达与细胞提前自溶存在关联性,这也是E.coli作为宿主细胞提高表达外源分泌蛋白质产量的瓶颈所在[16]。

图1 工程菌与野生菌自溶情况及外源蛋白质表达对比Fig.1 Com parison of cell lysis and ScFv expression between Engineered E.coli and w ild-type E.coli
2.2工程菌与野生菌细胞活性对比
由图2可知,工程菌在第10小时 (对数期后期)IPTG诱导外源蛋白质大量表达后,CFU数目立即呈指数级下降,但10~18 h内活细胞数目只是略微下降,说明外源蛋白质大量表达积累对细胞产生毒害作用,导致大部分细胞活性降低成为VBNC状态,这也是外源蛋白质表达后活细胞数目略微下降,细胞没有立即自溶的原因。第18小时后工程菌细胞发生大幅自溶,其活细胞数目呈指数级下降,而此时CFU数目下降幅度变缓,第24小时后CFU基本不变,这种现象说明发生自溶的细胞主要是VBNC状态的细胞。野生菌同样在第15小时后出现CFU指数下降,至24 h大部分细胞成为VBNC细胞后开始大幅自溶。

图2 工程菌与野生菌活菌数、CFU数目对比Fig.2 Com parison of viable cell number and CFU between engineered E.coli and w ild-type E.coli
2.3工程菌与野生菌抗胁迫基因和自溶基因表达对比
2.3.1工程菌与野生菌热胁迫应激相关基因表达对比图3是工程菌与野生菌热胁迫应激相关基因的动态行为对比,表明工程菌培养时间6~15 h内,工程菌抗胁迫基因表达量高于野生菌,特别是添加IPTG诱导外源蛋白质表达后,胁迫基因表达出现波峰现象。第6、7.5、9 h的rpoH基因表达量分别是野生菌相同时刻的3.17、3.60、2.77倍,说明外源基因的导入和基因工程改造对宿主菌产生了一些不利影响,一定程度上触发了细胞内热胁迫应激系统。而诱导表达外源蛋白质过程中,第12小时时工程菌rpoH基因表达上调至野生菌的5.46倍,可见外源蛋白质表达使这种作用表现得更加明显。但是第13.5、15小时rpoH表达量又出现回落,甚至第24小时表达量低于野生菌数分之一,继续监测发酵结束时rpoH表达量,发现两菌表达量几乎检测不到,所以数据上趋近于1。

图3 大肠杆菌热胁迫应激相关基因相对表达率Fig.3 Relative expression rate of heat stresses response genes in E.coli
大肠杆菌热应激机理,rpoH基因编码Sigma32调节子,通过调控dnaK/J-grpE和groEL/groES等分子伴侣蛋白基因,负责细胞热胁迫应激,降解错配蛋白质,阻止蛋白质错误折叠,或使错误折叠蛋白质复性[17-18]。原核生物的热休克蛋白质DnaK/DnaJ连接在未折叠好的多肽疏水片段来维持可溶性和防止聚集,而GrpE触发核苷酸交换使DnaK和DnaJ从多肽上分离 (催化DnaK/DnaJ/多肽分解)[19-20]。大肠杆菌热胁迫应激反应能迅速诱导热休克蛋白质(Heat Shock Proteins,HSPs)产生,随后经过一段适应期HSPs合成速率下降至一个新的平衡水平。在发酵罐培养中发现,rpoH基因控制的热胁迫相关基因 dnaK,dnaJ,groES,groEL的表达趋势与rpoH一致,说明这些基因的表达是受rpoH调节子的严控。
2.3.2工程菌与野生菌酸胁迫应激相关基因表达对比图4是与酸胁迫相关的基因H-NS,rpoS,gadE,gadX的表达动态,其中H-NS在外源蛋白表达过程中的第12小时是野生菌的-28.8倍,而rpoS是6.12倍,值得注意的是,工程菌中gadE的表达在未诱导前第9小时高出工程菌200多倍,但是随后在第12小时出现大幅下降但仍维持在高水平表达,gadE高水平表达的同时激活gad酸抗性系统中gad脱羧酶和逆向转运基因如gadX,这也说明外源蛋白质产生的胁迫能引起不同基因在不同水平上的差异。第15小时后发现工程菌这些基因和热胁迫基因明显低于野生菌表达水平,同时大量工程菌细胞在12~18 h内成为VBNC细胞,并在18 h后开始出现强烈的细胞自溶,而野生菌出现自溶要比工程菌晚数小时,这也说明mRNA表达水平从某种意义上来说可以反映细胞的活性。继续检测至发酵结束后第48小时,发现工程菌与野生菌表达量基本持平。可能在发酵罐中,在第15至24小时表达外源蛋白质工程菌细胞活性下降,细胞抗胁迫能力变弱。
H-NS基因是酸抗性(Acid resistance,AR)调节系统的高级调节子,促进rpoS mRNA降解和抑制某些氨基酸依赖的AR系统如gadX,adiY,cadC等调节子的表达[21-22]。所以当外源蛋白质表达产生胁迫后,H-NS表达量反而降低,其对rpoS的抑制作用解除,直接或者间接地促进了gad酸抗性系统基因的表达。gadE是编码谷氨酸盐依赖型酸抗性系统的中心激活元件,H-NS直接或间接通过EvgA,YdeO,GadX和GadW等抑制gadE表达[23],从结果可见,gadE在工程菌中表达量超出野生菌数百倍,差异巨大。

图4 大肠杆菌酸胁迫应激相关基因相对表达率Fig.4 Relative expression rate of acid stresses response genes in E.coli
2.3.3工程菌与野生菌氧胁迫应激相关基因表达对比图5显示大肠杆菌中编码超氧化物歧化酶的sodA[24],编码过氧化氢酶HPll的 katE[25]被认为能够应对突然氧胁迫对细胞造成的蛋白质羰基化损伤[26],IPTG诱导后第12小时高出数倍,但随细胞生长速率下降到很低水平。
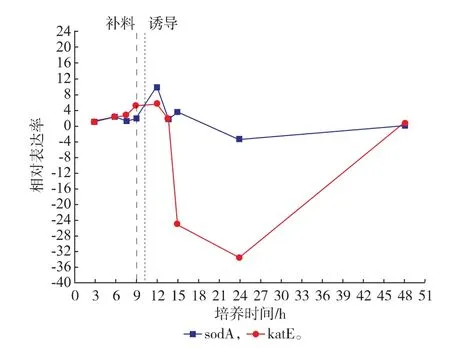
图5 大肠杆菌氧胁迫应激相关基因相对表达率Fig.5 Relative expression rate of oxygen stresses response genes in E.coli
2.3.4工程菌与野生菌自溶途径相关基因表达对比图6是Murata等发现的σE引导的自溶途径基因的表达变化图谱。外源蛋白质表达前,工程菌rpoE基因表达低于野生菌,但外源蛋白质表达后的第12小时,rpoE高水平表达,而ompA、ompC稳定地稍高表达随后骤降,而ompW、ompX虽然分别在第9小时和第6小时表达量突降,但外源蛋白质表达过程中的第12小时后,其表达量同样急升后再降低。rpoE编码的σE最早是在研究编码热刺激σH因子的rpoH基因时被定义成σE转录因子,σE调控相关基因来修复热刺激或其他外界胁迫造成的折叠异常的周质蛋白质或膜蛋白质[27]。而Murata等[11,28]于2012年系统地阐述了一条完整的σE引导的细胞自溶途径,即当细胞受到pH胁迫(pH stress)、氧化胁迫(Oxidative stress)、温度胁迫(Heat shock)和营养物匮乏(Nutrient starvation)等环境胁迫时,未折叠好的周质蛋白质在周质空间或细胞膜上积累到一定程度,σE蛋白质在细胞质内被激活,调节sRNA-micA和rybB的基因转录,然后通过这两个sRNA与同源mRNA的相互影响以及核糖核酸酶的降解作用,降低ompA、ompC和ompW外膜蛋白质mRNA水平,进而减少这3个膜蛋白质的表达,导致外膜缺陷,引起细胞的自溶。但是Murata等是基于大肠杆菌摇瓶培养在对数期和稳定期过表达rpoE基因,发现σE引导的自溶途径使受损的VBNC细胞发生自溶。而在发酵罐细胞自溶过程中并没有发现rpoE基因的持续性高表达。已知ompA作为细胞外膜极其重要的结构蛋白质维持细胞菌体形态和亲水化合物的跨膜传递,ompC是大肠杆菌细胞内主要的阳离子选择性孔蛋白质[29],它们在外源蛋白质表达后表达量较野生菌降低。ompW编码革兰氏阴性菌中β-折叠小外膜蛋白质应对环境变化,但ompW,ompX的表达机制目前并不清楚,在结果中可以看出,细胞自溶过程中外膜蛋白基因表达量显著下降[30-32]。出现这种现象可能是因为外源蛋白质大量表达产生强烈胁迫导致细胞受损VBNC积累,细胞内σE启动激活以清除这些VBNC细胞,受σE自溶途径负调控的ompA和ompC表达量减少,细胞外膜结构破坏,随后自溶发生[33]。这和基于摇瓶发现σE引导细胞自溶的现象一致。然而也发现,这些自溶相关基因在15 h后较野生菌表达量明显下降,不同于Murata等利用rpoE基因的瞬时表达系统,其受诱导后rpoE基因持续高表达。分析自溶现象发现,σE引导的自溶现象特异性在稳定期发生,当rpoE基因被诱导表达后,σE相关调控基因上下调,某些基因在时间上特异性表达增强或受阻[11]。这也许能说明在外源蛋白质表达前,工程菌中rpoE并没有高水平表达而导致自溶。

图6 大肠杆菌σE引导的自溶途径基因相对表达率Fig.6 Relative expression rate of cell lysis genes derected byσEin E.coli
3 结语
工程菌诱导表达的第10至18小时内,ScFv高效表达至36.08 mg/L,且大部分积累在细胞内。由胁迫基因转录水平可知,第10至15小时胁迫相关基因表达活跃,热胁迫应激基因rpoH,dnaK,dnaJ,groES,groEL表达量较野生菌高1~10倍不等;酸胁迫途径基因H-NS表达量降低,其对酸胁迫应激基因rpoS,gadE,gadX等的抑制作用解除,表达量较野生菌高至数十倍不等,甚至gadE出现超高表达(~237倍);氧胁迫应激基因sodA,katE表达量较野生菌高1~8倍不等。说明外源蛋白质高效表达并积累在细胞内引起多重细胞胁迫应激反应。由细胞生长状态可知,外源蛋白质表达后活细胞数维持在1010个/L,而CFU数目却从第9小时的7.19×1010个/L骤降至第18小时的2.43×108个/L,说明大部分细胞成为VBNC细胞,而野生菌在此期间因无外源蛋白质表达,细胞内胁迫基因表达水平较工程菌低,所以大部分活细胞进入VBNC状态出现在第24小时,比工程菌晚6 h。
工程菌和野生菌明显细胞自溶现象分别发生在第18小时和第24小时,其生物量大幅降低,活细胞数目大幅降低,而CFU数目稍微降低,说明工程菌和野生菌发生细胞自溶的主要是VBNC状态细胞。自溶相关基因rpoE在第12小时表达量达到最高,其调控的外膜蛋白ompA,ompC,ompW,ompX随后表达量下降,但发酵罐中细胞在第12小时并没有立即发生自溶现象,这和摇瓶水平自溶途径启动发生细胞自溶现象的结果有所不同。第10至18小时内,工程菌相关胁迫基因和自溶基因表达量较野生菌低数倍至数十倍不等,原因是野生菌在这段时间内处于稳定期,细胞内胁迫基因表达相对活跃,而工程菌中细胞活性骤降或死亡,抗胁迫能力极低。这个观点可以在第24小时野生菌细胞活性下降发生自溶后,相关基因表达率持平得到印证。而σE引导的细胞自溶途径中的关键调控元件rpoE并没有在这段时间持续性高表达,说明细胞内可能存在其他途径导致细胞自溶。
通过研究知,发酵罐中发生细胞自溶的主要是VBNC细胞。因此,结合细胞胁迫应激和自溶机理研究大肠杆菌生产过程中ScFv表达,对发酵罐中VBNC形成原因和数量变化以及控制细胞自溶过程至关重要。可以通过进一步调查VBNC数目变化,了解评估外部或内部胁迫对细胞的影响,以界定细胞生长状态——维持存活还是发生自溶。
现在,以改造sigma因子转录调控子为基础的基因工程和合成代谢设计,已经成为调节细菌调控网络,提高细菌抗逆性和代谢物产量等菌种改造的重要工具[34]。Martin等[35]运用系统生物学的原理和方法,构建胁迫诱导反馈调节机制来控制重组蛋白质生产,已经实现通过胁迫诱导型启动子感应胁迫后来下调重组蛋白基因表达。进一步探索工程菌细胞中sigma因子引导的胁迫和自溶机制,将有助于寻找分子改造的靶点来提高细胞抗性和构建自溶控制开关,从而平衡外源蛋白表达和细胞生长,实现产量的最大化。
[1]Elvin JG,Couston RG,van derWalle C F.Therapeutic antibodies:Market considerations,disease targetsand bioprocessing[J]. International Journal of Pharmaceutics,2013,440(1):83-98.
[2]Zarschler K,Witecy S,Kapplusch F,etal.High-yield production of functional soluble single-domain antibodies in the cytoplasm of Escherichia coli[J].M icrobial Cell Factories,2013,12:97.
[3]Riesenberg D,Guthke R.High-cell-density cultivation of microorganisms[J].Applied M icrobiology and Biotechnology,1999,51(4):422-430.
[4]Chou C P.Engineering cellphysiology to enhance recombinantprotein production in Escherichia coli[J].App lied M icrobiology and Biotechnology,2007,76(3):521-532.
[5]Neubauer P,Lin H Y,Mathiszik B.Metabolic load of recombinantprotein production:inhibition of cellular capacities forglucose uptakeand respiration after induction ofaheterologousgene in Escherichia coli[J].Biotechnology and Bioengineering,2003,83(1):53-64.
[6]Glick BR.Metabolic Load and HeterologousGene-Expression[J].Biotechnology Advances,1995,13(2):247-261.
[7]MarlesW J,Lew isR J.Stress responsesofbacteria[J].Current Opinion in Structural Biology,2007,17(6):755-760.
[8]BuryM S,NomaneY,Reymond N,etal.Globalanalysisofextracytoplasmicstresssignaling in Escherichia coli[J].PLoSGenetics,2009,5(9):51-58.
[9]Sikdar R,Simmons A R,DoerrlerW T.Multiple envelope stress response pathways are activated in an Escherichia coli strain w ithmutations in twomembersof the DedAmembrane protein fam ily[J].Journal of Bacteriology,2013,195(1):12-24.
[10]Rice KC,BaylesKW.Molecularcontrolofbacterialdeath and lysis[J].M icrobiology and M olecular Biology Reviews,2008,72(1):85-109.
[11]Murata M,Noor R,Nagamitsu H,etal.Novelpathway directed byσEto cause cell lysis in Escherichia coli[J].Genes to Cells,2012,17(3):234-247.
[12]Noor R,Murata M,YamadaM.Oxidative stressasa trigger for grow th phase-specific sigmaE-dependentcell lysis in Escherichia coli[J].Journal of M olecular M icrobiology and Biotechnology,2009,17(4):177-187.
[13]Barry H P,Susan C B,Gordon A M.A Rapid,Directmethod for enumerating respiring enterohemorrhagic Escherichia coli O157:H7 inWater[J].Applied and EnvironmentalM icrobiology,1995,61:2614-2619.
[14]Abe A,Ohashi E,Ren H,et al.Isolation and characterization of a cold-induced nonculturable suppression mutant of Vibrio vulnificus[J].M icrobiological Research,2007,162(2):130-138.
[15]Hobbie JE,Daley R J,Jasper S.Use of nucleopore filtersfor counting bacteria by fluorescencemicroscopy[J].Applied and EnvironmentalM icrobiology,1976,33(5):1225-1228.
[16]Schlegel S,Rujas E,Ytterberg A J,et al.Optim izing heterologous protein production in the periplasm of E.coli by regulating geneexpression levels[J].M icrobial Cell Factories,2013(12):24-36.
[17]Arsene F,omoyasu T,Bukau B.The heatshock response of Escherichia coli[J].International Journal of Food M icrobiology,2000,55(1-3):3-9.
[18]Hoffmann F,Rinas U.Rolesofheat-shock chaperones in the production of recombinantproteins in Escherichia coli[J].Advances in Biochem ical Engineering-Biotechnology,2004,89:143-161.
[19]Bukau B,Horw ich A L.The Hsp70 and Hsp60 chaperonemachines[J].Cell,1998,92(3):351-366.
[20]Hartl FU,Hayer-HartlM.Protein folding-Molecular chaperones in the cytosol:from nascent chain to folded protein[J].Science,2002,295(5561):1852-1858.
[21]Krin E,Danchin A,Soutourina O.Decrypting the H-NS-dependent regulatory cascade of acid stress resistance in Escherichia coli[J].BMC M icrobiology,2010(10):273-282.
[22]Giangrossi M,Zattoni S,Tramonti A,et al.Antagonistic role of H-NS and GadX in the regulation of the glutamate decarboxylase-dependent acid resistance system in Escherichia coli[J].Journal of Biological Chem istry,2005,280(22):21498-21505.
[23]Sayed A K,Odom C,Foster JW.The Escherichia coli AraC-family regulators GadX and GadW activate gadE,the central activatorofglutamate-dependentacid resistance[J].M icrobiology-Sgm,2007,153(8):2584-2592.
[24]Fee JA.Regulation of sod genes in Escherichia coli:Relevance to superoxide-dismutase function[J].M olecular M icrobiology,1991,5(11):2599-2610.
[25]Vonossowski I,Mulvey M R,Leco P A,et al.Nucleotide-sequence of Escherichia-Coli kate,which encodes catalase hpii[J]. Journal of Bacteriology,1991,173(2):514-520.
[26]Dukan S,Nystrom T.Oxidative stressdefenseand deterioration ofgrow th-arrested Escherichia coli cells[J].Journalof Biological Chem istry,1999,274(37):26027-26032.
[27]AdesSE.Regulation by destruction:design of the sigmaEenvelope stress response[J].Current Opinion in M icrobiology,2008,11(6):535-540.
[28]Udekwu K I,Wagner EG.Sigma E controls biogenesis of the antisense RNA M icA[J].Nucleic Acids Research,2007,35(4):1279-1288.
[29]Apirakaramwong A,Fukuchi J,Kashiwagi K,et al.Enhancement of cell death due to decrease in Mg2+uptake by OmpC(cation-selective porin)deficiency in ribosomemodulation factor-deficientmutant[J].Biochem ical and Biophysical Research Communications,1998,251(2):482-487.
[30]Brambilla L,Moran-Barrio J,Viale A M.Expression of the Escherichia coli ompW colicin S4 receptor gene is regulated by temperatureandmodulated by theH-NSand StpA nucleoid-associated proteins[J].FEMSM icrobiology Letters,2014,352(2):238-244.
[31]Pilsl H,Smajs D,Braun V.Characterization of colicin S4 and its receptor,OmpW,aminor protein of the Escherichia coli outer membrane[J].Journal of Bacteriology,1999,181(11):3578-3581.
[32]Fernandez C,Adeishvili K,Wuthrich K.Transverse relaxation-optimized NMR spectroscopy w ith the outermembrane protein OmpX in dihexanoylphosphatidylcholinem icelles[J].Proceedings of the National Academy of Sciences of the United States of America,2001,98(5):2358-2363.
[33]Nitta T,Nagam itsu H,MurataM,etal.Function of the sigma(E)regulon in dead-cell lysis in stationary-phase Escherichia coli[J]. Journal of Bacteriology,2000,182(18):5231-5237.
[34]Tripathi L,Zhang Y,Lin Z.Bacterial sigma factors as targets for engineered or synthetic transcriptional control[J].Frontiers in Bioengineering and Biotechnology,2014,2(33):1-7.
[35]Dragosits M,Nicklas D,Tagkopoulos I.A synthetic biology approach to self-regulatory recombinant protein production in Escherichia coli[J].Journal of Biological Engineering,2012,6(1):2-12.
Cell Lysis Analysis of E.coli Expressing ScFv in Bioreactor
HUWeiguo1,2,3,AN Zhanfei1,2,3,LIU Xiuxia1,2,3,DAIXiaofeng1,2,3,YANG Yankun*1,2,3,BAIZhonghu1,2,3
(1.National Engineering Laboratory for Cereal Fermention Technology,Jiangnan University,Wuxi 214122,China;2.Key Laboratory of Industrial Biotechnology,M inistry of Education,Jiangnan University,Wuxi 214122,China;3.Key Laboratory of Carbohydrate Chemistry and Biotechnology,M inistry of Education,Jiangnan University,Wuxi 214122,China)
Cell lysis is a process problem in the protein expression using bacterial host.Under the same fermentation condition,the differences in the expression of foreign protein and cell activity between engineered and w ild-type Escherichia coli W 3110 expressed by the humanized single antibody fragments(ScFv)were studied.The resultsshowed thathigh expression and accumulation of heterologous protein in the engineered E.coli cellswere found,most living cells entered viable but nonculturable(VBNC)state 6 h in advance and the occurrence of cell lysis compared w ith w ild-type.Thought the analysis of transcription levels of both E.coli c,we found that the process of ScFv expression causing overshoot phenomenon of multiple stressed responses pathway genes included rpoH,dnaK,dnaJ,groES,groEL in heat stress response pathway,rpoS,gadE,gadX in acidstress response pathway,sodA,katE in oxygen stress response patheway.However,during cell lysis process in the fermentation tank,the expression of membrane protein gene ompA,ompC,ompW,ompX was significantly decreased,but rpoE did notappear to continue to be high expression.These findingsprovideusnew ideas to improve the resistanceofengineering bacteria cellsand control cells lysis.
engineering cell lysis,VBNC,σEpathway,stress response,bioreactor
Q 815
A
1673—1689(2016)09—0978—09
2014-11-29
国家973计划项目(2013CB733602);中央高校基本科研业务费专项项目(JUSRP51401A);江苏高校优势学科建设工程项目。
杨艳坤(1978—),男,河北石家庄人,理学博士,副教授,硕士研究生导师,主要从事微生物学、基因工程、分子遗传、蛋白质的分离纯化等方面的研究。E-mail:yangyankun@jiangnan.edu.cn

