基于酶联免疫反应的玉米细菌性枯萎病菌快速检测方法
孔德昭, 彭 娟, 刘丽强, 唐丽娟, 匡 华
(食品科学与技术国家重点实验室,江南大学,江苏 无锡214122)
基于酶联免疫反应的玉米细菌性枯萎病菌快速检测方法
孔德昭,彭 娟,刘丽强,唐丽娟,匡 华*
(食品科学与技术国家重点实验室,江南大学,江苏 无锡214122)
通过菌体免疫小鼠获得高灵敏的高特异性单克隆抗体,并以此为基础建立一种快速、灵敏的单克隆抗体双抗体夹心法检测玉米细菌性枯萎病菌(Pantoea stewartill subsp.Stewartii)。通过小鼠脾脏融合实验获得3株单克隆抗体(12B4、10B1、11C2),并通过双抗体夹心法筛选配对细胞株,建立双抗体夹心法。最低检测限(LOD)为1.5×104cfu/mL,线性范围在4.57×105~1.11× 108cfu/mL。该方法对玉米细菌性枯萎病菌具有很好的特异性,对玉米种子添加回收实验回收率为85.6%~90.2%,相对标准偏差低于5.0%。
玉米细菌性枯萎病菌;单克隆抗体;双抗体夹心法;玉米
玉米细菌性枯萎病 (Stewart’s BacterialWilt of Corn)是玉米上的一种毁灭性的病害,我国尚无该病害发生。其病原菌玉米细菌性枯萎病菌,学名Erwinia stewartii Dye,异名Pawoea stewaritii subsp. stewartii[1]。玉米细菌性枯萎病菌(Pss)属于肠杆菌科多源菌属,是一种黄色、不运动、无内生孢子、革兰氏阴性兼性厌氧杆菌,可以引起玉米细菌性枯萎病。1897年首次发现于美国纽约长岛,之后传播到世界其他地区[3]。目前已知发生地区有加拿大、墨西哥、巴西、秘鲁、圭亚那、意大利、波兰、罗马尼亚、南斯拉夫、泰国、越南、马来西亚等。作为一种典型的维管束萎蔫病害,玉米在生长的各个阶段均能被玉米细菌性枯萎病菌进行侵染。玉米细菌性枯萎病菌可以通过带菌种子远距离传播(种传)[4],在病区则以昆虫传播为主,如玉米跳甲等。在国际贸易中,带菌昆虫和病株不易成为传播途径,因此带菌种子是该病远距离传播的主要因素,是传入无病区的主要侵染源,病菌存在于种子的内、外部。我国目前尚未发现玉米细菌性枯萎病的发生,但传入风险很高,已经列为我国进境一类检疫对象,只有证实未染菌的玉米产品才可以入境。在1992年农业部颁布的《中华人民共和国进境植物检疫危险性病、虫、杂草名录》中,被列为一类危险性有害生物。
对玉米细菌性枯萎病菌的检测诊断方法包括野外观察、生理生化鉴定[5]、免疫学检测和鉴定[6-7]以及PCR检测技术[8-9],环介导等温扩增(LAMP)技术[10]和生物传感技术[11]也被用来检测玉米细菌性枯萎病菌。
但生化检测技术耗时过长,且检测结果存在不可靠性。PCR检测技术具有很好的灵敏性与准确性,但由于依赖于昂贵的仪器和专业的检测人员,不适用于大量产品的快速检测。ELISA检测技术依赖于高度特异性与灵敏性的抗体,在检测灵敏度上虽然不如PCR方法,但是由于检测快速、方便、便宜,因此十分适合于大批量样品的粗筛检测。
由于玉米细菌性枯萎病菌会对农业带来的巨大威胁与损失,因此快速准确的检测方法显得尤为重要。因此作者制备了玉米细菌性枯萎病菌的单克隆抗体并建立了双抗体夹心ELISA法,为玉米细菌性枯萎病菌的快速免疫检测奠定基础。
1 材料与方法
1.1材料与试剂
6种植物病原菌菌株来自英国NCPPB中心(National Collection of Plant Pathogenic Bacteria):玉米细菌性枯萎病菌(Pantoea stewartiisub sp.stewartii,NCPPB449),丁香假单胞杆菌斑点致病变种(Pseudomonas syringae pv.Maculicola,NCPPB1820),水稻细菌性谷枯病菌 (Burkholderia glumae,NCPPB 3591,NCPPB2391),水 稻 细 菌 性 条 斑 病 菌(Xanthomonas oryzae pv.Oryzicola,NCPPB 1585),丁香假单胞菌丁香致病变种 (Pseudomonas syringae pv.syringae,NCPPB2844)。弗氏完全佐剂和弗氏不完全佐剂,3,3',5,5'-;四甲基联苯胺(TMB)明胶:Sigma公司;辣根过氧化酶标记的羊抗兔/鼠IgG:康成生物工程公司产品;玉米种子:购自超市;马铃薯葡萄糖琼脂培养基(NBY):北京路桥公司;其余试剂:均购自国药集团化学试剂有限公司。
1.2主要仪器
MK3酶标仪:Thermo scientific;PH050A型培养箱:上海恒一科学仪器有限公司制造;96孔酶标板:无锡国盛实验器材有限公司。
1.3实验方法
1.3.1植物病菌培养方法玉米细菌性枯萎病菌冻存菌株使用LB培养基,pH 7.0,28℃条件下复苏1~2 d,在营养琼脂平板上划线,28℃培养2~3 d,之后单菌落接种在NBY液体培养基中,pH 7.0,28℃培养2 d。其他菌株首先使用LB培养基复苏1~2 d,在营养琼脂上划线活化培养2~3 d,然后挑取单菌落接种于M210培养基 (0.8%酶水解干酪素,0.5%蔗糖,0.03%K2HPO4,0.03%MgSO4·7H2O,pH 7.0),37℃培养。
1.3.2玉米细菌性枯萎病菌单克隆抗体的制备灭活的玉米细菌性枯萎病菌使用无菌生理盐水调节菌体浓度为1010cfu/mL,取一定体积灭活菌体稀释到适当浓度后与弗氏完全佐剂等体积混合,乳化至形成油包水结构后,皮下多点注射免疫6~8周龄的雌性BALB/c小鼠,剂量为108cfu/只,间隔周期为3周,之后使用弗氏不完全佐剂乳化,第3次免疫时剂量减半。3次免疫后小鼠尾部采血并利用间接ELISA检测血清效价,待效价达到要求后,挑选效价最高的小鼠进行腹腔注射冲刺免疫,剂量为1×107cfu/只。冲刺免疫3 d后,将小鼠处死并取脾细胞与SP2/0骨髓瘤细胞进行融合。融合过程中细胞筛选采用间接ELISA方法挑选对玉米细菌性枯萎病菌具有高亲和力的强阳性的孔进行亚克隆并冻存。使用最终冻存的细胞株制备腹水,并采用辛酸饱和硫酸铵法纯化得到单克隆抗体。单克隆抗体标记HRP采用NaIO4法,详细步骤见参考文献[12]。
1.3.3配对筛选利用双抗体夹心ELISA法进行单抗配对筛选,操作方法如下:将获得的玉米细菌性枯萎病菌单抗分别稀释到6μg/mL包被,封闭,然后加入玉米细菌性枯萎病菌标准品作为阳性对照(1×108cfu/mL,100μL/孔),加入标准品稀释液作为阴性对照(PBS,100μL/孔),37℃反应1 h后,加入HRP标记的单抗 (稀释1 000倍),37℃反应1 h,显色并终止反应,检测后,取阳性孔吸光值与阴性孔吸光值比值≥2.1的配对进行进一步优化,以确定最灵敏的配对并建立标准曲线[13]。
1.3.4玉米细菌性枯萎病菌双抗体夹心ELISA标准曲线的建立以配对优化后的ELISA双抗体夹心法为基础,建立玉米细菌性枯萎病菌双抗体夹心ELISA标准曲线。将玉米细菌性枯萎病菌用PBS稀释成一系列浓度,每个浓度做3个重复,零孔做6个重复。以玉米细菌性枯萎病菌浓度为横坐标,对应的OD450值为纵坐标绘制标准曲线。根据绘制的曲线选取最佳的线性范围。最低检测限(LOD)为阴性对照孔平均值与3倍标准差之和在标准曲线中所对应的浓度。
1.3.5玉米细菌性枯萎病菌双抗体夹心ELISA特异性玉米细菌性枯萎病菌(NCPPB449),丁香假单胞杆菌斑点致病变种(NCPPB1820),水稻细菌性谷枯病菌(NCPPB 3591,NCPPB2391),水稻细菌性条斑病菌(NCPPB 1585),丁香假单胞菌丁香致病变种(NCPPB2844)灭活菌株用PBS稀释到108cfu/mL,并用建立的ELISA方法检测,检测同时做标准曲线作为对照。
1.3.6实际样品检测取500 g超市购买的玉米种子,使用0.5%的NaOCl浸泡5~15min进行表面消毒,然后使用无菌生理盐水冲洗3次,无菌条件下晾干。表面消毒后的检验样品粉碎,适量无菌生理盐水于4℃条件浸泡过夜。浸泡液转移至离心管中,4 000 r/min下离心10 min,弃去沉淀,上清液转入另外离心管,10 000 r/mim下离心15min,弃去上清液,加2mL生理盐水使之悬浮,得到悬液[11]。使用国标免疫分离方法验证悬液为阴性样品[14],即取用的玉米种子未被玉米细菌性枯萎病菌感染。在悬液中添加不同浓度玉米细菌性枯萎病菌 (1×106、5× 106、1×107cfu/mL)作为阳性质控,使用悬液作为阴性质控,每个浓度做3个重复。
2 结果与分析
2.1玉米细菌性枯萎病菌单克隆抗体及配对筛选
经过融合筛选共获得3株对玉米细菌性枯萎病菌强阳性的细胞株,配对筛选结果见表1。
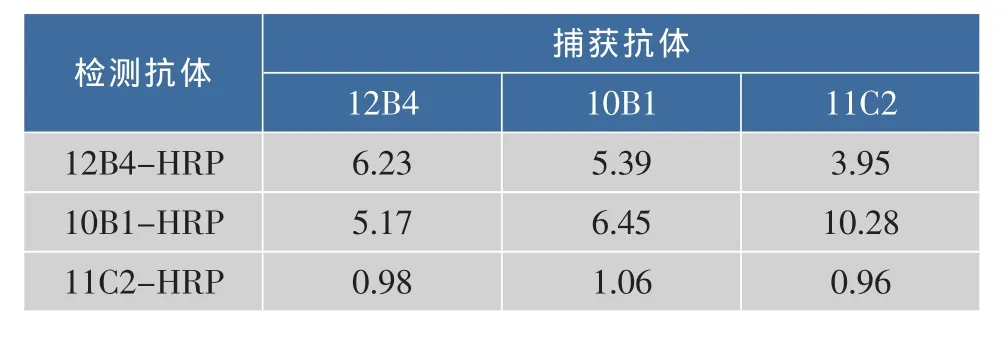
表1 玉米细菌性枯萎病菌单抗配对结果Table 1 Pairw ise study of Pantoea stewartii subsp.stewartii m Abs
由结果可以看出,以抗体11C2作为捕获抗体,以抗体10B1酶标抗体作为检测抗体时,所建立的双抗体夹心法对玉米细菌性枯萎病菌具有较高的灵敏度。进一步优化实验表明,该对抗体配对的灵敏度与检测范围均为最佳配对。因此选择11C2-10B1HRP作为最优配对并建立双抗体夹心法。
2.2玉米细菌性枯萎病菌双抗体夹心ELISA标准曲线的建立
11C2-10B1HRP检测玉米细菌性枯萎病菌的标准曲线见图1。

图1 玉米细菌性枯萎病菌双抗体夹心ELISA标准曲线Fig.1 Standard curve of sandw ich ELISA for Pantoea stewartiisubsp.stewartii
图1为玉米细菌性枯萎病菌双抗体夹心法的非线性拟合的标准曲线,该方法对玉米细菌性枯萎病菌检测的最低检测限(LOD)为 5×104cfu/mL,定量限(QL)为4.57×105cfu/mL。LOD为0孔平均值加上3倍0孔SD对应的菌体浓度。QL为2.1倍的0孔平均值所对应的菌体浓度。线性范围在4.57×105~1.11×108cfu/mL。
2.3玉米细菌性枯萎病菌双抗体夹心ELISA特异性
11C2-10B1HRP双抗体夹心法检测玉米细菌性枯萎病菌的特异性见图2。

图2 玉米细菌性枯萎病菌双抗体夹心ELISA特异性Fig.2 Specificity of monoclonal sandw ich ELISA for Pantoea stewartiisubsp.stewartii
图2表明,该双抗体夹心ELISA方法对玉米细菌性枯萎病菌有很好的特异性,与丁香假单胞杆菌斑点致病变种、水稻细菌性谷枯病菌、水稻细菌性条斑病菌、丁香假单胞菌丁香致病变种均没有交叉反应。
2.4玉米细菌性枯萎病菌双抗体夹心ELISA对玉米种子的检测
为检验所建立双抗体夹心ELISA方法的可靠性,参考国标及文献,对玉米种子样品中玉米细菌性枯萎病菌进行定量检测。回收率与相对标准偏差见表2。在玉米种子样品的检测中,对玉米细菌性枯萎病菌的回收率为85.6%~90.2%,相对标准偏差低于5.0%。显示出所建立的双抗体夹心ELISA方法在实际样品检测中具有较好的准确性与稳定性。

表2 双抗体夹心ELISA对玉米种子中玉米细菌性枯萎病菌的检测结果(n=3)Table 2 Result from analysis of Pantoea stewartii subsp. stewartii in incurred corn seed by monoclonal sandw ich ELISA(n=3)
3 结语
玉米细菌性枯萎病是玉米的一种毁灭性的病害,因此对玉米细菌性枯萎病菌的快速准确的检测显得尤为必要。本研究中,我们制备了针对玉米细菌性枯萎病菌的单克隆抗体,并以此为基础建立了双抗体夹心ELISA检测方法。其最低检测限(LOD)为1.5×104cfu/mL,线性范围在4.57×105~1.11×108cfu/mL。该方法对玉米细菌性枯萎病菌具有很好的特异性,对实际样品检测具有很好的准确性与稳定性,对于实际样品的快速、准确检测具有很好的指导意义。
[1]MERGAERT J,VERDONCK L,KERSTERSK.Transfer of erw inia-ananas(synonym,erw inia-uredovora)and erw inia-stewartii to the genus pantoea emend as pantoea-ananas(serrano 1928)comb-nov and pantoea-stewartii(sm ith 1898)comb-nov,respectively,anddescriptionofpantoea-stewartiisubspindologenessubspnov[J].InternationalJournalofSystematic Bacteriology,1993,43:162-173.
[2]玉米细菌性枯萎病菌检疫鉴定方法.SN/T 1375-2004[S].北京:中国标准出版社,2004.
[3]BLOCK CC,HILL JH,MCGEED C.Seed transmission of Pantoea stewartii in field and sweetcorn[J].Plant Disease,1998,82(7):775-780.
[4]M ICHENER PM,PATAKY JK,WHITE D G.Rates of transmitting Erwinia stewartii from seed to seedlings of a sweet corn hybrid susceptible to stewart'sw ilt[J].Plant Disease,2002,86(9):1031-1035.
[5]郭翼奋,梁再群,俞大绂.玉米细菌性枯萎病选择性培养基——黑色素培养基[J].微生物学报,1982,4:339-345. GUO Yifen,LIANG Zaiqun,YU Dafu.Nigrosinemedium-Selectivemedium for isolation of Erw inia Stewartii form imported corn[J].Acta M icrobiogica Sinica,1982,4:339-345.(in Chinese)
[6]ZHANG F,LIJ,ZOU M,et al.Simultaneous detection of Clavibacter michiganensis subsp.nebraskensis and Pantoea stewartiisubsp.stewartii based onm icrosphere immunoreaction[J].Journal of Biomolecular Screening,2013,18(4):474.
[7]齐玲玲,金涌,邹明强,等.胶体金免疫层析试纸条快速检测玉米细菌性枯萎病菌[J].检验检疫科学,2010,20(1):1-4. QI Lingling,JIN Yong,ZOU M ingqiang,et al.A colloidal gold-based immunochromatographic strip for rapid detection of erw iniastewartiisubsp.stewartii[J].Journal of Inspection and Quarantine,2010,20(1):1-4.(in Chinese)
[8]THAPA S P,PARK D H,W ILSON C,et al.Multiplex PCR assay for the detection of Pantoea stewartii subsp.stewartii using species-specific geneticmarkers[J].Australasian Plant Pathology,2012,41(5):559-564.
[9]漆艳香,朱水芳,赵文军,等.玉米细菌性枯萎病菌TaqMan探针实时荧光PCR检测方法的建立[J].植物保护学报,2004,31(1):51-56. QIYanxiang,ZHU Shuifang,ZHAO Wenjun,et al.Detection and identification of Pantoea stewartii stewartii using TaqMan probe[J].Journal of Plant Protection,2004,31(1):51-56.(in Chinese)
[10]袁钧,高文娜,汪万春,等.玉米细菌性枯萎病菌LAMP检测方法的建立[J].植物检疫,2013,27(5):61-65. YUAN Jun,GAO Wenna,WANG Wanchun,et al.LAMP for the detection of Pantoea stewartii subsp.stewartii.[J].Plant Quarantine,2013,27(5):61-65.(in Chinese)
[11]XUE Q,QI C.An immunosensor based on magnetic relaxation sw itch and polystyrene m icroparticle-induced immune multivalency enrichment system for the detection of Pantoea stewartii subsp.Stewartii[J].Biosensors and Bioelectronics,2013,43:6-11.
[12]KUANG H,WANG W B,XU L G,et al.Monoclonal antibody-based sandw ich ELISA for the detection of staphylococcal enterotoxin A[J].International Journal of Environmental Research and Public Health,2013,10(4):1598-1608.
[13]PENG J,MENG X,DENG X,et al.Development of a monoclonal antibody-based sandw ich ELISA for the detection of ovalbum in in foods[J].Food and Agricultural Immunology,2014,25(1):1-8.
科技信息
加拿大批准一种蛋白酶用于水解蛋白与水解酵母
2016年7月14日加拿大卫生部发布通告,修订食品酶列表,批准一种产自嗜热脂肪地芽孢杆菌(Geobacillus stearothermophilus TP7)的蛋白酶用于水解动物、植物与牛奶蛋白以及水解酵母。
目前加拿大卫生部已批准多种有机体来源的蛋白酶用于食品,这包括水解动物、牛奶与植物蛋白。然而尚未批准嗜热脂肪地芽孢杆菌TP7。经过评估,加拿大卫生部认为该蛋白酶用于食品是安全的。
[信息来源]食品伙伴网.欧盟发布对孔雀石绿和发酵大豆提取物的安全性进行评估[EB/OL].(2016-7-15).http: //news.foodmate.net/2016/07/387696.html
欧盟批准UV处理的牛奶和反式白藜芦醇作为新食品
2016年7月19日,欧盟通过欧委会决议EU 2016/1189,同意修订EC 258/97指令,将UV处理的牛奶和反式白藜芦醇作为新食品(原料)投放市场。具体要求为:(1)对新食品UV处理的牛奶给出了详细的定义,并设定了维生素D3在UV处理的牛奶中的最高限量为0.5~3.2μg/100g(全乳)、0.1~1.5μg/100g(半脱脂乳);标签中应标明“UV处理”和营养成分中需标明“因UV处理产生的维生素D”含量;(2)新食品原料反式白藜芦醇,作为膳食补充剂(片剂)提供给成年人服用,每天最大服用量不超过150mg;标签中应标明“反式白藜芦醇”字样,并具有“在医生监督下服用”描述字样。同时对反式白藜芦醇片剂的纯度、铅汞等限量要求做出明确的规定。
[信息来源]国家质量监督检验检疫总局.欧盟批准UV处理的牛奶和反式白藜芦醇作为新食品 [EB/OL].(2016-7-19).http://jckspaqj.aqsiq.gov.cn/wxts/gwsp/201607/t20160722_470812.htm
Rapid Detecion of Pantoea stewartii subsp.Stewartii Using Enzyme-Linked Immunoassay
KONG Dezhao,PENG Juan, LIU Liqiang,TANG Lijuan,KUANG Hua*
(State Key Lab of Food Science&Technology,Jiangnan University,Wuxi 214122,China)
Asensitiveandrapidmonoclonal antibody-basedsandw ichenzyme-linked immunosorbent assay(ELISA)was established to detect Pantoea stewartill subsp.Stewartii(Pss). Threemurinehybridomas(12B4/10B1/11C2)wereobtained from the spleen cells fused produce.A pairofmonoclonalantibodies(mAb)wasselected for the sandw ich ELISAmethod.ThemAb 10B1 was conjugated w ith horseradish peroxidase(HRP)as the detection antibody and themAb 11C2was used as the capture antibody.The lim it of detection of thismethod was 1.5×104cfu/m L,and the linear range from 4.57×105to 1.11×108cfu/m L.
Pantoea stewartill subsp.stewartii,monoclonalantibody,sandw ich ELISA,corn
S 432.42
A
1673—1689(2016)09—0958—05
2014-09-17
国家“十二五”科技支撑计划项目(2012BAC01B07)。
孔德昭(1990—),男,安徽宣城人,食品安全检测方向博士研究生。E-mail:kdz19900910@163.com
匡华(1981—),女,河南新乡人,工学博士,教授,博士研究生导师,主要从事食品安全方面的研究。E-mail:kuangh@jiangnan.edu.cn

