人体线粒体N-乙酰氨基葡萄糖转移酶在酿酒酵母中的表达
韩宝仙, 高晓冬, 中西秀树
(江南大学 生物工程学院,江苏 无锡 214122)
人体线粒体N-乙酰氨基葡萄糖转移酶在酿酒酵母中的表达
韩宝仙,高晓冬*,中西秀树
(江南大学 生物工程学院,江苏 无锡 214122)
O-GlcNAc是一种广泛存在于蛋白质丝/苏氨酸残基上的动态可逆的蛋白质翻译后修饰方式,广泛分布在细胞浆和细胞核中,参与调节多种细胞途径。蛋白质的O-GlcNAc糖基化与许多疾病密切相关,如糖尿病、神经退行性疾病和癌症等。在体内,O-GlcNAc动态修饰由N-乙酰氨基葡萄糖转移酶(OGT)和N-乙酰氨基葡萄糖苷酶(OGA)协同完成。OGT具有3种异构体,分别是ncOGT、mOGT和sOGT。目前对于mOGT的功能和调节机制尚未清楚。作者在酿酒酵母细胞中表达了人源的mOGT,发现mOGT抑制酵母细胞的生长。在酿酒酵母细胞中mOGT具有O-GlcNAc糖基化活性,当其活性位点突变后,O-GlcNAc糖基化活性明显降低,但其同样能抑制酵母细胞生长。作者在酿酒酵母细胞中构建了研究mOGT的系统。可以利用该人源化的酵母筛选和mOGT相互作用的蛋白质和基因,也可以用来筛选抑制mOGT活性的药物,进而研究mOGT的功能与调节机制。
O-GlcNAc糖基化;人源化;酿酒酵母;线粒体N-乙酰氨基葡萄糖转移酶(mOGT)
Hart于1984年发现了蛋白质的O-GlcNAc糖基化现象[1]。O-GlcNAc糖基化是O-GlcNAc基团通过β-O-连糖苷键连接到蛋白质的丝氨酸或苏氨酸上的一种蛋白质翻译后修饰方式。这种糖基化方式存在于所有高等真核生物中,与其他的蛋白质糖基化不同,蛋白质的 O-GlcNAc糖基化同时存在于胞核和胞浆中。目前己发现的O-GlcNAc修饰蛋白有近千种,而且其数量还在不断增加[2-3]。O-GlcNAc糖基化与磷酸化一样,是一个动态的过程,不断伴随着 O-GlcNAc的添加和移除[4]。如图1所示,OGlcNAc糖基化只需要两个酶的参与:β-N-乙酰氨基葡萄糖转移酶(OGT)[5]和β-N-乙酰氨基葡萄糖苷酶(OGA)[6],其中 OGT负责O-GlcNAc的添加,OGA负责O-GlcNAc的移除。打破 O-GlcNAc糖基化的动态平衡,会诱发很多疾病,如糖尿病、神经性退性疾病、心血管疾病等[7]。
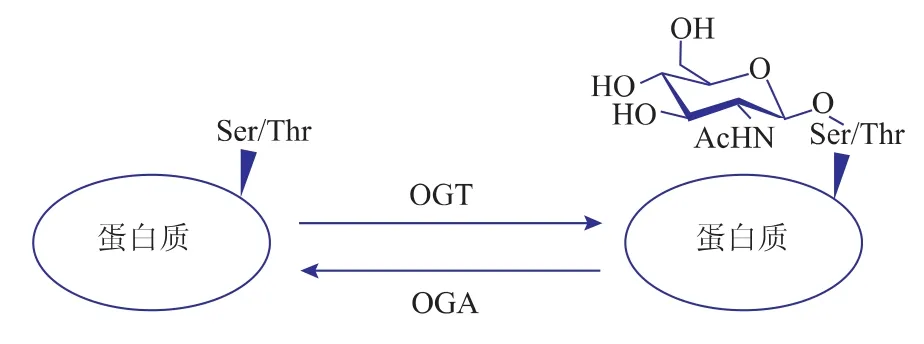
图1 O-糖基化修饰的方式[17]Fig.1 M odification mode of O-G lcNAcylation[17]
OGT几乎存在于所有的组织中,在小鼠和人的体内存在着至少 4种不同的转录产物及蛋白质亚型。如图2所示,OGT具有两个结构域:一个是含有12个34肽重复序列(TPR)的N端结构域,另一个是具有糖基转移活性的C端结构域,C端结构域由2个保守的催化结构域(catalytic domain,C D)C D I、C DⅡ和1个磷酸肌醇结合区域 (PPO)组成[8]。TPR结构域主要参与调节 OGT与底物蛋白的结合,能够与不同的蛋白质相互作用[9]。同时,TPR结构域对OGT的活性存在一定程度的影响。OGT具有 3种异构体,分别是 ncOGT(Nucleocytoplasmic OGT),mOGT(Mitochondrial OGT),sOGT(Shorter OGT),这3种异构体的 C端结构域是相同的,不同在于含有不同数目的TPR重复序列,它们分别就有12,9,2个TPR结构域。ncOGT,sOGT定位在细胞核和细胞质中,mOGT(Mitochondrial OGT)定位在线粒体内膜上[10]。
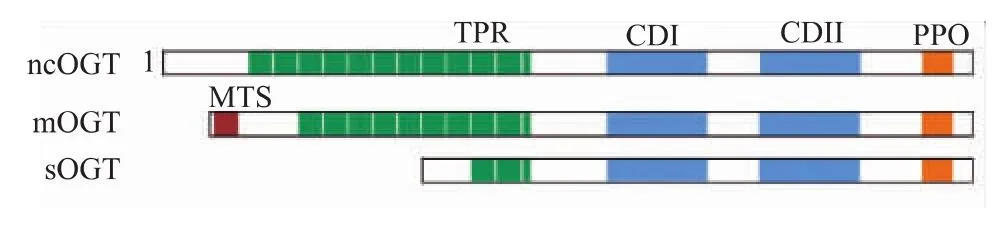
图2 OGT的结构示意[8]Fig.2 Schematic diagram of O-GlcNAc transferase(OGT)[8]
基因组测序表明,人类与酿酒酵母存在着高度的基因保守性,尤其是那些和基本细胞代谢及分裂有关的基因[11-13]。许多与人类疾病相关的蛋白在酵母中均能找到与其氨基酸序列相似的蛋白质[14-15]。正是由于基本大分子及细胞生理机制上都存在着保守性,在酵母细胞中表达出的人源性蛋白可以很好地保持原有功能,而且一些人类细胞的生理过程在酵母细胞中也能得以模拟。酵母细胞较之哺乳动物细胞的突出优点就是其基因组的柔韧性和易操作性,而且酵母细胞能为靶蛋白提供一个空白的表达背景,避开了哺乳动物各种复杂的生理过程对靶蛋白研究的干扰。利用酵母系统能很好的研究人类蛋白的功能及调节机制,可以从人的cDNA文库中进行高通量的相关基因的筛选。酵母是低等真核生物,其细胞中不存在OGT。目前对于mOGT的研究很少,它的功能及调节机制未知,本研究在酿酒酵母细胞中表达了人源的mOGT,通过酿酒酵母来研究mOGT的功能和调节机制。
1 材料与方法
1.1菌株与质粒
酿酒酵母菌株Saccharomyces cerevisiaeYPH499,mOGT表达用质粒 pRS424GAL1pr及引物相关信息见表1。

表1 该研究所用的菌株、质粒和引物Table 1 Lists of strains,p lasm ids and primers used in this study
1.2试剂
限制性内切酶、DNA T4连接酶及KOD DNA聚合酶:TaKaRa公司 (大连);PCR产物纯化试剂盒、质粒小量抽提试剂盒、琼脂糖凝胶回收试剂盒、脱脂奶粉:上海生工;ClarityTM Western ECL Substrate显色剂、SDS-PAGE凝胶配制试剂盒:碧云天生物技术研究所;Mouse anti-HA一抗、Goat anti-mouse IGg-HRP二抗:北京全式金生物技术有限公司;O-Linked N-Acetylglucosamine Antibody(RL2)抗体:赛默飞世尔科技 (中国)有限公司;PVDF膜:美国伯乐公司;无水甲醇、无水乙醇等其他试剂:进口分装或国产分析纯。
1.3主要仪器
电子天平、pH计:梅特勒-托利多仪器公司(上海);恒温培养箱、无菌操作台:上海三发科学仪器公司;电泳仪:北京六一仪器厂;压力蒸汽灭菌器(立式):上海申安器械厂;恒温摇瓶柜:太仓强乐设备厂;PCR仪、移液枪:Eppendorf公司;凝胶成像系统:美国Bio-Rad公司;SDS-PAGE凝胶电泳仪:美国伯乐公司;半干电转仪:美国伯乐公司;紫外分光光度计、ImageQuantTMLAS 400mini:美国GE;荧光倒置显微镜:日本尼康公司。
1.4培养基及其他溶液配制
1.4.1LB培养基胰蛋白胨10 g/L,酵母抽提物5 g/L,氯化钠10 g/L,琼脂粉20 g/L(固体培养基)。
1.4.2YPAD培养基酵母抽提物20 g/L,蛋白胨10 g/L,腺嘌呤30 mg/L,琼脂粉20 g/L(固体培养基),葡萄糖20 g/L。
1.4.3SD培养基YNB 6.7 g/L,缺陷型粉末2 g/L,葡萄糖20 g/L,琼脂粉20 g/L(固体培养基)。SG培养基是用半乳糖代替葡萄糖。
1.4.48 mol/L尿素480.48 g尿素,8.766 g NaCl,25mmol/L(pH 8.0),加去离子水定容至1 L。
1.4.5TBST溶液5 mol/L NaCl 30 mL,1 mol/L Tris·HCl(pH 8.0)10 mL,Tween20 500 uL,加去离子水定容至1 L。
1.4.65%脱脂牛奶称取5g脱脂奶粉,用TBST定容至100mL。
1.4.7转膜缓冲溶液称取甘氨酸14.4 g,Tris·HCl 3.03,量取无水甲醇200mL,加去离子水定容至1 L。
1.5实验方法
1.5.1细胞生长分析将质粒 pRS424-GALpr,pRS424-GALpr-mOGT转化至 YPH499细胞中,在SD色氨酸缺陷平板上筛选阳性克隆。将阳性转化子在以葡萄糖为碳源的色氨酸缺陷培养基培养过夜,至 OD660为1.0,不同的转化子取相同数量的细胞,分别以10倍梯度稀释细胞,在以葡萄糖和半乳糖为碳源的色氨酸缺陷平板上点板,分别在 30℃和37℃培养细胞,观察细胞的生长情况。
1.5.2蛋白质提取将不同细胞接种在 5mL以葡萄糖为碳源的SD色氨酸培养基上,于37℃培养至OD660为1.0,收集细胞转移至25mL以葡萄糖为碳源的SD色氨酸培养基上,于37℃培养至OD660为1.0,收集细胞转移至30mL以半乳糖为碳源的SG色氨酸培养基中,起始OD660为0.4,37℃培养至OD660为0.8~1.0。不同转化子收集相同数量的细胞,用PBS洗细胞2次,加8 mol/L尿素缓冲溶液和蛋白酶抑制剂PMSF,加玻璃珠振荡破碎细胞,15 000 g离心10min,上清液即为所提取蛋白质。用 BCA试剂盒测蛋白质浓度。
1.5.3蛋白质免疫印迹电泳:取 100 ug蛋白质样品上样跑电泳,浓缩胶电压 80 V,40 min,分离胶电压100 V,90min;转膜:采用半干式转膜方式,电压25 V,电流1.0 A,时间30min;封闭:5 g/dL的脱脂奶粉封闭3 h;孵育抗体:一抗1∶3 000,4℃过夜;二抗1∶5 000室温1 h;显色:ECL显色液 A和 B混匀,涂于膜上,用ImageQuant LAS4000mini显色。
2 结果与讨论
2.1mOGT活性表达及其对酿酒酵母细胞生长的影响
作者从人的cDNA文库中克隆得到mOGT,并将其连接到酵母细胞表达载体pRS424-GALpr上,得到pRS424-GALpr-mOGT。在酿酒酵母YPH499细胞内表达pRS424-GALpr-mOGT,研究在酿酒酵母细胞内mOGT的活性及mOGT对酿酒酵母细胞生长的影响。如图3(a)所示,在以半乳糖为碳源的色氨酸液体培养基上诱导培养24 h后,可检测到细胞内多种蛋白质被mOGT糖基化。由此可知,在酿酒酵母细胞内mOGT具有O-GlcNAc糖基化活性,能够糖基化酿酒酵母细胞的多种蛋白质。如图3(b)所示,在以葡萄糖为碳源的色氨酸缺陷培养基上,无半乳糖mOGT不表达,pRS424-GALpr-mOGT转化子和对照pRS424-GALpr转化子生长情况相同,对酿酒酵母细胞的生长无影响。在以半乳糖为碳源的色氨酸缺陷培养基上,半乳糖诱导mOGT表达,无论是在30℃还是37℃下,mOGT的表达都会抑制酿酒酵母细胞的生长。这种抑制作用,可能正是因为mOGT糖基化酵母细胞内的蛋白质而影响它们的结构与功能,从而影响酿酒酵母细胞的生长。

图3 mOGT活性表达及其对酿酒酵母细胞生长的影响Fig.3 mOGT shows the O-GlcNAcylation activity in yeast cell and inhibits the grow th of yeast
2.2H382A-mOGT突变子构建、表达及活性分析
Michael[16]等研究发现,His498为OGT的催化活性位点,当His498位点突变为Ala后,OGT活性降低至少95%,该位点对应于mOGT的His 382位点。本研究旨在探究酵母细胞中当mOGT的活性位点His 382突变为Ala后,突变的mOGT是否具有活性。利用融合PCR的方法,将mOGT的1144(C),1145(A),1146(T)位的碱基突变为GCT,即将mOGT 382位的组氨酸(His)突变为丙氨酸(Ala)。将空质粒pRS424-GALpr,pRS424-GALpr-mOGT-3HA,pRS424-GALpr-H382A-mOGT-3HA分别转化至酿酒酵母YPH499细胞内,得到的转化子经半乳糖诱导培养24 h后,用anti-HA抗体检测mOGT及突变体的表达情况,用O-Linked N-Acetylglucosamine Antibody(RL2)检测细胞内的蛋白质糖基化情况,Actin作为内参蛋白质。如图4(a)所示,当mOGT的His 382位点突变为Ala后,对于mOGT的表达水平与稳定性无影响。但是,如图4(b)所示,表达H382A-mOGT的细胞内被糖基化的蛋白质明显比表达野生型mOGT的被糖基化的蛋白质少。由此可知,当mOGT的活性位点His 382突变为Ala后,H382A-mOGT活性较野生型mOGT活性明显降低。
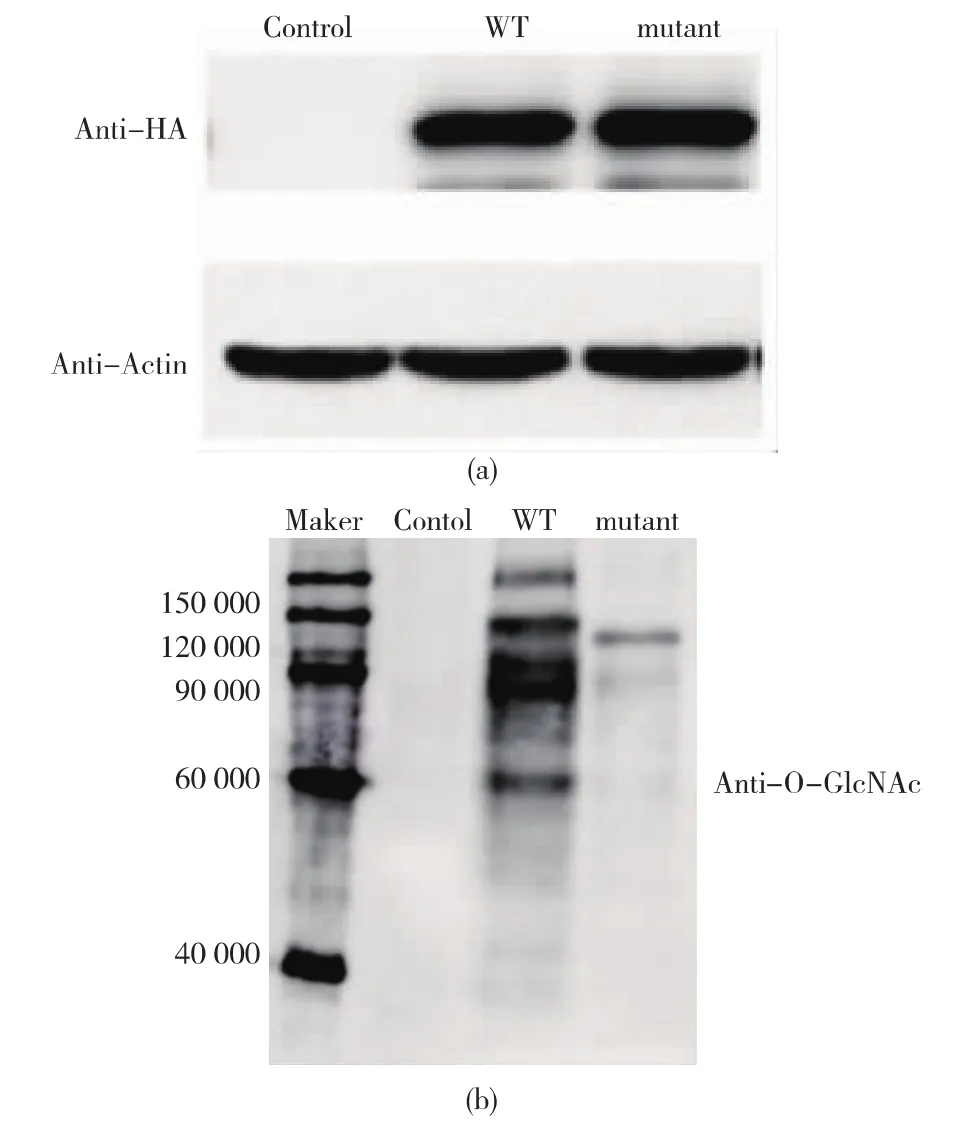
图4 H382A-mOGT在酵母细胞中活性明显降低Fig.4 H382A-mOGT mutant protein shows decreased activity in yeast cells
2.3H382A-mOGT对酿酒酵母细胞生长的影响
本研究已发现H382A-mOGT的O-GlcNAc糖基化活性明显降低,是否对于酿酒酵母细胞的抑制作用也明显减弱?为探究H382A-mOGT对酿酒酵母细胞生长的的影响,将质粒pRS424-GALprmOGT、pRS424-GALpr-H382A-mOGT分别转化至酿酒酵母YPH499细胞内,观察突变体对酿酒酵母细胞生长的影响,结果见图5。在以葡萄糖为碳源的色氨酸缺陷平板上,mOGT及H382A-mOGT未表达,突变体与野生型生长状况相同,均不抑制酿酒酵母细胞的生长。在以半乳糖为碳源的色氨酸缺陷平板上,经半乳糖诱导后,mOGT、H382A-mOGT均表达,结果是H382A-mOGT同野生型的mOGT相同,都能抑制酿酒酵母细胞的生长,且抑制作用强度完全相同。这说明mOGT的O-GlcNAc糖基化活性可能不是抑制酿酒酵母细胞生长的主要原因,而mOGT的TPR结构域与细胞内的蛋白质相互作用,从而影响蛋白质的结构与功能,是抑制酿酒酵母细胞生长的主要原因。

图5 H382A-mOGT突变体同样抑制酿酒酵母细胞生长Fig.5 H382A-mOGT protein still inhibit the cell grow th of yeast
3 结语
在酿酒酵母细胞中表达了人源的mOGT,研究发现,在酿酒酵母细胞中mOGT具有O-GlcNAc糖基化活性,能够糖基化酿酒酵母细胞的蛋白质。可以利用该人源糖基化酵母,通过蛋白质组学的方法来确定酵母细胞被糖基化的蛋白质及位点,进而研究在人体细胞内被mOGT糖基化的蛋白质,因此可通过该人源化酵母来研究mOGT的功能和调节机制。研究发现,mOGT的TPR结构域与细胞内的蛋白质相互作用是抑制酿酒酵母细胞生长的主要原因,可以通过该现象来研究与TPR结构域相互作用的蛋白质,进而研究这些蛋白质对于mOGT的生理功能的影响,可进一步研究mOGT的调节机制。
[1]TORRESC R,HARTGW.Topography and polypeptide distribution of term inal N-acetylg-lucosam ine residues on the surfaces of interact lymphocytes.evidence forO-GlcNAC[J].The Journal of Biological Chem istry,1984,259(6):330 8-3317.
[2]WELLS L,VOSSELLER K,HART G W.Glycosylation of nucleocytoplasmic proteins:signal transduction and O-GlcNAc[J]. Science,2001,291(5512):2376-2378.
[3]HART G W,HOUSLEY M P,SLAWSON C.Cycling of O-linkedβ-N-acetylglucosam ine on nucleocytop lasm ic proteins[J]. Nature,2007,446(7139):1017-1022.
[4]SLAWSON C,HOUSLEY M P,HARTGW.O-GlcNAc cycling:how a single sugar post-translationalmodification is changingthewaywe think aboutsignaling networks[J].Journal of Cellular Biochem istry,2006,97(1):71-83.
[5]KREPPEL L K,HARTGW.Regulation of a cytosolic and nuclearO-GlcNAc transferase Role of the tetratricopeptide repeats[J]. Journal of Biological Chem istry,1999,274(45):32015-32022.
[6]GAO Y,WELLSL,COMERF I,etal.Dynamic O-glycosylation ofnuclearand cytosolic proteins:cloning and characterization of a neutral,cytosolic beta-N-acetylglucosaminidase from human brain[J].The Journal of Biological Chem istry,2001,276(13):9838-9845.
[7]YIW,CLARK PM,MASON D E,etal.Phosphofructokinase 1 glycosylation regulatescellgrow th andmetabolism[J].Science,2012,337(6097):975-980.
[8]RUAN H B,SINGH J P,LIM D,et al.Cracking the O-GlcNAc code in metabolism [J].Trends in Endocrinology& M etabolism,2013,24(6):301-309.
[9]IYER SPN,HARTGW.Roles of the tetratricopeptide repeat domain in O-GlcNAc transferase targeting and protein substrate specificity[J].Journal of Biological Chem istry,2003,278(27):24608-24616.
[10]HANOVER JA,YU S,LUBASW B,et al.M itochondrial and nucleocytoplasmic isoforms of O-linked GlcNAc transferase encoded by a singlemammalian gene[J].Archives of Biochem istry and Biophysics,2003,409(2):287-297.
[11]LANDER E S,LINTON L M,BIRREN B,et al.Initial sequencing and analysis of the human genome[J].Nature,2001,409(6822):860-921.
[12]VENTER JC,ADAMSM D,MYERSEW,etal.The sequence of the human genome[J].Science,2001,291(5507):1304-1351.[13]GOFFEAU A,BARRELLBG,BUSSEY H,etal.Lifew ith 6000 genes[J].Science,1996,274(5287):546-567.
[14]BOTSTEIN D,CHERVITZSA,CHERRY JM.Yeastasamodelorganism[J].Science,1997,277(5330):1259.
[15]REITER L T,POTOCKIL,CHIEN S,et al.A systematic analysis of human disease-associated gene sequences in Drosophila melanogaster[J].Genome Research,2001,11(6):1114-1125.
[16]LAZARUSM B,NAM Y,JIANGi J,etal.Structure of human O-GlcNAc transferase and its complex w ith a peptide substrate[J]. Nature,2011,469(7331):564-567.
[17]徐林,于洪蛟,管栋,等.蛋白分子O-糖基化的研究进展[J].中国细胞生物学学报,2013,35(11):1689-1694. XU Lin,YU Hongjiao,GUAN Dong,et al.Research advances in protein O-GlcNAcylation[J].Chinese Journal of Cell Biology,2013,35(11):1689-1694.(in Chinese)
科技信息
欧盟批准转基因大豆用于食物或动物饲料
欧盟委员会宣布,已批准进口美国孟山都公司研发的Roundup Ready 2 Xtend转基因大豆,同时还宣布批准德国拜耳作物科学公司(Bayer CropScience)的1款转基因大豆产品。在获得欧盟批准后,这2款转基因大豆将被允许在食物或动物饲料中使用,但不得用于种植。欧盟委员会在声明中表示:“这些转基因作物所生产的任何产品都将受制于欧盟严格的标签和可追溯性规定。”
[信息来源]国家质量监督检验检疫总局.加拿大批准苹果酸氢钠作为被膜剂用于部分食品[EB/OL].(2016-7-25). http://jckspaqj.aqsiq.gov.cn/wxts/gwbz/201607/t20160725_470884.htm
Expression of A Human M itochondrial N-acetylglucosam ine Transferase in Saccharomyces cerevisiae
HAN Baoxian,GAO Xiaodong*,NAKANISHIHideki
(School of Biotechnology,Jiangnan University,Wuxi214122,China)
N-acetylglucosam ine(O-GlcNAc)modification on protein serines/threonines is a dynam ic,inducible and abundant post-translational modification,which is found on numerous cytoplasmand nucleus proteins,regulating many cellular process.It has demonstrated that O-GlcNAc plays important roles in some human diseases,such as diabetes and neurodegenerative. O-GlcNAcylation cycle is regulated by O-GlcNAc transferase(OGT)and O-GlcNAcase(OGA)in vivo.There are three isoforms of OGT have been found inmammalian cell.They are nucleoplasm ic OGT(ncOGT),m itochondrial OGT(mOGT)and shorter OGT(sOGT).We have expressed mOGT in yeast cellsw ith a final goal to study its biological function.A certain number of yeast proteins were clearly revealed in mOGT overexpressed cells,demonstrating the activity ofmOGT in yeastcells.Furthermore,itwas found that humanmOGT protein inhibited the cell grow th of yeast.This humanized yeaststrain can beused for studying thebiological function and the regulationmechanism of humanmOGT.
O-GlcNAcmodification,humanization,Saccharomycescerevisiae,m itochondrial O-GlcNAc transferase(mOGT)
Q 786
A
1673—1689(2016)09—0987—06
2015-01-07
教育部科学技术研究重大项目(313027);中央高校基本科研业务费专项项目(JUSRP311A02)。
高晓冬(1965—),男,浙江桐乡人,农学博士,教授,博士研究生导师,主要从事细胞糖生物学方面的研究。E-mail:xdgao@jiangnan.edu.cn

