全局调控因子Lrp的表达强化谷氨酸棒状杆菌发酵生产L-缬氨酸
陈 诚, 李颜颜, 尹良鸿, 胡瑾瑜, 王小元*,3
(1.食品科学与技术国家重点实验室 江南大学,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122;3.江南大学 食品安全与营养协同创新中心,江苏 无锡214122)
全局调控因子Lrp的表达强化谷氨酸棒状杆菌发酵生产L-缬氨酸
陈诚1,2,李颜颜2,尹良鸿2, 胡瑾瑜2,王小元*1,2,3
(1.食品科学与技术国家重点实验室 江南大学,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122;3.江南大学 食品安全与营养协同创新中心,江苏 无锡214122)
作者研究发现全局调控因子Lrp的表达能促进谷氨酸棒状杆菌发酵生产L-缬氨酸,但对菌体生长有一定影响。RT-PCR分析发现:Lrp的表达能提高L-缬氨酸合成相关基因ilvA、ilvBN、ilvC、ilvD及转运相关基因brnFE的转录水平,这也许是L-缬氨酸产量提高的原因。实验还发现:表达含有点突变(Arg39Trp)的Lrp可以进一步提高谷氨酸棒状杆菌L-缬氨酸的产量,而且对菌体生长的影响也减小;这种效果在lrp-brnF间隔区域存在突变的L-缬氨酸生产菌VWB-1中更加明显。在VWB-1中共表达lrp1和brnFE基因,5 L罐发酵L-缬氨酸产量达到42.1 g/L,比对照提高了48.9%。
Lrp;调控;谷氨酸棒状杆菌;L-缬氨酸
支链氨基酸L-缬氨酸(L-valine)在生命代谢中起重要作用,因此被广泛应用于食品、饲料、化妆品和药物等领域。谷氨酸棒状杆菌(Corynebacterium glutamicum)作为一种常见的氨基酸工业生产菌株,也被用于发酵生产L-缬氨酸[1]。近年来随着谷氨酸棒状杆菌全基因组测序的完成[2],代谢工程已被用来改造优化谷氨酸棒状杆菌中L-缬氨酸代谢合成和调控[3-5]。
全局调控蛋白Lrp广泛存在于多种原核微生物中[6]。大肠杆菌(Escherichia coli)Lrp能够调控L-缬氨酸合成和转运的相关基因[7]。谷氨酸棒状杆菌Lrp可以结合在其编码基因lrp及其相邻的支链氨基酸转运蛋白复合体BrnFE的编码基因brnFE之间的间隔区域[8],促进BrnFE表达[9]。在谷氨酸棒状杆菌中过量表达Lrp和BrnFE可以提高支链氨基酸L-异亮氨酸产量[10],但Lrp对谷氨酸棒状杆菌中L-缬氨酸代谢合成及调控作用尚未见报道。
作者在谷氨酸棒杆菌野生型菌株ATCC13869和L-缬氨酸高产菌株VWB-1中过量表达Lrp,研究其对L-缬氨酸产量的影响及其对L-缬氨酸代谢合成和转运相关基因的调控作用。发现VWB-1中Lrp和lrp-brnFE基因间隔序列的突变可提高L-缬氨酸产量,并通过在VWB-1中共同表达lrp和brnFE基因,提高了L-缬氨酸发酵水平。
1 材料与方法
1.1菌株和培养基
本研究所用菌株和载体见表1。大肠杆菌E.coli JM109使用LB培养基 (酵母提取物5 g/L,蛋白胨10 g/L,NaCl 10 g/L;固体培养基加入琼脂粉18 g/L)在 37℃培养。谷氨酸棒状杆菌 C.glutamicum ATCC13869使用LBG培养基(LB培养基加入5 g/L葡萄糖)在30℃培养。菌株C.glutamicum VWB-1为作者所在实验室筛选得到的L-缬氨酸高产菌株,使用LBGB培养基 (LBG培养基加入18.5 g/L脑心浸液)在30℃培养。C.glutamicum电转恢复培养基使用LBHIS培养基(蛋白胨5 g/L,酵母提取物2.5 g/L,NaCl5 g/L,D-山梨醇91 g/L,脑心浸液18.5 g/L;固体培养基加入琼脂粉15 g/L)。必要时添加抗生素卡那霉素和氯霉素,质量浓度为30μg/mL。pJYW-3是基于载体 pEC-XK-99E构建的 E.coli和C.glutamicum穿梭表达载体,pJYW-4是含tac启动子的pJYW-3[11]。

表1 本研究所用菌株和载体Table 1 Strains and p lasm ids used in this study
1.2各种新载体和基因重组菌的构建
本研究所用引物序列及相关信息见表2。引物主要依据C.glutamicum ATCC13032基因组序列[2]设计,LF1突变相关引物LF1-F/LF1-R根据VWB-1测序结果设计。

表2 本研究所用引物Table 2 Primers used in this study

续表2
以C.glutamicum ATCC13869和VWB-1的基因组为模板扩增lrp和brnFE基因。VWB-1来源的lrp(记为 lrp1)基因编码的 Lrp1蛋白相比于ATCC13869来源的Lrp有一个点突变Arg39Trp。以lrp-F和lrp-R为引物扩增基因lrp和lrp1,Bam HI和Eco RI酶切纯化后连接pJYW-4,得到pJYW-4-lrp和pJYW-4-lrp1。以brnFE-F和brnFE-R为引物扩增基因brnFE、Bam HI和Eco RI,酶切纯化后连接pJYW-4,得到pJYW-4-brnFE。以pJYW-4-brnFE为模板,以brnFE-tac-F和brnFE-R为引物扩增得到带有tac启动子和brnFE基因的片段,Eco RI酶切纯化后连接pJYW-4-lrp和pJYW-4-lrp1,得到pJYW-4-lrp-brnFE和pJYW-4-lrp1-brnFE。
以载体pDXW-11[12]为模板,cat-F和cat-R为引物,扩增得到包含3个终止子和SD序列但不含启动子的氯霉素抗性基因cat,BstZ17 I和Pst I酶切纯化后连接pJYW-3,得到启动子检测载体pJYW-3-cat。采用相同方法将cat基因连接到pJYW-4、pJYW-4-lrp和pJYW-4-lrp1,分别得到pJYW-4-cat、pJYW-4-lrp-cat和pJYW-4-lrp1-cat。
以C.glutamicum ATCC13869和VWB-1基因组为模板,LF-1和LF-2为引物,扩增得到包含lrp-brnF间隔区域的片段,测序发现两个来源的lrp-brnF间隔区域序列存在差异。分别以LF-F/LFR和 LF1-F/LF1-R为引物, 直接退火得到ATCC13869和VWB-1来源的lrp-brnF间隔片段,并引入Aat II和Bam HI粘性末端,记为LF和LF1。为检测LF和LF1的启动子活性,将LF和LF1连接pJYW-3-cat,得到pJYW-3-LF-cat和pJYW-3-LF1-cat。为研究lrp和lrp1对LF和LF1活性的影响,将构建的lrp和lrp1片段交错连接pJYW-3-LF-cat和pJYW-3-LF1-cat,得到4个载体pJYW-3-LF-lrp-cat,pJYW-3-LF-lrp1-cat,pJYW-3-LF1-lrp-cat和pJYW-3-LF1-lrp1-cat。
构建的新载体均转入E.coli JM109进行保存和扩增,见图1。大肠杆菌感受态的制备和转化参照文献[13]。谷氨酸棒状杆菌ATCC13869感受态的制备和电转参照文献 [14-15];VWB-1电转化方法为电击2次并在46℃水浴6min。
1.3谷氨酸棒杆菌培养基和发酵条件
1.3.1种子培养基30 g/L葡萄糖,5 g/L(NH4)2SO4,5 g/L尿素,1 g/L KH2PO4,0.04 g/L FeSO4,0.07 g/L MnSO4,0.1 g/L MgSO4,0.7 g/L甲硫氨酸,0.2 mg/L生物素,0.05 mg/L VB1,60 g/L大豆浸出汁。
1.3.2发酵培养基120 g/L葡萄糖,40 g/L(NH4)2SO4,1 g/L KH2PO4,0.04 g/L FeSO4,0.07 g/LMnSO4,0.1 g/L MgSO4,0.7 g/L甲硫氨酸,0.3mg/L生物素,0.05mg/L VB1,10 g/L大豆浸出汁。
1.3.3摇瓶发酵将冻存于甘油管的菌种接种于LBHIS平板,30℃活化48 h。将一环培养物接种于装有25 mL种子培养基的250 mL摇瓶,18 h后转接至装有25mL发酵培养基的250mL摇瓶,初始OD562控制为1.0,30℃、200 r/min发酵96 h。发酵过程另加20 g/L CaCO3控制pH,30 mg/L卡那霉素保持载体。

图1 本研究所构建的载体Fig.1 Plasm ids constructed in this study
1.3.45 L罐发酵同样条件培养200mL种子,接入装有2 L发酵培养基的5 L发酵罐 (Biostat B,Germany)。发酵过程中pH通过补加NH4OH自动控制为7.2,温度保持30℃,通过调节搅拌转速(0 h,200 r/min;12~96 h,提高到600 r/min)和通气量(1.5 vvm)控制溶氧在30%,发酵液葡萄糖质量浓度低于60 g/L时流加葡萄糖溶液。每隔12小时取样,发酵96 h。
1.4各种参数分析方法
1.4.1发酵过程参数分析L-缬氨酸和其他氨基酸含量通过高效液相色谱(AgilentTechnologies 1200 series,USA)测定[16];发酵液葡萄糖含量采用文献[17]方法测定;OD562采用紫外分光光度计(UV-1800,日本岛津公司)测定;细胞干重采用公式
DCW(g/L)=0.649 5×OD562-2.792 5计算[10]。
1.4.2实时定量荧光PCR分析相关基因转录水平差异通过实时定量荧光 PCR分析仪(Applied Biosystems,San Mateo,CA,USA)定量检测。总RNA的提取、纯化、反转录和PCR采用文献[18]的方法,所用引物见表2。不同谷氨酸棒状杆菌菌体收集时间根据各自发酵过程中达到对数中后期的时间确定[10],选择 16srRNA作为内参,数据处理采用Nolden方法[19]。
1.4.3氯霉素抗性基因cat活性分析96孔板测定氯霉素的最小抑菌浓度(MIC)测定参照Pendlenton方法[20]。在较低氯霉素浓度时为获得较精确的结果,浓度采用等差梯度稀释代替等比梯度稀释。氯霉素抗性基因cat编码的氯霉素乙酰转移酶(Cat)活性采用Shaw方法[21]测定,菌体收集方法改为直接超声破碎,然后4℃、12 000 r/min离心10 min(Allegra C-15R,Beckman Coulter,USA),1单位Cat酶活(U)定义为1μmol/min。
2 结果与讨论
2.1Lrp的表达对谷氨酸棒状杆菌生长和发酵生产L-缬氨酸的影响
为了研究Lrp对谷氨酸棒杆菌中L-缬氨酸代谢合成和转运的调控作用,载体pJYW-4、pJYW-4-lrp和pJYW-4-lrp1和pJYW-4-brnFE被构建并分别转入野生型菌株ATCC13869和L-缬氨酸高产菌株VWB-1。摇瓶发酵结果见图2。在ATCC13869中,对照菌株ATCC13869/pJYW-4几乎不产L-缬氨酸(0.2 g/L),而L-缬氨酸在ATCC13869/pJYW-4-lrp和ATCC13869/pJYW-4-lrp1中的产量则分别提高了16.0和17.5倍(3.2、3.5 g/L)。VWB-1作为筛选得到的L-缬氨酸高产菌株,VWB-1/pJYW-4中L-缬氨酸产量为28.1 g/L,而在VWB-1/pJYW-4-lrp和VWB-1/pJYW-4-lrp1L-缬氨酸则分别提高了5.3%和22.0%,达到29.6 g/L和34.3 g/L,见图2。这些数据表明Lrp的表达能明显提高谷氨酸棒状杆菌中L-缬氨酸产量,且Lrp1对产量提升更多。

图2 谷氨酸棒状杆菌ATCC13869和VWB-1摇瓶发酵Fig.2 Flask fermentation of C.glutamicum ATCC13869 and VWB-1
2.2Lrp的表达对谷氨酸棒状杆菌L-缬氨酸合成和转运相关基因的转录水平的影响
为了研究Lrp对谷氨酸棒状杆菌中L-缬氨酸代谢合成和转运的影响,对各种谷氨酸棒状杆菌中L-缬氨酸合成和转运相关基因 ilvA、ilvBN、ilvC、ilvD、ilvE、brnFE和lrp进行了实时定量荧光PCR分析。如图3所示,在ATCC13869中表达Lrp和Lrp1时,ilvA、ilvBN、ilvC、ilvD、lrp和brnFE转录水平上调,而ilvE略微下调,Lrp和Lrp1影响程度差别不大;而在VWB-1中表达Lrp和Lrp1时,大多数基因转录水平变化趋势和在ATCC13869中一致。这表明Lrp能提高谷氨酸棒状杆菌L-缬氨酸合成和转运相关基因的转录水平,这可能就是L-缬氨酸的产量提升的主要原因。值得注意的是,在VWB-1中Lrp能使lrp自身转录显著上调(17.0倍),而突变Lrp1仅仅使lrp自身转录略有上调(2.9倍);而在ATCC13869中并没有这种差异现象。这表明Lrp在谷氨酸棒状杆菌中还能提高自身编码基因lrp转录水平,而突变Lrp1在VWB-1中减弱了对自身编码基因lrp1的调控作用。为了揭示这种差异的来源,将来自于谷氨酸棒状杆菌ATCC13869和VWB-1的Lrp以及lrp-brnFE间隔区域进行了测序,发现Lrp和Lrp1存在一个点突变Arg39Trp,而lrp-brnFE间隔区域序列也存在突变,见图4。在谷氨酸棒状杆菌中,Lrp可以结合在间隔区域(加粗标注位置),促进BrnFE表达[8]。在大肠杆菌中,Lrp(与谷氨酸棒状杆菌Lrp同源性仅36%)N端为活性区域,C端区域与DNA结合。可以调控的基因包括lrp自身的转录[7]。Lrp1的突变靠近C端,lrp-brnFE间隔区域在靠近lrp端Lrp结合位点存在点突变,都可能影响与Lrp蛋白的结合及调控。
推测lrp在VWB-1中自身转录水平显著提高与Lrp和LF的相互作用有关。Lrp1的突变抑制与近lrp端DNA结合,从而抑制lrp转录。而LF1的突变促进Lrp蛋白与DNA的结合,从而促进lrp和brnFE的转录;但没有发现这两个突变对brnFE的转录的影响。因此在VWB-1中表达Lrp时,正常Lrp蛋白和突变LF1共同作用下,lrp转录水平显著提高。而在VWB-1中表达Lrp1时,Lrp1和LF1共同作用使lrp1的转录水平提高幅度有限;结合发酵结果分析,Lrp1和LF1共同作用在增加L-缬氨酸产量的同时弱化了生长抑制。
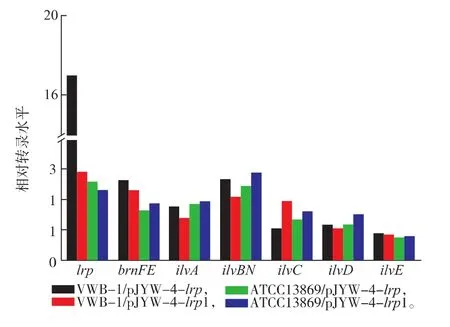
图3 谷氨酸棒状杆菌中L-缬氨酸合成和转录相关基因的实时荧光定量PCR分析Fig.3 RT-PCR analysis of genes involved in L-valine synthesisand gene transcription of Corynebacterium glutam icum
2.3谷氨酸棒状杆菌Lrp1编码基因及其上游序列LF1的突变对Lrp自身转录的影响
为验证以上关于Lrp和LF相互作用的推测,作者构建一系列带有lrp-brnF间隔序列LF和LF1的启动子检测载体。氯霉素乙酰转移酶Cat被选作报告基因。这些载体被转入E.coli JM109,并采用96孔板法测定氯霉素的最小抑菌浓度MIC(图5a)。带有tac启动子的JM109/pJYW-4-cat、JM109/pJYW-4-lrp-cat和JM109/pJYW-4-lrp1-cat的氯霉素MIC分别为60、30、30mg/L。在cat之前串联lrp或lrp1表达都引起Cat表达量下降,且Lrp和Lrp1影响效果相同,排除Lrp1的突变对pJYW-4自身tac启动子的影响。对照JM109/pJYW-4和JM109/pJYW-3-cat氯霉素MIC仅为0.5 mg/L;而JM109/pJYW-3-LF-cat和JM109/pJYW-3-LF1-cat氯霉素MIC分别提高到8mg/L和10mg/L,表明在cat之前连接的LF和LF1具有微弱的启动子活性。
为模拟谷氨酸棒状杆菌基因组中LF与lrp的位置组合,在LF(LF1)与cat之间连接lrp(lrp1)。得到的JM109/pJYW-3-LF-lrp-cat和JM109/pJYW-3-LF1-lrp-cat氯霉素MIC分别提升到12 mg/L和18mg/L,而JM109/pJYW-3-LF-lrp1-cat和JM109/ pJYW-3-LF1-lrp1-cat MIC分别下降到6 mg/L和8 mg/L。这表明LF和LF1即使受到调控也不具备较强的启动子活性。正常Lrp的表达能促进LF和LF1后Cat的表达从而提高MIC,突变Lrp1反而起抑制作用。与LF相比,在受到Lrp或Lrp1调控时LF1更能促进Cat的表达。
含有各种pJYW-3系列载体的E.coli JM109菌的Cat酶活测定结果(图5b)与MIC测定结果基本吻合。JM109/pJYW-3-cat的Cat酶活很低,JM109/ pJYW-3-LF-cat和JM109/pJYW-3-LF1-cat有较低的酶活。LF与lrp串联后,LF1使酶活上升而lrp1使酶活下降。JM109/pJYW-3-LF1-lrp-cat酶活最高。

图5 大肠杆菌JM 109氯霉素最小抑菌浓度和Cat酶活Fig.5 M IC of chloram phenicol and activity of Cat in E.coli JM 109
2.4共同表达 lrp1-brnFE对谷氨酸棒状杆菌VWB-1发酵生产L-缬氨酸的影响
为了进一步促进VWB-1发酵生产L-缬氨酸,将转运蛋白BrnFE与Lrp1共同表达,构建了重组菌VWB-1/pJYW-4-lrp1-brnFE。摇瓶发酵产量较对照菌VWB-1/pJYW-4提高了35.6%,达到38.1g/L。这表明共同表达lrp1和brnFE可以提高谷氨酸棒状杆菌VWB-1 L-缬氨酸产量。进一步对VWB-1/ pJYW-4-lrp1-brnFE进行5 L罐发酵,见图6。发酵96 h,L-缬氨酸产量提高了48.9%,达到42.1 g/L,产率0.439 g/(L·h),比产量0.905 g/(L·g干细胞),糖酸转化率0.243 g/g葡萄糖。发酵终了时葡萄糖质量浓度已经很低,但菌体量和L-缬氨酸质量浓度还有上升趋势。再补加葡萄糖并延长发酵时间L-缬氨酸产量可能还会提高,但发酵周期过长对产率有不利影响。通过培养基优化、发酵策略优化或者一些代谢改造减弱或消除Lrp1的生长抑制,产量可能会进一步提高。
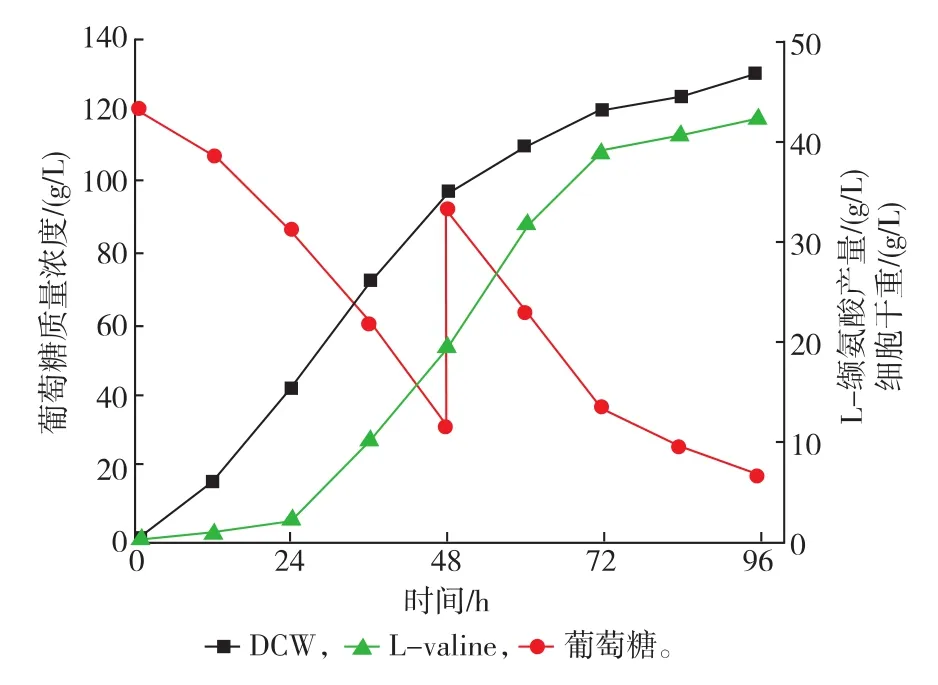
图6 VWB-1/pJYW-4-lrp1-brnFE 5 L罐发酵Fig.6 Fed-batch fermentation of VWB-1/pJYW-4-lrp1-brnFE
3 结语
研究发现全局调控因子Lrp能提高谷氨酸棒状杆菌L-缬氨酸合成及转运相关的基因转录水平,从而提升发酵L-缬氨酸产量,但对菌体生长有抑制作用。VWB-1中Lrp1和LF1突变共同作用影响Lrp1与lrp-brnF间隔DNA结合,一方面促进L-缬氨酸相关基因表达,另一方面弱化生长抑制,因此产量提升效果最显著。在VWB-1中共同表达Lrp1和BrnFE可进一步提高其L-缬氨酸产量。
[1]Park JH,Sang Y L.Fermentative production ofbranched chain amino acids:a focusonmetabolic engineering[J].ApplM icrobiol Biotechnol,2009,85:491-506.
[2]Kalinowski J,Bathe B,BartelsD,etal.The complete Corynebacterium glutamicum ATCC13032 genome sequenceand its impact on the production of L-aspartate-derived amino acidsand vitamins[J].JBiotechnol,2003,104:5-25.
[3]Radmacher E,Vaitsikova A,Burger U,etal.Linking centralmetabolism w ith increased pathway flux:L-valine accumulation by Corynebacterium glutamicum[J].Appl Environ M icrobiol,2002,68:2246-2250.
[4]LeyvalD,Delaunay S,Goergen JL,etal.Characterisation of the enzyme activities involved in the valine biosynthetic pathway in a valine producing strain of Corynebacterium glutamicum[J].J Biotechnol,2003,104:241-252.
[5]王小元.谷氨酸棒状杆菌生产缬氨酸的代谢工程研究进展[J].食品与生物技术学报,2012,31(3):225-231. WANG Xiaoyuan.Metabolic engineering in C.glutamicum to increase L-valineproduction[J].J Food Sci Biotech,2012,31(3):225-231.(in Chinese)
[6]Lintner RE,M ishra PK,Srivastava P,etal.Limited functional conservation ofaglobal regulator among related bacterialgenera:Lrp in Escherichia,Proteus and Vibrio[J].BMC M icrobiol,2008,8:60.
[7]Joseph M C,Rowena G M.The leucine-responsive regulatory protein,a global regulator ofmetabolism in Escherichia coli[J]. M icrobiol Reviews,1994,58:466-490.
[8]Lange C,MustafiN,Frunzke J,etal.Lrp of Corynebacterium glutamicum controls expression of the brnFE operon encoding the exportsystem for L-methionineand branched-chain amino acids[J].J Biotechnol,2012,158:231-241.
[9]KennerknechtN,Sahm H,Yen M,etal.Exportof L-Isoleucine from Corynebacterium glutamicum:a two-gene-encodedmember ofa new translocator family[J].J Bacteriol,2002,184:3947-3956.
[10]Yin L,Shi F,Hu X,et al.Increasing L-isoleucine production in Corynebacterium glutamicum by overexpressing global regulatorLrp and two-componentexportsystem BrnFE[J].J ApplM icrobiol,2013,114:1369-1377.
[11]Hu J,LiY,Zhang H,etal.Construction of a novelexpression system foruse in Corynebacterium glutamicum[J].Plasm id,2014,75:18-26.
[12]Xu D,Tan Y,Li Y,et al.Construction of a novel promoter-probe vector and its application for screening strong promoter for Brevibacterium flavum metabolic engineering[J].W orld JM icrobiol Biotechnol,2011,27:961-968.
[13]Sambrook J,RussellDW.Molecular cloning:a laboratorymanual[M].New York:Cold Spring Harbor Laboratory Press,1996.
[14]Van der Rest M E,Lange C,Molenaar D.A heat shock follow ing electroporation induces highly efficient transformation of Corynebacterium glutamicum w ith xenogeneic plasmid DNA[J].ApplM icrobiol Biotechnol,1999,5:541-545.
[15]Xu D,Tan Y,Huan X,et al.Construction of a novel shuttle vector for use in Brevibacterium flavum,an industrial amino acid producer[J].JM icrobiolM ethods,2010,80:86-92.
[16]Koros A,Varga Z S,Molnar P.Simultaneous analysis of am ino acids and am ines as their ophthalaldehyde-ethanethiol-9-fluorenylmethyl chloroformate derivatives in cheese by high-performance liquid chromatography[J].J Chromatogr A,2008,1203:146-152.
[17]M illerG L.Use of dinitrosalicylic acid reagent fordeterm ination of reducing sugars[J].Anal Chem,1959,31:426-428.
[18]Livak K J,Schmittgen TD.Analysisof relative gene expression data using real-time quantitative PCR and the 2–ΔΔCTmethod[J]. M ethods,2001,25:402-408.
[19]Nolden L,Farw ick M,Burkovski,et al.Glutamine synthetases of Corynebacterium glutamicum:transcriptional control and regulation ofactivity[J].FEMSM icrobiol Lett,2001,201:91-98.
[20]Pendleton S J,Story R,O’Bryan C A,et al.Brief communication:a membrane filtration method for determining minimum inhibitory concentrationsofessentialoils[J].Agric Food Anal Bacteriol,2012,2(2):88-93.
[21]Shaw W V.Chloramphenicol acetyltransferase from chloramphenicol-resistant bacteria[J].M ethods Enzymol,1975,43:737-755.
Expression of G lobal Regulator Lrp Facilitates L-Valine Production in Corynebacterium glutam icum
CHEN Cheng1,2,LIYanyan2, YIN Lianghong2, HU Jinyu2, WANG Xiaoyuan*1,2,3
(1.State Key Laboratory of Food and Science Technology,Jiangnan University,Wuxi 214122,China;2.School of Biotechnology,Jiangnan University,Wuxi 214122,China;3.Collaborative Innovation Center of Food Safety and Nutrition,Jiangnan University,Wuxi 214122,China)
L-valine is one of the branched chain am ino acids w idely used in food,feed,and drug industries.In this study,the global regulator Lrp was found to improve L-valine production in C. glutamicum,butslightly inhibit the grow th.RT-PCR analysisshowed thatexpression of lrp increased the transcriptional levels of genes related to L-valine biosynthesis(ilvA,ilvBN,ilvC,ilvD)and export(brnFE),whichm ightbe the reason for the improved L-valine production.A single amino acid substitution(Arg39Trp)in Lrp reduced the grow th inhibition and led to higher L-valine production,especially in L-valine production strain C.glutamicum VWB-1 which containsmutations in the region between lrp and brnF.By co-expressing lrp1 and brnFE in VWB-1,L-valine productionof fed-batch fermentation reached 42.1 g/Lwhichwas48.9%increase.
Lrp,regulation,Corynebacterium glutamicum,L-valine
Q 933
A
1673—1689(2016)09—0920—08
2014-09-09
国家自然科学基金项目(31370131);江苏省“六大人才高峰”资助项目(2012-SWYY-008)。
王小元(1956—),男,山西垣曲人,博士,教授,博士研究生导师,主要从事工业微生物代谢工程优化和食源性病原微生物的致病机制方面的研究。E-mail:xwang@jiangnan.edu.cn

