纹带棒状杆菌致机会性感染的研究进展
葛燕梅 综述,童华诚 审校
东南大学医学院附属南京同仁医院医学检验科,江苏南京 211102
棒状杆菌属是一类菌体一端或两端膨大呈棒状的革兰阳性杆菌,菌体染色不均匀,呈不规则栅栏状排列。纹带棒状杆菌属于棒状杆菌属,通常认为其是人皮肤和鼻咽部等黏膜的正常寄生菌。2000年之前,由于病原菌鉴定技术手段和条件的限制以及对此类细菌致病性认识的不足,大部分临床实验室通常难以将纹带棒状杆菌准确鉴定至种水平,往往一律视作污染菌处理,所以罕有纹带棒状杆菌引起的感染病例的报道。近年来,随着抗菌药物、免疫抑制剂和激素的广泛使用以及侵入性操作的增加,纹带棒状杆菌引起医院内感染的病例报道越来越多,逐渐成为重要的条件致病菌,常引起机会性感染,如肺部感染、心内膜炎、血流感染(BSI)和导管相关感染等,且多为重症感染,甚至危及患者生命。本文将对国内外纹带棒状杆菌引起感染的研究现状进行综述,重点关注纹带棒状杆菌引起BSI的研究现状。
1 纹带棒状杆菌的病原学特征
纹带棒状杆菌是需氧无芽孢类白喉棒状杆菌属细菌,是人类皮肤微生物的一部分,能够在院内传播或暴发。纹带棒状杆菌生长较缓慢,培养24 h后,菌落呈圆形凸起,表面湿润光滑,呈奶油状,不溶血,边缘完整,直径为1.0~1.5 mm[1]。革兰染色表现为革兰阳性杆菌,V形,栅栏状,略微弯曲,侧边不平,末端略膨大,单个或成双排列。菌落似小的凝固酶阴性的葡萄球菌,API Coryne系统可鉴定,但多数还需要附加试验。纹带棒状杆菌触酶试验阳性,所有菌株都能水解酪氨酸,对O129试验敏感。部分菌株CAMP反应阳性,但对CAMP的反应没有其他菌种强。主要生化反应结果见表1。
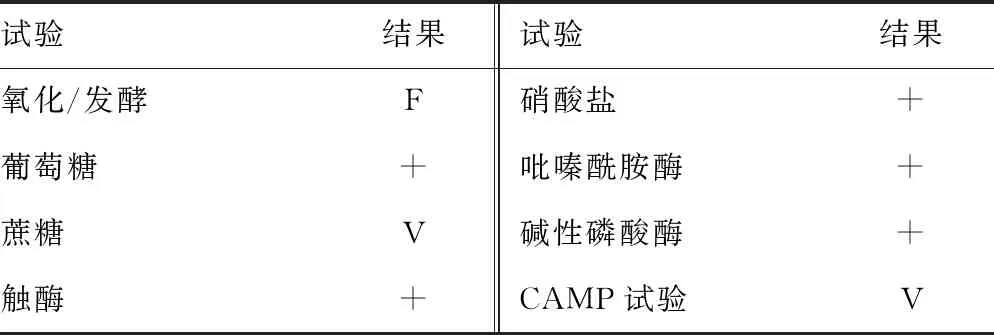
表1 纹带棒状杆菌的主要生化反应结果
2 纹带棒状杆菌临床分离株分子分型和耐药性特征
目前,纹带棒状杆菌同源性分析中运用最广泛的技术是脉冲场凝胶电泳(PFGE),该技术被认为是病原微生物学细菌分子分型研究的“金标准”。林冬玲等[2]的研究中61株临床分离的纹带棒状杆菌共分为34个型别;王雪冰等[3]的研究中197株临床分离的纹带棒状杆菌共分为82个型别;ALIBI等[4]的研究中63株临床分离的纹带棒状杆菌共分为22个型别;NAVAS等[5]的研究中64株临床分离的纹带棒状杆菌共分为46个型别。综合分析国内外这些研究结果,说明纹带棒状杆菌的基因呈多样性,而且不同的地区和医院会有不同的优势型别菌株出现。这些优势型别菌株的出现说明纹带棒状杆菌可在医院内传播。
细菌多重耐药(MDR)是指一种细菌对3类或3类以上抗菌药物同时耐药。近年来,纹带棒状杆菌MDR菌株在不断增加。有研究表明,纹带棒状杆菌能通过异体传播,它的MDR菌株能引起医院内感染暴发[6]。纹带棒状杆菌耐药现象的发生导致临床抗菌药物治疗失败和病程迁延,从而增加临床治疗负担。
相关研究报道,纹带棒状杆菌对万古霉素和利福平等抗菌药物表现出较好的敏感性,而对β-内酰胺类、大环内脂类、氨基糖苷类、四环素类抗菌药物及克林霉素表现出较高水平的耐药性[7-8]。王雪冰等[3]研究中197株纹带棒状杆菌分离株中99.5%的被测菌株至少对1种抗菌药物表现耐药,ALIBI等[4]的研究中93.7%的被测菌株表现出至少对1种抗菌药物耐药。
纹带棒状杆菌的耐药机制尚不清楚,但很多学者对此进行了研究。GOMILA等[9]的研究表明,棒状杆菌属的氟喹诺酮耐药机制是gyrA基因发生突变引起DNA螺旋酶结构异常,使结合药物能力发生改变从而导致耐药;ALIBI等[4]研究亦证实大多数对氟喹诺酮耐药的纹带棒状杆菌菌株表现出gyrA基因的双重突变;CAMPANILE等[10]的研究表明,纹带棒状杆菌菌株的质粒pTP10携带的耐药基因erm(X)、tetA/B、cmxA/B、aphA1分别针对大环内酯类、四环素类、氯霉素类和氨基糖苷类抗菌药物耐药;国内学者曹俊敏等[11]亦发现,纹带棒状杆菌菌体编码ermX基因、tetAB基因,从而导致纹带棒状杆菌对大环内酯类和四环素类抗菌药物的耐药性;GALIMAND等[12]研究发现,纹带棒状杆菌含有氨基糖苷类3-N-乙酰转移酶AAC(3)-XI,因而对氨基糖苷类抗菌药物产生耐药性。
3 纹带棒状杆菌引起的非BSI现状
检索国内外关于纹带棒状杆菌感染病例的报道,发现国外对于纹带棒状杆菌引起各种不同类型感染的病例报道较多。在下呼吸道感染患者的痰液或气管抽吸物中培养出纹带棒状杆菌的病例报道最多见,包括肺部感染、胸腔积液、肺脓肿等[13-15]。其次是纹带棒状杆菌感染导致不同类型心内膜炎的病例报道[16-18],其他关于纹带棒状杆菌感染引起的关节炎、脑膜炎等也有报道[19-21]。表2呈现了近10年来国外关于纹带棒状杆菌感染的具体病例情况[13-21]。分析纹带棒状杆菌感染病例的特点发现,大多数报道的患者均为老年男性,而且合并基础疾病。因此,在该类患者微生物培养提示纹带棒状杆菌生长时,不能轻易判断为污染菌,需结合其他感染指征综合判断,并根据药敏结果及时进行干预。国内关于纹带棒状杆菌引起感染的单个病例报告较少,1994年孙波[22]报道了3例纹带棒状杆菌所致的肾小球肾炎病例,2001年有研究报道了纹带棒状杆菌引起的中耳炎病例,此后陆续有纹带棒状杆菌引起肺部感染、腹腔感染、脑膜炎、切口感染等的病例报告[23-29]。
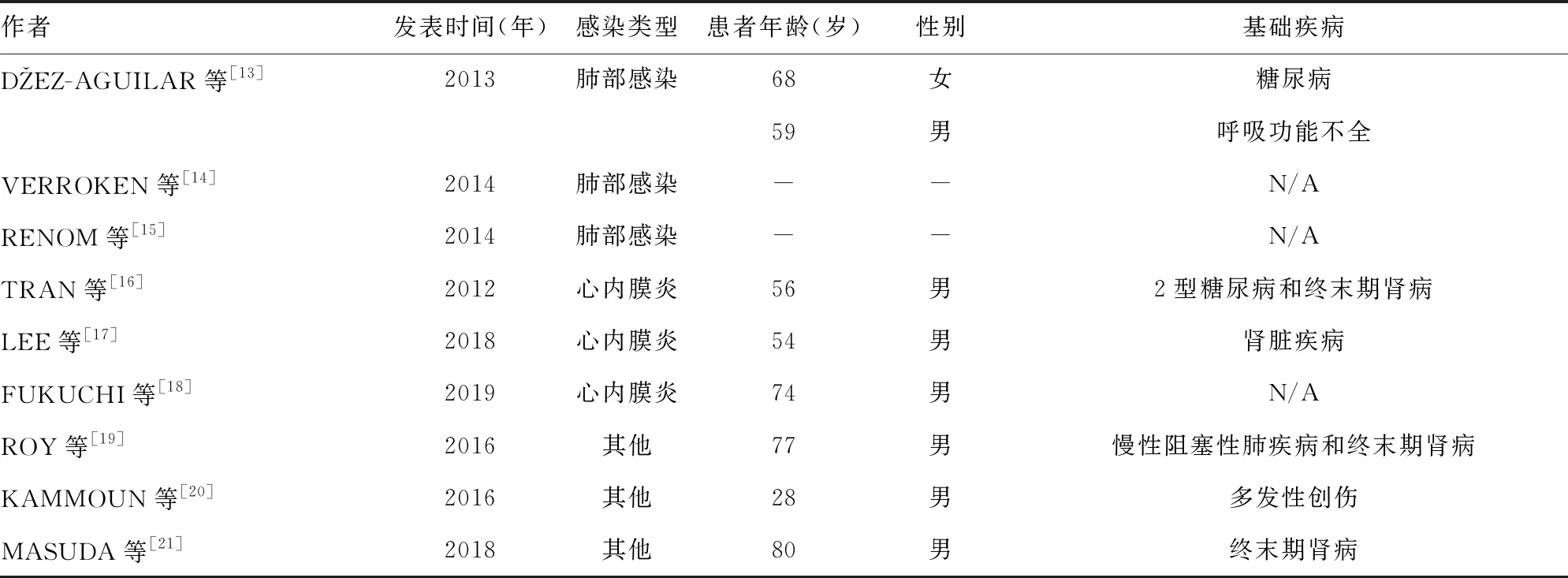
表2 近10年国外纹带棒状杆菌引起的非BSI病例报告
4 纹带棒状杆菌引起BSI的病例报道
BSI是细菌、真菌等病原微生物侵入血液循环生长、繁殖并产生大量毒素和代谢产物而引起的严重的全身感染性疾病,可导致感染性休克、弥散性血管内凝血、急性呼吸窘迫综合征以及多器官功能障碍综合征等一系列并发症,病死率高。随着广谱抗菌药物、免疫抑制剂的广泛应用以及静脉置管等侵入性操作的增加,BSI的发生率持续升高,造成严重危害。目前,国内将血培养分离出病原微生物作为BSI的病原学诊断依据,血培养被认为是诊断BSI的参考标准[30]。近年来,随着病原学鉴定技术的发展,由纹带棒状杆菌引起BSI的病例报道也越来越多。1989年国外就有纹带棒状杆菌引起BSI的病例报道[31],此后陆续有类似的病例报道,直到近10年纹带棒状杆菌引起BSI的相关病例报道才慢慢增多(表3)[32-38]。而国内关于纹带棒状杆菌引起BSI的病例报道较少,典型的BSI病例为2017年江鸿等[39]报道的导管相关性纹带棒状杆菌BSI 1例。分析目前关于纹带棒状杆菌引起的BSI研究现状发现,由纹带棒状杆菌引起的BSI主要发生在有基础疾病且进行过静脉置管操作的患者,主要为导管相关BSI(CRBSI)。

表3 近10年纹带棒状杆菌引起的BSI的病例报道
CRBSI是指患者有BSI的临床表现,如发热、寒战等,从导管和外周血培养中分离出相同的病原菌,且没有其他感染源的侵入。如果中心静脉置管的患者出现菌血症症状,且外周静脉血培养及导管尖端培养出同一种菌,即可考虑诊断CRBSI。一旦怀疑CRBSI,无论是否拔除导管,都应该立即进行血培养和经验性治疗。细菌可能会附着于导管内壁,于其表层形成一层生物膜,正常治疗浓度的抗菌药物很难杀灭生物膜内的细菌,因此怀疑CRBSI时宜采取导管抗菌药物封闭疗法和全身性抗菌药物联合治疗,一旦明确病原菌后,应立即依据药敏试验结果调整抗菌药物,使经验治疗尽快转变为目标治疗。近期笔者所在医院报道了1例纹带棒状杆菌引起的CRBSI病例[38],该病例与之前国外报道的纹带棒状杆菌引起的CRBSI病例具备多项相同特征:中老年患者、有多种基础疾病史、长时间静脉导管置入、免疫功能受损以及使用多种抗菌药物等。因此,可以将这些特征视为纹带棒状杆菌引起CRBSI的高危因素。
笔者所在医院分离的该株纹带棒状杆菌对万古霉素敏感,对青霉素、环丙沙星、克林霉素和红霉素均耐药。根据之前的研究分析引起院内感染的纹带棒状杆菌多为MDR菌,但迄今未发现对万古霉素耐药菌株。因此,在临床上对于具备高危因素的患者,应重视纹带棒状杆菌引起的感染,根据药敏试验结果,及时调整抗菌药物的使用,做到有效干预。
5 小 结
随着医学科学和病原菌鉴定技术的发展,各种侵入性操作的增加,感染性疾病的病原菌谱也发生了显著变化。以往被认为是非致病菌及一些“正常菌群”侵犯免疫力低下的宿主引起感染的情况越来越多见。作为环境和人体正常寄生菌之一的纹带棒状杆菌引起各种机会性感染病例的报道也逐渐增多,对纹带棒状杆菌引起的包括脓毒症等严重感染的研究也有了新的进展。由于此类细菌不容易被准确鉴定和识别,且MDR的感染菌株多次检出甚至引发医院内感染,因此,临床对于使用侵入性操作和免疫力低下的患者应予以充分的关注,对此类病原体引起的严重感染应给予适当、及时和有针对性的治疗,进一步重视临床微生物学在抗感染治疗过程中的作用和地位。

