酿酒酵母SPS途径调控因子Stp1的泛素化过程
李应宇, 吕永坤, 周景文, 堵国成, 陈 坚*
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122)
酿酒酵母SPS途径调控因子Stp1的泛素化过程
李应宇1,2,吕永坤1,2,周景文1,2,堵国成1,2,陈坚*1,2
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122)
研究酿酒酵母SPS途径关键调控因子Stp1p泛素化调控机制。通过构建基于双分子荧光互补技术的泛素化检测载体、泛素化位点定点突变及突变体氨基酸利用这三个层面来研究Stp1p的泛素化过程。通过对Stp1p的潜在的4个泛素化位点突变结果表明,与Stp1p相比,各突变体的荧光强度均有一定程度的减弱,其中三重突变体Stp1K49,129,113R荧光强度明显弱化。表明潜在的泛素化位点突变后,Stp1p的泛素化过程受到阻遏。进一步的氨基酸利用实验表明,泛素化位点突变对于调控菌体氮源利用具有重要的作用。上述结果说明,泛素化位点突变可以调控Stp1p的泛素化过程,进而影响菌体氮源的利用。
SPS途径;双分子荧光互补;氮代谢阻遏;尿素,氨基酸
酿酒酵母细胞内有着精确的代谢调控途径,以保证其可以对外界环境的变化做出准确的应答,维持细胞的正常生长[1]。当培养基中存在偏好型氮源(如谷氨酰胺、天冬酰胺、铵盐等)时,会抑制非偏好型氮源(如精氨酸、尿素、脯氨酸等)的利用。而当这些偏好型氮源耗尽后,细胞才开始利用非偏好型氮源。这种优势氮源的存在抑制贫乏氮源利用的现象称为氮代谢阻遏 (Nitrogen Catabolite Repression,NCR)[2]。除了NCR调控途径,还有SPS信号途径及泛素-蛋白酶解途径。胞外的氨基酸信号可以通过SPS信号传导至细胞核内,从而激活相关透性酶(AAP)基因的表达[3]。SPS信号途径主要由细胞膜上的Ssy1-Ptr3-Ssy5复合体、转录激活因子Stp1组成[4]。研究表明,调控因子Stp1同时也受到TOR途径中的磷酸激酶复合体TORC1的调控[5]。胞外氮源的氮代谢调节分为两个层面,一方面是基因转录水平的表达或抑制[6],另一方面是细胞膜上氨基酸透性酶的稳定与降解[7]。而且,细胞膜上的氨基酸转运蛋白的降解主要是通过泛素-蛋白酶解途径被转运到液泡内得以降解[8]。当培养基中存在过量的甲硫氨酸时,会同时激活SPS信号途径及甲硫氨酸代谢途径[9]。甲硫氨酸代谢途径中两个关键的透性酶Mup1p和Mup3p能够特异性转运甲硫氨酸,而SPS途径下游的透性酶一般均为非特异性透性酶[10]。当细胞中的甲硫氨酸足以维持生长时,透性酶Mup1p和Mup3p会被转运至液泡内降解[11],见图1。

图1 SPS途径中关键因子Stp1p的调控机理Fig.1 Regulation mechanism of key regulator Stp1p of SPS pathway
作者采用双分子荧光互补技术检测泛素化,基于双分子荧光互补技术构建了一个泛素化检测载体,将待研究蛋白质的编码序列(去除终止密码子)插入到检测载体的多克隆位点,表达的蛋白质末端带有荧光分子的羧基端,表达的泛素分子末端带有荧光分子的氨基端。如果待研究蛋白质受到泛素化调控,则该蛋白质与泛素分子的结合将使荧光分子的羧基端、氨基端重新结合成一个完整的荧光分子,因而在荧光显微镜下可以观察到荧光。作者主要研究转运蛋白Stp1p的泛素化调控机制。根据泛素化位点在线软件UbPred[12]预测Stp1p可能的泛素化位点,该软件预测准确率达到72%。对于含有特定结构的蛋白质,其准确率可高达85%[13]。通过定点突变的方法,研究泛素化位点突变对Stp1p泛素化的影响以及细胞对氨基酸利用的影响,在泛素化过程层面为深入研究酿酒酵母氮源代谢调控提供可靠的理论基础及依据。
1 材料与方法
1.1材料
1.1.1菌株与质粒酿酒酵母 Saccharomyces cerevisiae CEN.PK2-1D-Δubi4(MATαura3-52;trp1-289;leu2-3,112;his3Δ1;MAL2-8C;SUC2)和泛素化检测载体pUbDetec16:作者所在研究室构建[14]。大肠杆菌E.coli JM109用于质粒载体构建。
1.1.2培养基及培养条件YNB液体培养基:1.74 g/L酵母基础氮源(不含氨基酸,不含硫酸氨),20 g/LD-glucose,5 g/L硫氨酸。亮氨酸、尿嘧啶双缺陷型培养基 (DM-leu-,ura-):YNB培养基中添加50 μg/mL组氨酸、50μg/mL色氨酸。YNB完全培养基:YNB培养基中添加50μg/mL组氨酸、50μg/mL色氨酸、50μg/mL亮氨酸、50μg/mL尿嘧啶。YPD培养基:20 g葡萄糖,20 g蛋白胨,10 g酵母粉,定容至1 L。LB培养基:胰蛋白胨10 g,酵母粉5 g,氯化钠10 g,调节pH至7.0,定容至1 L。固体培养基为相应的液体培养基中加入20 g/L琼脂粉。
E.coli JM109培养条件:从LB平板上挑取E.coli JM109单菌落至加有20 mL LB的250 mL的摇瓶中,置于37℃转速为200 r/min的摇床上培养。S.cerevisiae CEN.PK2-1D-Δubi4培养条件:1)化学法转化培养条件:挑取S.cerevisiae CEN.PK2-1D-Δubi4单菌落至含有20 mL YPD的250 mL的摇瓶,置于30℃转速为200 r/min的摇床上培养12~16 h,离心收集细胞制备感受态。2)生理实验养条件:从斜面中接种一环S.cerevisiae CEN.PK2-1D-Δubi4细胞于20 mL加有色氨酸和组氨酸的YNB培养基中,置于30℃转速为200 r/min的摇床上。生长至对数中期,以5%的转接体积分数转接入含有20mL的YNB的培养基(加入了生长所必需的氨基酸)中,于30℃转速为200 r/min的摇床上生长到对数期离心收集细胞。用无菌水洗涤2次后,在磷酸盐缓冲液中(与所取菌液等体积)重悬后制作玻片观察荧光。
1.1.3主要试剂与仪器S.cerevisiae总DNA的提取、感受态的制备以及质粒的转化:醋酸锂转化法[15];E.coli JM109感受态的制备:使用上海生工有限公司一步法制备大肠杆菌感受态试剂盒;大肠杆菌质粒的提取:上海生工有限公司质粒提取试剂盒;DNA的片段回收和纯化:Fermentas公司相关的试剂盒;限制性内切酶、连接酶和DNA聚合酶等:大连宝生物有限公司。
1.2方法
1.2.1pUbDetec16系列表达载体的构建和转化
根据NCBI上发布的S.cerevisiae S228C的STP1基因(GenBank accession number:NC_001136)序列设计引物,用于从S.cerevisiae基因组中扩增基因和重组质粒的鉴定,见表1。引物两端分别加有限制性内切酶EcoR I和Sma I。用限制性内切酶分别酶切载体pUbDetec16和PCR反应的产物,把经过纯化的线性化的质粒和目标DNA片段以1∶4的比例混合,16℃连接过夜。将连接混合液转化E.coli JM109涂布在含有100μg/mL氨苄青霉素的LB平板上,12 h后随机挑选克隆子进行菌落PCR验证。挑选阳性转化子送上海生工测序。挑选测序正确的重组质粒利用醋酸锂转化法转化S.cerevisiae CEN.PK2-1DΔubi4,涂布DM-leu-,ura-平板。于30℃培养箱培养3~4 d,挑选单菌落进行菌落PCR验证后接种相应的液体培养基,待生长至对数期转接以便于后续试验。

表1 STP1定点突变所用引物Table 1 Primers used for the site directed mutagenesis of STP1
1.2.2重组质粒转化子荧光检测待研究蛋白编码基因(不含终止密码子)插入至pUbDetec16多克隆位点处,使用醋酸锂转化法转化 S.cerevisiae CEN.PK2-1D-Δubi4。涂布DM-leu-,ura-平板,3~4 d后挑取单菌落进行菌落PCR验证。将阳性转化子接DM-leu-,ura-液体培养基,待生长至对数中期时,于8 000 r/min离心5min去上清液。用无菌水洗涤细胞,重新在添加有相应氨基酸的YNB培养基中重悬菌体,30℃、200 r/min继续培养90 min。使用分光光度计测定OD600,并取200 uL于96孔全黑酶标板,在发射光/激发光为485/524条件下检测荧光强度。检测荧光前需对菌悬液进行预处理。取适量菌悬液,离心去上清液。再用磷酸盐PBS洗涤细胞,再次离心去上清液,最后再用等体积PBS重悬菌体,取200 uL于全黑的荧光酶标板上检测,分别计算其置信度。
1.2.3泛素化位点定点突变通过泛素化检测表明调控因子Stp1p受到泛素化调控。使用在线泛素化位点预测软件UbPred对Stp1p的泛素化位点进行预测,其中潜在的泛素化位点有第49、60、113、129位赖氨酸。分别对这4个赖氨酸位点进行突变,得到7个突变体组合:Stp1pK49R,Stp1pK60R,Stp1pK113R,Stp1pK129R,Stp1pK49,129R,Stp1pK49,129,113R,Stp1pK49,60,113,129R。分别计算各突变体的荧光强度变化率(CR)。

其中,F阳为阳性对照的单位荧光强度;F突变体为突变体的单位荧光强度;F阴为阴性对照的单位荧光强度。
1.2.4系列突变体对酿酒酵母氮源利用的影响将 活 化 的 pUbDetec16、Stp1p及 系 列 突 变 株Stp1pK49,129R、Stp1pK49,113,129R、Stp1pK49,60,113,129R接种 YNB液体培养基(不添加硫酸铵),并添加以下10种氨基酸Asn、Gln、Phe、Met、Trp、Leu、Arg、Pro、Ala,各种氨基酸的终浓度均为5 mmol/L,置于30℃,200 r/min摇床培养48 h。分别在接种前及培养完成后取样,通过各种氨基酸的利用率来研究突变质粒对于菌体氮源利用的影响。
2 结果与讨论
2.1重组质粒的构建及转化
以S.cerevisiae CEN.PK2-1D全基因组为模板,PCR扩增出STP1的基因片段。将PCR扩增所得的基因片段连接到pMD-T Simple Vector上测序验证,测序结果与NCBI的序列一致。随后将STP1插入质粒pUbDetec16,获得重组质粒pUbDetec16-STP1。把重组质粒转化S.cerevisiae CEN.PK2-1DΔubi4,随后挑取转化子进行菌落PCR验证。可以扩增到目的条带,表明重组菌构建成功。
2.2调控因子Stp1p荧光检测
将Stp1p系列突变质粒转化S.cerevisiae CEN. PK2-1D-Δubi4,于YNB液体培养基中培养至对数生长期。由于酪蛋白水解物中含有丰富的氨基酸,通过在培养基中添加0.25%的酪蛋白水解物能够诱导蛋白质的泛素化,从而能够增强阴性对照及阳性对照间的差异。将活化的菌体接种DM-leu-和ura-,于30℃、200 r/min摇床培养至对数生长期。添加0.25%酪蛋白水解物后继续培养90min,制作玻片观察荧光。以空载体pUbDtect16为阴性对照;Gap1p受到泛素化调控,故以其阳性对照。在荧光显微镜下,阴性对照检测不到荧光;阳性对照有较强的荧光信号,见图2。荧光检测及泛素化置信度比较结果表明调控因子Stp1p受到泛素化过程调控。

图2 Stp1p及对照荧光图片Fig.2 Fluorescence of Stp1p and the control
2.3泛素化位点定点突变及其对Stp1p泛素化的影响
图3结果表明,分别将调控因子Stp1p的第49、60、113、129位赖氨酸突变为精氨酸后,各突变体荧光强度均有一定程度的减弱。单点突变体中,第49、60、129位赖氨酸位点突变后,其荧光强度均有一定程度的减弱。而第113位赖氨酸位点突变为精氨酸后,荧光强度减弱明显,表明113位的赖氨酸位点是其潜在的泛素化位点。进一步复合突变后发现,三重突变体Stp1pK49,113,129R的荧光强度进一步减弱。与三重突变相比,四重突变Stp1pK49,60,113,129R的荧光强度则没有明显的变化。结合单点突变的结果,表明第60位的赖氨酸可能并不是其泛素化位点。另一方面表明赖氨酸位点突变能够影响Stp1p的泛素化调控过程。

图3 调控因子Stp1p突变体荧光强度的变化Fig.3 Change fold of fluorescence of Stp1p mutant strains
2.4Stp1p泛素化对氨基酸利用的影响
Stp1p是SPS途径中关键的调控因子,胞外的氨基酸信号通过细胞膜上的Ssy1-Ptr3-Ssy5复合体传至调控因子Stp1p,再由Stp1p进入核内调控相关透性酶基因的表达。由于Stp1p能够调控的许多透性酶基因的表达,因此过量表达Stp1p将会影响酵母胞外氨基酸的吸收利用。如表2所示,相比于对照组,Stp1p及突变体在天冬酰胺、谷氨酰胺、甲硫氨酸、色氨酸、苯丙氨酸、亮氨酸这6种氨基酸利用水平有较为显著的提升。而在Stp1p及系列突变体的比较中显示,三重突变体与四重突变体的氨基酸利用水平变化不太显著。分析其原因可能是由于泛素化预测软件的准确还有待提高,即第60位的赖氨酸位点并不是其泛素化位点。结合突变体荧光强度试验的结果,第60位的赖氨酸单点突变的荧光强度较弱,并且三重突变体和四重突变体的荧光强度几乎一致。
此外,酵母菌这9种氨基酸利用水平的差异还可能与相关透性酶的表达量及菌体对氨基酸的偏好性吸收有关。如甲硫氨酸为多肽合成的起始氨基酸;亮氨酸是一种主要的支链氨基酸,能够加速菌体新陈代谢,因而在菌体代谢旺盛过程中需要大量的吸收利用;天冬酰胺、谷氨酰胺等为偏好型氮源,酵母菌的氮源利用由于NCR效应而选择性的利用优势氮源,从而抑制非偏好型氮源(如精氨酸、脯氨酸)的利用。氨基酸利用水平几乎没有变化的可能与其他代谢途径如TOR途径等代谢调控途径有关。
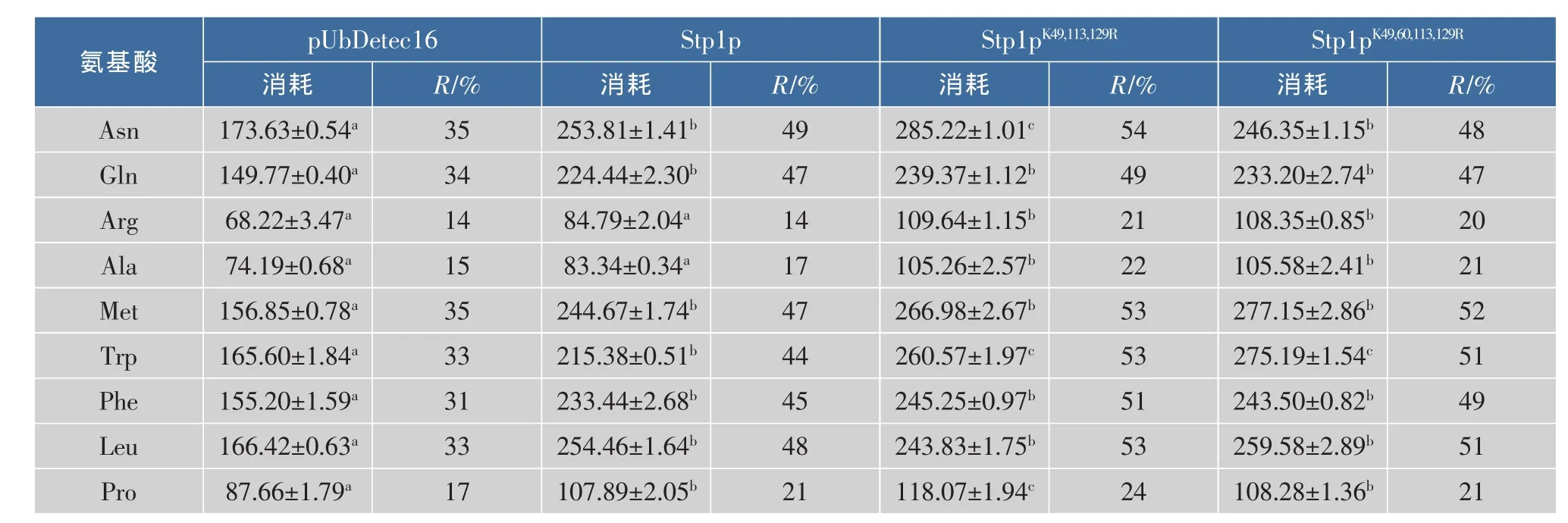
表2 突变体对氨基酸利用的影响Table 2 Effect ofmutants on am ino acid utilization
3 结语
通过构建S.cerevisiae细胞中SPS途径调控因子Stp1p的泛素化检测重组质粒。针对调控因子Stp1p,作者通过构建泛素化检测重组质粒、泛素化位点定点突变、氨基酸检测实验来研究其泛素化调控过程对于菌体氮源利用的影响。通过荧光强度检测表明调控因子Stp1p能够受到泛素化调控。为了研究其泛素化位点对其调控功能的影响,通过泛素化位点定点突变及系列突变体氨基酸利用水平来研究其泛素化调控。实验结果显示,不同突变体的荧光强度都有所不同,其中三重突变体的荧光强度变化最为明显,而四重突变体与三重突变体相比几乎没有变化,表明第60为赖氨酸位点可能并不是其主要的泛素化位点。其次可以发现Stp1p的第113位赖氨酸位点突变能够明显影响其泛素化过程,其余位点的突变荧光强度变化则相对小,表明第113位的赖氨酸是其主要的泛素化位点之一。进一步通过检测突变体的氨基酸利用效率来研究其泛素化过程对于氮源利用的影响。结果表明,泛素化位点突变能够影响菌体的氨基酸利用效率。本研究中所采用的方法对于构建蛋白质泛素化文库具有重要意义,为未知蛋白的泛素化调控研究提供了新思路,能够更深入的了解酿酒酵母氮代谢中的泛素化调控机理,对于工业化过程提高氮源利用率具有重要意义。
[1]ZHAO X,ZOU H,FU J,etal.Nitrogen regulation involved in the accumulation of urea in Saccharomyces cerevisiae[J].Yeast,2013,30(11):437-47.
[2]RAIR,TATE JJ,NELSON D R,etal.Gln3mutations dissociate responses to nitrogen lim itation(nitrogen catabolite repression)and rapamycin inhibition of TorC1[J].Journal of Biological Chem istry,2013,288(4):2789-2804.
[3]TATE J J,GEORIS I,DUBOIS E,et al.Distinct phosphatase requirements and GATA factor responses to nitrogen catabolite repression and rapamycin treatment in Saccharomyces cerevisiae[J].Journal of Biological Chem istry,2010,285(23):17880-17895.
[4]MERHIA,ANDREB.Internalam ino acids promote Gap1 permease ubiquitylation via TORC1/Npr1/14-3-3-dependentcontrolof the Bularrestin-like adaptors[J].M olecular and Cellular Biology,2012,32(22):4510-4522.
[5]LJUNGDAHLPO.Am ino-acid-induced signalling via the SPS-sensing pathway in yeast[J].Biochem ical Society Transactions,2009,37(1):242-247.
[6]TUMUSIIME S,ZHANG C,OVERSTREET M S,et al.Differential regulation of transcription factors Stp1 and Stp2 in the Ssy1-Ptr3-Ssy5 am ino acid sensing pathway[J].Journal of Biological Chem istry,2011,286(6):4620-4631.
[7]Abdel-Sater,F.Jean,Merhi A,et al.Am ino acid signaling in yeast:activation of Ssy5 protease is associated w ith its phosphorylation-induced ubiquitylation[J].Journal of Biological Chem istry,2011,286(14):12006-12015.
[8]SHIN C S,KIM S Y,HUH W K.TORC1 controls degradation of the transcription factor Stp1,a key effector of the SPS amino-acid-sensing pathway in Saccharomyces cerevisiae[J].Journal of Cell Science,2009,122(12):2089-2099.
[9]TATE JJ,GEORIS I,FELLER A,etal.Rapamycin-induced Gln3 dephosphorylation is insufficient for nuclear localization:Sit4 and PP2A phosphatasesare regulated and function differently[J].Journal of Biological Chem istry,2009,284(4):2522-2534.
[10]SCHOTHORST J,KANKIPATIH N,CONRAD M,etal.Yeastnutrient transceptors provide novel insight in the functionality of membrane transporters[J].Current Genetics,2013,59(4):197-206.
[11]SASAKI T,TAKAGI H.Phosphorylation of a conserved Thr357 in yeast Nedd4-like ubiquitin ligase Rsp5 is involved in down-regulation of the generalam ino acid permease Gap1[J].Genes Cells,2013,18(6):459-475.
[12]MENANTA,BARBEY R,THOMASD.Substrate-mediated remodeling ofmethionine transportbymultiple ubiquitin-dependent mechanisms in yeastcells[J].Embo Journal,2006,25(19):4436-4447.
[13]LJUNGDAHL PO.Am ino-acid-induced signalling via the SPS-sensing pathway in yeast[J].Biochem ical Society Transactions,2009,37(1):242-247.
[14]POOLE K,E WALKER M,Warren T,et al.Proline transport and stress tolerance of ammonia-insensitive mutants of the PUT4-encoded proline-specific permease in yeast[J].Journal of General and Applied M icrobiology,2009,55(6):427-439.
[15]RADIVOJAC P,VACICV,HAYNESC,etal.Identification,analysis,and prediction of protein ubiquitination sites[J].Proteins-Structure Function and Bioinformatics,2010,78(2):365-380.
Ubiquitination Process on Regulator of SPSPathway in Saccharomyces cerevisiae
LIYingyu1,2,LU Yongkun1,2,ZHOU Jingwen1,2,DU Guocheng1,2,CHEN Jian*1,2
(1.Key Laboratory of Industrial Biotechnology,M inistry of Education,Jiangnan University,Wuxi 214122,China;2.School of Biotechnology,Jiangnan University,Wuxi 214122,China)
The ubiquitinationmechanism of key regulator Stp1p was investigated in Saccharomyces cerevisiae.The ubiquitination detection vector was constructed based on the BiFC(Bimolecular fluorescence complementation)technology to assay the ubiquitination process of Stp1p.The site-directedmutagenesis on the potential ubiquitination siteswere performed to verify the effecton its ubiquitination regulation and the nitrogen utilization.The fluorescence levels ofmutant strains were down-regulated compared to the w ild type strain.Furthermore,the triplemutant Stp1K49,129,113Rachieved the lowest level among the all of the strains.The results indicated that the process of ubiquitination was significantly repressed by removing the potential ubiquitination residues.In addition,the am ino acid utilization assay implied the ubiquitination sites played a vital role on its ubiquitination process.The results presented here demonstrated that the ubiquitination processwas invovled in the regulation of Stp1p by site-directedmutagenesis of potentialubiquitination sites and thus impact thenitrogen utilization process.
SPSpathway,bimolecular fluorescence complementation,nitrogen catabolite repression,urea,am ino acid
Q 93
A
1673—1689(2016)09—0907—06
2014-09-23
国家自然科学基金重点项目(31130043);国家973计划项目(2012CB720802)。
陈坚(1962—),男,江苏扬州人,工学博士,教授,博士研究生导师,主要从事食品生物技术和生化工程方面的研究。E-mail:jchen@jiangnan.edu.cn

