pH对桑黄 TH021菌株液体发酵抗氧化能力的影响
刘成荣
(莆田学院 环境与生物工程学院, 福建 莆田 351100)
pH对桑黄 TH021菌株液体发酵抗氧化能力的影响
刘成荣
(莆田学院 环境与生物工程学院, 福建 莆田 351100)
【目的】 探索pH对桑黄TH021菌株液体发酵及其甲醇提取物抗氧化能力和主要活性成分的影响,为充分利用该菌提供依据。【方法】 用5 L机械搅拌发酵罐在pH 4.5,5.5,6.5和7.5下进行桑黄TH021菌株液体发酵,于培养第8天时获取滤液、菌丝体,测定其生长速率,分析甲醇提取物对DPPH自由基清除能力、亚铁离子螯合作用、超氧阴离子清除作用及主要活性成分含量,研究pH对桑黄TH021液体发酵甲醇提取物抗氧化能力及活性成分的影响。【结果】 桑黄TH021菌株生长的最适pH值为6.5。在pH为6.5时,桑黄TH021菌株滤液甲醇提取物产量(LYC)达到最高,为(4.63±0.01) g/L;桑黄TH021菌株液体发酵菌丝体甲醇提取物对DPPH、超氧阴离子的清除作用,以及滤液甲醇提取物对亚铁离子的螯合作用均达到最高;菌丝体甲醇提取物总酚含量和黄酮类物质含量均达到最高,分别为(14.04±1.69)和(9.21±1.14) mg/g。在pH为7.5时,桑黄TH021菌株液体发酵滤液甲醇提取物多糖含量达到最高,为(66.10±1.96) mg/g。【结论】 pH对桑黄TH021菌株液体发酵甲醇提取物抗氧化能力及主要活性成分有显著影响,因此要在适宜的pH下使用。
pH;桑黄;液体发酵;抗氧化能力
生物新陈代谢中能产生许多自由基,但是由氧产生的自由基能引起如癌症、动脉粥样硬化及衰老等许多疾病[1]。虽然几乎所有生物均能够保护自身免受自由基的侵害[2],但随着衰老、生理功能的降低,这种自身保护机能就会下降进而导致各种疾病。抗氧化剂能阻止这种侵害,人工合成的抗氧化剂已广泛应用于食品工业,但人们对人工合成的抗氧化剂是否会引起肝损伤和致癌而担忧,因此天然抗氧化剂成为首选,各种食、药用菌富含多糖、多酚和黄酮类物质而具有抗氧化作用[3],这些物质能使生物体免受自由基的伤害而少患许多疾病,所以各种食药用菌是人类理想的天然抗氧化剂。
桑黄(Phellinusigniarius)是一种著名的药用真菌,属于多孔菌科,具有抗氧化、抗菌、抗病毒、抗肿瘤、抗突变和免疫调节作用[4-7],它是目前国际公认的生物治癌领域中效率最高的药用真菌[8]。但目前难以通过人工固体栽培获得该菌子实体,导致该菌子实体的野生资源因人们大量采集严重匮乏。一些研究表明,药用真菌如桑黄的液体发酵菌丝体药理学特性与其子实体相似。因此可以对该菌进行深层培养获得其菌丝体及代谢产物,以满足人们不断增长的需要。Mau等[9]、Vaz等[10]研究认为,从食用真菌中提取小分子物质如抗氧化成分时,甲醇是最好的溶剂。Beatriz等[11]研究指出,当pH为4.3时,蜂胶甲醇提取物的抗氧化活性比其他pH时高近90%;Midori等[12]研究认为,在酸性条件下不同pH值儿茶素的抗氧化活性不同,且与抗氧化剂的酸解离程度相关。pH在真菌培养过程中是一个重要参数,它影响一系列真菌培养的进程、次级代谢产物的产生[13],对于桑黄菌仅见有关桑黄液体发酵工艺及活性成分的研究报道[14-15],尚未见到有关pH对桑黄液体发酵抗氧化特性影响的研究。因此,本研究以桑黄TH021菌株为研究对象,在pH 4.5,5.5,6.5,7.5下进行液体发酵,分析pH对其抗氧化物质含量及活性的影响,以期为桑黄菌的利用提供依据。
1 材料与方法
1.1材料
供试菌种及子实体:桑黄TH021菌株为莆田学院微生物实验室保存的变异菌株;按常规方法进行桑黄TH021菌株人工固体栽培获取子实体。
主要仪器设备:发酵罐(BIOTECH-5BG,上海保兴生物设备工程有限公司)、冷冻摇床(HZ-9310K,金坛市盛蓝仪器制造有限公司)、酸度计(TP311,北京时代新维测控设备有限公司)、 高压蒸汽灭菌器(LDZX-50FBS,上海申安医疗器械有限公司)。
主要试剂:葡萄糖、KH2PO4、MgSO4、甲醇、氯化亚铁、菲咯嗪、四唑氮蓝、NADH、吩嗪硫酸甲酯、Al(NO3)3、 NaNO2、苯酚、硫酸等药品,均为分析纯。
1.2方法
1.2.1pH对桑黄TH021菌株生长及提取物产量的影响桑黄TH021菌株先在母种培养基(组分为:玉米粉50 g、葡萄糖30 g、KH2PO41 g、MgSO40.75 g、VB15 mg、水1 000 mL)上于27 ℃培养,长好后再贮藏在2~4 ℃冰箱中。
在pH自动控制5 L发酵罐中,用1 mol/L NaOH和HCl溶液将培养液pH分别调节并控制在4.5,5.5,6.5,7.5,发酵培养基组分(g/L)为:葡萄糖 28.0、酵母膏10、KH2PO41.5、MgSO4·7H2O 2.0、VB10.01。工作容积2 L,接种量500 mL。发酵条件:温度27 ℃,转速130 r/min,通气量2 L/min,持续8 d。菌丝体洗净冷冻干燥,发酵滤液冻干成细粉末即为干滤液,以及子实体备甲醇抽提之用。干滤液、子实体和菌丝体在抽提前分别粉碎成0.2 mm的细粉末;按Nevcihan等[16]的方法进行甲醇抽提:将5 g桑黄TH021菌株子实体、干滤液、菌丝体和发酵培养基样品(未培养菌体的上述发酵培养基经真空浓缩、冷冻干燥而成),分别与100 mL甲醇混合,然后在25 ℃、150 r/min下激烈振荡24 h,经提取过滤,滤渣用100 mL甲醇按上述方法再提取 2次,合并滤液在40 ℃下真空干燥即得到子实体、干滤液、菌丝体和发酵培养基的甲醇提取物,4 ℃下保藏备用;在上述桑黄TH021菌株液体发酵过程中,测定桑黄TH021菌株液体发酵的比生长速率(C)、最大细胞生长量(P)、残糖含量(CT)、滤液质量(LY)、菌丝体甲醇提取物产量(JS)、滤液甲醇提取物产量(LYC)、菌丝体甲醇提取物产量对菌丝干质量的相对比率(JJB)及滤液甲醇提取物产量对菌丝干质量的相对比率(LJB)。
1.2.2pH对桑黄清除DPPH自由基的影响按Shimada等[17]的方法,将pH为4.5,5.5,6.5,7.5的桑黄液体发酵滤液甲醇提取物、菌丝体甲醇提取物、子实体甲醇提取物以及接种前培养基的甲醇提取物各4 mL(每种提取物均设5和10 mg/L两个质量浓度水平),分别与1.0 mL DPPH甲醇溶液(10 mmol/L)完全混合,在室温下放置30 min, 以未加样品为空白,在517 nm下测吸光度,按下式计算对DPPH自由基的清除率。
清除率=[1-(Ai-Aj)/A0]×100%。
式中:Ai为添加样品的吸光度,Aj为空白试剂的吸光度,A0为未加样品的吸光度。
1.2.3pH对桑黄与亚铁离子螯合的影响按Dinis等[18]的方法,取1 mL桑黄TH021菌株液体发酵滤液甲醇提取物、菌丝体甲醇提取物、子实体甲醇提取物及接种前培养基甲醇提取物,分别与3.7 mL甲醇、0.1 mL氯化亚铁(2 mmol/L)混合,再加入0.2 mL菲咯嗪(5 mmol/L),室温下放置10 min,于562 nm下测吸光度,计算桑黄样品对菲咯嗪-Fe2+复合物形成的抑制率,用来表示桑黄与亚铁离子的螯合作用大小。
抑制率=[A空白-A样品]/A空白×100%。
式中:A空白为菲咯嗪-Fe2+复合物的吸光度;A样品为添加桑黄甲醇提取物后的吸光度。
1.2.4pH对桑黄清除超氧阴离子的影响参照Li等[19]的方法并稍加修改, 将1 mL NBT(四唑氮蓝)溶液(0.156 mmol/L)、1 mL NADH溶液(0.468 mmol/L)(NBT和NADH溶液均用 pH 7.4 100 mmol/L的磷酸缓冲液配制),分别加入0.1 mL pH为4.5,5.5,6.5,7.5的桑黄液体发酵滤液甲醇提取物、菌丝体甲醇提取物、子实体甲醇提取物以及接种前培养基的甲醇提取物(PYJ)等样品(每种提取物均设0.2,0.6 mg/mL 2个质量浓度水平),充分混合,混合物中均分别加入1.0 mL PMS(吩嗪硫酸甲酯)(0.06 mmol/L,PMS用pH 7.4 100 mmol/L的磷酸盐缓冲液配制),在25 ℃下放置5 min,在560 nm下测吸光度并以下式计算对超氧阴离子的抑制率。
抑制率=[A空白-A样品]/A空白×100%。
式中:A空白为空白液的吸光度;A样品为添加桑黄甲醇提取物后的吸光度。
1.2.5滤液、菌丝体、子实体和发酵培养基抗氧化剂成分的测定将桑黄滤液、菌丝体、人工栽培获取的子实体和未培养菌体的发酵培养基甲醇提取物,进行总酚含量、黄酮类物质(总黄酮)含量和多糖含量测定。总酚含量按Singleton等[20]的方法进行测定;桑黄提取物黄酮类物质(总黄酮)含量测定采用Al(NO3)3-NaNO2分光光度比色法测定[21],以每克桑黄样品干物质中所含黄酮类物质(总黄酮)质量计;培养液残糖含量、滤液和菌丝体的多糖含量按苯酚-硫酸法进行测定[22]。
1.2.6数据处理每个处理均重复3次,用SPSS 18.0软件中的Duncan法进行数据处理和分析。
2 结果与分析
2.1pH对桑黄TH021菌株生长及提取物产量的影响
pH对桑黄TH021菌株生长及提取物产量的影响见表1。从表1可知,在pH 4.5~6.5内,随着pH升高,桑黄TH021菌株比生长速率(C)、最大细胞生长量(P)都逐渐升高, pH 6.5时菌株比生长速率、最大细胞生长量(P)达到最高,但pH超过6.5则两者都下降,说明pH 6.5是药用真菌桑黄TH021菌株生长的最适pH值。

表 1 pH对桑黄TH021菌株生长及提取物产量的影响Table 1 Effect of pH on cell growth and production of methanol extract of Phellinus igniarius TH021 strain
注 同列数据后标不同小写字母表示差异显著(P<0.05),下表同。
Note:Different letters in each column mean significant difference(P<0.05),the same below.
从表1也可知, pH为4.5~6.5时随着pH升高,菌丝体甲醇提取物产量(JS)总体表现为降低;而滤液甲醇提取物产量(LYC)总体表现为升高,pH为6.5时达到最高,为(4.63±0.01) g/L,但与pH 7.5时差异不明显;pH为4.5~7.5时随着pH值升高,菌丝体甲醇提取物产量对菌丝干质量的相对比率(JJB)总体表现为先升高后降低,而滤液甲醇提取物产量对菌丝的相对比率(LJB)则不断上升,原因是随着pH值不断升高,菌丝体中活性物质不断被甲醇抽提出来,造成菌丝体减轻而滤液中活性物质不断增多的结果。
2.2pH对桑黄TH021菌株清除DPPH自由基的影响
表2显示,无论质量浓度是5 mg/mL还是10 mg/mL,桑黄TH021菌株液体发酵滤液甲醇提取物和菌丝体甲醇提取物pH为6.5时对DPPH自由基的清除能力均最大;在同一pH值下,菌丝体甲醇提取物对DPPH的清除能力显著高于滤液甲醇提取物(P<0.05);pH为6.5的10 mg/mL桑黄TH021菌株菌丝体甲醇提取物对DPPH自由基的清除能力最高,为(87.12±2.77)%,与10 mg/mL子实体甲醇提取物对DPPH自由基的清除能力无显著差异(P>0.05)。

表 2 pH对桑黄TH021菌株清除DPPH自由基的影响Table 2 Effect of pH on DPPH radical scavenging of Phellinus igniarius TH021 strain %
2.3pH对桑黄TH021菌株螯合亚铁离子的影响
由于亚铁离子能促使羟基自由基的形成,因此,它在氧化应激反应中起着关键作用。从图1可以看出,pH 6.5质量浓度的桑黄滤液和菌丝体甲醇提取物对亚铁离子的螯合能力在各自组中达到最高,且桑黄液体发酵滤液甲醇提取物对亚铁离子的螯合作用在所有组中最高,达83%。
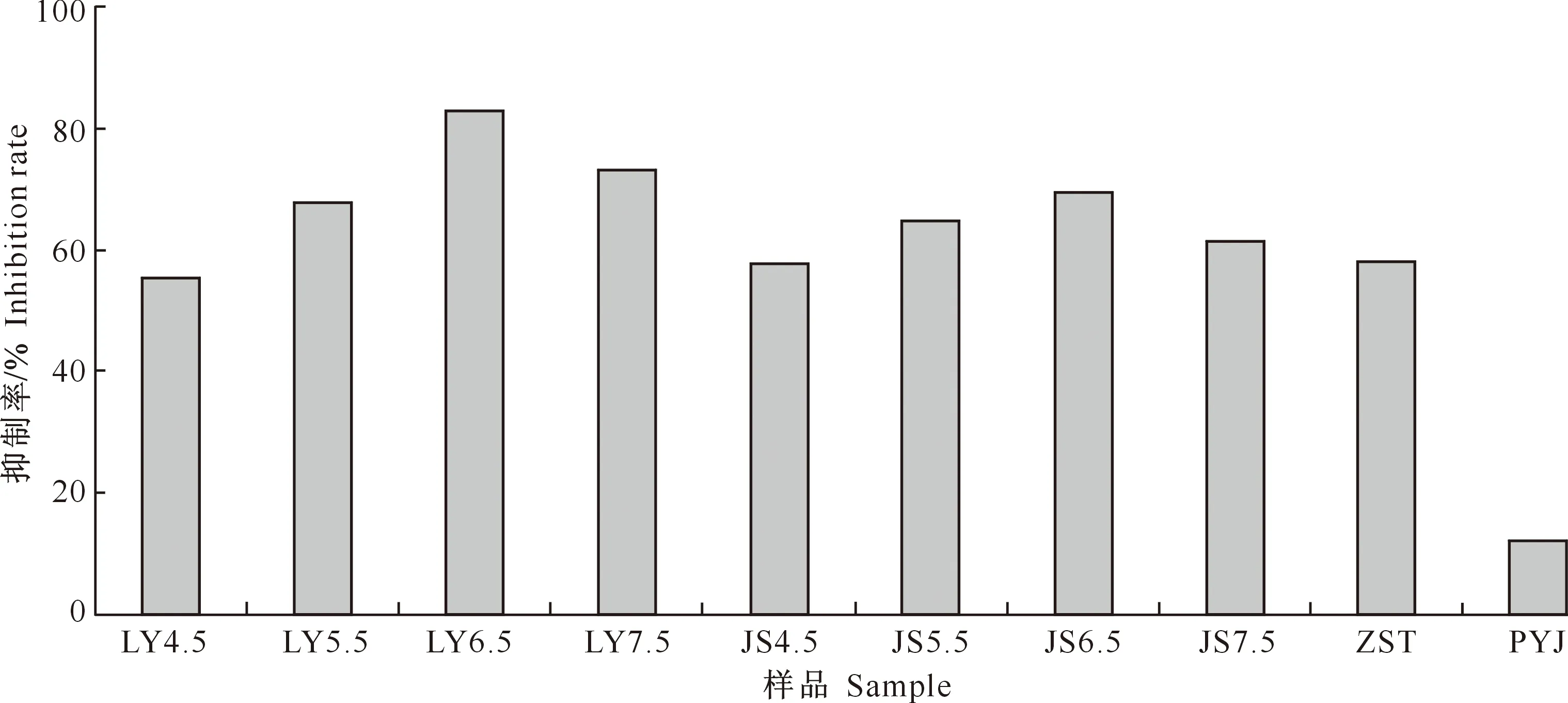
图 1 pH对桑黄TH021菌株螯合亚铁离子的影响
2.4pH对桑黄TH021菌株清除超氧阴离子的影响
pH对桑黄TH021菌株清除超氧阴离子自由基的影响见表3。从表3可知, pH 6.5时0.6 mg/mL 的桑黄液体发酵菌丝体甲醇提取物对超氧阴离子自由基的清除作用显著高于其他pH组(P<0.05),但显著低于0.6 mg/mL子实体甲醇提取物(P<0.05),可见桑黄液体发酵菌丝体和滤液甲醇提取物对超氧阴离子自由基的清除作用处于一般水平。

表 3 pH对桑黄TH021菌株清除超氧阴离子自由基的影响Table 3 Effect of pH on scavenging ability of superoxide anion of Phellinus igniariusTH021 strain in liquid fermentation %
2.5pH对桑黄TH021菌株液体发酵物中抗氧化剂含量的影响
pH对桑黄TH021菌株液体发酵液中抗氧化剂含量的影响见表4。由表4可以看出, pH为6.5时桑黄菌丝体甲醇提取物中总酚、黄酮类物质含量达到最高,分别为(14.04±1.69)和(9.21±1.14)mg/g,但均显著低于子实体甲醇提取物中的总酚、黄酮类物质含量(P<0.05);pH为7.5时滤液甲醇提取物中多糖含量达到最高,为(66.10±1.96) mg/g,显著高于子实体多糖含量(P<0.05)。据此认为,对桑黄进行液体提取多糖是一条比较好的途径,但pH从6.5增至7.5时,菌丝体甲醇提取物多糖、总酚和黄酮类物质含量变低(P<0.05),可能与这些抗氧化物质的特性有关。
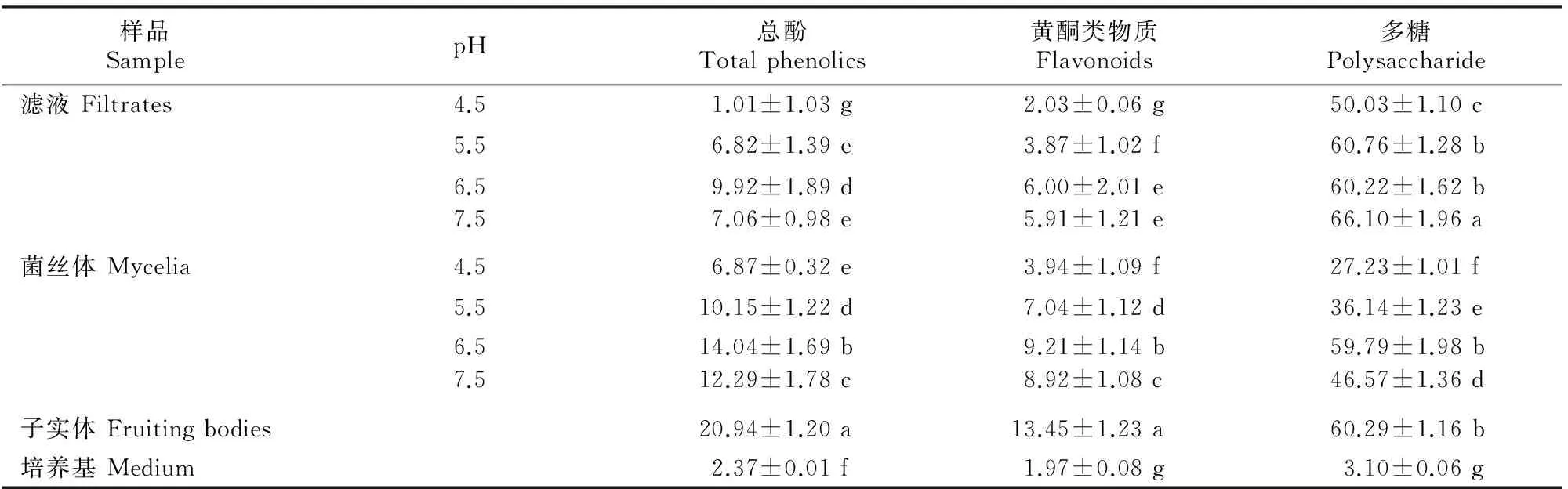
表 4 pH对桑黄TH021菌株液体发酵物中抗氧化剂含量的影响Table 4 Effect of pH on antioxidant compounds of methanol extracts ofPhellinus igniarius TH021 strain in liquid fermentation mg/g
3 讨 论
3.1pH对桑黄TH021菌株生长及提取物产量的影响
众所周知,外界环境pH影响着微生物的生长,不同pH下微生物细胞膜电位、物质电离程度及溶解度不同,本试验结果表明,桑黄TH021菌株发酵的最适pH为6.5,这与骆冬青等[23]、杨全[24]的研究结果一致,也符合一般真菌适合在弱酸性环境下生长的特征。
3.2pH对桑黄TH021菌株抗氧化及清除自由基能力的影响
DPPH性质稳定,因此可用DPPH自由基的清除能力评价物质的抗氧化能力。本试验发现,桑黄TH021菌株清除DPPH自由基的活力在pH为 6.5 时达到最高,与张镜等[25]关于阴香(Cinnamoumumburmannii)花色苷对DPPH自由基清除活性的研究结果类似。陈季武等[26]研究发现,11种黄酮类化合物均能清除DPPH,它们都是典型的酚羟基化合物,外界不同pH可使这11种黄酮类化合物酚羟基的数目和位置发生变化,从而使其对DPPH等自由基的清除能力表现出差异。螯合作用的大小可以反映物质的抗氧化能力,本试验发现,pH为6.5时,桑黄TH021发酵液对亚铁离子的螯合作用最强。谢普军等[27]研究认为,在pH大于10时,橄榄苦苷发生降解,pH为14时全部降解,此时其对亚铁离子的螯合作用减弱甚至消失。
在不同pH条件下抗氧化剂清除自由基的能力不同, Quan等[28]研究发现,在碱性条件下绿茶儿茶酚酚类物质会分解或变为同分异构体,导致其抗氧化能力下降。Sokó-ętowska等[29]报道,多酚类化合物的性质和应用都根源于其独特的化学结构,其中酚羟基结构是多酚类化合物的有效基团之一。Huang等[30]报道,生物系统中的pH 和代谢产物均可使多酚类化合物的结构发生改变,从而影响其抗氧化活性及对自由基的清除作用。
Niki[31]认为,机体内的抗氧化反应是各种抗氧化活性成分的复合作用,而不是某一种活性物质的影响。本试验中,桑黄液体发酵滤液、菌丝体和子实体甲醇提取物中主要成分总酚、黄酮类物质和多糖,在不同酸碱度下清除自由基和抗氧化能力不同,表现出不同的DPPH清除能力、亚铁离子螯合作用和超氧阴离子自由基清除作用。
[1]Shu C H,Lung M Y.Effect of culture pH on the antioxidant properties ofAntrodiacamphoratain submerged culture [J].Journal of the Chinese Institute of Chemical Engineers,2008,39(1):1-8.
[2]Mau J L,Lin H C,Song S F.Antioxidant properties of several specialty mushrooms [J].Food Research International,2002,35(6):519-526.
[3]Diplock A T,Charleux J L,Crozier-willi G,et al.Functional food science and defence against reactive oxidative species [J].The British Journal of Nutrition,1998,80(1):77-112.
[4]Liu Y F,Yang Y,Jia W,et al.Determination of total flavones in the medicinal mushroomPhellinus[J].Acta Edulis Fungi,2006,13(2):49-52.
[5]Song T Y,Lin H C,Yang N C,et al.Antiproliferative and antimetastatic effects of the ethanolic extract ofPhellinusigniarius(Linnearus:Fries) Quelet [J].Journal of Ethnopharmacology,2008,115(1):50-56.
[6]Wang Y,Wang S J,Mo S Y,et al.A unique highly oxygenated pyrano [4,3-c][2]benzopyram-1,6-dione derivative with antioxidant and cytotoxic activities from the fungusPhellinusigniarius[J].Organic Letters,2005,7(9):1675-1678.
[7]Wu M J,Jiang D Z,Liu T M,et al.Structural analysis of water soluble polysaccharide PIP1 extracted from the ctured mycelium ofPhellinunigniarius[J].Chemical Research in Chinese Universities,2006,22(6):708-711.
[8]卯晓岚.中国大型真菌 [M].郑州:河南科技出版社,2000:465.
Mao X L.Macrofungi in China [M].Zhengzhou:Henan Science and Technology Publishing House,2000:465.
[9]Mau J L,Lin H C,Chen C C.Antioxidant properties of several medicinal mushrooms [J].Journal of Agriculture and Food Chemistry,2002a,50(21):6072-6077.
[10]Vaz J A,Heleno S A,Martins A,et al.Wild mushrooms clitocybe alexandri and lepista inversa:invitroantioxidant activity and growth inhibition of human tumour cell lines [J].Food and Chemical Toxicology,2010,48(10):2881-2884.
[11]Beatriz C B S,Mello D,Miriam D,et al.Antioxidant activity and polyphenol contents in Brazilian green propolis extracts prepared with the use of ethanol and water as solvents in different pH values [J].International Journal of Food Science and Technology,2012,47(12):2510-2518.
[12]Midori K,Tamiyoshi S,Kinuyo N.Effects of pH and metal ions on antioxidative activities of catechins [J].Bioscience Biotechnol Biochemistry,2001,65(1):126-132.
[13]Tamerler C,Ullah M,Adlard M W,et al.Effect of pH on physiology ofMetarhiziumanisopliaefor production of swainsonine [J].FEMS Microbiol Letter,1998,168(1):17-23.
[14]李剑梅,王艳华,郭玲玲,等.桑黄液体发酵工艺的研究 [J].微生物学杂志,2014,34(6):74-78.
Li J M,Wang Y H,Guo L L,et al.Liquid fermentation technology ofPhellinusigniarius[J].Journal of Microbiology,2014,34(6):74-78.
[15]王钦博,杨焱,刘艳芳,等.一年生和两年生桑黄子实体的成分和生物活性 [J].食用菌学报,2010,17(2):71-75.
Wang Q B,Yang Y,Liu Y F,et al.Chemical composition and bioactivities of one- and two-year-oldPhellinusbaumiifruit bodies [J].Journal of Edible Fungi,2010,17(2):71-75.
[16]Nevcihan G,Cengiz S,Bektas T,et al.Evaluation of antioxidant activities of 3 edible mushrooms:Ramariaflava(Schaef.:Fr.)Quel.,Rhizopogonroseolus(Corda)T.M.Fries.,andRussuladelicaFr [J].Food Science Biotechnol,2010,19(3):691-696.
[17]Shimada K,Fijikawa K,Yahara K,et al.Antioxidative properties of xanthan on the autoxidation of soybean oil in cyclodextrin emulsion [J].Journal of Agriculture Food Chemistry,1992,40(6):945-948.
[18]Dinis T C P,Madeira V M C,Almeida L M.Action of phenolic derivates (acetoaminophen,salicylate and 5-aminosalycilate) as inhibitors of membrane lipid peroxidation and as peroxyl radical scavengers [J].Archives of Biochemistry and Biophysics,1994,315(1):161-169.
[19]Li X L,Zhou A G,Yong H.Antioxidation and antimicroorganism activities of purification polysaccharide fromLygodiumjaponicuminvitro[J].Carbohydr Polym,2006,66(1):34-42.
[20]Singleton V L,Rossi J A.Colometric of total phenolics with phosphomolybdic-phosphotungstic acid reagents [J].American Journal of Enology and Viticulture,1965,16(2):144-158.
[21]刘善新,贾元印.不同生长时间桑枝中黄酮成分的比较 [J].时珍国药研究,1997,8(1):20-21.
Liu S X,Jia Y Y.Comparative study on flavone chemical constituents extracted fromRamulusmoriwith different growing periods [J].Shizhen Journal of Traditional Chinese Medicine Research,1997,8(1):20-21.
[22]Lung M Y,Tsai J C .Antioxidant properties of polysaccharides from the willow bracket medicinal mushroom,Phellinusigniarius(L.) Quél.(Aphyllophoromycetideae) in submerged culture [J].International Journal of Medicinal Mushrooms,2009,11(4):383-394.
[23]骆冬青,汪维云.桑黄液体培养工艺的优化试验 [J].包装与食品机械,2008,26(4):24-27.
Luo D Q,Wang W Y.The optimization experiment of submerged culture technics ofPhellinusigniarius[J].Packaging and Food Machine,2008,26(4):24-27.
[24]杨全.桑黄的液体发酵及其粗多糖抗肿瘤作用的研究 [D].长春:吉林农业大学,2002.
Yang Q.Liquid fermentation ofPhellinusigniariusand antitumor activity of proteoglycan from it’s mycelia [D].Changchun:Jilin Agricultural University,2002.
[25]张镜,温思霞, 廖富林.温度、光照及 pH 值对阴香花色苷清除 DPPH自由基活性的影响 [J].食品科学,2009,30(13):120-123.
Zhang J,Wen S X,Liao F L.Effects of temperature,light and pH on DPPH radical scavenging activity of anthocyanin extracted from fruit ofCinnamoumumburmannii[J].Food Science,2009,30(13):120-123.
[26]陈季武,胡斌,赵实.天然黄酮类化合物清除DPPH 的构效关系 [J].发光学报,2005,26(5):664-668.
Chen J W,Hu B,Zhao S.Structure-activity relationship of the natural flavonoids in scavenging DPPH [J].Chinese Journal of Luminescence,2005,26(5):664-668.
[27]谢普军,黄立新,张彩虹.油橄榄叶提取物中橄榄苦苷稳定性及对亚铁离子的螯合作用 [J].食品工业科技,2013,34(4):133-136.
Xie P J,Huang L X,Zhang C H.Stability of oleuropein in olive leaves extracts and its chelating action to ferrous ions [J].Science and Technology of Food Industry,2013,34(4):133-136.
[28]Quan V V,John B G,Costas E,et al.Effects of aqueous brewing solution pH on the extraction of the major green tea constituents [J].Food Research International,2013,53(2):713-719.
[30]Huang D,Ou B,Prior R L.The chemistry behind antioxidant capacity assays [J].Journal of Agricultural and Food Chemistry,2005,53(6):1841-1856.
[31]Niki E.Assessment of antioxidant capacity of natural products [J].The Journal of Database Marketing and Customer Strategy Management,2010,11(8):801.
Effect of pH on antioxidant ability ofPhellinusigniariusTH021 strain in liquid fermentation
LIU Chengrong
(DepartmentofEnvironmentalandBioengineering,PutianUniversity,Putian,Fujian351100,China)
【Objective】 This study explored the influence of culturing pH on liquid fermentation ofPhellinusigniariusTH021 strain,the antioxidant capacity of its methanol extracts,and the main bioactive compounds to provide theoretical basis for making full use of the strain.【Method】 Liquid fermentation ofPhellinusigniariusTH021 strain at controlled pH of 4.5,5.5,6.5,and 7.5 was conducted in a 5 L stirring fermenter.After 8 days,the growth rate,DPPH radical scavenging activities,and scavenging effects of ferrous ions were determined.The influence of pH on antioxidant capacity of methanol extract and active ingredients ofPhellinusigniariusTH021 strain in liquid fermentation were analyzed.【Result】 The optimal pH value for mycelium growth ofPhellinusigniariusTH021 strain was 6.5.At pH 6.5,the yield of filtrate methanol extract ofPhellinusigniariusTH021 strain reached the highest value of (4.63±0.01) g/L.The DPPH radical scavenging capacity and scavenging ability of superoxide anion of the methanol extracts of mycelia,and ferrous ion chelation of the methanol extracts also reached the highest level at pH 6.5.Antioxidant production reached maximum at pH 7.5 and the polysaccharide content in extracts was (66.10±1.96) mg/g.The maximum total phenolic content and flavonoids content of the methanol extracts of mycelia were (14.04±1.69) mg/g and (9.21±1.14) mg/g at pH 6.5,respectively.【Conclusion】 pH significantly affected antioxidant ability and contents of antioxidant compounds of methanol extracts of liquid fermentation of TH021 strain.
pH;Phellinusigniarius;liquid fermentation;antioxidant ability
时间:2016-08-0909:41DOI:10.13207/j.cnki.jnwafu.2016.09.029
2015-01-16
福建省省属高校科研专项计划项目(JK2013046);福建省教育厅A类科技项目(JA07165)
刘成荣(1964-),男,福建莆田人,教授,主要从事生物技术研究。
S646
A
1671-9387(2016)09-0214-07
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160809.0941.058.html

