功能性育苗基质中生防菌及腐植酸钾对甜瓜穴盘苗的促生作用
孙跃跃,马军妮,李玉龙,来航线,薛泉宏
(西北农林科技大学 资源环境学院,陕西 杨凌712100)
功能性育苗基质中生防菌及腐植酸钾对甜瓜穴盘苗的促生作用
孙跃跃,马军妮,李玉龙,来航线,薛泉宏
(西北农林科技大学 资源环境学院,陕西 杨凌712100)
【目的】 探索向育苗基质中加入生防菌及腐植酸钾对甜瓜穴盘育苗生长促进作用的影响。【方法】 以甜瓜品种“白沙蜜”为供试材料,采用穴盘育苗技术,将菌剂和腐植酸钾单独或配合施用,共设置不施菌剂及腐植酸钾(对照)、单施放线菌菌剂、单施真菌(灰黄青霉)菌剂、放线菌菌剂与真菌菌剂混施、腐植酸钾单施、放线菌菌剂与腐植酸钾配施、真菌菌剂与腐植酸钾配施、放线菌菌剂+真菌菌剂+腐植酸钾配合施用8个处理,测定不同处理对甜瓜苗茎叶、根系生物量、根系体积与表面积等生物学特性以及叶片POD、PAL、PPO活性、MDA含量和净光合速率等生理生化特性的影响。【结果】 用菌剂及腐植酸钾处理后,甜瓜穴盘幼苗生物量均高于对照,其中,放线菌与腐植酸钾、灰黄青霉与腐植酸钾配施处理的苗期生物量较对照分别增加34.1%和19.5%;灰黄青霉与腐植酸钾配施处理甜瓜穴盘幼苗根系总长度、总表面积、平均直径、总体积较对照分别增加46.7%,44.5%,12.5%和62.5%;各处理单叶面积及叶片绿色度值较对照均有所增加,其中灰黄青霉单施、灰黄青霉与腐植酸钾配施处理叶面积较对照分别增加37.3%和85.6%,叶片SPAD值较对照分别增加16.7%和13.6%;灰黄青霉与腐植酸钾配施处理叶片净光合速率较对照增加24.1%;单施生防菌剂、腐植酸钾或两者混施,叶片POD、PAL、PPO活性及丙二醛(MDA)含量均低于对照,其中灰黄青霉与腐植酸钾配施处理的叶片POD、PAL、PPO、MDA较对照分别下降 56.5%,12.0%,25.7%和33.3%。【结论】 施用生防菌剂及腐植酸钾能促进甜瓜幼苗生长及根系发育,提高光合速率,降低MDA含量,提高甜瓜穴盘育苗质量,其中生防放线菌与真菌灰黄青霉混合接种时的促生作用更为显著。
育苗基质;生防菌;腐植酸钾;甜瓜;促生作用
随着我国设施农业发展,设施土壤连作障碍日趋严重,这对土壤管理提出了更高的要求,对健康抗病种苗的需求量也不断增大。以土壤为基质的传统育苗用时长,劳动强度大,效率低,且易受天气影响,幼苗移栽成活率低,对土传病害抗性差,取而代之发展起来的工厂化育苗已成为种苗生产的主要方式[1]。工厂化基质育苗材料质地较轻,具有良好的保水、保肥及通气性,虽然克服了传统育苗存在的部分缺陷[2],但仍未解决所育种苗对土传病害抗性较差的问题。因此通过添加某些有效成分培育壮苗健苗、提高种苗的抗病性,是目前亟待解决的问题。当前对育苗基质的研究主要集中在原材料选择及其配比方面[3-4],对如何培育抗病促生健苗、提高幼苗质量与抗病性的研究不多。现有研究表明,放线菌剂[5-6]、生防真菌灰黄青霉[7-8]具有良好的防病促生作用;腐植酸钾与放线菌剂配合施用也有明显的促生防病效果[9],但目前尚不清楚向育苗基质中添加上述生防菌及化学成分对提高穴盘苗质量有何影响。本研究以普通育苗基质为材料,拟探索通过添加具有抗病促生作用的生防菌及腐植酸钾提高甜瓜种苗质量的效果及可行性,以期为新型生物活性功能基质的研发提供新思路及科学依据。
1 材料与方法
1.1材料
1.1.1供试甜瓜甜瓜品种“白沙蜜”,种子从市场购买。选择大小一致、籽粒饱满、形态正常的种子进行试验。
1.1.2供试基质普通育苗基质,由安徽丰田农业科技有限公司提供。其主料为沼气发酵固体残留物沼渣,经二次发酵配制。沼气发酵原料来源于以小麦、木薯为原料生产酒精后的废渣。
1.1.3供试菌剂放线菌菌剂(A)为放线菌的固态发酵产物,由放线菌Act12(密旋链霉菌Streptomycespactum)与D74(娄彻氏链霉菌Streptomycesrochei)分别制备成粉末状菌剂后,按质量比1∶1混合而成。真菌菌剂(C)由生防真菌CF3(灰黄青霉Penicilliumgriseofulvum)固态发酵制得。以上菌种均由西北农林科技大学资源环境学院微生物资源研究室分离、筛选及鉴定保藏,均具有广谱抗病能力,而且产生的代谢产物对作物具有促生作用[10-11]。菌剂Act12、D74及CF3的有效活菌数分别为2.3×109,3.5×1010和1.1×1010CFU/g。
1.1.4供试腐植酸钾所用腐植酸钾由新疆双龙腐植酸有限公司生产,其腐植酸含量(按干基计)≥400 g/kg,钾含量(K2O按干基计)≥50 g/kg,pH 9~10。
1.2方法
1.2.1穴盘育苗试验试验于2014年3-7月在西北农林科技大学科研温室进行。所用育苗穴盘为4×8穴。试验共设8个处理:不施菌剂及腐植酸钾(CK);单施放线菌菌剂(A);单施真菌菌剂(C);放线菌菌剂与真菌菌剂混施(AC);腐植酸钾单施(F);放线菌菌剂与腐植酸钾配合施用(AF);真菌菌剂与腐植酸钾配合施用(CF);放线菌菌剂+真菌菌剂+腐植酸钾配合施用(ACF)。放线菌、真菌单独接种时的剂量分别为1.5,1.0 g/kg(按干基计),混合接种时,用量均为原用量的1/2;腐植酸钾用量均为5 g/kg(按干基计)。
1.2.2样品采集及指标测定待甜瓜穴盘苗幼苗长至4~5片真叶时,无损测定叶片绿色度及光合特性;采集长势一致、健康无病害的甜瓜幼苗,测定其叶面积、生物量、叶片诱导酶活性等指标。
(1)生物学性状。植株总鲜质量、地上部分鲜质量、根系鲜质量测定采用称重法;叶片绿色度采用SPAD-502便携式叶绿素仪测定;测算叶面积时,先用刻度尺测量从叶尖沿叶脉至叶柄起点的距离作为叶片长度,再测叶片最宽距离为叶片宽度,二者相乘即为叶面积。根系各参数(包括根系总长度、总表面积、平均直径、总体积)采用WinRHIZO根系扫描仪扫描测定。
(2)生理生化指标。光合特性(叶片净光合速率、气孔导度、胞间CO2浓度、蒸腾速率、水分利用率)采用LI-6400光合速率仪测定;根系活力、叶片过氧化物酶(POD)活性、苯丙氨酸解氨酶(PAL)活性、丙二醛(MDA)含量测定均参照高俊凤[12]的方法。多酚氧化酶(PPO)活性测定参照郑莲姬等[13]的方法。
1.3数据处理
采用Excel 2003、SPSS 19.0软件对试验数据进行处理与统计分析,用Duncan’s多重比较法进行差异显著性分析。
2 结果与分析
2.1生防菌剂和腐植酸钾对甜瓜生物量及根系活力的影响
2.1.1生物量由表1可以看出,单施生防菌剂、腐植酸钾及生防菌剂与腐植酸钾混施均能促进甜瓜幼苗生长,其中放线菌、真菌制剂单施时穴盘甜瓜幼苗根系与对照差异明显(图1)。

表 1 生防菌剂和腐植酸钾对甜瓜生物量及根系活力的影响Table 1 Effect of actinomyces agent and potassium humate on biomass and root activity of melon
注:同列数据后标注不同小写字母表示差异显著(P<0.05),下表同。
Note:Different lowercase letters in each column indicate significant difference (P<0.05),the same below.

图 1生防放线菌与生防真菌对甜瓜穴盘苗根系生长的影响
A.生防放线菌单施;B.生防真菌单施
Fig.1Effect of biocontrol actinomyces and fungi on melon plug seedlings
A.Only actinomyces;B.Only fungi
由表1可见,除了单施放线菌剂处理外,其余处理幼苗总鲜质量和根系鲜质量与对照的差异均达到显著(P<0.05)水平。其中AC与AF处理甜瓜地上部分鲜质量、根系鲜质量及总鲜质量较对照分别增加43.6%,160.0%,52.4%与28.2%,100.0%,34.1%。
2.1.2根系活力由表1可知,单施真菌处理C及真菌、放线菌与腐植酸钾混施处理ACF的甜瓜根系活力较对照分别提高40.6%和17.8%(P<0.05),而腐植酸钾的3个处理F、AF及CF的根系活力分别较对照下降40.7%(P<0.05),11.2%和4.7%,显示腐植酸钾对甜瓜根系活力有降低作用,其原因可能与腐植酸钾用量过大有关。
2.2生防菌剂和腐植酸钾对甜瓜根系形态的影响
由表2可知,生防放线菌A和生防真菌C单施、二者配施,或与腐植酸钾F配合施用,均能促进甜瓜幼苗根系生长,对根系总表面积、总长度、平均直径及根系总体积有明显影响(图2)。其中AC、CF、ACF处理根系总长度较对照分别增加45.4%,46.7%和48.0%,根系总表面积分别较对照增加45.0%,44.5%和43.9%,根系总体积较对照分别增加62.5%,62.5%和58.3%,且与对照的差异均达到显著(P<0.05)水平。而F处理则使得根系总长度、总表面积分别较对照下降8.2%和7.1%,但差异不显著(P>0.05)。
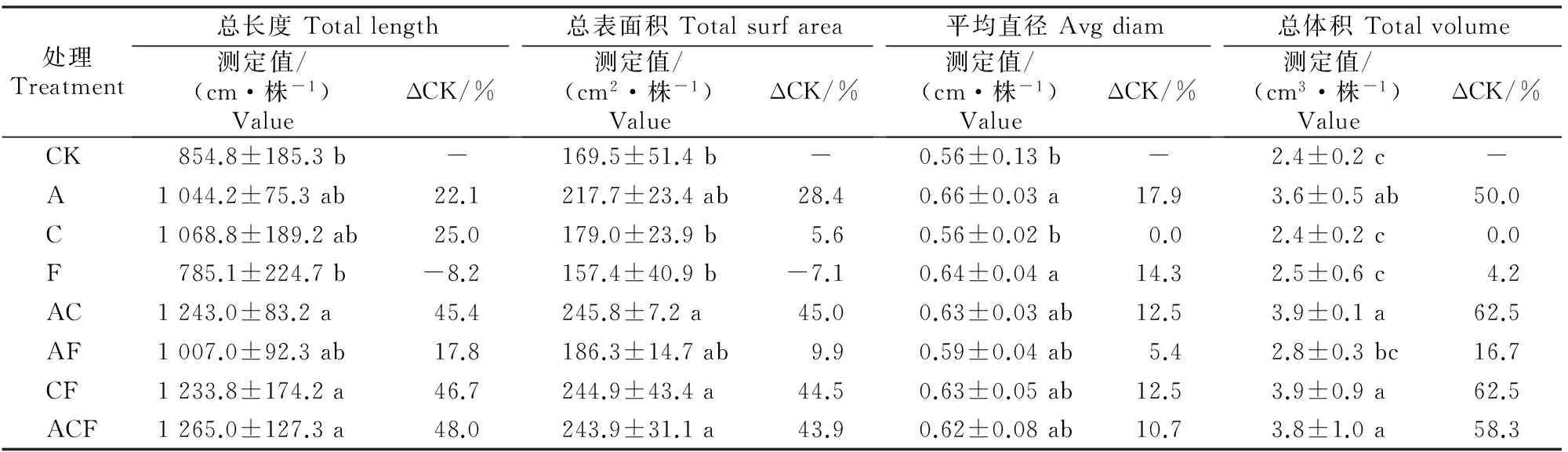
表 2 生防菌剂和腐植酸钾对甜瓜根系形态的影响Table 2 Effect of actinomyces agents and potassium humate on root morphology of melon
2.3生防菌剂和腐植酸钾对甜瓜叶面积及叶片绿色度的影响
由表3可知,生防菌剂及腐植酸钾处理均能增加甜瓜幼苗叶面积和叶片绿色度,其中C、CF、ACF处理甜瓜幼苗叶面积较对照分别增加37.3%,85.6%和34.7%(P<0.05);除F处理外,其他处理甜瓜幼苗叶片绿色度与对照的差异均达到显著(P<0.05)水平,其中AC、C、CF处理甜瓜幼苗叶片绿色度较对照分别增加16.7%,16.7%和13.6%。
2.4生防菌剂和腐植酸钾对甜瓜光合特性的影响
由表4可知,生防菌剂和腐植酸钾处理对甜瓜光合特性有一定影响,其中AC、CF处理甜瓜幼苗净光合速率分别较对照增加19.0%和24.1%,与对照差异均达到显著(P<0.05)水平;A、CF、ACF处理的气孔导度分别较对照增加41.6%,50.7%和66.7%,蒸腾速率分别较对照增加33.3%,45.8%和54.2%,与对照的差异均达到显著(P<0.05)水平;A、ACF处理的胞间CO2浓度分别较对照增加19.7%和25.8%(P<0.05),与对照的差异达到显著(P<0.05)水平。其余处理各指标与对照差异均不显著(P>0.05)。
从各光合参数之间的相关性计算结果可知,气孔导度与胞间CO2浓度(R2=0.923,P<0.01)、蒸腾速率(R2=0.992,P<0.01)之间均呈极显著正相关,蒸腾速率与胞间CO2浓度也呈极显著正相关(R2=0.880,P<0.01)。
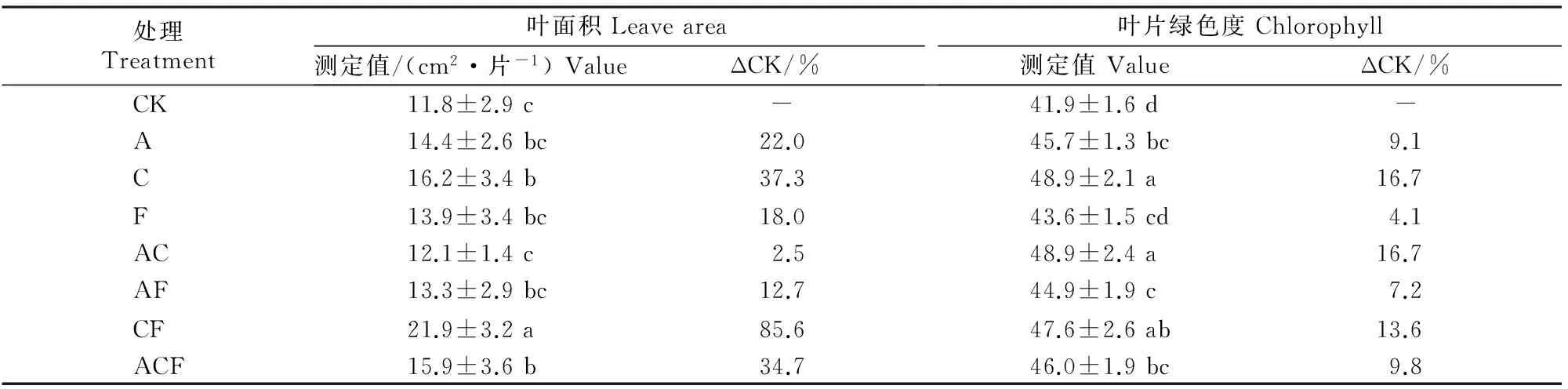
表 3 生防菌剂和腐植酸钾对甜瓜幼苗叶面积及叶片绿色度的影响Table 3 Effect of actinomyces agent and potassium humate on area and chlorophyll of melon leaf

表 4 生防菌剂和腐植酸钾对甜瓜光合特性的影响Table 4 Effect of actinomyces agent and potassium humate on photosynthetic characteristics of melon
2.5生防菌剂和腐植酸钾对甜瓜叶片诱导酶活性及丙二醛含量的影响
由表5可知,施用生防菌剂和腐植酸钾对甜瓜叶片POD、PAL、PPO活性及MDA含量均有影响,其中,POD、PPO活性分别较对照降低28.9%~72.7%和25.7%~45.3%,各处理与对照差异均达到显著(P<0.05)水平;PAL活性较对照下降4.0%~29.3%,除CF、ACF处理外,其余处理与对照差异均达到显著(P<0.05)水平;MDA含量较对照下降4.8%~33.3%,除A、AF处理外,其余处理与对照差异均达到显著(P<0.05)水平。
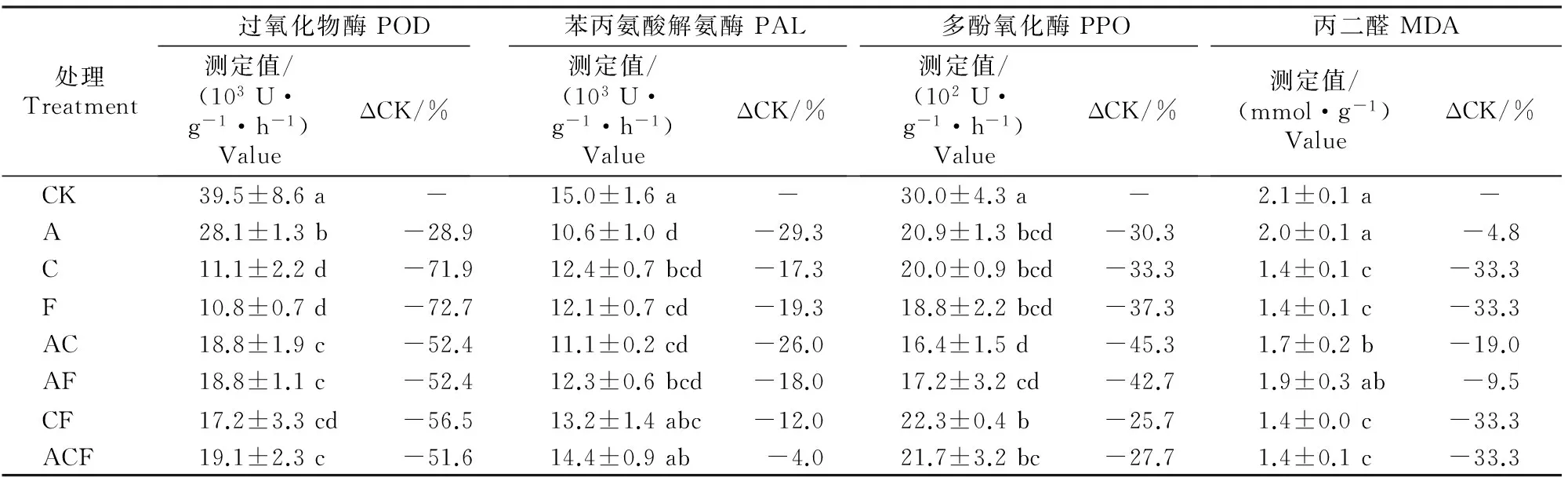
表 5 生防菌剂和腐植酸钾对甜瓜叶片诱导酶活性及丙二醛含量的影响Table 5 Effect of actinomyces agent and potassium humate on induced enzyme activities and malondialdehyde content of melon leaf
3 讨 论
工厂化育苗已成为设施农业及高附加值种植业的常规育苗技术,其中基质是决定工厂化育苗质量的关键。现有研究主要集中在基质原料及配比上,而对通过改进基质组成、接种有益微生物及添加养分提高基质育苗质量的研究不多[14-15]。目前对生防放线菌[16]、真菌[8]及腐植酸钾[17-18]的防病促生作用已有较多研究,但尚不清楚将其加入普通育苗基质会对育苗质量有何影响。
本研究表明,在以沼渣为主要成分的育苗基质中接入放线菌、真菌活菌制剂及腐植酸钾,对甜瓜幼苗均有一定的促生及提高抗逆性的效果。其中,放线菌与生防真菌、腐植酸钾与生防真菌配施处理的效果优于其他处理,表现为甜瓜幼苗地上部生长较快,根系发达,光合能力增强,MDA含量下降,叶片细胞质膜中膜脂抗氧化能力增强。其中的甜瓜幼苗根系发达,主要表现为大多处理根系长度、表面积、直径及总体积较对照基质明显增加。根系长度及表面积增大有助于增加根系对养分、水分的吸收量。根系是植物吸收养分、水分的主要器官,菌剂及腐植酸钾对根系生长的促进作用将直接影响到甜瓜幼苗茎叶发育及健康程度。至于供试菌剂的促生原因可能与其具有产生植物激素的能力有关,其详细机制有待后续研究证实。
本研究发现,甜瓜幼苗光合能力增强,主要表现在添加菌剂及腐植酸钾后甜瓜单叶面积增大、叶片绿色度增加及净光合能力增强。这些效应对培育健苗、壮苗有重要意义,也解释了添加菌剂及腐植酸钾后甜瓜幼苗总生物量增加的原因。向基质中加入菌剂及腐植酸钾提高了穴盘苗的光合能力,不仅促进了穴盘甜瓜苗生长,对于移栽后植株生长及产量也有重要的促进作用(另文报道)。
本研究发现,添加菌剂及腐植酸钾后甜瓜幼苗叶片MDA含量下降,表明叶片细胞质膜中膜脂抗氧化能力增强。MDA是膜脂过氧化的主要产物,其累积量可作为衡量细胞膜受伤害程度的指标[19]。MDA含量下降,表明向沼渣原料基质中加入生防菌及腐植酸钾可提高穴盘甜瓜苗的抗逆性,对提高幼苗移栽后的抗性有重要作用。
另外,本研究还发现,向基质中加入菌剂及腐植酸钾后,甜瓜叶片的3种诱导酶POD、PPO及PAL活性均较对照明显下降,这与陈秦等[16]的研究结果相同,与段春梅等[11]的研究结果相反。PPO、PAL和POD是植物体内常见的诱导酶,当植物受到病害或者是逆境胁迫时,这些酶会被激活或被大量合成,从而起到保护植物的作用。本研究中,加入菌剂及腐植酸钾在表现出良好促生效应、细胞质膜中脂类抗氧化性增强的同时,出现3种诱导酶活性下降,其原因尚不清楚,推测这些添加组分影响了甜瓜幼苗的蛋白质代谢。而上述3种诱导酶均属于蛋白质,但其详细机理有待进一步研究。
本研究还发现,腐植酸钾单施或与生防放线菌及生防真菌配施时,甜瓜幼苗根系活力明显下降,推测与其用量过大(5 g/kg)有关。试验所用腐植酸钾的pH为9~10,用量过大导致基质pH较高,对根系有伤害。因此,后续试验应对其适宜用量进行研究。
4 结 论
将生防放线菌、真菌制剂单独或与腐植酸钾混合后加入以沼渣为主料的育苗基质,可制备具有促生活性的功能基质;使用该基质可显著影响穴盘甜瓜苗的生物学特性、生理生化功能及抗逆性,对培育健苗、壮苗,提高穴盘甜瓜苗质量有重要作用。
[1]刘帅成,何洪城,曾琴.国内外育苗基质研究进展 [J].北方园艺,2014(15):205-208.
Liu S C,He H C,Zeng Q.Research progress of breeding substrate at home and abroad [J].Northern Horticulture,2014(15):205-208.
[2]闫杰,罗庆熙,韩丽萍.工厂化育苗基质研究进展 [J].中国蔬菜,2006(2):34-37.
Yan J,Luo Q X,Han L L.A survey of the research on industrial nursery substrate [J].China Vegetables,2006(2):34-37.
[3]赵玲,敖永华,刘荣厚.不同配比沼渣基质对草莓生长发育及叶绿素荧光特性的影响 [J].沈阳农业大学学报,2010,41(2):185-189.
Zhao L,Ao Y H,Liu R H.Effects of different ratio of biogas residue media on the growth and chlorophyll fluorescence characteristics of strawberry [J].Journal of Shenyang Agricultural University,2010,41(2):185-189.
[4]吴春玲,刘娟,李贵忠,等.利用沼渣复合基质进行黄瓜穴盘育苗的试验研究 [J].蔬菜,2006(1):40-41.
Wu C L,Liu J,Li G Z,et al.Experimental study on the use of biogas compound substrates plug seedling of cucumber [J].Vegetable,2006(1):40-41.
[5]赵娟,杜军志,薛泉宏,等.3株放线菌对甜瓜幼苗的促生与抗性诱导作用 [J].西北农林科技大学学报(自然科学版),2010,38(2):109-116.
Zhao J,Du J Z,Xue Q H,et al.The growth-promoting effect of and resistance induction of 3 antagonistic actinomyces onCucumismelon[J].Journal of Northwest A&F University(Natural Science Edition),2010,38(2):109-116.
[6]孙敬祖,薛泉宏,唐明,等.放线菌制剂对连作草莓根区微生物区系的影响及其防病促生作用 [J].西北农林科技大学学报(自然科学版),2009,37(12):153-158.
Sun J Z,Xue Q H,Tang M,et al.Study on the effect of actinomycetes on microflora of replanted strawberry’s root domain and the bio-control effectiveness [J].Journal of Northwest A&F University(Natural Science Edition),2009,37(12):153-158.
[7]申光辉,薛泉宏,张晶,等.草莓根腐病拮抗真菌筛选鉴定及其防病促生作用 [J].中国农业科学,2012,45(22):4612-4626.
Shen G H,Xue Q H,Zhang J,et al.Screening,identification and biocontrol potential of antagonistic fungi against strawberry root rot and plant growth promotion [J].Scientia Agricultrue Sinica,2012,45(22):4612-4626.
[8]陈杰,郭天文,汤琳,等.灰黄青霉CF3对马铃薯土传病原真菌的拮抗性及其促生作用 [J].植物保护学报,2013(4):301-308.
Chen J,Guo T W,Tang L,et al.The antagonism ofPenicilliumgriseofulvumCF3 against soil-borne fungal pathogens of potato and its growth-promoting effect on the plant [J].Journal of Plant Protection,2013(4):301-308.
[9]张忠良,刘列平,何斐.放线菌剂与腐植酸钾对魔芋抗病促生效果研究 [J].腐植酸,2014(4):45-49.
Zhang Z L,Liu L P,He F.Study of combined application of actinomycetes biocontrol agents and potassium humate on disease resistance and growth-promoting effect ofAmorphophalluskonjac[J].Humic Acid,2014(4):45-49.
[10]许英俊,薛泉宏,邢胜利,等.3株放线菌对草莓的促生作用及对PPO活性的影响 [J].西北农业学报,2008(1):129-136.
Xu Y J,Xue Q H,Xing S L,et al.The growth of promoting effect and induced endurance of three actinomyces strains to strawberry [J].Acta Agriculturae Boreali-Occidentalis Sinica,2008(1):129-136.
[11]段春梅,薛泉宏,赵娟,等.放线菌剂对黄瓜幼苗生长及叶片PPO活性的影响 [J].西北农业学报,2010(9):48-54.
Duan C M,Xue Q H,Zhao J,et al.Effects of antimicrobial actinomyces on growth and PPO activity in cucumber [J].Acta Agriculturae Boreali-Occidentalis Sinica,2010(9):48-54.
[12]高俊凤.植物生理学实验技术 [M].北京:高等教育出版社,2000.
Gao J F.The experiment method of plant physiology [M].Beijing:Higher Education Press,2000.
[13]郑莲姬,钟耕,张盛林.白魔芋中多酚氧化酶活性测定及其护色研究 [J].西南大学学报(自然科学版),2007(2):118-121.
Zheng L J,Zhong G,Zhang S L.PPO activity determination and anti-browning measure forAmorphophallusalbus[J].Journal of Southwest University(Natural Science Edition),2007(2):118-121.
[14]黄云,廖铁军,欧国武,等.大棚蔬菜无土栽培固体基质筛选的研究 [J].西北农业学报,2002(1):87-91.
Huang Y,Liao T J,Ou G W,et al.Study on screening solid matrices of vegetable soilless culture in plastics film shed [J].Acta Agriculturae Boreali-Occidentalis Sinica,2002(1):87-91.
[15]张淑静,王清海,刘幸红,等.轻基质添加生防菌对黑松育苗的影响 [J].山东林业科技,2010(2):59-61.
Zhang S J,Wang Q H,Liu X H,et al.Effect of adding biocontrol bacteria in light media on black pine seedling [J].Journal of Shandong Forestry Science and Technology,2010(2):59-61.
[16]陈秦,薛泉宏,申光辉,等.放线菌制剂对番茄PPO活性及生物量的影响 [J].西北农林科技大学学报(自然科学版),2010,38(3):184-188.
Chen Q,Xue Q H,Shen G H,et al.Effect of biocontrol actinomyces agent on growth and PPO activity of tomato [J].Journal of Northwest A&F University(Natural Science Edition),2010,38(3):184-188.
[17]姚海兰,史春余,王汝娟.腐植酸钾对食用甘薯块根品质的调控效应 [J].腐植酸,2009(1):24-28.
Yao H L,Shi C Y,Wang R J.Effect of potassium humate on storage root quality of edible sweetpotato [J].Humic Acid, 2009(1):24-28.
[18]杨安民,刘漫道,唐保善,等.腐植酸钾在棉花上应用效果研究 [J].中国棉花,1999(7):12-14.
Yang A M,Liu M D,Tang B S,et al.Effect of potassium humate apply on cotton [J].China Cotton,1999(7):12-14.
[19]梁新华,史大刚.干旱胁迫对光果甘草幼苗根系MDA含量及保护酶POD、CAT活性的影响 [J].干旱地区农业研究,2006(3):108-110.
Liang X H,Shi D G.Effect of drought stress on the content of malondialdehyole and activity of cell defense enzymes inGlycyrrhizaglabraseedlings roots [J].Agricultural Research in the Arid Areas,2006(3):108-110.
Growth-promoting effect of biocontrol bacteria and potassium humate in functional nursery substrate on plug seedling of melon
SUN Yueyue,MA Junni,LI Yulong,LAI Hangxian,XUE Quanhong
(CollegeofResourcesandEnvironment,NorthwestA&FUniversity,Yangling,Shaanxi712100,China)
【Objective】 This study aimed to explore the growth-promoting effect of biocontrol agent and potassium humate in nursery substrate on plug seedling of melon. 【Method】 Using melon variety “Baishami” as test materials,plug seedling technology was used to study the effect of biological agent and potassium humate on biological,physiological and biochemical characteristics of melon seedling including biomass of root and aerial part,total length,total area,total volume of root,activities of POD,PAL and PPO in leaf,content of MDA,leaf chlorophyll value and photosynthetic characteristics.A total of eight treatments were set:no agent and potassium humate treatment (CK),only actinomyces agent treatment (A),only fungi agent treatment (C),actinomyces agent and fungi agent mixed treatment (AC),only potassium humate treatment (F),actinomyces agent and potassium humate mixed treatment (AF),fungi agent and potassium agent mixed treatment (CF),actinomyces agent,fungi agent and potassium humate mixed treatment (ACF).【Result】 The biomass of melon seedlings treated by biocontrol agent and potassium humate were all higher than that in CK,with the highest increases of 34.1% and 19.5% in AF and CF.The root total length,total area,average diameter,and total volume in CF were increased by 46.7%,44.5%,12.5% and 62.5%,respectively.The single leaf area and leaf chlorophyll value were increased in all treatments compared with the control treatment.The leaf areas in C and CF were increased by 37.3% and 85.6% and the leaf chlorophyll values in C and CF were increased by 16.7% and 13.6%,respectively.Leaf net photosynthetic rate was increased by 24.1% in CF treatment.No matter only applied them mixed,The leaf POD,PAL and PPO activities and MDA content were all lower in treatments with biocontrol agent,potassium huamte or both. The leaf POD,PAL and PPO activities and MDA content were decreased by 56.5%,12.0%,25.7% and 33.3% in CF.【Conclusion】 Appling biocontrol agent and potassium humate would promote growth and root development of melon seedlings,improve photosynthetic rate,decrease MDA content,and promote quality of melon plug seedlings.The growth-promoting effect was more significant when the biocontrol actinomyces andP.griseofulvumwere inoculated together.
nursery substrate;biocontrol agent;potassium humate;melon;growth-promoting effect
时间:2016-08-0909:41DOI:10.13207/j.cnki.jnwafu.2016.09.023
2015-01-30
安徽宿州市科技计划项目“功能性基质研究与应用”;国家科技支撑计划项目(2012BAD14B11)
孙跃跃(1989-),男,安徽蚌埠人,在读硕士,主要从事微生物资源利用研究。E-mail:sunyue19890715@126.com
薛泉宏(1957-),男,陕西白水人,教授,硕士,博士生导师,主要从事微生物生态与资源利用研究。
E-mail:xuequanhong@163.com
S652.06+2
A
1671-9387(2016)09-0174-07
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160809.0941.046.html

