食源性沙门氏菌耐药表型与耐药基因的研究
侯雪娇,吴科敏,莫国东,刘书宏,言天久,焦鹏涛,韦 平,*
(1.广西大学养禽与禽病研究所,广西 南宁 530005;2.广西畜牧研究所,广西 南宁 530001;3.广西百色市畜牧技术推广站,广西 百色 533000)
食源性沙门氏菌耐药表型与耐药基因的研究
侯雪娇1,吴科敏1,莫国东2,刘书宏1,言天久3,焦鹏涛1,韦平1,*
(1.广西大学养禽与禽病研究所,广西 南宁 530005;2.广西畜牧研究所,广西 南宁 530001;3.广西百色市畜牧技术推广站,广西 百色 533000)
为了解食源性沙门氏菌(Salmonella)的耐药状况以及耐药基因与耐药表型的关系,从基因水平上探究Salmonella的耐药机制。本研究对215 株分离自1 093 份市售新鲜肉类中的Salmonella进行了耐药状况检测,设计了16 种引物对耐药基因进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,并对扩增产物进行克隆测序。结果显示,分离株对磺胺异恶唑耐药率最高(71.7%),其次为四环素(69.8%)、甲氧嘧啶(67.9%)和复方新诺明(52.8%),分离株对环丙沙星、呋喃妥因和头孢类比较敏感。三重及以上耐药的菌株占60.5%,最多可以耐受13 种抗生素;PCR共扩增到10 种耐药基因,测序结果表明扩增到的序列与GenBank上相应参考序列的相似性均在99%以上;β-酰胺类以及四环素类的耐药基因检出情况与耐药表型具有很高的一致性,符合率均在90%以上,其次为磺胺类(81.6%)。说明本研究中的食源性Salmonella分离株的耐药率高,多重耐药情况较为严重,耐药表型与耐药基因检测结果基本一致。
食品安全;沙门氏菌;抗生素;耐药表型/耐药基因
随着世界贸易的全球化,食品安全也日益成为全球关注的热点问题,世界卫生组织(World Health Organization,WHO)将2015年世界卫生日的主题定为“食品安全”,旨在呼吁全球人共同关注食源性疾病,保障人类餐桌的安全。沙门氏菌(Salmonella)是一种重要食品源性病原菌,世界上每年都会有数以百万计的人死于Salmonella的感染[1]。美国疾病预防与控制中心2013年的调查数据显示,在引起食品中毒的细菌、病毒以及其他病原中,Salmonella占首位,并且在过去的16 年里Salmonella的感染状况并没有减少的趋势[2]。
自20世纪40年代被人类发现以来,抗生素在对抗Salmonella等细菌性疾病方面起到了卓越的贡献,但是近年来随着抗生素的广泛应用,尤其是农业生产以及畜牧业中为防治疾病感染以及促生长为目的的不合理使用,导致菌群中的敏感菌株逐渐被杀灭,抗性菌株被选择或诱导出来,大量增殖并且成为优势群体[3-4]。耐药菌不仅给养殖业带来巨大的经济损失,也通过食品的污染威胁着人类的健康。据WHO统计,世界上每年有1 700万 人死于各类细菌、病毒等传染病,而细菌耐药性的广泛传播以及多重耐药现象是其中最主要的原因之一[5]。细菌的耐药机制的产生比较复杂,目前研究认为主要是通过质粒、整合子、转座子等可移动基因原件的介导下通过耐药基因的水平传播获得耐药性[6]。本研究检测了广西地区3 个城市的鲜肉类食品源性Salmonella耐药状况和耐药基因,以建立本地区的耐药基因库,有利于从根源上了解耐药性的产生的机制及其快速检测,完善对耐药食品源性Salmonella的风险评估,指导合理的临床用药。
1 材料与方法
1.1材料
2012年1月—2015年7月间,自南宁、钦州、百色市的超市和自由市场中采集1 093 份鲜肉(包括猪肉297 份、牛肉255 份、鸡肉276 份、鸭肉265 份)并参照Salmonella国标检测方法GB 4789.4—2010《食品安全国家标准 食品微生物学检验 沙门氏菌检验》[7]进行分离培养,经沙门菌属保守基因invA特异性聚合酶链式反应(polymerase chain reaction,PCR)[8]和生化实验双重鉴定并用沙门菌属诊断血清进行血清分型,获得215 株食源性Salmonella。
1.1.2培养基与试剂
MH琼脂购自广东环凯微生物科技有限公司。
PCR以及克隆测序试剂:2×Taq Master Mix、100 bp DNA Ladder、DL2000 Marker 日本TaKaRa公司;PUC-T TA快速连接试剂盒 北京康为生物科技有限公司;感受态细胞 北京天根生化科技有限公司;胶回收试剂盒 北京全式金生物技术有限公司。
1.1.3药敏纸片
共选择8 类抗生素中的16 种常规药敏纸片,包括:青霉素类中的氨苄西林、阿莫西林;第三代头孢类中的头孢噻肟、头孢他啶、头孢曲松;磺胺类及其增效剂中的复方新诺明、甲氧嘧啶、磺胺异恶唑;氨基糖苷类中的庆大霉素、链霉素、卡那霉素;喹诺酮类中的环丙沙星、萘啶酸;四环素类中的四环素;硝基呋喃类中的呋喃妥因;氯霉素类中的氯霉素,均购自杭州天和微生物试剂有限公司;药敏实验质控菌株大肠埃希氏菌ATCC 25922,由广西北海进出口检验检疫局赠予。
1.2方法
1.2.1Salmonella分离株耐药表型的检测
新生儿肺透明膜病伴羊水吸入性肺炎死亡法医解剖附1例报告 …………陈嘉妮,陈继樑,杨文仲,杨开明(82)
采用WHO推荐使用的Kirby-Bauer法(纸片琼脂扩散法)检测215 株分离株对8 类16 种供试抗生素的敏感性,简要步骤如下:挑取营养琼脂上纯培养的待检菌株,同时以大肠杆菌ATCC 25922为质控菌株,悬于4 mL生理盐水中,用细菌浊度仪测量并将浊度调整到0.5 麦氏浊度,取无菌棉签将菌液均匀涂布于MH琼脂上,用无菌镊子贴上药敏纸片,于37 ℃孵育18~24 h后取出,结果参照美国临床和实验室标准化委员会(Clinical and Laboratory Standards Institute,CLSI)2012版[9]药敏结果判定标准。
1.2.2Salmonella分离株耐药基因的PCR检测
采用热裂解法[10]提取细菌的总DNA,具体操作如下:取细菌纯培养物一环,置于1.5 mL的EP管中,加入25 mmol/L的NaOH 50 μL混合均匀后100 ℃水浴10 min,然后加入4 μL 1 mol/L的Tris-HCl,将上述混悬液12 000 r/min离心5 min,上清液即为DNA提取物。
根据GenBank中收录的耐药基因序列以及相关文献[11-12],用Primer Premier 5软件设计16 对引物,分别扩增β-内酰胺类、四环素类、磺胺类、氯霉素类、氨基糖苷类的耐药基因,引物序列见表1。PCR反应体系:Mix 12.5 mL,20 μmol/L的上下游引物各0.5 mL,DNA模板2 mL,加灭菌超纯水配成25 μL的体系;PCR反应条件:94 ℃预变性2 min,94 ℃变性30 s,退火30 s(各引物退火温度见表1),72 ℃延伸35 s,循环30 次后72 ℃终延伸2 min。产物进行1%琼脂糖凝胶电泳,并在凝胶成像系统上观察、拍照。

表1 耐药基因PCR引物及其序列Table1 PCR primers for antimicrobial-resistant genes
1.2.3Salmonella分离株耐药基因的克隆与测序
对PCR阳性扩增片段参照试剂盒说明书说进行凝胶回收;取胶回收产物3 μL、PUC-T载体1 μL、连接Buffer 5 μL、T4 DNA Ligase 1 μL,混匀后于25 ℃反应5 min,4 ℃保存备用;将连接产物转化DH5α感受态细胞,并送至上海英骏生物技术有限公司进行测序,将测序结果与GenBank上收录的序列进行同源性比对、分析。
2 结果与分析
2.1Salmonella分离株耐药表型测定结果
由图1药敏实验表明,Salmonella分离株对磺胺异恶唑、四环素、甲氧嘧啶、复方新诺明产生了很强的耐药性,耐药率均在50%以上(耐药率分别为:磺胺异恶唑71.7%、四环素69.8%、甲氧嘧啶67.9%、复方新诺明52.8%);其次为青霉素类的氨苄西林和阿莫西林;分离株对氨基糖苷类抗生素表现为不同程度的耐药性,其中对链霉素比较耐药而对庆大霉素较为敏感,前者耐药率高于后者20%以上;分离株对环丙沙星和呋喃妥因最为敏感。多重耐药分析结果显示,除了26 株对16 种供试药物全部敏感外,其余189 株均有不同程度的耐药性,其中耐3 种及以上抗生素的有130 株,占分离株的60.5%;耐5 种及以上抗生素的有93 株,占分离株的43.2%;耐10种及以上的有13 株,其中有4 株分离株可耐受高达13 种抗生素,这4 株分离株血清分型的结果:有2 株为S. enteritidis,另2 株分别为S. newlands和S. derby,其中前3 株均分离自钦州市,另1 株分离自南宁市。
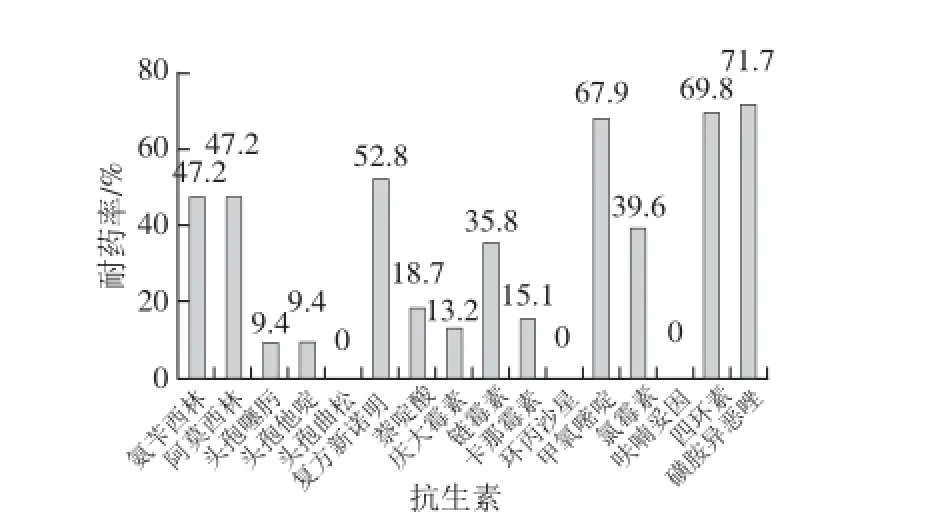
图1 1 Salmonellanella分离株对16 种抗生素的耐药状况Fig.1 Drug resistances of Salmonella isolates against 16 antibiotics
2.2Salmonella分离株耐药基因的检测结果

表2 耐药基因检出情况及测序的结果Table2 Detection of drug-resistant genes and sequence analysis
由表2可知,共扩增检测到了10 种耐药基因,其中β-内酰胺类检测到了blaTEM-I,blaPSE-1和blaCMY-2未检测到;磺胺类中以sulⅡ检出率最高,其次为sulI与sulⅢ,其中有4 个分离株同时检测到sulI、sulⅡ与sulⅢ这3 种基因,24 个分离株同时检测到sulI与sulⅡ基因,另有18 个分离株同时检测到sulⅢ与sulⅡ基因;氨基糖苷类中以strB检出最高,其次为aadA1,而aadB、aph(3’)-Ⅱa未检测到;氯霉素类以flo检出率最高,其次为cmLA,cat1未检测到,其中有16 个分离株同时检测到flo与cmLA基因;四环素类检测到了tetA、tetB,而tetG未检测到,其中有15 株同时携带有tetA与tetB基因,另外在4 株四环素敏感菌株中也扩增到了tetB基因。耐药基因序列的测定结果显示,本研究中扩增到的耐药基因与GenBank收录的参考序列的DNA相似性很高,都在99%以上。
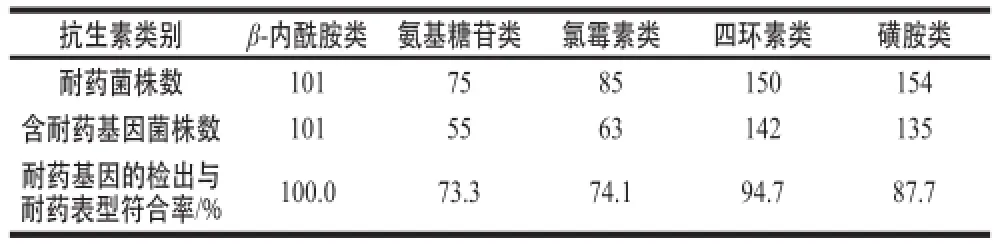
表3 耐药基因的检出与耐药表型的符合情况Table3 Consistency between drug-resistant phenotypes and drug-resistant geenneess
另外,由表3可知,215 个分离株对5 类抗生素耐药基因的检出情况与耐药表型的符合率都在70%以上,其中β-酰胺类以及四环素类的一致性最高,两者符合率均在90%以上,其次为磺胺类(87.7%),而氨基糖苷类和氯霉素类的符合率则相比而言较低,其符合率分别为73.3%与74.1%。
3 讨 论
本研究中的食源性Salmonella分离株耐药问题比较严重,除了环丙沙星、呋喃妥因和第三代头孢类比较敏感外,对磺胺类及其增效剂、四环素类以及β-内酰胺类等都产生了很强的耐药性,尤其是磺胺类,已高达71.7%。而黄志广等[13]在佛山农贸市场分离的食源性Salmonella对呋喃妥因和氯霉素耐药率高,杨保伟等[14]自陕西地区零售畜禽肉中分离的Salmonella对四环素、链霉素和卡那霉素耐药性最强,说明在不同时间、不同地区,由于生产中的用药情况的不同,其分离的Salmonella的耐药状况会有所不同;另外,本研究中对3 种及以上抗生素耐药的菌株占60.5%,耐10种以上的有13 株,有4 株分离株甚至可耐受高达13 种抗生素,这4 株中有3 株分离自钦州市,钦州市养殖业起步较早,但多年来发展缓慢,大部分仍为农户型的小养殖场,大型、规范化的养殖场却寥寥无几,由于农户缺乏饲养管理相关知识,抗生素滥用情况比较普遍,这是钦州株耐药性比较严重的一个重要原因。以上数据说明食源性Salmonella分离株的耐药问题已经相当严重,应该引起高度重视。据WHO统计,全球每年有大约90%的抗生素用于食用动物的饲料添加剂和疾病的防治,其中以作为饲料添加剂为主,只有10%用于人类疾病的治疗[15]。畜禽养殖中这种长期、少量的预防性或者促生长为目的用药是诱导细菌产生耐药性的重要原因。Salmonella作为一种食品源性病原菌,又是人畜共患病原,其耐药的产生给临床治疗带来了很大的挑战,多重耐药菌株的感染暴发将会给人类健康带来灾难性的后果[16-17]。
本研究的215 株分离株中,氯霉素类、β-内酰胺类、磺胺类、氨基糖苷类和四环素类5 类抗生素中检测到的优势耐药基因分别为flo、blaTEM-I、sulⅡ、strB、tetA。5 类耐药基因检出情况与耐药表型的符合率都在70%以上,但是不同类抗生素耐药基因与耐药表型符合率有所差别,其中β-内酰胺类、四环素类的符合率都在90%以上,而氯霉素类和氨基糖苷类的符合率均在70%左右;另外,本研究中有4 株四环素类敏感菌株中也检测到了tetB基因。说明耐药表型与耐药基因的存在有密切的关系,但是又遵循严格的一一对应关系,因为细菌的耐药机制相当复杂,耐药基因的位置(是在质粒上抑或是染色体上)、其遗传结构如何、耐药基因的表达情况、不同耐药基因之间的相互作用、细菌生物膜的形成等都会影响细菌对抗生素的耐药性,细菌对一种药物的耐药可能是几种耐药基因和耐药机制共同作用的结果[18-19],这些机制还需要进一步的研究。本研究中对耐药基因序列的测定结果表明,耐药基因的序列与参考序列的相似性很高,均在99%以上,有些即使个别碱基发生了突变,但其氨基酸序列相似性依然很高。刘芳菲等[20]在鸡源Salmonella中检测到的blaTEM-1、tetA等11 种耐药基因,王利勤等[21]在鸡源大肠埃希菌中检测到的aac(3)-Ⅱ、aph(3’)-I和aac(6’)-I等耐药基因与参考序列的相似性也均在97%以上,说明细菌的耐药基因比较稳定,自然条件下突变率较低。
本研究对广西地区3 个城市的肉类食品Salmonella的耐药性检测结果表明,本地食源性Salmonella耐药率比较高、多重耐药比较严重,耐药基因与耐药性相关性较强、耐药机制复杂,不同类抗生素的耐药基因与耐药表型的符合率不同,很多耐药机制还需要进行更加深入的研究。为防止Salmonella耐药性的产生和指导合理的临床用药提供理论依据,呼吁养殖业应立即减少动物饲养中促生长性与预防性抗生素的使用,尽量通过药敏实验选择敏感药物进行细菌性疾病的治疗,并且采用联合用药与交替用药的方法减少耐药性的产生,同时及时研发新药或使用微生态制剂等抗生素替代物,以减少食源性Salmonella的耐药性,保障人类的安全。
[1] ZHANG J, YANG X, KUANG D, et al. Prevalence of antimicrobial resistance of non-typhoidal Salmonella serovars in retail aquaculture products[J]. International Journal of Food Microbiology, 2015, 210: 47-52. DOI:10.1016/j.ijfoodmicro.2015.04.019.
[2] YANG Q, WANG F, JONES K L, et al. Evaluation of loop-mediated isothermal amplification for the rapid, reliabl e, and robust detection of Salmonella in produce[J]. Food Microbiology, 2015, 46: 485-493. DOI:10.1016/j.fm.2014.09.011.
[3] 丁元廷. 细菌耐药机制的国内外最新研究进展[J]. 现代预防医学,2013, 40(6): 1109-1111. DOI:10.3969/j.issn.1671-4695.2009.11.077.
[4] CLEMENTE L, MANAGEIRO V, JONES-DIAS D, et al. Antimicrobial susceptibility and oxymino-β-lactam resistance mechanisms in Salmonella enterica and Escherichia coli isolates from different animal sources[J]. Research in Microbiology, 2015, 166(7): 574-583. DOI:10.1016/j.resmic.2015.05.007.
[5] 蒋红霞, 曾振灵. 细菌耐药机制及耐药性控制对策[J]. 动物医学进展, 2001, 22(4): 4-7. DOI:10.3969/j.issn.1007-5038.2001.04.002.
[6] 李郁, 焦新安, 魏建忠, 等. 屠宰生猪多重耐药沙门菌I类整合子与耐药基因的检测[J]. 中国人兽共患病学报, 2008, 24(4): 327-330. DOI:10.3969/j.issn.1007-5038.2012.07.010.
[7] 卫生部, 中国国家标准化管理委员会. GB 4789.4—2010食品安全国家标准 食品微生物学检验 沙门氏菌检验[S]. 北京: 中国标准出版社, 2010.
[8] 王海源, 赵志伟, 莫国东, 等. 食品中常见病原菌多重PCR检测方法的建立[J]. 中国动物检疫, 2013(10): 51-56. DOI:10.3969/j.issn.1005-944X.2013.10.022.
[9] Clinical and Laboratory Stand ards Institute. M100-S22 Performance Standards for Antimicrobial Susceptibility Testing, Twenty-Second Informational Supplement[S]. Clinical and Laboratory Standards Institute, 2012: 44-49.
[10] YAMAZAKI W, TAGUCHI M, ISHIBASHI M, et al. Developmen t and evaluation of a loop-mediated isothermal amplification assay for rapid and simple detection of Campylobacter jejuni and Campylobacter coli[J]. Journal of Medical Microbiology, 2008, 57(4): 444-451. DOI:10.1099/jmm.0.47688-0.
[11] CHEN S, ZHAO S, DAVID G, et al. Characterization of multiple antimicrobial resistant Salmonella serovars isolated from retail meats[J]. Applied and Environmental Microbiology, 2004, 7: 1-7.
[12] 王晓泉. 不同来源多重耐药性沙门氏菌分离株的耐药机制和脉冲场凝胶电泳分析[D]. 扬州: 扬州大学, 2007: 41-56. DOI:10.7666/ d.y1103222.
[13] 黄志广, 莫嘉延, 李凤贞. 佛山市高明区农贸市场中食源性沙门氏菌血清型与耐药性现状[J]. 公共卫生与预防医学, 2012, 23(6): 6-9.
[14] 杨保伟, 盛敏, 席美丽, 等. 食源性沙门氏菌耐药性检测及相关质粒[J]. 微生物学报, 2008, 48(8): 1006-1012. DOI:10.3321/ j.issn:0001-6209.2008.08.004.
[15] 杨保伟. 食源性沙门氏菌特性及耐药机制研究[D]. 杨凌: 西北农林科技大学, 2010: 1-18.
[16] 姚大伟, 江芸, 徐幸莲, 等. 生鲜猪肉中沙门氏菌的分离、鉴定及耐药性检测[J]. 食品科学, 2012, 33(24): 210-214.
[17] 刘军锋, 贾克刚. 细菌耐药机制的研究进展[J]. 国际检验医学杂志,2006, 27(11): 1015-1017. DOI:10.3969/j.issn.1673-4130.2006.11.022.
[18] KARIUKI S, GORDON M A, FEASEY N, et al. Antimicrobial resistance and management of invasive Salmonella disease[J]. Vaccine,2015, 33(3): 21-29. DOI:10.1016/j.vaccine.2015.03.102.
[19] 杜雄伟, 李叶, 王晓辉. 沙门氏菌耐药机制的研究进展[J]. 江苏农业科学, 2010(6): 487-490. DOI:10.3969/j.issn.1002-1302.2010.06.194.
[20] 刘芳菲, 赵玉林, 李昌文, 等. 鸡源性沙门氏菌耐药基因检测与耐药相关性分析[J]. 中国预防兽医学报, 2013, 35(8): 627-630. DOI:10.3969/j.issn.1008-0589.2013.08.06.
[21] 王利勤, 王晶钰, 董瑞, 等. 鸡源致病性大肠埃希菌中氨基糖苷类抗生素耐药基因的检测[J]. 动物医学进展, 2012, 33(7): 49-53. DOI:10.3969/j.issn.1007-5038.2012.07.010.
Evaluation of Drug-Resistant Phenotypes and Genes in Foodborne Salmonella Isolates
HOU Xuejiao1, WU Kemin1, MO Guodong2, LIU Shuhong1, YAN Tianjiu3, JIAO Pengtao1, WEI Ping1,*
(1. Institute for Poultry Science and Health, Guangxi University, Nanning 530005, China; 2. Institute of Animal Husbandry in Guangxi, Nanning 530001, China; 3. Animal Husbandry Technology Promotion Station of Baise, Baise 533000, China)
In order to investigate the relationship between drug-resistant phenotypes and genes and explore the mechanism of drug resistance at the gene level, a total of 215 Salmonella strains isolated from 1 093 retail meat samples were assayed for antimicrobial susceptibility. Totally 16 pairs of primers were designed to amplify the drug-resistant genes and sequence homology was detected after T-A cloning. Results indicated that the Salmonella isolates showed the highest resistance to sulfisoxazole (SIZ) (71.7%), followed by tetracycline (TET) (69.8%), trimethoprim (TMP) (67.9%) and compound sulfamethoxazole (TSU) (52.8%), and all these isolates were sensitive to ciprofloxacin (CIP), nitrofurantoin (NIT) and cephalosporin. Approximately 60.5% of these isolates showed resistance to at least 3 kinds of antibiotics, and 4 of them were even resistant to 13 drugs. Ten drug-resistant genes were detected and they were found to share a homology higher than 99% with
equences. The consistency rates between drug-resistant phenotype and drug-resistant gene for β-lactams and tetracycline were both higher than 90%, followed by sulfonamides (81.6%). This study demonstrated that the drug resistance rate of foodborne Salmonella was high and their multi-drug resistance was serious. And the results of detection of drugresistant phenotypes and drug-resistant genes were consistent.
food safety; Salmonella; antibiotics; antimicrobial resistance phenotype/resistance genes
10.7506/spkx1002-6630-201619028
TS201.6
A
1002-6630(2016)19-0166-05
侯雪娇, 吴科敏, 莫国东, 等. 食源性沙门氏菌耐药表型与耐药基因的研究[J]. 食品科学, 2016, 37(19): 166-170.
DOI:10.7506/spkx1002-6630-201619028. http://www.spkx.net.cn
HOU Xuejiao, WU Kemin, MO Guodong, et al. Evaluation of drug-resistant phenotypes and genes in foodborne Salmonella isolates[J]. Food Science, 2016, 37(19): 166-170. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201619028. http://www.spkx.net.cn
2015-11-04
广西科学研究与技术开发计划项目(桂科重14121003-4-1);国家现代农业(广西肉鸡)产业技术体系创新团队建设专项(nycytxgxcxtd-04-20-2)
侯雪娇(1990—),女,硕士研究生,研究方向为食源性病原菌。E-mail:houxuejiaomk@163.com
韦平(1962—),男,教授,博士,研究方向为食品源性病原菌的检测技术。E-mail:pingwei8@126.com

