快速冷冻工艺对牛肉品质和组织结构的影响
冯宪超,周光宏*
(1.南京农业大学动物科技学院,畜牧学博士后流动站,江苏 南京 210095;2.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
快速冷冻工艺对牛肉品质和组织结构的影响
冯宪超1,2,周光宏1,*
(1.南京农业大学动物科技学院,畜牧学博士后流动站,江苏 南京 210095;2.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
通过对比普通冷冻工艺与快速冷冻工艺对牛腱子肌的色泽、解冻汁液损失率、蒸煮损失率、剪切力指标的影响,并且结合苏木精-伊红染色法、扫描电子显微镜、透射电子显微镜观察两种冷冻工艺对牛肉组织结构的影响。结果发现:快速冷冻工艺使解冻后牛腱子肌的H值仅上升了0.9%,而普通冷冻工艺处理后的H值上升了9.4%,两种冷冻工艺对H值的影响差异显著(P<0.05)。普通冷冻工艺处理的牛腱子肌解冻汁液损失率极显著高于快速冷冻工艺(P<0.01)。同时,普通冷冻工艺处理的牛腱子肌的蒸煮损失率明显高于快速冷冻工艺,两者差异显著(P<0.05)。另外,普通冷冻工艺处理的牛腱子肌的剪切力低于快速冷冻工艺和对照组,但是差异不显著。电子显微镜观察得出,普通冷冻工艺处理明显比快速冷冻工艺处理处理使解冻后牛肉的肌束间隙更大、肌原纤维间隙更大,同时普通冷冻工艺也破环了肌纤维横截面的结构。结果表明:快速冷冻工艺很好地保护了牛肉鲜艳的色泽,提高肉的食用品质。另外,快速冷冻工艺极大地降低了肉中冰晶的大小,保护了肉的组织结构,优化了肉的口感。
快速冷冻;牛肉;品质;结构
冷冻是一种使用广泛,并且高效的食品保鲜方法[1]。建国初期,我国居民肉食消费普遍以热鲜肉为主。目前,随着人民生活水平提高和消费习惯改变,冷却肉在肉制品消费中的所占比重越来越高,肉类消费安全也日益受到重视。20世纪90年代以来,国外开始关注改进食品的冷冻工艺、延长食品冷藏期等相关方面的研究。21世纪以来,冷冻工艺已被广泛应用于肉制品行业,因为它可以使肉的品质几个月之内保持在一个合理的、可接受的水平[2]。冷冻,这种延长肉类保质期最常见的做法,在确保所有地区的肉类产品供应安全方面起着至关重要的作用,也是国家储备和调节肉食品市场的重要调控手段[2]。通常按照冷却介质与肉品的接触方式可将肉品的冷冻方法分为3种:空气冷冻法、间接接触冷冻法和直接接触冷冻法[3]。然而,冷冻和解冻对肉品质的影响仍然是一个重大问题,这一过程主要会影响肉的含水量或者带来令人不愉快的肉色[4]。通常水包含在肉的肌肉纤维之间,冷冻过程对肉制品的品质特性有很大影响。当肉中的水结冰时,造成了溶质(蛋白质、碳水化合物、脂肪、维生素和矿物质)浓度的增加,从而破坏了复杂的肉内稳态系统。肌肉纤维环境的改变会影响细胞膜的特性,进而影响肉的品质。特别是冷冻肉组织内冰晶的大小、位置和分布是确定冷冻速率的关键[5],同时影响着肉类的品质[6]。研究指出冷冻速率过低是造成细胞内外形成大块冰晶体的主要原因[7]。而大的冰晶体会损害肌肉内的蛋白质和肌肉的细胞膜,因此造成不好的肉品品质特性,例如过高的滴水损失等[6,8-9]。相反,冷冻速率过快会在肉内形成无数细小的冰晶体,这些冰晶体均匀地分布在肌肉细胞内。肉的保质期一般是通过外观、质地、风味、颜色、微生物活动和营养价值等来确定的[10]。所有这些指标都受到冷冻贮藏和解冻过程的影响。相对于普通冷柜,快速冷冻能力冷柜具有更强的冷冻能力,可以加快冷冻速率,实现快速冷冻,从而提高食品的品质。因此,本实验对比分析快速冷冻能力冷柜冷冻(以下简称快速冷冻)和普通冷柜冷冻(以下简称普通冷冻)对肉品的保鲜效果,研究快速冷冻工艺对肉品品质及其组织结构的影响。
1 材料与方法
1.1材料与试剂
新鲜牛腱子肌购于南京苏果超市。
氯化钠、无水乙醇、氯仿、冰乙酸、戊二醛、锇酸、正丁醇、醋酸戊酯、甘油、磷酸盐、卡可酸钠、四氧化锇、醋酸钠、醋酸铀(均为分析纯) 美国Amresco公司。
1.2仪器与设备
BC/BD-272SE 272升卧式冷柜 海尔集团;M包 中国深圳市创鑫仪器有限公司;CR200Minota色差仪 美国美能达公司;BS233型电子分析天平北京赛多利斯计量仪器有限公司;Salte 235型沃布氏嫩度仪 美国G-R电器制造公司;高真空镀膜机 中国江苏伟创真空镀膜科技有限公司;OlympusBX41生物显微镜日本Olympus公司;S-3000N型扫描电子显微镜、H-7650透射电子显微镜 日本Hitachi公司。
1.3方法
1.3.1速冻液冷冻方法的可行性验证
为了实验的便捷性,本研究采用速冻液冷冻方法来代替快速冷冻能力冷柜进行快速冷冻。首先验证速冻液冷冻代替快速冷冻能力冷柜快速冷冻的可行性:将含量为26 g/100 mL(下同)的食盐水速冻液装入桶中置于冷柜中降温,同时放入温度热电偶监测速冻液的温度,待速冻液冷却到-20 ℃后将其从冷柜中取出。将用于快速冷冻的M包(用于测试冰箱性能的实验包,符合GB/T 8059.2—1995《家用制冷器具冷藏冷冻箱》[11])置于速冻保温桶中,倒入冷冻好的速冻液进行快速冷冻降温。记录M包的降温速率,直到M包的温度达到稳定为止。作为对比实验,将快速冷冻能力冷柜开机调至快速冷冻档,待样机进入稳定状态,放入M包,将其与冷柜前后壁面以最大接触面接触,记录M包的降温时间,直至M包的温度达到稳定为止。
由于冰晶的形态主要是通过结晶区的时间决定的,肉品保鲜中也是采用通过结晶区的时间来判断冷冻速率,M包的物理性质与牛肉基本相同,所以对比M包在速冻液和快速冷冻能力冷柜中通过结晶区(-5~0 ℃)的降温速率(图1)和通过结晶区的时间(速冻液冷冻方法为71 min,快速冷冻能力冷柜冷冻为68min),结果表明两种冷冻方式的降温速率曲线吻合良好,所以可以认为采用速冻液冷冻方法代替快速冷冻能力冷柜冷冻是准确可行的方案。

图1 速冻液冷冻和快速冷冻能力冷柜冷冻降温速率曲线Fig.1 Freezing speed curve of the frozen liquid and refrigerator with three times of cooling capacity
1.3.2样品处理
将26 g/100 mL的食盐水速冻液装入保温桶中,降温至-20 ℃。将牛腱子肌按照5 cm×5 cm×3 cm平均分为5 块,记为1~5号,保证其质量相近,然后分别称质量。将对照组(1号)牛腱子肌置于4 ℃的冷藏室内保鲜冷藏。冷柜温度设定为-20 ℃,开机至稳定,将普通冷冻的2 块牛腱子肌(2、3号)置于冷柜中,肉块中心放置热电偶。由于快速冷冻的冷冻速率远远高于普通冷冻,预实验冷冻发现,当冷柜中普通冷冻肉降低至-2 ℃再开始快速冷冻过程,牛腱子肌完成冷冻的时间很接近,便于同时进行冷冻肉的解冻实验。所以待普通冷冻牛腱子肌温度降至-2 ℃时,将用于快速冷冻的2块牛腱子肌(4、5号)置于速冻保温桶中,肉块中心放置热电偶,倒入冷冻好的-20 ℃的速冻液进行快速降温。当快速冷冻的牛腱子肌温度与普通冷冻的牛腱子肌相一致(实验中为-16.5 ℃)时,取出所有正在冷冻的4 块牛腱子肌,同时将对照组牛腱子肌从冷藏室内取出,分别放置在保鲜袋上,在室温(15~20 ℃)条件下充分解冻12 h。
1.3.3肉色测定

样品色度测定前,用标准白板校正色度计,白板的参数为:L*=97.83、a*=-0.43、b*=1.98,每个样品随机取3 个点测定冷冻前和解冻后的肉色。
1.3.4解冻汁液损失率测定
样品分别在解冻前和解冻后称质量,然后按照公式(1)计算解冻汁液损失率。

式中:m1为解冻前牛腱子肌质量/g;m2为解冻后牛腱子肌质量/g。
1.3.5蒸煮损失率测定
将样品在85 ℃水浴锅中蒸煮20 min,蒸煮前称质量mb/g。蒸煮后冷却到室温,然后再次称质量ma/g,按公式(2)计算蒸煮损失率。

1.3.6剪切力测定
将样品置于沸水中,直到其中心温度达到75 ℃时,取出冷却至室温,沿肌原纤维方向取3 个直径1.27 cm的肉柱,用沃布氏嫩度仪沿着与肌原纤维垂直的方向剪切肉柱,记录剪切力值[13]。
1.3.7苏木精-伊红(hematoxylin and eeosin staining,HE)染色普通电子显微镜观察
同时对上述肉样做石蜡切片进行光镜观察。具体做法是:从样品上剪下小块组织,顺肌肉纤维方向取稍大于5 mm×5 mm×5mm的样品放入Carnoy试剂(60%(V/V,下同)无水乙醇,30%氯仿,10%冰乙酸混合制备)中固定1 h左右(在固定10 min左右时进行适当的修整,使得样品形状规则)。固定后的样品转入无水乙醇中脱水2 h,正丁醇脱水2 h,正丁醇过夜,然后在60℃条件下石蜡透蜡、包埋、切片,HE红常规染色后封片。
1.3.8扫描电子显微镜观察
从样品上剪下小块组织,顺肌肉纤维方向取稍大于5 mm×5 mm×5 mm的小样品放入体积分数3%的戊二醛溶液中固定3 d或更长时间。用双蒸水清洗后,用戊二醛-锇酸再进行双固定,再用体积分数30%、50%、70%、80%、90%和100%的乙醇梯度脱水,100%的乙醇反复脱水3~4 次,每次10 min左右。采用二氧化碳临界点干燥法用醋酸戊酯置换样品中的脱水剂(乙醇)。在置换的同时进行干燥。用银粉导电胶将样品固定在样品台上,随后在高真空镀膜机内给样品表面镀一层金属膜。在扫描电子显微镜下进行微观结构观察[14]。
1.3.9透射电子显微镜观察
将肌肉薄片从样品中切除,标本切成1 mm×1 mm×2 mm的片段,在0.1 mol/L的磷酸盐缓冲液中用体积分数3.0%的戊二醛处理,室温下初始pH值为7.4,然后放在冰箱里过夜。在pH 7.4的卡可酸钠缓冲液中清洗2 h。随后,在含有2%的四氧化锇的卡可酸钠缓冲液中,pH 7.4条件下作用2 h,再用2%的醋酸钠溶液冲洗。在水中放置1 h后用2%醋酸铀染色,随后放在通风柜中,用锡箔纸包住瓶子保存。乙醇脱水:依次用体积分数50%、75%、95%、100%乙醇作用10 min,再用100%乙醇作用20 min[15]。观察肌原纤维超微结构的变化,用80 kV工作电压的透射电子显微镜H-7650拍摄。
1.4数据分析
数据表示为?±s,通过SPSS统计软件包程序对数据进行单因素方差分析。并利用多重比较,观察各组数据差之间的不同,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1快速冷冻工艺对牛肉肉色的影响
2.1.1亮度L*

图2 两种冷冻工艺处理的牛腱子肌冷冻前和解冻后L*值对比Fig.2 Color L* values of beef tendon muscle subjected to normal and quick freezing treatments before freezing and after thawing
由图2可知,4 ℃对照组,以及两种冷冻工艺处理的牛腱子肌的L*值,均为解冻后低于冷冻前,说明随着贮藏时间的延长,L*值下降,且与冷冻前相比差异显著(P<0.05)。快速冷冻工艺解冻后的L*值下降了10.7%,普通冷冻工艺解冻后的L*值下降了10.0%,两种冷冻工艺之间没有显著差别。
2.1.2红度a*

图3 两种冷冻工艺处理的牛腱子肌冷冻前和解冻后肉色a*值Fig.3 Color a* values of beef tendon muscle subjected to normal and quick freezing treatments before freezing and after thawing
a*值表示肉色的红度,有正负值之分,正值表示红度,负值表示绿度。由图3可知,对照组以及两种冷冻工艺处理的牛腱子肌的a*值,都是解冻后低于冷冻前,说明随着贮藏时间的延长,肉的a*值下降。4 ℃贮藏使得肉的a*值下降,与贮藏前相比差异显著(P<0.05)。快速冷冻工艺解冻后肉的a*值仅下降了3.5%,普通冷冻工艺解冻后肉的a*值下降了5.2%,解冻后快速冷冻工艺的牛腱子肌的a*值显著高于普通冷冻工艺,差异显著(P<0.05)。
2.1.3黄度b*

图4 两种冷冻工艺处理的牛腱子肌冷冻前和解冻后肉色Fig.4 Color b* values of beef tendon muscle subjected to normal and quick freezing treatments before freezing and after thawing
b*值表示肉色的黄度,有正负值之分,正值表示黄度,负值表示蓝度。由图4可知,对照组以及快速冷冻工艺处理的牛腱子肌的b*值,均为解冻后低于冷冻前,快速冷冻工艺解冻后肉的b*值下降了5.5%。但是普通冷冻工艺处理的牛腱子肌的b*值是解冻后高于冷冻前,升高了6.2%,可能是由于普通冷冻工艺处理牛肉的冷冻时间比较长造成的。4 ℃贮藏使得b*值下降明显,差异显著。
2.1.4色度角H
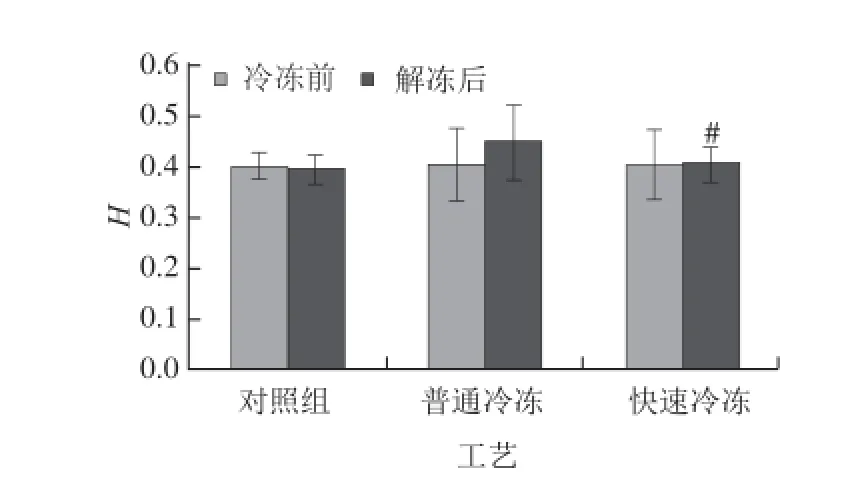
图5 两种冷冻工艺处理的牛腱子肌冷冻前和解冻后肉色H值Fig.5 Color H values of beef tendon muscle subjected to normal and quick freezing treatments before freezing and after thawing
肉色的变化可以通过H值来进行准确、直观的量化反映。H值在0~90之间时,值越低说明肉色越红,越高则表示肉色越黄。另外b*/a*越小,H值越小,即肉样的红色越接近新鲜红肉色泽[16]。由图5可知,对照组牛腱子肌的H值解冻后略低于冷冻前。快速冷冻工艺解冻后牛腱子肌的H值仅上升了0.9%,而普通冷冻工艺解冻后牛腱子肌的H值上升了9.4%,解冻后快速冷冻工艺牛腱子肌与普通冷冻工艺牛腱子肌相比差异显著(P<0.05)。说明快速冷冻工艺很好地保护了肉色的鲜红色泽。
2.2两种冷冻工艺对牛肉解冻汁液损失率的影响

图6 两种冷冻工艺处理的牛腱子肌解冻汁液损失对比Fig.6 Thawing loss values of beef tendon muscle subjected to normal and quick freezing treatments
由图6可知,普通冷冻工艺处理的牛腱子肌解冻汁液损失率明显高于快速冷冻工艺,两者差异极显著(P<0.01)。由于普通冷冻工艺处理牛肉的冷冻时间比较长,牛肉内部形成的冰晶比较多,所以造成的解冻汁液损失比较多。说明快速冷冻工艺提高了冷冻过程中牛肉的保水性。
2.3两种冷冻工艺对牛肉蒸煮损失率的影响

图7 两种冷冻工艺处理的牛腱子肌蒸煮损失率对比Fig.7 Cooking loss values of beef tendon muscle subjected to normal and quick freezing treatments.
由图7可知,普通冷冻工艺处理的牛腱子肌的蒸煮损失率明显高于快速冷冻工艺,两者差异显著(P<0.05)。说明普通冷冻工艺处理牛肉的冷冻时间较长,牛肉内部形成了大量的冰晶,所以造成的较高的汁液损失。
2.4两种冷冻工艺对牛肉剪切力的影响
由图8可知,普通冷冻工艺处理的牛腱子肌的剪切力低于快速冷冻工艺和对照组,但是差异不显著,说明普通冷冻工艺处理牛腱子肌的冷冻时间比较长,长时间的冷冻使牛腱子肌得到了充分的嫩化。

图8 两种冷冻工艺处理的牛腱子肌解冻后的剪切力对比Fig.8 Shear force of beef tendon muscle subjected to normal and quick freezing treatments.
2.5两种冷冻工艺对牛肉组织结构的影响
2.5.1普通电子显微镜观察

图9 两种冷冻工艺处理的牛腱子肌解冻前后对比Fig.9 HE staining of beef tendon muscle subjected to normal and quick freezing treatments before freezing and after thawing
HE染色观察肌束的横截面,通过肌束之间的空隙大小来判断冰晶形成的多少和大小。图9C2是普通冷冻后腱子肌解冻后肌肉组织,可以观察到明显比快速冷冻工艺处理后牛腱子肌解冻后(图9B2)肌肉组织的间隙要大,说明快速冷冻工艺使牛肉组织间的冰晶形成减少。
2.5.2扫描电子显微镜观察
骨骼肌的横切面一般呈圆形,其中肌原纤维的横切面呈不规则的多边形。扫描电子显微镜观察到的是肌原纤维束的横截面,肌原纤维间的空隙大小可以用来判断肌肉组织中形成的冰晶的多少和大小。图10C2是普通冷冻后牛腱子肌解冻的肌肉组织,可以观察到普通冷冻工艺解冻后牛腱子肌肌纤维组织明显比快速冷冻工艺解冻后的间隙要大,同时普通冷冻工艺也破坏了肌纤维横截面的结构,说明快速冷冻工艺使牛肉组织间的冰晶形成减少,同时能保护肉的组织结构。

图10 两种冷冻工艺处理的牛腱子肌解冻前后对比(×50000)Fig.10 Scanning electron microscope (SEM) of images beef tendon muscle subjected to normal and quick freezing treatments before freezing and after thawing (× 500)
2.5.3透射电子显微镜观察
透射电子显微镜观察到的是肌原纤维的纵截面。通过肌原纤维间空隙的大小,以及肌原纤维的完整性来判断肌肉组织中形成的冰晶的大小。图11C2是普通冷冻工艺解冻后牛腱子肌肉组织,可以观察到明显比快速冷冻工艺解冻后的间隙要大(图11B2),说明快速冷冻工艺使牛肉组织间的冰晶形成减少。

图11 两种冷冻工艺处理的牛腱子肌解冻前后对比(×2 5000)Fig.11 Transmission electron microscope (TEM) images of beef tendon muscle subjected to normal and quick freezing treatments before freezing and after thawing (×2 500)
3 讨 论
通过普通冷冻和快速冷冻两种冷冻工艺处理后,研究结果表明随着贮藏时间的延长,肉的亮度值L*一般都会下降。然而,解冻后快速冷冻的处理方式保护了牛肉的红色,同时快速冷冻工艺处理使牛肉令人不愉快的亮黄色显著降低。H值可以准确、直观的量化肉色的变化情况,H值越小,肉样的红色越接近新鲜红肉色泽,本课题组研究表明快速冷冻工艺很好地保护了肉的鲜红色泽。大量研究通过比较肉色与高铁肌红蛋白对氧化的耐受能力,验证肉品在被冷藏后,冷冻和解冻的过程中肌红蛋白被氧化,随后造成了肉品表面最佳颜色(即鲜红色泽)的降低[17-20]。冷冻速率对肌肉结构具有重要的影响作用,冰晶体的形成会影响细胞的物理损伤程度和蛋白质的化学变化,从而可能进一步影响肉中脂肪稳定氧化的程度[6]。众所周知,冷冻和解冻过程会导致牛肉表面色泽变暗,同时由于增加了肌红蛋白的氧化敏感性,而降低了肉色的稳定性[21-22]。在冷冻贮藏条件下,高铁肌红蛋白还原酶的活力被抑制,高铁肌红蛋白无法还原为肌红蛋白,这使得高铁肌红蛋白得到大量的积累,进而使肉的红色度下降[23]。本研究发现普通冷冻工艺处理的牛腱子肌的解冻汁液损失率明显高于快速冷冻工艺,同时蒸煮损失率明显高于快速冷冻工艺,说明了快速冷冻工艺提高了冷冻过程中牛肉的保水性。
肌肉中水分含量大约是70%,主要存在于肌肉组织的肌细胞中,即肌原纤维中、肌原纤维间、肌原纤维与细胞膜之间、细胞间和肌束之间的空隙中[24]。水是两性分子,可以和蛋白质分子中的电荷相互吸引结合到蛋白质分子上,称为结合水,宰后这部分水基本不变[24]。另外一部分水分叫不易流动水,它受空间效应的影响而存在于肌肉中,或与结合水结合,但没有和蛋白质结合。宰后早期不能自由流动,但可被干燥除去,也可以被冷冻。在肌肉转变为肉的过程中受影响最大的是不易流动水,也是在加工中要尽可能保持的水分[25]。由于细胞间水分所组成的主体溶液中的盐的浓度比细胞内水分所组成的主体溶液低,因此细胞间的液体具有较高的冷冻点,晶核首先在细胞间形成。这一部分液体的冷冻导致剩余水分中盐浓度的升高,从而引起细胞间渗透压的升高,为了平衡细胞内外的溶质浓度,水分从肌纤维解离进入细胞间,这种水分进入细胞间后随着温度的降低会以已经形成的冰晶为晶核,导致冰晶进一步生长,所以如果冷冻的时间过长,就导致了细胞间的冰晶不断增大,细胞间隙也比快速冷冻要大得多[26]。而快速冷冻,是在短时间形成大量细小的冰晶,所以肌细胞和肌束间隙也相对小一些[27-28]。同时,冰晶从冰核开始长大的同时不断在克服组织结构的束缚,反过来讲也就是冰晶的生长挤压肌纤维,破坏了肌肉组织的组织结构。电子显微镜观察发现快速冷冻肌肉组织中形成的冰晶要小于普通冷冻的肉样。另外,快速冷冻工艺比普通冷冻形成的冰晶小是由于冷冻时,冰晶的大小与晶核的数目有关,而晶核的数目多少与冷冻的速率有关。快速冷冻时,晶核同时形成的数量多、大小分布比较均匀,因此,形成的冰晶小[29]。这些结果说明冷冻速率对冰晶的大小有显著影响,随着冷冻速率增大,样品组织中形成冰晶的速率增大,冰晶形态逐渐变小,数量逐渐增多,在冷冻组织中分布的均匀程度逐渐增大[27]。由此可见,冷冻传热速率对冰晶形成速率及大小有极显著影响。由结果可知,普通冷冻工艺和快速冷冻工艺都影响了牛肉的组织结构,普通冷冻工艺使得肌束之间的空隙加大,同时影响了肌纤维的整体完整性,但是快速冷冻工艺极大地缓解了这一现象,快速冷冻工艺得到的结果和对照组极为相似,只是轻微地影响了肌束间的空隙,对肌纤维的整体结构影响很小。
[1] KIANI H, SUN D W. Water crystallization and its importance to freezing of foods: a review[J]. Trends in Food Science & Technology,2011, 22(8): 407-426. DOI:10.1016/j.tifs.2011.04.011.
[2] 余小领, 周光宏, 徐幸莲. 肉品冷冻工艺及冻结方法[J]. 食品工业科技, 2006, 27(5): 199-202. DOI:10.3969/j.issn.1002-0306.2006.05.065.
[3] 胡宏海, 路立立, 张泓. 肉品冻结解冻及无损检测技术研究现状与展望[J]. 中国农业科技导报, 2015, 17(5): 6-10. DOI:10.13304/ j.nykjdh.2015.57.
[4] ZHOU G, ZHANG W, XU X. China’s meat industry revolution:challenges and opportunities for the future[J]. Meat Science, 2012,92(3): 188-196. DOI:10.1016/j.meatsci.2012.04.016.
[5] BEVILACQUA A E, ZARITZKY N E. Ice morphology in frozen beef[J]. International Journal of Food Science & Technology, 1980,15(6): 589-597. DOI:10.1111/j.1365-2621.1980.tb00978.x.
[6] LEYGONIE C, BRITZ T J, HOFFMAN L C. Impact of freezing and thawing on the quality of meat: review[J]. Meat Science, 2012, 91(2):93-98. DOI:10.1016/j.meatsci.2012.01.013.
[7] 李卫兵, 赵刚. 基于修正的Mazur方程的细胞最优化低温保存方案理论预测[J]. 化学学报, 2010, 68(7): 617-622,
[8] GRUJIĆ R, PETROVIĆ L, PIKULA B, et al. Definition of the optimum freezing rate-1. investigation of structure and ultrastructure of beef M. iongissimus dorsi frozen at different freezing rates[J]. Meat Science, 1993, 33(3): 301-318. DOI:10.1016/0309-1740(93)90003-Z.
[9] MARTINO M N, OTERO L, SANZ P D, et al. Size and location of ice crystals in pork frozen by high-pressure-assisted freezing as compared to classical methods[J]. Meat Science, 1998, 50(3): 303-313. DOI:10.1016/S0309-1740(98)00038-2.
[10] McMILLIN K W. Where is MAP going? a review and future potential of modified atmosphere packaging for meat[J]. Meat Science, 2008,80(1): 43-65. DOI:10.1016/j.meatsci.2008.05.028.
[11] 闫俊青, 王云飞, 陈蒲, 等. GB/T 8059.2 —1995 家用制冷器具 冷藏冷冻箱[S]. 北京: 中国标准出版社, 1995.
[12] MANCINI R A, HUNT M C. Current research in meat color[J]. Meat Science, 2005, 71(1): 100-121, DOI:10.1016/j.meatsci.2005.03.003.
[13] HOLMAN B W B, ALVARENGA T I R C, van de VEN R J, et al. A comparison of technical replicate (cuts) effect on lamb Warner-Bratzler shear force measurement precision[J]. Meat Science, 2015,105: 93-95. DOI:10.1016/j.meatsci.2015.02.013.
[14] CHAURASIYA R S, SAKHARE P Z, BHASKAR N, et al. Efficacy of reverse micellar extracted fruit bromelain in meat tenderization[J]. Journal of Food Science and Technology, 2015, 52(6): 3870-3880. DOI:10.1007/s13197-014-1454-z.
[15] JIN T X, ZHU H M, XU L. Moisture movement characteristics and their effect on the ultrastructure of cooked meat during vacuum cooling[J]. Biosystems Engineering, 2006, 95(1): 111-118. DOI:10.1016/j.biosystemseng.2006.06.004.
[16] 王玮, 葛毅强, 王永涛, 等. 超高压处理保持猪背最长肌冷藏期间肉色稳定性[J]. 农业工程学报, 2014, 30(10): 248-253. DOI:10.3969/ j.issn.1002-6819.2014.10.031.
[17] LEYGONIE C, BRITZ T J, HOFFMAN L C. Oxidative stability of previously frozen ostrich Muscularis iliofibularis packaged under different modified atmospheric conditions[J]. International Journal of Food Science & Technology, 2011, 46(6): 1171-1178. DOI:10.1111/ j.1365-2621.2011.02603.x.
[18] OTREMBA M M, DIKEMAN M E, BOYLE E A E. Refrigerated shelf life of vacuum-packaged, previously frozen ostrich meat1[J]. Meat Science, 1999, 52(3): 279-283. DOI:10.1016/S0309-1740(99)00003-0.
[19] FAROUK M M, SWAN J E. Effect of muscle condition before freezing and simulated chemical changes during frozen storage on the pH and colour of beef[J]. Meat Science, 1998, 50(2): 245-256. DOI:10.1016/S0309-1740(98)00036-9.
[20] LANARI M C, BEVILACQUA A E, ZARITZKY N E. Pigment modifications during freezing and frozen storage of packaged beef[J]. Journal of Food Process Engineering, 1990, 12(1): 49-66. DOI:10.1111/j.1745-4530.1990.tb00040.x.
[21] RENERRE M. Factors involved in the discoloration of beef meat[J]. International Journal of Food Science & Technology, 1990, 25(6):613-630. DOI:10.1111/j.1365-2621.1990.tb01123.x.
[22] KIM Y H B, FRANDSEN M, ROSENVOLD K. Effect of ageing prior to freezing on colour stability of ovine longissimus muscle[J]. Meat Science, 2011, 88(3): 332-337. DOI:10.1016/j.meatsci.2010.12.020.
[23] 黄鸿兵. 冷冻及冻藏对猪肉冰晶形态及理化品质的影响[D]. 南京:南京农业大学, 2005: 43-44
[24] 周光宏. 肉品加工学[M]. 北京: 中国农业出版社, 2008: 30-31.
[25] LAMBERT I H, NIELSEN J H, ANDERSEN H J, et al. Cellular model for induction of drip loss in meat[J]. Journal of Agricultural and Food Chemistry, 2001, 49(10): 4876-4883. DOI:10.1021/jf010121y.
[26] BERTRAM H C, ANDERSEN R H, ANDERSEN H J. Development in myofibrillar water distribution of two pork qualities during 10-month freezer storage[J]. Meat Science, 2007, 75(1): 128-133. DOI:10.1016/j.meatsci.2006.06.020.
[27] 余小领, 白云, 李学斌, 等. 宰后不同时间冻结对猪肉保水性和组织结构的影响[J]. 食品与发酵工业, 2007, 33(3): 18-22. DOI:10.3321/ j.issn:0253-990X.2007.03.006.
[28] CHOE J H, STUART A, KIM Y H B. Effect of different ageing temperatures prior to freezing on meat quality attributes of frozen/thawed lamb loins[J]. Meat Science, 2016, 116: 158-164. DOI:10.1016/j.meatsci.2016.02.014.
[29] 余小领. 冷冻和解冻工艺对猪肉保水性和组织结构的影响研究[D].南京: 南京农业大学, 2006: 62-64.
Effects of Fast Freezing on the Quality and Microstructure of Beef
FENG Xianchao1,2, ZHOU Guanghong1,*
(1. Animal Husbandry Post-doctoral Station, College of Animal Science, Nanjing Agricultural University, Nanjing 210095, China;2. College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China)
This study investigated and compared meat color, thawing loss, cooking loss, and shear force of beef subjected to normal freezing and quick freezing. The microstructure of frozen beef was also studied by HE staining, scanning electron microscopy (SEM) and transmission electron microscopy (TEM). The results showed that the H value of bovine tendon muscle subjected to quick freezing-thawing process rose by only 0.9%, compared to as high as 9.4% for the normally frozen and thawed sample, suggesting a signifi cant difference between both freezing methods (P < 0.05). Thawing loss of beef tendon muscle subjected to normal freezing was signifi cantly higher than that of the sample subjected to fast freezing(P < 0.01). At the same time, cooking loss of beef tendon muscle subjected to normal freezing was also signifi cantly higher than that of the samples subjected to fast freezing (P < 0.05). In addition, shear force of beef tendon muscle subjected to normal freezing was lower but not signifi cantly than that of the quick-frozen and control groups. Electron microscopy results showed that normal freezing could result in noticeably bigger intermuscular gap and larger intermyofi brillar space in thawed beef when compared with fast freezing, and it also destroyed the cross-sectional area of muscle fi bers. On the other hand, fast freezing could protect the bright color of beef and improve its eating quality. In addition, fast freezing could greatly reduce the size of ice crystals in meat, protect the microstructure of meat, and optimize the taste of meat.
fast freezing; beef; quality; structure
10.7506/spkx1002-6630-201619001
TS251
A
1002-6630(2016)19-0001-07
冯宪超, 周光宏. 快速冷冻工艺对牛肉品质和组织结构的影响[J]. 食品科学, 2016, 37(19): 1-7. DOI:10.7506/spkx1002-6630-201619001. http://www.spkx.net.cn
FENG Xianchao, ZHOU Guanghong. Effects of fast freezing on the quality and microstructure of beef[J]. Food Science,2016, 37(19): 1-7. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201619001. http://www.spkx.net.cn
2016-02-15
国家自然科学基金青年科学基金 项目(31601497);中国博士后基金项目(2016M591857)
冯宪超(1981—),男,副教授,博士,研究方向为畜产品加工。E-mail:xcfeng@nwsuaf.edu.cn
周光宏(1960—),男,教授,博士,研究方向为畜产品加工。E-mail:ghzhou@njau.edu.cn

