磁性Fe3O4纳米带鱼肽微粒的制备及对CW-2细胞膜流动性的影响
石芸洁,林慧敏*,金图南,邓尚贵
(浙江海洋大学食品与医药学院,浙江 舟山 316000)
磁性Fe3O4纳米带鱼肽微粒的制备及对CW-2细胞膜流动性的影响
石芸洁,林慧敏*,金图南,邓尚贵
(浙江海洋大学食品与医药学院,浙江 舟山 316000)
目的:制备磁性Fe3O4纳米带鱼肽微粒,并研究其对CW-2细胞膜流动性的影响。方法:以磁性Fe3O4纳米微粒为内核,负载具有抑制肿瘤增殖作用的带鱼酶解小肽,通过共沉淀法合成磁性Fe3O4纳米带鱼肽微粒,采用X射线衍射、透射式电子显微镜、原子力显微镜等方法对该纳米粒子结构进行表征;利用荧光偏振法研究该微粒在非磁场与交变磁场中对CW-2人结肠癌细胞膜流动性的影响。结果:共沉淀法合成的磁性Fe3O4纳米带鱼肽微粒呈球形,粒径约10 nm,分布较均匀,颗粒之间有黏连现象,形成缠绕弯曲的线状。与单体磁性Fe3O4纳米微粒相比,带鱼酶解小肽的包覆增强了纳米铁微粒的分散稳定性;该粒子最佳使用pH值范围是6.5~9.0,比较适合于在生物体系中应用。细胞膜流动性检测显示24 h时实验组CW-2细胞膜荧光偏振度P值显著减小、平均微黏度η值减小,表明磁性Fe3O4纳米带鱼肽微粒可使CW-2细胞膜流动性增大,作用呈量效关系。结论:磁性Fe3O4纳米带鱼肽微粒在交变磁场中增强了带鱼酶解小肽的抗肿瘤活性。
磁性Fe3O4纳米微粒;带鱼酶解小肽;结构表征;CW-2细胞;细胞膜流动性
海洋生物资源丰富,从海洋动物中提取的化合物约10%具有抗癌活性[1-2],但是很多海洋生物中提取的活性物质组织器官靶向性不强,为了将活性物质尽可能有选择性地运送到靶部位,提高靶部位的药物浓度,减少药物对全身正常组织的毒副作用,同时可减少用药量并使治疗费用降低,靶向给药已成为肿瘤治疗的主要途径[3-4]。
以超顺磁性纳米颗粒作为载体及药物载体的研究近年来在各领域不断发展[5],由于磁性Fe3O4纳米微粒的制作简单,直径可达10 nm以下,具有比表面积效应和磁效应,在外加磁场的作用下可具有靶向性,且Fe3O4的晶体对细胞无毒[6]。在磁性Fe3O4的晶体表面可很容易地包埋生物高分子,如多聚糖[7-8]、蛋白质等形成核壳式结构[9-10],使得其被广泛地应用于药物释放等生物医学领域[11-12]。
结肠癌是常见的发生于结肠部位的消化道恶性肿瘤。由于肿瘤组织和正常组织的细胞都在微米级别,且电性能差别不大,采用现有的射频、微波等加热方法很难使某一特定靶区获得完整的、均匀的升温效果,这样肿瘤加温治疗就难以达到理想的效果。利用纳米级金属颗粒作为热介质具有突出的优点:便于从细小的毛细血管或狭窄的血窦中通过;增加导体的表面积,极大提高介质的电性能,使其产生的热量最大化;特定的活性肽修饰的金属纳米微粒具有特殊的靶向性亲和能力。
前期研究中发现带鱼酶解小肽(分子质量小于1 kD)具有抗氧化、抗菌功效,同时对多种肿瘤细胞具有抗增殖能力,但抗肿瘤活性较低[13-14]。主要原因可能是分子粒径较大,且没有肿瘤靶向性。本实验以磁性Fe3O4纳米微粒为内核,负载具有抑制肿瘤增殖作用的带鱼酶解小肽,通过共沉淀法合成磁性Fe3O4纳米带鱼肽微粒,采用X射线衍射(X-ray diffraction,XRD)、透射式电子显微镜(transmission electron microscope,TEM)、原子力显微镜(atomic force microscope,AFM)等检测方法对该纳米粒子晶体结构、粒径等进行表征;利用荧光偏振法研究该微粒在非磁场与交变磁场中对CW-2人结肠癌细胞膜流动性影响,以期为海洋酶解活性肽的进一步高效利用提供新思路。
1 材料与方法
1.1材料与试剂
带鱼酶解小肽:参照文献[13-14]方法自行制备;磁性Fe3O4纳米微粒购于重庆威斯腾公司。
RPMI-1640培养基于-20 ℃保存,临用前根据需要加10%胎牛血清(fetal bovine serum,FBS);培养用抗菌素溶液:用100万 U/瓶的青-链霉素溶于5 mL三蒸水中,按0.5 mL/L加入培养基中;灭活补体的FBS:将FBS置于56 ℃水浴30 min,-20 ℃冻存备用。
1.2交变电磁场装置
型号:SPG-20G;频率:237 kHz;电流:50 A;匝数:7 圈;测温范围:-150~+150 ℃;线圈直径:9 cm。实验组维持磁场60 min,去除磁场。对照组细胞的处理条件除无磁场照射外,其余与实验组相同。
1.3磁性Fe3O4纳米带鱼肽微粒的制备
取5 mg的带鱼酶解小肽溶解于0.07 mL的无水乙醇中,用蒸馏水缓慢稀释至50 mL,置于分液漏斗中,30 min内逐滴滴入到匀速搅拌的40 mL磁性Fe3O4纳米微粒(5 mg)水溶液中,在磁力搅拌器中600 r/min搅拌反应2 h,最后3 000 r/min离心40 min,倒掉上清液,加入蒸馏水,超声分散,重复3 次,纯化的磁性Fe3O4纳米带鱼肽微粒分散在水中,4 ℃冷藏备用。
1.4磁性Fe3O4纳米带鱼肽微粒的结构表征
晶体结构分析:利用BedeD1型射线衍射仪对样品晶体结构及化学计量成分进行测试,所采用的X射线源为射线GuKa,波长为0.154 06 nm。
傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)分析:采用KBr压片法制备试样,用智能傅里叶变换红外光谱仪进行鉴定与结构分析,测定波数范围为4 000~1 000 cm-1。
晶体的尺寸和形态分析:采用负染法,取5 μL样品晶体混悬液滴于TEM载样铜网上,在室温放置后取出,用滤纸吸干,滴加5 μL 3%的磷钨酸负染,并且自然晾干,在加速电压下观察纳米晶体的形态。用ZAFM-II型号的原子力显微镜来测定磁性Fe3O4纳米带鱼肽微粒的直径、高度和粗糙度等形貌特征。
1.5磁性Fe3O4纳米带鱼肽微粒对CW-2细胞膜流动 性的影响
参照文献[15-16],将实验组细胞及对照组细胞以磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤2 次后,用PBS配成终浓度为2×108个/L的单细胞悬液,取l mL细胞悬液与l mL 1,6-二苯基-1,3,5-己三烯溶液混合,37 ℃保温30 min,用PBS洗涤2 次后,细胞混匀在3 mL的PBS中,在激发波长360 nm,发射波长430 nm的条件下测定IVV、IVH、IHV、IHH的荧光强度,其中H为偏振光垂直方向,V为偏振光水平方向,前脚注为发射光,后脚注为激发光,由公式(1)~(3)计算出荧光偏振度P和膜的平均微黏度η。

1.6数据统计分析
采用SPSS 13.0版统计分析软件,对数据进行方差分析或秩和检验,结果以±s表示。
2 结果与分析
2.1晶体结构分析

图1 磁性Fe3O4纳米微粒、带鱼酶解小肽和磁性Fe3O4纳米带鱼肽微粒的XRD对比光谱Fig.1 XRD spectra of Fe3O4nanoparticle, hairtail pe ptides, magnetic Fe3O4nanoparticles loading hairtail peptides
由图1可知,纯磁性Fe3O4纳米微粒的X射线衍射谱峰大致出现在2θ=30.24°、35.40°,分别对应立方相(220)、(311)晶面[17-18]。在复合带鱼酶解小肽后,样品中Fe3O4的特征衍射峰消失,Fe3O4的最强衍射峰的强度也明显消失,说明带鱼酶解小肽对Fe3O4的严密包覆导致了曲线中Fe3O4的特征衍射信号强度减弱或消失,这一点在后续实验中被TEM结果证实。以上结果说明带鱼酶解小肽与磁性Fe3O4纳米微粒成功地结合在一起。
2.2FTIR分析
图2是磁性Fe3O4纳米微粒、带鱼酶解小肽和磁性Fe3O4纳米带鱼肽微粒的FTIR图。在磁性Fe3O4纳米微粒FTIR图中3 439 cm-1附近出现的峰是由—OH的伸缩振动产生的,589 cm-1和632 cm-1处的峰分别是磁性Fe3O4纳米微粒中的铁氧键和亚铁氧键的特征吸收峰。在带鱼酶解小肽和磁性Fe3O4纳米微粒混合而成的微粒的FTIR图中可以看出,磁性Fe3O4纳米带鱼肽微粒在1 635、1 114、589 cm-1处具有特征吸收峰,并且与Fe3O4的红外光谱一致。其中,磁性Fe3O4纳米带鱼肽微粒在589 cm-1处出现Fe—O—Fe吸收峰,其他特征吸收峰几乎不变,表明复合材料中有Fe3O4的存在。与带鱼酶解小肽相比,磁性Fe3O4纳米带鱼肽微粒在1 817、1 201、837 cm-1处吸收峰消失,表明带鱼酶解小肽的甲基(—CH3)、亚甲基(—CH2)、酮基(C=O)与磁性Fe3O4纳米微粒之间存在化学键的结合。

图2 磁性FFee3O4纳米微粒、带鱼酶解小肽和磁性FFee3O4纳米带鱼肽微粒的FFTTIIRR图Fig.2 FTIR spectra of Fe3O4nanoparticle, hairtail peptides, magnetic Fe3O4nanoparticles loading hairtail peptides
2.3TEM图像分析

图3 磁性Fe3O4纳米带鱼肽微粒的TTEEMM照片Fig.3 TEM pictures of magnetic Fe3O4nanoparticles loading hairtail peptides
图3是磁性Fe3O4纳米带鱼肽微粒的TEM照片,合成的样品呈球形,颗粒之间有黏连现象,形成缠绕弯曲的线状。样品粒径约10 nm,球形,边缘呈无定形的即为带鱼酶解小肽。图3C是样品的高分辨TEM图片,可以清晰地看到磁性Fe3O4纳米微粒的晶格,证明其结晶性能非常好,晶格间距为0.298 nm,属于(220)晶面。图3D是磁性Fe3O4纳米带鱼肽微粒的能谱图,可以看到N元素的存在,这应该可以归结为带鱼酶解小肽含有的N元素;Fe和O元素的原子比例为41.95∶58.05,与磁性Fe3O4纳米微粒的成分相符合。
2.4AFM图像分析
通过AFM测试每一层的扫描图像、高度成像(三维图)、相位图像,结果如图4所示。AFM可以测试样品的粗糙度,测试结果的表面根均方值会因为样品浓度和样品种类的不同而改变,由图4A可知,带鱼酶解小肽微粒分布不均匀,而且很不平坦。由图4B可知,磁性Fe3O4纳米带鱼肽微粒分布非常均匀,由于带鱼酶解小肽的胶黏作用,磁性Fe3O4纳米微粒与带鱼酶解小肽形成了团聚,微粒分布很平坦。

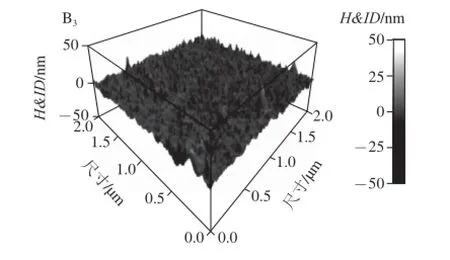
图4 带鱼酶解小肽(A)和磁性Fe3O4纳米带鱼肽微粒(B)的AFM照片Fig.4 AFM pictures of hairtail peptides (A) and magnetic Fe3O4nanoparticles loading hairtail peptides (B)
2.5样品的稳定性
样品在pH 6.5的条件下,存放3 周都不产生任何聚集;调整pH值到9.0以上时,会产生少量的聚集。这是由于氨基的等电点在pH 9.0左右,碱性过强时,会中和掉氨基所带的正电荷;改变pH值降低到5.0以下时,由于纳米粒子本身有碱性氧化物组成,因此放置2 d以后,纳米粒子会被溶解掉。因此,磁性Fe3O4纳米带鱼肽微粒的最佳使用pH值范围是6.5~9.0,比较适合于在生物体系中应用。
2.6CW-2细胞膜流动性变化

表1 磁性Fe3O4纳米带鱼肽微粒对CW--22细胞膜P、η值的影响Table1 Effect of magnetic Fe3O4nanoparticles loading hairtaill peptides on membrane fluidity in CW-2 cells in terms of and value
细胞膜流动性可以用荧光偏振度P、微黏度η表示,P和η越小,细胞膜的流动性越大[19]。由表1可知,磁性Fe3O4纳米带鱼肽微粒在交变磁场作用于CW-2细胞24 h后,P值显著减小,η值减小,表明样品可使CW-2细胞膜流动性增大,且作用呈量效关系。
细胞膜流动性是生物膜最基本的物理性质,生物膜的各项功能如能量转化、物质运输、信息传递等都与膜的流动性密切相关,细胞要发挥正常的生理功能要求膜处于一定的流动状态[20]。研究表明,细胞癌变后,细胞膜流动性会发生改变,且因瘤细胞来源的不同其变化趋势也不同,但基本上遵循下述规律:实体瘤细胞膜的流动性比相应的正常细胞低,腹水瘤、白血病等细胞膜流动性较相应正常细胞高[21]。
荧光偏振法是应用最广的测定膜脂流动性的方法[22-23],由荧光偏振度计算出的微黏度值反映了脂质的有序程度和脂链摆动的速率。在流体力学中,微黏度值的倒数被称为流动性。膜脂区无序性越大,脂质分子排列越不整齐,微黏度值越小,流动性越大,反之,流动性越小。本实验采用该法检测磁性Fe3O4纳米带鱼肽微粒对CW-2细胞膜流动性的影响。结果表明,CW-2细胞作为实体瘤细胞,其膜流动性较正常细胞低,在交变磁场经磁性Fe3O4纳米带鱼肽微粒处理后细胞膜流动性增加。这有助于诱导细胞分化、从而降低其癌变的恶性程度。同时由于膜流动性的改变,会影响细胞膜上蛋白质的位 置,导致细胞膜上抗原决定簇的暴露或掩盖,从而引起细胞免疫原性的改变[24]。另外,细胞膜流动性增大可加速细胞膜内一些蛋白分子的扩散和旋转运动,促进药物进入细胞内部,进而诱发肿瘤细胞死亡[25]。
3 结 论
裸露的纳米Fe3O4粒子易沉淀。为了增加裸露的超顺磁性Fe3O4颗粒悬浮稳定性及生物相容性,通常需对其进行表面修饰,这种修饰同时也增强了包覆分子的生物活性。本实验通过共沉淀法合成磁性Fe3O4纳米带鱼肽微粒,粒径约10 nm,分布较均匀,带鱼酶解小肽包覆的纳米Fe3O4具有较好的生物相容性。荧光偏振法研究表明该微粒在交变磁场中对CW-2人结肠癌细胞膜流动性有明显的增强作用,提示交变磁场作用下Fe3O4纳米带鱼肽微粒引起的细胞膜流动性增强可能是结肠癌细胞死亡的一个原因。
[1] KIM S K, WIJESEKARA I. Development and biological activities of marine-derived bioactive peptides: a review[J]. Journal of Functional Foods, 2010, 2(1): 1-9. DOI:10.1016/j.jff.2010.01.003.
[2] 欧阳高亮, 李祺福, 田长海. 海洋生物抗肿瘤活性物质及其作用机理研究进展[J]. 海洋科学, 2003, 27(7): 21-24.
[3] DANHIER F, FERON O, PR☒AT V. To exploit the tumor microenvironment: passive and active tumor targeting of nanocarriers for anti-cancer drug delivery[J]. Journal of Controlled Release, 2010,148(2): 135-146. DOI:10.1016/j.jconrel.2010.08.027.
[4] 熊平, 郭萍, 向东, 等. 引导磁场下磁性药物靶向治疗的理论分析[J].物理学报, 2006, 55(8): 4383-4387.
[5] AGIOTIS L, THEODORAKOS I, SAMOTHRAKITIS S, et al. Magnetic manipulation of superparamagnetic nanoparticles in a microfluidic system for drug delivery applications[J]. Journal of Magnetism and Magnetic Materials, 2016, 401: 956-964. DOI:10.1016/j.jmmm.2015.10.111.
[6] 李慧, 王大新, 顾健. 超顺磁性纳米颗粒治疗肿瘤的应用进展[J]. 中国组织工程研究与临床康复, 2009, 13(51): 10133-10136.
[7] 黄可龙, 陈洁, 刘素琴, 等. 磁性 Fe3O4/壳聚糖的化学修饰及包覆机理研究[J]. 无机化学学报, 2007, 23(8): 1491-1494.
[8] ZHU A, YUAN L, LIAO T. Suspension of Fe3O4nanoparticles stabilized by chitosan and o-carboxymethylchitosan[J]. International Journal of Pharmaceutics, 2008, 350(1): 361-368. DOI:10.1016/ j.ijpharm.2007.09.004.
[9] CAN K, OZMEN M, ERSOZ M. Immobilization of albumin on aminosilane modified superparamagnetic magnetite nanoparticles and its characterization[J]. Colloids and Surfaces B: Biointerfaces, 2009,71(1): 154-159. DOI:10.1016/j.colsurfb.2009.01.021.
[10] ZHENG J, LI Y, SUN Y, et al. A generic magnetic microsphere platform with “clickable” ligands for purification and immobilization of targeted proteins[J]. ACS Applied Materials & Interfaces, 2015,7(13): 7241-7250. DOI:10.1021/acsami.5b00313.
[11] XU Y, KARMAKAR A, WANG D, et al. Multifunctional Fe3O4cored magnetic-quantum dot fluorescent nanocomposites for RF nanohyperthermia of cancer cells[J]. Journal of Physical Chemistry C,2010, 114(11): 5020-5026. DOI:10.1021/jp9103036.
[12] CHOWDHURI A R, BHATTACHARYA D, SAHU S K. Magnetic nanoscale metal organic frameworks for potential targeted anticancer drug delivery, imaging and MRI contrast agent[J]. Dalton Transactions, 2015, 45: 539-541. DOI:10.1039/C5DT03736K.
[13] 林慧敏. 带鱼下脚料酶解小肽亚铁螯合物结构鉴定及其生物活性研究[D]. 福州: 福建农林大学, 2012: 26-38.
[14] 林慧敏, 邓尚贵, 庞杰, 等. 超滤法制备高抗茵抗氧化活性带鱼蛋白亚铁螫合肽(Fe-HPH)的工艺研究[J]. 中国食品学报, 2012, 12(6):16-21.
[15] SEN S, SIROBHUSHANAM S, HANTAK M P, et al. Short branched-chain C6 carboxylic acids result in increased growth,novel ‘unnatural’ fatty acids and increased membrane fluidity in a Listeria monocytogenes branched-chain fatty acid-deficient mutant[J]. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 2015, 1851(10): 1406-1415. DOI:10.1016/ j.bbalip.2015.07.006.
[16] 季宇彬, 王胜惠, 高世勇, 等. 龙葵碱对H22荷瘤小鼠细胞膜流动性和膜蛋白水平的影响[J]. 中草药, 2005, 36(2): 239-241.
[17] 周洁, 马明, 张宇, 等. 溶胶-凝胶法制备不同尺寸的Fe3O4磁性颗粒及表征[J]. 东南大学学报(自然科学版), 2005, 35(4): 614-617.
[18] SUN J, ZHOU S, HOU P, et al. Synthesis and characterization of biocompatible Fe3O4nanoparticles[J]. Journal of Biomedical Materials Research Part A, 2007, 80(2): 333-341. DOI:10.1002/jbm.a.30909.[19] 陈丽, 张建, 于娟, 等. 胡桃醌对人肝癌BEL-7402细胞增殖和膜流动性的影响[J]. 数理医药学杂志, 2009, 22(2): 144-148.
[20] MENDANHA S A, ALONSO A. Effects of terpenes on fluidity and lipid extraction in phospholipid membranes[J]. Biophysical Chemistry,2015, 198: 45-54.
[21] SHERBET G. Membrane fluidity and cancer metastasis[J]. Pathobiology, 1989, 57(4): 198-205. DOI:10.1016/j.bpc.2015.02.001.
[22] SELVARAJ S, KRISHNASWAMY S, DEVASHYA V, et al. Influence of membrane lipid composition on flavonoid-membrane interactions: implications on their biological activity[J]. Progress in Lipid Research, 2015, 58: 1-13. DOI:10.1016/j.plipres.2014.11.002.
[23] MYKYTCZUK N, TREVORS J, LEDUC L, et al. Fluorescence polarization in studies of bacterial cytoplasmic membrane fluidity under environmental stress[J]. Progress in Biophysics and Molecular Biology, 2007, 95(1): 60-82. DOI:10.1016/j.pbiomolbio.2007.05.001.
[24] BARITAKI S, APOSTOLAKIS S, KANELLOU P, et al. Reversal of tumor resistance to apoptotic stimuli by alteration of membrane fluidity: therapeutic implications[J]. Advances in Cancer Research,2007, 98: 149-156. DOI:10.1016/S0065-230X(06)98005-1.
[25] GARG S, DHAVALA S, KRUMOVA K, et al. Targeting membrane fluidity as a therapeutic strategy in cancer using BPM 31510[J]. Cancer Research, 2015, 75(Suppl 15): 2458-2458. DOI:10.1158/1538-7445.
Preparation of Magnetic Fe3O4Nanoparticles Loading Peptides Derived from Enzymatic Hydrolysis of Hairtail Waste Proteins and Its Effect on Membrane Fluidity in CW-2 Cells
SHI Yunjie, LIN Huimin*, JIN Tunan, DENG Shanggui
(College of Food and Pharmacy, Zhejiang Ocean University, Zhoushan 316000, China)
Objective: To prepare magnetic Fe3O4nanoparticles loading peptides derived from enzymatic hydrolysis of hairtail processing waste proteins and explore its effect on membrane fluidity in CW-2 cells. Methods: The target product was synthesized by co-precipitation method, and its structure characteristics and particle size distribution were observed with X-ray diffraction (XRD), transmission electron micros cope (TEM) and atomic force microscope (AFM). Meanwhile, its effect on membrane fluidity in human colon cancer CW-2 cells was explored by fluorescence polarization in a non-magnetic field and an alternating magnetic field. Results: Magnetic Fe3O4nanoparticles loading hairtail peptides were uniformly distributed with a size of approximately 10 nm and they were found to adhere to each other to form intertwined curves. Compared with the single magnetic Fe3O4particles, loading of hairtail peptides enhanced dispersion stability of magnetic nano-Fe3O4particles. The optimum pH for magnetic Fe3O4nanoparticles loading hairtail peptides was 6.5-9.0. Cell membrane fluidity tests showed that P and η values in the experimental group were significantly reduced after 24 h of alternating magnetic field exposure, indicating that the magnetic Fe3O4nanoparticles loading hairtail peptides could increase cell membrane fluidity. Conclusion: Magnetic Fe3O4nanoparticles loading hairtail peptides can enhance the anti-tumor activity of hairtail peptides in an alternating magnetic field.
magnetic Fe3O4nanoparticles; hairtail enzymatic peptides; structure characterization; CW-2 cell; cell membrane fluidity
10.7506/spkx1002-6630-201619005
S38
A
1002-6630(2016)19-0031-05
石芸洁, 林慧敏, 金图南, 等. 磁性Fe3O4纳米带鱼肽微粒的制备及对CW-2细胞膜流动性的影响[J]. 食品科学, 2016,37(19): 31-35. DOI:10.7506/spkx1002-6630-201619005. http://www.spkx.net.cn
SHI Yunjie, LIN Huimin, JIN Tunan, et al. Preparation of magnetic Fe3O4nanoparticles loading peptides derived from enzymatic hydrolysis of hairtail waste proteins and its effect on membrane fluidity in CW-2 cells[J]. Food Science, 2016,37(19): 31-35. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201619005. http://www.spkx.net.cn
2015-11-22
国家自然科学基金青年科学基金项目(31301597);国家自然科学基金面上项目(31471609);海洋公益性行业科研专项(2013418013-4)
石芸洁(1995—),女,本科生,主要从事水产品加工与贮藏研究。E-mail:2278560458@qq.com
林慧敏(1979—),女,副教授,博士,主要从事水产品加工与贮藏研究。E-mail:linhuixiaomin@126.com

