南瓜硒多糖的制备表征及活性分析
商龙臣,吴少魏,张 驰,廖红华,刘信平,*
(1.湖北民族学院化学与环境工程学院,湖北 恩施 445000;2.湖北民族学院生物科学与技术学院,湖北 恩施 445000)
南瓜硒多糖的制备表征及活性分析
商龙臣1,吴少魏1,张驰2,廖红华2,刘信平1,*
(1.湖北民族学院化学与环境工程学院,湖北 恩施 445000;2.湖北民族学院生物科学与技术学院,湖北 恩施 445000)
对南瓜多糖进行硒化修饰,并对南瓜硒多糖的体外抗氧化和抑制人乳腺癌细胞MDA-MB-231生长等活性进行研究。以提取、分离、纯化的南瓜多糖为前体物,用Na2SeO3硒化修饰制备南瓜硒多糖,并用紫外光谱、红外光谱、原子荧光光谱、热重分析对产物结构进行表征,采用邻苯三酚自氧化法、水杨酸法、四甲基偶氮唑蓝比色法测定其清除超氧阴离子自由基(O2-•)、羟自由基(•OH)的能力以及对人乳腺癌细胞MDA-MB-231生长的抑制作用。结果表明:制备产物结构中含有Se=O键和Se—C键,即实现了南瓜多糖的硒化。南瓜硒多糖对O2-·、·OH的清除作用显著强于南瓜多糖,与样品量呈正相关;南瓜硒多糖对人乳腺癌细胞MDA-MB-231生长有抑制作用,比南瓜多糖具有更好的抑制效果。
南瓜硒多糖;制备;表征;活性Abstract: Objective: To investigate selenium modification of pumpkin polysaccharide and to evaluate the in vitro antioxidant activity and antitumor effect against human breast cancer MDA-MB-231 cells of the modifi ed polysaccharide. Methods: Pumpkin polysaccharide was prepared and purified and it was modified by reaction with Na2SeO3to obtain selenium-containing polysaccharide. Furthermore, the structure of the modifi ed polysaccharide was characterized through UV, IR, atomic fluorescence spectroscopies and thermogravimetric analysis. Finally, its scavenging effect onand ·OH as well as growth inhibitory effect on breast cancer cells were tested by using pyrogallol autoxidation, salicylic acid method and methyl thiazolyl tetrazolium colorimetric assay. Results: Se=O and Se-C bonds were observed in the structure of the target product, thus successfully achieving the selenium modification of pumpkin polysaccharide. The selenium-containing pumpkin polysaccharide had signifi cantly stronger scavenging effects onand ·OH than ordinary pumpkin polysaccharide, which were concentration-dependent. Meanwhile, the modifi ed polysaccharide also inhibited the growth of human breast cancer cells in a dose-dependent manner more signifi cantly than did the unmodifi ed one.
元素硒(Se)以其显著的抗肿瘤、抗氧化、提高免疫力等多种生理活性功能,特别是有机硒化物能有效避免无机硒易引起中毒的缺点,备受医药、食品保健等诸多领域普遍关注。目前,溶解性好、低毒、具有良好抗瘤活性的硒多糖已成为研究热点。近年来,对硒多糖的研究已取得了一定进展[1-4],但因天然硒多糖资源紧缺,制约了其开发应用,对植物多糖进行硒化修饰是解决该问题的有效途径,当前这项研究正处于起步阶段,已成功合成了百合、大蒜、黄芪、刺槐、灵芝、枸杞等植物多糖硒酸酯[5-9]。
我国各地富产南瓜,主供人畜食用,量多、价低,但也造成了浪费量大,经济利用率低的结果。目前已有研究证实南瓜多糖具有抗氧化、降血糖、调血脂等生理活性[10]。目前针对南瓜多糖的提取、纯化、活性研究较多[11],如孔倩[12]、孙婕[13]等分别研究了南瓜多糖的硫酸酯化衍生物和磷酸酯化衍生物的制备及抗氧化活性,但对南瓜多糖的硒化修饰目前尚未见报道。本实验依据课题组前期研究的优化结果[14-15],将硒与多糖有机结合,以南瓜多糖为前体物,亚硒酸钠(Na2SeO3)为硒化试剂制备南瓜硒多糖,利用紫外光谱、红外光谱、热重分析手段表征目标产物结构,并对其体外抗氧化及抑制肿瘤细胞生长等活性进行初步研究,旨在探讨硒化修饰对南瓜多糖活性功能的影响,为进一步研究南瓜硒多糖作为抗氧化能力较强的保健食品和抗肿瘤药品的应用奠定必要的实验基础,同时促进南瓜资源合理深加工,提高其利用效能。
1 材料与方法
1.1材料与试剂
本实验所用南瓜为恩施本地产南瓜(Cucurbita moschata Duch.)。
Na2SeO3、VC、邻苯三酚、苯酚、水杨酸、RPMI-1640培养基、四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT) 美国Sigma公司;系列葡聚糖分子质量标准品、人乳腺癌细胞MDA-MB-231由湖北民族学院附属医院提供。所有药品或试剂均为国产分析纯或优级纯。
1.2仪器与设备
傅里叶红外光谱仪 德国Bruker Optics公司;紫外-可见分光光度计 日本岛津公司;AFS-9760双道原子荧光光度计 北京海光公司;MARS6 全自动微波消解仪 美国CEM公司;HP1100型高压液相色谱仪 上海惠普公司;DE-6300型综合热分析仪 上海弗安公司;MB-Ⅲ型酶标仪 上海汇松公司。
1.3方法
1.3.1南瓜硒多糖的制备
前体物的制备[16-18]:以恩施本地产普通南瓜为原材料,通过提取、分离、脱色、纯化等系列工艺得到南瓜多糖。采用苯酚-硫酸法测得前体物含糖量为61.4%,高效凝胶渗透色谱法测定多糖相对分子质量Mr为15 800,经纸层析分析表明其是由D-葡萄糖、D-半乳糖、L-阿拉伯糖、木糖和D-葡萄糖醛酸(物质的量比为0.181∶0.084∶0.071∶0.021∶0.179)组成的酸性杂多糖。
依据课题组前期研究的优化结果[14-15]进行南瓜硒多糖的合成:称取5 g南瓜多糖于500 mL圆底烧瓶,加入250 mL体积分数0.8% HNO3溶解,加入4.0 g Na2SeO3、7.0 g BaCl2,70 ℃磁力搅拌加热反应8 h,冷却。加入适量无水Na2SO4,静置,3 000 r/min 离心15 min,取上清液用Na2SO4检测直到无BaSO4沉淀为止,除去反应中的催化剂BaCl2;用无水Na2CO3调上清液pH值为7,旋转蒸发浓缩,透析至使抗坏血酸不变红为止,除净未反应完的SeO32-。将产物用4 倍体积的95%乙醇沉淀,冰箱静置过夜,过滤,冷冻干燥,即得到南瓜硒多糖。
1.3.2南瓜硒多糖含量的测定及结构表征
以紫外光谱、红外光谱和热重分析法对南瓜硒多糖进行结构表征,双道原子荧光光谱测定产物的硒含量。并且在将目标产物放置3 个月后,重复紫外光谱、红外光谱和原子荧光光谱扫描,考察其稳定性。
紫外光谱扫描:称取0.1 g样品,微波消解,冷却定容至25 mL,参比用Na2SeO3质量浓度为0.1 g/L。在5 mL消化液和Na2SeO3中分别加入加8 mL 0.1 g/L邻苯二胺溶液,阴暗处静置反应50 min,各加入10 mL甲苯萃取,振荡3 min静置。取甲苯萃取后的上层溶液,以甲苯为参比,用石英比色皿在200~800 nm波长范围内扫描。
红外光谱扫描:用KBr压片法测定样品的红外光谱。
原子荧光光谱扫描:取0.1 g样品,微波消解,用双道原子荧光光谱扫描测定硒含量。
热重分析:采用热分析仪,在氧化铝坩锅中装入样品3.00 mg,程序升温速率10 ℃/min,扫描温度范围:50~800 ℃,静态空气氛围,每个样品平行测定3 次。
1.3.3南瓜硒多糖体外抗氧化活性实验
以未修饰的南瓜多糖作对比,VC作阳性对照,测定南瓜硒多糖的抗氧化活性。南瓜多糖、南瓜硒多糖、VC阳性对照液均配制为1 mg/mL,对照实验样液为1 μg/mL Na2SeO3与1 mg/mL南瓜多糖体积比1∶1的混合液,冰箱冷藏,用时稀释。
1.3.3.1超氧阴离子自由基(O2-•)清除率测定
以邻苯三酚自氧化法测定样品清除O2-•的能力[19-20]:取4 mL 50 mmol/L的Tris-HCl缓冲液(pH 8.2),加入1.5 mL超纯水,混匀,25 ℃水浴保温20 min,分别依次加入1、2、3、4、5 mL的南瓜多糖溶液、南瓜硒多糖溶液、Na2SeO3与南瓜多糖混合液及VC溶液,迅速加入已于25 ℃预热过的3 mmol/L邻苯三酚0.4 mL,摇匀,于420 nm波长处每隔30 s测定其吸光度(A420nm)。平行测定3 次,按照式(1)计算O2-•清除率。
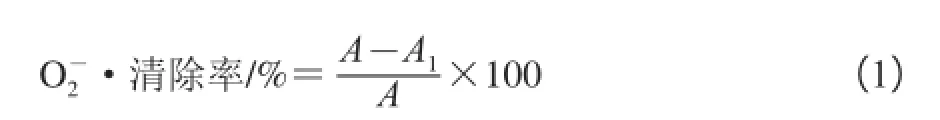
式中:A为未加样品的空白组吸光度;A1为加入不同样品反应体系的吸光度。
1.3.3.2羟自由基(•OH)清除率测定
以水杨酸法测定样品清除•OH的能力[20-21]:以超纯水为空白,在试管中依次加入0.5 mL 5 mmol/L的FeSO4溶液,1、2、3、4、5 mL的南瓜多糖溶液、南瓜硒多溶糖液、Na2SeO3与南瓜多糖混合液及VC液,0.5 mL 5 mmol/L的H2O2,摇匀,静置10 min,再加入2 mL 10 mmol/L水杨酸溶液,定容摇匀,10 min后于510 nm波长处测定吸光度。按照式(2)计算•OH清除率。
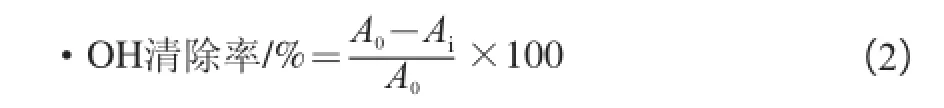
式中:Ai为加入不同样品反应体系的吸光度;A0为未加样品的空白组吸光度。
1.3.4南瓜硒多糖体外抑制人乳腺癌细胞MDA-MB-231生长活性测定
以pH 7.4的磷酸盐缓冲液(phosphate buffered saline,PBS)为溶剂,配制0.1 mol/L的南瓜多糖溶液、南瓜硒多糖溶液、MTT溶液、Na2SeO3溶液,0.22 μm微孔滤膜过滤除菌,4 ℃避光保存待用,使用前用RPMI-1640培养基稀释。将0.25 g胰蛋白酶加入到100 mL PBS(pH 7.2)中,搅拌(避免出现泡沫)混匀,过滤除菌,备用。
以MTT比色法对南瓜硒多糖进行抗肿瘤活性研究[22-23]:在37 ℃、5% CO2培养箱中,以RPMI-1640培养液(含10%的灭活胎牛血清、100 μg/mL的青链霉素)传代培养人乳腺癌细胞MDA-MB-231,每2~3 d传代一次,细胞生长至占瓶底面积80%时,消化调整细胞密度至2×105个/mL并分装入25 mL的培养瓶中,继续培养至对数生长期。用胰蛋白酶消化处于对数生长期的人乳腺癌细胞MDA-MB-231,以RPMI-1640培养液配成单细胞悬液,接种于96 孔板中(200 μL/孔),培养24 h后,弃去培养基,每孔加入含有样品的培养基200 μL,南瓜多糖、南瓜硒多糖和Na2SeO3均设置质量浓度60、90、120 μg/mL 3组,每试样设复孔3 个,同时设置无细胞的培养液调零孔,以未加药的细胞组为空白对照组,0.1 μg/mL紫杉醇为阳性对照组。于37 ℃、50% CO2培养箱中分别培养24、48、72 h。弃去上清液,每孔加入RPMI-1640培养基120 μL、5 mg/mL MTT溶液20 μL,继续培养2 h后,小心吸除孔内培养液,每孔加入二甲基亚砜200 μL,37 ℃摇床轻摇30 min,使结晶溶解。用酶联免疫检测仪在570 nm波长处测定各孔光密度(OD570nm)值。各实验平行测定3 次,按照式(3)计算各样品对人乳腺癌细胞MDA-MB-231生长的抑制率。

1.4数据处理
以SPSS 10统计软件包对数据进行统计学处理及单因素方差分析。
2 结果与分析
2.1南瓜硒多糖的结构表征
用AFS-9760双道原子荧光光度计测得目标产物南瓜硒多糖中硒含量为215.7 μg/g,将产物放置3 个月后再次测定,结果发现光谱、硒含量和未放置前基本一致,即目标产物结构本身及其含硒量均无明显的变化,说明南瓜硒多糖具有较好的稳定性。南瓜硒多糖的紫外光谱、红外光谱和热重分析结果见图1~4。
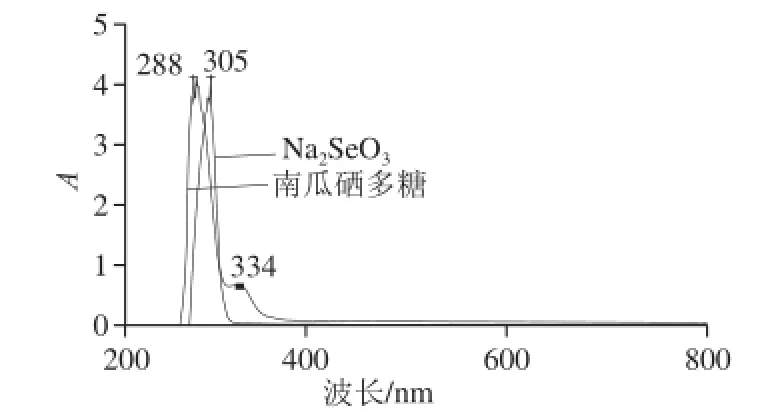
图1 Na 1 Na2SeOSeO3、南瓜硒多糖的紫外光谱Fig.1 UV absorption spectra of Na2SeO3and selenium-containing pumpkin polysaccharide
如图1所示,在紫外光区190~400 nm波长范围内对Na2SeO3溶液和南瓜硒多糖溶液进行扫描,分析纯波长处出现最大峰,这是的Se=O特征吸收峰;南瓜硒多糖在288、334 nm波长处出现两双峰,334 nm波长处的吸收峰与文献[24]报道在335 nm波长处存在的Se=O特征吸收峰相吻合,288 nm波长处吸收峰是南瓜硒多糖中Se—O键的吸收峰,与Na2SeO3相比,目标产物南瓜硒多糖中的Se=O吸收峰由于受产物中其他官能团的影响而发生了明显的红移现象。

图2 Na 2 Na2SeOSeO3、南瓜多糖和南瓜硒多糖的红外光谱Fig.2 IR spectra of sodium selenite, pumpkin polysaccharide and selenium-containing pumpkin polysaccharide
由图2可知,南瓜多糖红外光谱具有典型的多糖特征吸收峰(3 341、2 930、1 637、1 556、1 382、1 158、1 075、1 023、1 138、1 017、831、716 cm-1)。3 341 cm-1处出现的宽峰是O—H的伸缩振动,2 930 cm-1为C—H伸缩振动吸收峰,1 637 cm-1是羧基C=O的伸缩振动,1 556 cm-1是羧基C—O伸缩振动吸收峰,1 382 cm-1吸收峰是O—H弯曲振动,1 158 cm-1吸收峰是C—H弯曲振动,1 138 cm-1处的峰是糖类分子呋喃环的环伸缩振动特征峰,1 017 cm-1处为吡喃环伸缩振动特征峰,831 cm-1的吸收峰是呋喃环中C—H变角振动峰,716 cm-1处是吡喃糖环C—O—C振动吸收峰。与南瓜多糖相比,南瓜硒多糖红外光谱中多糖的一些特征吸收峰依然明显,只是在一些官能团特征峰的峰形、吸收波长出现了一定的红移和蓝移。O—H伸缩振动峰变得更宽,而弯曲振动峰显著减小,这说明硒化发生在羟基位置,使得—OH减少,C—H伸缩峰略有增大,而弯曲峰变化不大,C=O伸缩峰稍有增宽,C—O伸缩峰蓝移(1 449 cm-1),两个环的特征峰出现谱线红移,呋喃环峰形变小,而吡喃环相反增大,因此硒化对南瓜多糖的主要结构没有大的改变。从Na2SeO3红外光谱可看出860 cm-1附近的是亚硒酸Se=O伸缩振动吸收峰,附近的是的O—Se—O对称伸缩振动吸收峰,520 cm-1处是O—Se—O弯曲变角振动峰,而南瓜硒多糖中硒官能团的特征吸收峰相对来说出现了红移现象,在756 cm-1附近的是亚硒酸Se=O伸缩振动峰,1 028 cm-1处是亚硒酸酯中O—Se—O伸缩振动峰,756 cm-1附近的是Se—C的伸缩振动峰。
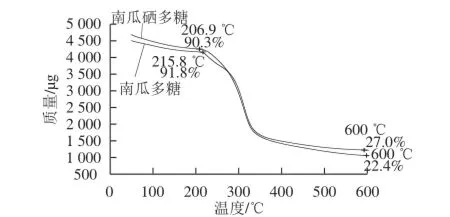
图3 南瓜多糖、南瓜硒多糖的热重曲线Fig.3 Thermal gravity curves of pumpkin polysaccharide and selenium-containing pumpkin polysaccharide

图4 南瓜多糖、南瓜硒多糖的微分热重曲线Fig.4 Differential thermal gravity curves of pumpkin polysaccharide and selenium-containing pumpkin polysaccharide
由图3、4可知,南瓜多糖在215.8 ℃开始分解,此时剩余质量为样品总质量的91.8%,312.6 ℃时质量损失速率最大,达到411.6 μg/min,到600 ℃基本达到恒质量,剩余质量为样品总质量的27.0%。而南瓜硒多糖在206.8 ℃开始分解,剩余质量为样品总质量的90.3%,312.6 ℃质量损失速率最大,为453.5 μg/min,600 ℃基本达到恒质量,剩余质量为样品总质量的22.4%。由此可知,由于南瓜硒多糖的生成,使得其开始分解的温度略低于未硒化的南瓜多糖,312.6 ℃时质量损失速率相对增大,且600 ℃基本恒质量时的剩余质量相应减少,即证明南瓜多糖中的羟基与SeO32-结合生成了南瓜硒多糖,使其热稳定性降低。
2.2对O2-•的清除作用
在pH 7.8条件下,邻苯三酚自氧化,生成O2-•和中间体,该中间体在420 nm波长处有一特征吸收峰,当加入O2-•清除剂时,O2-•的生成受抑制,邻苯三酚自氧化过程受阻,溶液在420 nm波长处吸收减弱。通过测定某物质对邻苯三酚自氧化的抑制作用,便可表征其对O2-•的清除能力。由图5可知,南瓜多糖、南瓜硒多糖、Na2SeO3和南瓜多糖混合液及VC对O2-•都有清除作用,清除能力由强到弱为:VC>Na2SeO3和南瓜多糖混合液>南瓜硒多糖>南瓜多糖,在60~180 s内,O2-•清除能力与样品量呈一定的正相关,随样品加入量的增大而增强,VC、Na2SeO3和南瓜多糖混合液增长的幅度较大,而南瓜多糖及南瓜硒多糖对O2-•的清除能力提高幅度相对平缓。

图5 样品对?•的清除能力比较Fig.5 Scavenging capacity of different polysaccharide samples against superoxide anion radical
2.3对•OH的清除作用
H2O2与Fe2+混合产生高活性•OH,•OH存活时间短,若在其中加入水杨酸,可有效捕捉•OH,并生成有色物质,该物质在510 nm波长处有强吸收。在反应体系中加入具有清除•OH能力的物质,便会与水杨酸竞争•OH,使有色物质生成量减少。采用固定反应时间法,在同体积的反应体系中加入不同量的被测物,于510 nm波长处测定吸光度,就能测定物质对•OH的清除作用。如图6所示,南瓜多糖、南瓜硒多糖、Na2SeO3和南瓜多糖混合液、VC对•OH具有较强的清除作用,且清除能力与样品加入量成正比,但相同质量浓度的南瓜硒多糖对☒OH的清除能力显著强于南瓜多糖,而弱于VC及Na2SeO3和南瓜多糖混合液。

图6 样品对•OH的清除能力比较Fig.6 Scavenging capacity of different polysaccharide samples against hydroxyl radical
2.4对人乳腺癌细胞MDA-MB-231的抑制作用
以南瓜多糖、南瓜硒多糖、Na2SeO3作用于人乳腺癌细胞MDA-MB-231 24、48、72 h后,经MTT法测定(72 h后影响作用接近72 h的效果,故数据分析只取到72 h),以0.1 μg/mL紫杉醇为阳性对照组,不加样品的细胞为空白对照组,各实验组对MDA-MB-231乳腺癌细胞生长的抑制率如表1所示。
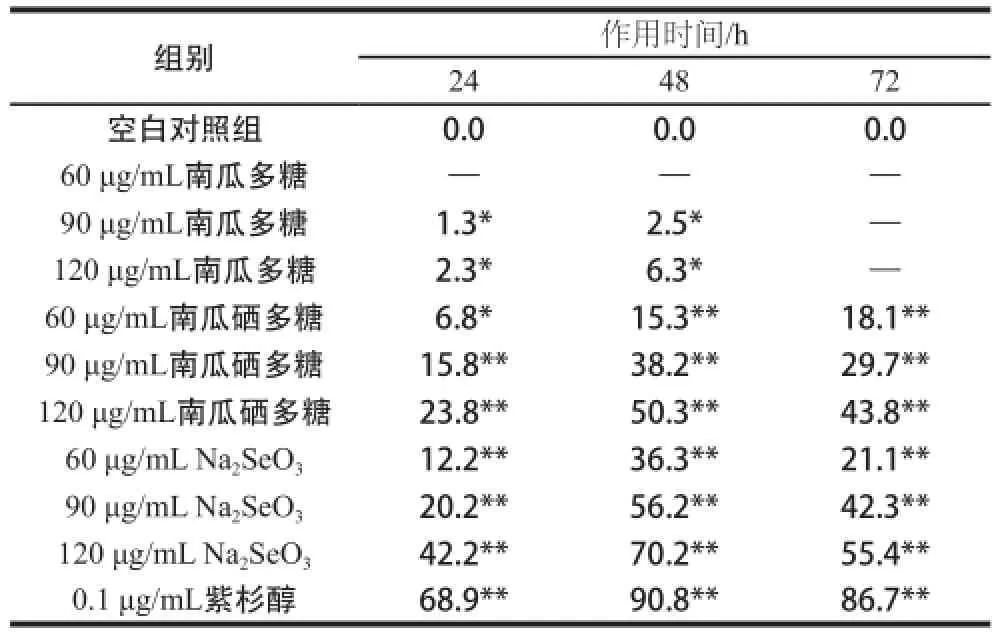
表1 样品对人乳腺癌细胞MDA-MB-231的抑制率Table1 Percentage inhibition of original and modified pumpkin polysaccharide against the growth of tumor cells %
由表1可知,以不同质量浓度的南瓜多糖、南瓜硒多糖和Na2SeO3处理人乳腺癌细胞MDA-MB-231不同时间后,对细胞生长的抑制效果均弱于0.1 μg/mL的紫杉醇。紫杉醇是目前治疗乳腺癌等肿瘤的特效药,但因其水溶性差以及临床应用中出现过敏反应、神经毒性、造血抑制、胃消化道黏膜炎等毒副作用[25],且毒性与其给药剂量呈正相关,使得其开发和应用受到限制。南瓜硒多糖虽在药效上无法与紫杉醇相比,但其源于对天然食品南瓜多糖的硒修饰,水溶性强,在应用上可作为协助功能性物质以减少紫杉醇用量。90、120 μg/mL的南瓜多糖作用24、48 h后对人乳腺癌细胞MDA-MB-231生长有一定的抑制作用,与空白对照组相比差异显著(P<0.05),但60 μg/L的南瓜多糖以及各剂量的南瓜多糖作用72 h均对人乳腺癌细胞MDA-MB-231生长没有抑制作用,与空白对照组相比无显著差异(P>0.05)。各质量浓度的南瓜硒多糖和Na2SeO3在3 个处理时间段都对人乳腺癌细胞MDA-MB-231的生长呈现出了较强的抑制能力,与空白对照组比较有显著或极显著差异(P<0.05或P<0.01),且在作用48 h时抑制作用达到最强,120、90 μg/mL的Na2SeO3对人乳腺癌细胞MDA-MB-231的抑制率分别达到70.2%、56.2%,120、90 μg/mL的南瓜硒多糖对MDA-MB-231乳腺癌细胞的抑制率分别为50.3%、38.2%;在作用72 h时,Na2SeO3和南瓜硒多糖对人乳腺癌细胞MDA-MB-231的抑制率均有所降低,120 μg/L的Na2SeO3和南瓜硒多糖对人乳腺癌细胞MDA-MB-231的抑制率分别为55.4%、43.8%。相比之下,相同质量浓度的无机Na2SeO3对MDA-MB-231乳腺癌细胞的抑制作用强于南瓜硒多糖。这也进一步说明无机硒化物中由于硒含量太大,容易在应用中引起硒过量中毒,对生命体健康造成负面影响。而有机南瓜硒多糖对癌细胞的抑制作用虽相对较弱,但安全性能较高,因此具有更广泛的应用前景。
3 结 论
本研究通过紫外光谱、红外光谱、热重分析对合成的南瓜硒多糖结构进行表征,以Se=O和Se—C键的存在证明合成了南瓜硒多糖。体外抗氧化和抗肿瘤实验表明,南瓜硒多糖对O2-•、•OH的清除能力以及抑制人乳腺癌细胞MDA-MB-231生长的能力明显强于南瓜多糖。本实验表明,将硒和南瓜多糖两者有机结合形成的南瓜硒多糖是更安全、稳定的抗氧化剂和抗肿瘤物质。本研究结果为筛选硒多糖类药品和绿色补硒保健产品提供了必要的实验基础和理论依据,同时为促进南瓜资源的合理深加工、拓宽利用渠道奠定了基础。
[1] LIU X P, WU H Y, ZHANG C, et al. Research on active selenium polysaccharide in Artemisia argyi[J]. Advanced Materials Research,2013, 634/638: 1054-1057. DOI:10.4028/www.scientific.net/ AMR.634-638.1054.
[2] LI Q, ZHANG C. Selenium distributions in Cordyceps militaris from different areas in China[M]// BANUELOS G S, LIN Z Q, YIN X B. Selenium in the environment and human health. BocaRaton: CRC Press, 2013: 895-899.
[3] 崔乔, 尚德静, 邹霞. 硒多糖的研究进展[J]. 中国生化药物杂志,2003, 24(3): 155-157. DOI:10.3969/j.issn.1005-1678.2003.03.021.
[4] 刘信平, 张驰, 周大寨. 营养元素硒在南瓜中赋存形态及分布研究[J]. 食品科学, 2006, 27(10): 61-64. DOI:10.3321/ j.issn:1002-6630.2006.10.009.
[5] 张继, 刘忠旺, 王凤霞, 等. 兰州百合多糖硒酸酯的合成及表征[J].高分子通报, 2009(10): 58-52.
[6] 梁淑轩, 马二红, 赵燕燕, 等. 醋酸催化下枸杞多糖的硒化修饰及抗肿瘤活性[J]. 食品研究与开发, 2011, 32(3): 160-165. DOI:10.3969/ j.issn.1005-6521.2011.03.046.
[7] 刘占峰, 孙汉文. 多糖的化学修饰研究进展[J]. 河北大学学报(自然科学版), 2005, 25(1): 104-112. DOI:10.3969/ j.issn.1000-1565.2005.01.024.
[8] 高义霞, 周向军, 王风霞, 等. 刺槐豆多糖硒酸酯的制备及表征[J].食品工业科技, 2012, 33(14): 288-290.
[9] 张珏, 王兴华. 硒多糖药理及获取研究进展[J]. 山西职工医学院学报, 2014, 24(2): 44-49.
[10] 毕新颖, 王建南, 姜玲玲, 等. 南瓜多糖的多重生理效应研究进展[J]. 生物学杂志,2014, 31(1): 78-83. DOI:10.3969/ j.issn.2095-1736.2014.01.078.
[11] 江璐, 何计国, 范慧红. 南瓜多糖的研究进展[J]. 食品与药品, 2007,9(8): 51-55. DOI:10.3969/j.issn.1672-979X.2007.08.017
[12] 孔倩, 周婷, 武改兰. 南瓜水溶性多糖的制备及硫酸酯化初步研究[J]. 食品科学, 2009, 30(16): 73-79. DOI:10.3321/ j.issn:1002-6630.2009.16.010.
[13] 孙婕, 尹国友, 牛美艳. 磷酸酯化南瓜多糖的制备及抗氧化活性研究[J]. 四川农业大学学报, 2013, 31(3): 322-328. DOI:10.3969/ j.issn.1000-2650.2013.03.016.
[14] 高义霞, 袁毅君, 周向军. 罗望子多糖硒酸酯的制备及表征[J]. 药物分析杂志, 2012, 32(7): 1222-1226.
[15] 庞秀芬, 杨国农, 赵青. 甘草硒多糖的制备研究[J]. 化学工程, 2009,37(9): 64-69. DOI:10.3969/j.issn.1005-9954.2009.09.017.
[16] 吴天鹏. 南瓜多糖提取纯化工艺的研究[J]. 应用化工, 2011, 40(6): 1066-1070. DOI:10.3969/j.issn.1671-3206.2011.06.038.
[17] 易国欣, 陈密玉, 李永星, 等. 南瓜多糖的提取与分离工艺的优化[J]. 海峡药学, 2003, 15(4): 14-16. DOI:10.3969/ j.issn.1006-3765.2003.04.032.
[18] 罗申军, 白璐, 赵秀举. 南瓜多糖提取过程优化[J]. 武汉轻工大学学报, 2015, 34(1): 52-54. DOI:10.3969/j.issn.2095-7386.2015.01.004.
[19] 曾军, 石国荣, 张湘元, 等. 珙桐叶水提物的抗氧化性能[J]. 湖南农业大学学报(自然科学版), 2009, 35(3): 295-298.
[20] 韩少华, 朱靖博, 王妍妍. 邻苯三酚自氧化法测定抗氧化活性的方法研究[J]. 中国酿造, 2009, 25(6): 155-157. DOI:10.3969/ j.issn.0254-5071.2009.06.050.
[21] 杨润亚, 明永飞, 王慧. 无花果叶中总黄酮的提取及其抗氧化活性测定[J]. 食品科学, 2010, 31(16): 78-83.
[22] 李上标, 裴淑艳, 蒋超, 等. MTT比色法研究应用进展[J]. 西北民族大学学报(自然科学版), 2013, 34(91): 68-76. DOI:10.3969/ j.issn.1009-2102.2013.03.016.
[23] 边兴艳. MTT比色法及其应用[J]. 国外医学(临床生物化学与检验学分册), 1998, 19(2): 83-85.
[24] 范文秀, 黄建华, 李新峥. 南瓜多糖的提取及光谱研究[J]. 光谱学与光谱分析, 2008, 28(10): 403-404.
[25] 廖明阳, 马华智. 紫杉醇的临床毒副作用分析[J]. 解放军药学学报,1999, 15(5): 25-26. DOI:10.3969/j.issn.1008-9926.1999.05.009.
Preparation, Characterization and Activity Analysis of Selenium-Containing Pumpkin Polysaccharide
SHANG Longchen1, WU Shaowei1, ZHANG Chi2, LIAO Honghua2, LIU Xinping1,*
(1. College of Chemistry and Environmental Engineering, Hubei University for Nationalities, Enshi 445000, China;2. College of Biological Science and Technology, Hubei University for Nationalities, Enshi 445000, China)
selenium-containing pumpkin polysaccharide; preparation; characterization; activity
10.7506/spkx1002-6630-201619008
TS201.2
A
1002-6630(2016)19-0048-06
商龙臣, 吴少魏, 张驰, 等. 南瓜硒多糖的制备表征及活性分析[J]. 食品科学, 2016, 37(19): 48-53. DOI:10.7506/ spkx1002-6630-201619008. http://www.spkx.net.cn
SHANG Longchen, WU Shaowei, ZHANG Chi, et al. Preparation, characterization and activity analysis of selenium-containing pumpkin polysaccharide[J]. Food Science, 2016, 37(19): 48-53. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201619008. http://www.spkx.net.cn
2015-05-08
国家自然科学基金地区科学基金项目(21461009;F030304);湖北省高校应用化学战略性新兴产业人才培养计划项目
商龙臣(1990—),男,硕士研究生,研究方向为食品化学。E-mail:13402703754@163.com
刘信平(1967—),女,教授,硕士,研究方向为天然硒产物的研究与开发。E-mail:xingping-liu@163.com

