MUTYH基因多态性对原发性男性不育症和精子DNA完整性的影响研究
申 琴,马 强,刘春莲,焦海燕
·论著·
MUTYH基因多态性对原发性男性不育症和精子DNA完整性的影响研究
申 琴,马 强,刘春莲,焦海燕
目的探讨MUTYH基因rs3219489、rs10527342位点单核苷酸多态性(SNPs)对原发性男性不育症和精子DNA完整性的影响及其与吸烟、饮酒的交互作用。 方法选取2011年8月—2012年12月在宁夏医科大学总医院生殖医学中心门诊就诊的245例原发性男性不育症患者为病例组,其中少精弱精症患者166例(少精弱精症亚组)、精液指标正常男性不育症患者79例(精液指标正常亚组);另选取同期在宁夏医科大学总医院体检健康且有生育史的男性329例为对照组。采用聚合酶链式反应-限制性片段长度多态性(PCR-RFLP)技术分析MUTYH基因rs3219489、rs10527342位点基因型分布和等位基因频率。采用精子染色质扩散(SCD)试验检测精子DNA损伤程度,采用精子DNA断裂指数(DFI)表示。结果对照组与病例组MUTYH基因rs3219489位点GG、CG、CC基因型分布比较,差异无统计学意义(P>0.05); CG+CC基因型频率和G、C等位基因频率比较,差异有统计学意义(P<0.05)。对照组与病例组MUTYH基因rs10527342位点AA、AP、PP基因型分布,AP+PP基因型频率和A、P等位基因频率比较,差异均无统计学意义(P>0.05)。对照组、少精弱精症亚组与精液指标正常亚组MUTYH基因rs3219489位点GG、CG、CC基因型分布比较,差异无统计学意义(P>0.05);CG+CC基因型频率和G、C等位基因频率比较,差异有统计学意义(P<0.05)。3组MUTYH基因rs10527342位点AA、AP、PP基因型分布,AP+PP基因型频率和A、P等位基因频率比较,差异均无统计学意义(P>0.05)。病例组精子DFI〔(46.2±22.3)%〕高于对照组〔(21.4±9.2)%〕(P<0.05)。少精弱精症亚组与精液指标正常亚组精子 DFI高于对照组,少精弱精症亚组精子DFI高于精液指标正常亚组(P<0.05)。MUTYH基因rs3219489、rs10527342位点不同基因型原发性男性不育症患者精子 DFI 比较,差异无统计学意义(P>0.05)。MUTYH基因rs3219489位点与rs10527342位点间存在中度连锁不平衡(D′=0.749,r2=0.289)。MUTYH基因rs3219489、rs10527342位点与吸烟、饮酒均不存在交互作用(P>0.05)。 结论MUTYH基因rs3219489位点的C等位基因可能是原发性男性不育症的保护因素,rs10527342位点可能与原发性男性不育症无关。精子DFI的增加可能会导致原发性男性不育症的患病风险增加。rs3219489、rs10527342位点可能对精子DNA完整性没有影响,且与吸烟、饮酒均无交互作用。
不育,男(雄)性;MUTYH基因;多态性,单核苷酸;精子;DNA
申琴,马强,刘春莲,等.MUTYH基因多态性对原发性男性不育症和精子DNA完整性的影响研究[J].中国全科医学,2016,19(30):3698-3704.[www.chinagp.net]
SHEN Q,MA Q,LIU C L,et al.Effect of MUTYH gene polymorphisms on primary male infertility and sperm DNA integrity[J].Chinese General Practice,2016,19(30):3698-3704.
引起男性不育的病因复杂,如精子发生障碍、环境因素等,其中有70%以上的男性不育原因不明,临床上称为原发性男性不育症(包括原发性无精子症及少弱畸精子症)。在很大程度上,原发性男性不育症是由于精子发生过程中,相关基因的突变导致异常的生精过程所引起的不育[1]。精子发生(spermatogenesis)是一个高度复杂的细胞增生与分化过程,涉及睾丸内大量活性氧(ROS)的损害以及吸烟、饮酒等环境因素的影响,从而导致DNA损伤[2]。RYBAR等[3]指出,在原发性男性不育症患者中,精子DNA损伤率较正常人明显升高,说明精子DNA损伤与原发性男性不育症密切相关。碱基切除修复MUTYH基因是DNA损伤修复中的主要途径[4]。MUTYH基因功能的异常会导致低效的DNA修复和8-羟脱氧鸟苷(8-OHdG)的积累,造成DNA损伤[5]。MUTYH基因rs10527342位点(AluYb8MUTYH)和rs3219489位点(Gln324His)单核苷酸多态性(SNPs)是错义突变位点,可能影响MUTYH基因的功能,从而导致个体DNA修复能力异常。因此,本研究探讨MUTYH 基因多态性与原发性男性不育症和精子DNA完整性的关系及其与吸烟、饮酒的交互作用,现报道如下。
1 对象与方法
1.1研究对象选取2011年8月—2012年12月在宁夏医科大学总医院生殖医学中心门诊就诊的245例原发性男性不育症患者为病例组,其中少精弱精症患者166例(少精弱精症亚组)、精液指标正常男性不育症患者79例(精液指标正常亚组);年龄21~43岁,平均年龄(32.5±5.9)岁;符合《世界卫生组织人类精液检查与处理实验室手册》的诊断标准[6],排除染色体异常者、Y染色体微缺失者、梗阻性无精子症和激素异常者。另选取同期在宁夏医科大学总医院体检健康且有生育史的男性329例为对照组,年龄28~71岁,平均年龄(51.0±15.5)岁。
1.2吸烟与饮酒情况收集受试者吸烟与饮酒情况,其中吸烟定义为每天吸烟不少于1支,持续1年,或总量不少于18包/年。饮酒定义为每周饮酒不少于2次;白酒不少于50 g/次,或其他酒类不少于500 ml/次。达不到此标准认定为不吸烟和不饮酒。
1.3标本采集使用含有乙二胺四乙酸(EDTA)抗凝剂的静脉采血管抽取外周静脉血3 ml,-20 ℃保存,用于基因组DNA提取;病例组患者提供1份精液标本(手淫法采集精液,收集患者一次排精量的精液),-80 ℃保存,用于精子染色质扩散(SCD)试验。另外收集67例对照组男性的精液标本作为SCD试验的对照。本研究通过了宁夏医科大学医学伦理委员会批准并获得所有受试者的知情同意。
1.4MUTYH基因SNPs分型
1.4.1DNA提取严格按照全血细胞DNA提取试剂盒说明书〔天根生化科技(北京)有限公司〕提取外周血基因组DNA,-20 ℃保存备用。
1.4.2聚合酶链式反应-限制性片段长度多态性(PCR-RFLP)进行SNPs分型从文献中查找 rs3219489位点[7]和 rs10527342位点[5]引物(见表1),均在GeneBank中进行序列比对验证。引物由生工生物工程(上海)股份有限公司合成。PCR 反应体系:双蒸水(ddH2O)4.625 μl,2×Masteer Mix 6.25 μl,DNA聚合酶0.125 μl,上游引物0.25 μl,下游引物0.25 μl,DNA 1.0 μl。扩增条件为:94 ℃预变性5 min;94 ℃变性30 s,68 ℃/63 ℃ 退火45 s,72 ℃延伸30 s,循环35次;72 ℃总延伸10 min。采用RsaⅠ和AluYb8 限制性内切酶(NEB公司)分别对rs3219489、rs10527342位点PCR产物进行酶切,酶切产物经3.0%琼脂糖凝胶电泳后用Gel Doc-2000凝胶成像系统观察条带分布来判断基因型。随机抽取30例样本进行两个位点的PCR-RFLP重复试验,保证酶切结果的正确性。每种基因型各挑选2例患者,经PCR扩增后进行测序验证,以确保基因分型的准确性。
1.5SCD试验采用SCD试验检测两组精子DNA损伤程度。计数300个精子,观察精子光晕大小,根据精子光晕与精子头横径的比例,分为大、中、小和无光晕4个等级:大光晕:>2/3精子头横径,中光晕:>1/3~2/3精子头横径,小光晕:≤1/3精子头横径。大光晕和中光晕表示精子DNA完整无碎片,小光晕和无光晕表示精子DNA断裂为碎片。精子DNA损伤程度采用精子DNA断裂指数(DNA fragment index,DFI) 表示,DFI=(小光晕精子数+无光晕精子数)/精子总数×100%。
2 结果
2.1Hardy-Weinberg平衡检验对照组MUTYH基因rs3219489、rs10527342位点基因型分布符合Hardy-Weinberg平衡(χ2值分别为1.23和1.09,P>0.05),说明本研究所选的样本具有群体代表性。2.2对照组与病例组MUTYH基因rs3219489、rs10527342位点基因型分布和等位基因频率比较对照组与病例组MUTYH基因rs3219489位点GG、CG、CC基因型分布比较,差异无统计学意义(P>0.05);CG+CC基因型频率,G、C等位基因频率比较,差异有统计学意义(P<0.05)。在显性遗传模型下,携带CG+CC基因型个体患原发性男性不育症的风险是携带GG型个体的0.69倍〔OR=0.69,95%CI(0.49,0.96)〕;携带C等位基因个体患原发性男性不育症的风险是携带G等位基因个体的0.75倍〔OR=0.75,95%CI(0.59,0.95)〕。对照组与病例组MUTYH基因rs10527342位点AA、AP、PP基因型分布,AP+PP基因型频率和A、P等位基因频率比较,差异均无统计学意义(P>0.05,见表2)。
2.3对照组、少精弱精症亚组与精液指标正常亚组MUTYH基因rs3219489、rs10527342位点基因型分布和等位基因频率比较对照组、少精弱精症亚组与精液指标正常亚组MUTYH基因rs3219489位点GG、CG、CC基因型分布比较,差异无统计学意义(P>0.05);CG+CC基因型频率和G、C等位基因频率比较,差异有统计学意义(P<0.05);其中精液指标正常亚组MUTYH基因rs3219489位点CG+CC基因型频率和C等位基因频率低于对照组和少精弱精症亚组,差异有统计学意义(P<0.05);对照组与少精弱精症亚组MUTYH基因CG+CC基因型频率和G、C等位基因频率比较,差异无统计学意义(P>0.05)。携带CG+CC型个体患精液指标正常男性不育症的风险是携带GG型个体的0.50倍〔OR=0.50,95%CI(0.30,0.82)〕;携带C等位基因个体患精液指标正常男性不育症的风险是携带G等位基因个体的0.56倍〔OR=0.56,95%CI(0.38,0.82)〕。对照组、少精弱精症亚组与精液指标正常亚组MUTYH基因rs10527342位点AA、AP、PP基因型分布,AP+PP基因型频率和A、P等位基因频率比较,差异均无统计学意义(P>0.05,见表3)。
2.4各组精子DFI比较病例组精子DFI〔(46.2±22.3)%〕高于对照组〔(21.4±9.2)%〕,差异有统计学意义(t=7.01,P<0.05)。对照组、少精弱精症亚组与精液指标正常亚组精子DFI比较,差异有统计学意义(P<0.05);其中少精弱精症亚组与精液指标正常亚组精子DFI高于对照组,差异有统计学意义(P<0.05);少精弱精症亚组精子DFI高于精液指标正常亚组,差异有统计学意义(P<0.05,见表4)。
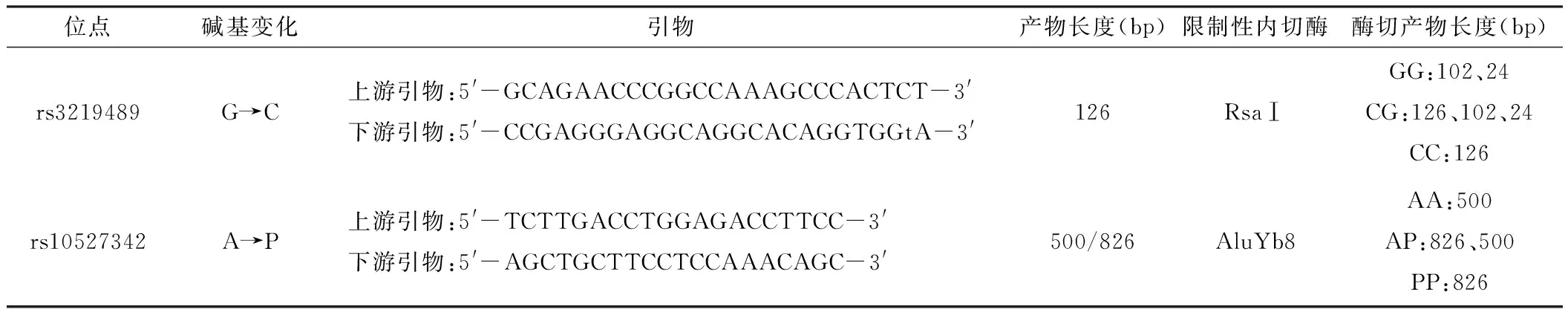
表1 MUTYH基因rs3219489、rs10527342位点SNPs分型基本信息
注:引物序列中的小写字母为人工引入的错配碱基;rs10527342位点是由326 bp的AluYb8元件反向插入MUTYH基因第15内含子中形成,是一种插入/缺失变异(A→P)
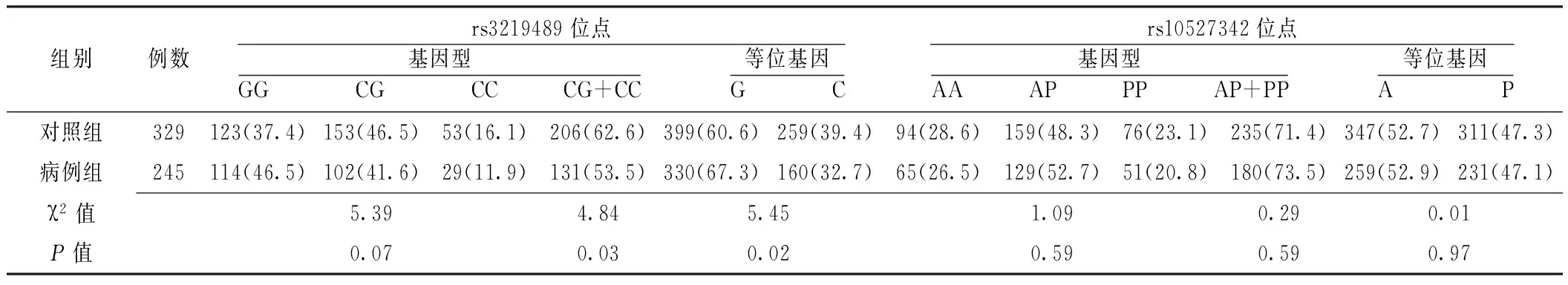
表2 对照组与病例组MUTYH基因rs3219489、rs10527342位点基因型分布和等位基因频率比较〔n(%)〕
表3对照组、少精弱精症亚组与精液指标正常亚组MUTYH基因rs3219489、rs10527342位点基因型分布和等位基因频率比较〔n(%)〕
Table 3Comparison of genotype distribution and allele frequency of MUTYH rs3219489 and rs10527342 among control group,oligoasthenospermia subgroup and normozoospermia subgroup

组别例数rs3219489位点基因型GG CG CC CG+CC 等位基因G Crs10527342位点基因型AA AP PP AP+PP 等位基因A P对照组329123(37.4)153(46.5)53(16.1)206(62.6)399(60.6)259(39.4)94(28.6)159(48.3)76(23.1)235(71.4)347(52.7)311(47.3)少精弱精症亚组16671(42.8)72(43.4)23(13.8)95(57.2)214(64.5)118(35.5)49(29.5)83(50.0)34(20.5)117(70.5)181(54.5)151(45.5)精液指标正常亚组 79 43(54.4)30(38.0)6(7.6)36(45.6)ab116(73.4)43(26.6)ab16(20.3)46(58.2)17(21.5)63(79.7)78(49.4)80(50.6)χ2值8.977.858.583.472.591.14P值0.060.020.010.480.270.57
注:与对照组比较,aP<0.05;与少精弱精症亚组比较,bP<0.05
Table 4Comparison of sperm DFI among control group,oligoasthenospermia subgroup and normozoospermia subgroup

组别例数精子DFI对照组6721.4±9.2少精弱精症亚组16650.0±22.1a精液指标正常亚组7938.2±20.7abF值32.80P值<0.01
注:DFI=DNA断裂指数;与对照组比较,aP<0.05;与少精弱精症亚组比较,bP<0.05
2.5原发性男性不育症患者MUTYH基因rs3219489、rs10527342位点不同基因型间精子 DFI 比较MUTYH基因rs3219489位点GG、CG、CC基因型原发性男性不育症患者精子 DFI 比较,差异无统计学意义(P>0.05,见表5);MUTYH基因rs10527342位点AA、AP、PP基因型原发性男性不育症患者精子 DFI 比较,差异无统计学意义(P>0.05,见表6)。
2.6MUTYH基因rs3219489、rs10527342位点遗传易患性分析及其与吸烟、饮酒的交互作用采用Haploview软件分析MUTYH基因rs3219489、rs10527342位点的单体型,结果显示,MUTYH基因rs3219489位点与rs10527342位点间存在中度连锁不平衡(D′=0.749,r2=0.289)。采用单纯病例研究,将研究对象按照基因型和环境因素进行分组,探讨基因-环境交互作用对原发性男性不育症患病风险的影响,结果显示,MUTYH基因rs3219489、rs10527342位点与吸烟、饮酒均不存在交互作用(P>0.05,见表7)。

表7 MUTYH基因rs3219489、rs10527342位点与吸烟、饮酒对原发性男性不育症发病影响的交互作用(例)
注:a数据有删失,表中数据剔除删失数据
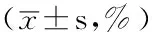
Table 5Comparison of sperm DFI among GG,CG and CC genotypes of MUTYH rs3219489 of patients with primary male infertility

基因型例数精子DFIGG11444±21CG10250±24CC2941±21F值0.32P值0.73
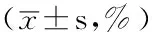
Table 6Comparison of sperm DFI of AA,AP and PP genotypes of MUTYH 10527342 of patients with primary male infertility

基因型例数精子DFIAA6543±19AP12948±24PP5146±22F值0.40P值0.68
3 讨论
人精子染色质由DNA双链和鱼精蛋白结合而形成高度浓缩的结构,易受到遗传或吸烟、饮酒等环境因素的损伤,是影响男性不育的重要因素之一[7]。人类DNA损伤修复系统主要包括:错配修复通路、碱基切除修复通路、核酸切除修复通路及双链断裂修复通路等[8]。MUTYH 基因定位于 1p32.1~1p34.3 ,长7.1 kb,含有16个外显子,编码一个535个氨基酸的蛋白[9],MUTYH是碱基切除修复通路的关键蛋白,是一种特异的腺嘌呤转葡糖基酶,定位于细胞核和线粒体内[10]。复制DNA后MUTYH迅速扫描子链 DNA,切除子链DNA中与母链8-OHdG错配的A[11]。MUTYH基因功能的异常会导致低效的DNA修复和8-OHdG的积累,造成DNA损伤。如果MUTYH 失活,则会因8-OHdG的异常积累引起G∶C→T∶A的碱基置换,从而引起相关基因及其蛋白发生功能性改变[12]。研究证实,rs3219489 (G→C,Gln324His)位点CC基因型会增加瑞典人群和日本人群直肠癌的患病风险[13],提示rs3219489位点可能会导致遗传不稳定性。rs10527342位点是由AluYb8元件反向插入MUTYH基因第15内含子中形成的一个常见变异[14]。AluYb8 MUTYH 突变纯合子或杂合子个体基因组中8-OHdG水平显著高于野生纯合子,并且是中国人群2型糖尿病的危险因素[15],提示该位点可导致MUTYH的功能异常。大量证据表明,MutY糖基化酶同系物(MUTYH)在许多癌症的发病机制中扮演着重要角色[16],并且MUTYH基因多态性是类风湿关节炎的危险因素[17]。2型糖尿病、肿瘤、风湿性关节炎以及男性不育等均是复杂的多基因疾病,受环境和遗传因素影响[18-21]。故推测MUTYH 基因的多态性可能会影响精子DNA完整性及原发性男性不育症。
rs3219489位点位于MUTYH基因的编码区[22],其G/C等位基因的变化可以直接影响蛋白质的功能,因此可以产生严重的表型后果[23-24]。CZARNY等[25]研究表明,rs3219489位点GG基因型增强迟发性复发类型的风险。CAI等[26]研究发现,rs3219489位点GG基因型、rs10527342位点均增加终末期肾脏疾病的风险,而CC基因型增加患直肠癌的风险[27],本研究结果显示,MUTYH 基因rs3219489位点与原发性男性不育症有关,携带CG+CC型个体患原发性男性不育症的风险较携带GG型个体低,携带C等位基因个体患原发性男性不育症的风险较携带G等位基因个体低;MUTYH 基因rs3219489位点与精液指标正常男性不育症有关,携带CG+CC型个体患精液指标正常男性不育症风险较携带GG型的个体低。G、C等位基因频率分布在精液指标正常亚组与对照组和少精弱精症亚组中亦有差异,携带C等位基因个体患精液指标正常男性不育症的风险是携带G等位基因个体的0.56倍,提示MUTYH 基因rs3219489位点的C等位基因可能是原发性男性不育症的保护因素;但是MUTYH 基因rs3219489位点3种不同基因型个体间精子DFI并无差异,提示MUTYH 基因rs3219489位点可能是通过更复杂的机制参与原发性男性不育症的发病过程。本研究探讨MUTYH 基因rs3219489位点与原发性男性不育症的遗传易患性,还需更多的研究来验证。MUTYH 基因rs10527342位点的变异基因型(PP和AP)并不会对原发性男性不育症的遗传易患性和精子DFI产生影响,同时,其与吸烟和饮酒也无交互作用。此位点还有待于在不同地区、不同人群中验证,进一步明确二者之间的关系。
本研究SCD试验结果表明,病例组患者精子 DFI 高于对照组,提示精子DFI的增加可能会增加原发性男性不育症的患病风险。精子DNA完整性降低不仅会影响精子的活力,导致流产[28],还会降低辅助生殖技术治疗的受精率和优质胚胎率[29]。此外,严重的精子DNA损伤还和辅助生殖技术成功率低有关[30]。因此,精子DNA完整性降低不仅可降低男性生育力,也会影响后续的辅助生殖治疗结果。
综上所述,精子DNA损伤修复是多基因、多步骤、多通路的复杂过程,同时与环境因素有关,虽然MUTYH基因rs3219489、rs10527342位点对原发性男性不育症的发病没有贡献,可能对精子DNA完整性没有影响,但此基因可能是微效基因,与其他相关基因的交互可能与原发性男性不育症相关。此外,本研究选取的研究对象是中国北方宁夏地区人群,证实了MUTYH基因rs3219489、rs10527342位点SNPs与本地区原发性男性不育症的发病无关,但可能只能反映宁夏地区人群的特征,此位点SNPs与不同人种、不同地区原发性男性不育症是否相关,有待于不同人群、多地区的研究证实。
作者贡献:申琴进行试验设计与实施、资料收集整理、撰写论文、成文并对文章负责;申琴、马强、刘春莲进行试验实施、评估、资料收集;焦海燕进行质量控制及审校。
本文无利益冲突。
[1]TÜTTELMANN F,RAJPERT-DE MEYTS E,NIESCHLAG E,et al.Gene polymorphisms and male infertility——a meta-analysis and literature review[J].Reprod Biomed Online,2007,15(6):643-658.
[2]TAHA E A,EZ-ALDIN A M,SAYED S K,et al.Effect of smoking on sperm vitality,DNA integrity,seminal oxidative stress,zinc in fertile men[J].Urology,2012,80(4):822-825.DOI:10.1016/j.urology.2012.07.002.
[3]RYBAR R,MARKOVA P,VEZNIK Z,et al.Sperm chromatin integrity in young men with no experiences of infertility and men from idiopathic infertility couples[J].Andrologia,2009,41(3):141-149.DOI:10.1111/j.1439-0272.2008.00905.
[4]ENGSTROM L M,BRINKMEYER M K,HA Y,et al.A zinc linchpin motif in the MUTYH glycosylase interdomain connector is required for efficient repair of DNA damage[J].J Am Chem Soc,2014,136(22):7829-7832.DOI:10.1021/ja502942d.
[5]CHEN H,SUN C,GUO W,et al.AluYb8 insertion in the MUTYH gene is related to increased 8-OHdG in genomic DNA and could be a risk factor for type 2 diabetes in a Chinese population[J].Mol Cell Endocrinol,2011,332(1/2):301-305.DOI:10.1016/j.mce.2010.11.021.
[6]谷翊群.世界卫生组织人类精液检查与处理实验室手册[M].5版.北京:人民卫生出版社,2001.
[7]BUNGUM M.Sperm DNA integrity assessment:a new tool in diagnosis and treatment of fertility[J].Obstet Gynecol Int,2012,2012:531042.DOI:10.1155/2012/531042.
[8]YSHAHI A,LEE J H,KANG Y, et al.Mismatch-repair protein MSH6 is associated with Ku70 and regulates DNA double-strand break repair[J].Nucleic Acids Res,2011,39(6):2130-2143.DOI:10.1093/nar/gkq1095.
[9]BRINKMEYER M K,DAVID S S.Distinct functional consequences of MUTYH variants associated with colorectal cancer:damaged DNA affinity,glycosylase activity and interaction with PCNA and Hus1[J].DNA Repair (Amst),2015,34:39-51.DOI:10.1016/j.dnarep.2015.08.001.
[10]MARKKANEN E,HÜBSCHER U,VAN LOON B.Regulation of oxidative DNA damage repair:the adenine:8-oxo-guanine problem[J].Cell Cycle,2012,11(6):1070-1075.DOI:10.4161/cc.11.6.19448.
[11]WANG L,LEE S J,VERDINE G L.Structural basis for avoidance of promutagenic DNA repair by MutY adenine DNA glycosylase[J].J Biol Chem,2015,290(28):17096-17105.DOI:10.1074/jbc.M115.657866.
[12]CHEN H,SUN C,GUO W,et al.AluYb8 insertion in the MUTYH gene is related to increased 8-OHdG in genomic DNA and could be a risk factor for type 2 diabetes in a Chinese population[J].Mol Cell Endocrinol,2011,332(1/2):301-305.DOI:10.1016/j.mce.2010.11.021.
[13]KUNO T,MATSUBARA N,TSUDA S,et al.Alterations of the base excision repair gene MUTYH in sporadic colorectal cancer[J].Oncol Rep,2012,28(2):473-480.DOI:10.3892/or.2012.1836.
[14]SUN C,CHEN H,GUO W,et al.A common mutation of the MYH gene is associated with increased DNA oxidation and age-related diseases[J].Free Radic Biol Med,2010,48(3):430-436.DOI:10.1016/j.freeradbiomed.2009.11.015.
[15]CAO L,ZHOU W,ZHU Y,et al.Combined analysis of polymorphism variants in hMTH1,hOGG1 and MUTYH genes on the risk of type 2 diabetes in the Chinese population[J].Gene,2013,519(1):50-54.DOI:10.1016/j.gene.2013.01.053.
[16]KONG F,HAN X Y,LUAN Y,et al.MUTYH association with esophageal adenocarcinoma in a Han Chinese population[J].Asian Pac J Cancer Prev,2013,14(11):6411-6413.
[17]KUNG Y J,TSAI K S,HUANG C M,et al.MUTYH gene polymorphisms as risk factors for rheumatoid arthritis[J].Biomed Res Int,2015,2015:893796.DOI:10.1155/2015/893796.
[18]AL MUFTAH W A,AL-SHAFAI M,ZAGHLOOL S B,et al.Epigenetic associations of type 2 diabetes and BMI in an Arab population[J].Clin Epigenetics,2016,8:13.DOI:10.1186/s13148-016-0177-6.
[19]ZHAO Z,WEN W,MICHAILIDOU K,et al.Association of genetic susceptibility variants for type 2 diabetes with breast cancer risk in women of European ancestry[J].Cancer Causes Control,2016,27(5):679-693.DOI:10.1007/s10552-016-0741-6.
[20]ADTANI P,MALATHI N.Epstein-Barr virus and its association with rheumatoid arthritis and oral lichen planus[J].J Oral Maxillofac Pathol,2015,19(3):282-295.DOI:10.4103/0973-029X.174643.
[22]SYNOWIEC E,WJCIK K A,CZUBATKA A,et al.Lack of association between polymorphisms of the DNA base excision repair genes MUTYH and hOGG1 and keratoconus in a Polish subpopulation[J].Arch Med Sci,2015,11(5):1101-1110.DOI:10.5114/aoms.2015.54867.
[23]NG P C,HENIKOFF S.Predicting the effects of amino acid substitutions on protein function[J].Annu Rev Genomics Hum Genet,2006,7:61-80.
[24]LEE P H,SHATKAY H.F-SNP:computationally predicted functional SNPs for disease association studies[J].Nucleic Acids Res,2008,36(Database issue):D820-824.
[25]CZARNY P,KWIATKOWSKI D,GALECKI P,et al.Association between single nucleotide polymorphisms of MUTYH,hOGG1 and NEIL1 genes,and depression[J].J Affect Disord,2015,184:90-96.DOI:10.1016/j.jad.2015.05.044.
[26]CAI Z,CHEN H,TAO J,et al.Association of base excision repair gene polymorphisms with ESRD risk in a Chinese population[J].Oxid Med Cell Longev,2012,2012:928421.DOI:10.1155/2012/928421.
[27]PICELLI S,ZAJAC P,ZHOU X L,et al.Common variants in human CRC genes as low-risk alleles[J].Eur J Cancer,2010,46:1041-1048.DOI:10.1016/j.ejca.2010.01.013.
[28]ROBINSON L,GALLOS I D,CONNER S J,et al.The effect of sperm DNA fragmentation on miscarriage rates:a systematic review and meta-analysis[J].Hum Reprod,2012,27(10):2908-2917.DOI:10.1093/humrep/des261.
[29]SIMON L,PROUTSKI I,STEVENSON M,et al.Sperm DNA damage has a negative association with live-birth rates after IVF[J].Reprod Biomed Online,2013,26(1):68-78.DOI:10.1016/j.rbmo.2012.09.019.
[30]BUCAR S,GONÇALVES A,ROCHA E,et al.DNA fragmentation in human sperm after magnetic-activated cell sorting[J].J Assist Reprod Genet,2015,32(1):147-154.DOI:10.1007/s10815-014-0370-5.
(本文编辑:陈素芳)
Effect of MUTYH Gene Polymorphisms on Primary Male Infertility and Sperm DNA Integrity
SHENQin,MAQiang,LIUChun-lian,JIAOHai-yan.
KeyLaboratoryofFertilityMaintainingoftheMinistryofEducation,NingxiaMedicalUniversity,Yinchuan750004,China
Correspondingauthor:JIAOHai-yan,KeyLaboratoryofFertilityMaintainingoftheMinistryofEducation,NingxiaMedicalUniversity,Yinchuan750004,China;E-mail:hyjiao1602@hotmail.com
ObjectiveTo evaluate the effect of two SNPs (rs3219489 and rs10527342) of MUTYH gene on primary male infertility and sperm DNA integrity and their interaction with smoking and alcohol consumption.Methods245 primary male infertile patients who received treatment in the Outpatient Department of the Center for Reproductive Medicine in the General Hospital of Ningxia Medical University from August 2011 to December 2012 were selected as case group,including 166 patients with oligoasthenospermia (oligoasthenospermia subgroup) and 79 patients with normozoospermia male infertility (normozoospermia subgroup),and 329 healthy males with reproductive history from the physical examination of the hospital in the same period were selected as control group.PCR-RFLP was employed to analyze the genotype distribution and allele frequency of MUTYH rs3219489 and rs10527342.The damage degree of DNA was determined by sperm chromatin dispersion and was manifested by sperm DNA fracture index (DFI).ResultsControl group and case group were not significantly different in the distribution of GG,CG and CC genotypes of MUTYH rs3219489 (P>0.05),but were significantly different in the frequency of CG+CC genotype and G and C allele frequency (P<0.05).Control group and case group were not significantly different in the distribution of AP,AP and PP genotypes,the frequency of AP+PP genotype and the A and P allele frequency of MUTYH rs10527342(P>0.05).Control group,oligoasthenospermia subgroup and normozoospermia subgroup were not significantly different in the distribution of GG,CG and CC genotypes of MUTYH rs3219489 (P>0.05),but were significantly different in the frequency of CG+CC genotype and the G and C allele frequency (P<0.05).The three groups were not significantly different in the distribution of AA,AP and PP genotypes,the frequency of AP+PP genotype and the A and P allele frequency of MUTYH rs10527342(P>0.05).Case group was higher than control group in sperm DFI〔(46.2±22.3)% vs.(21.4±9.2)%〕(P<0.05).Oligoasthenospermia subgroup and normozoospermia subgroup were higher than control group in sperm DFI,and oligoasthenospermia subgroup was higher than normozoospermia subgroup in sperm DFI (P<0.05).There were no significant differences in sperm DFI among patients with different genotypes of MUTYH rs3219489 and rs10527342 (P>0.05).Moderate linkage disequilibrium existed between MUTYH rs3219489 and rs10527342 (D′=0.749,r2=0.289).There were no interaction of MUTYH rs3219489 and rs10527342 with smoking and alcholic consumption (P>0.05).ConclusionC allele of MUTYH rs3219489 may be a protective factor for primary male infertility,and MUTYH rs10527342 may have correlation with primary male infertility.The increase of sperm DFI may cause the increase in the risk of primary male infertility,and rs3219489 and rs10527342 may have no correlation with the integrity of sperm DNA and have no interaction with smoking and alcoholic consumption.
Infertility,male;MUTYH gene;Polymorphism,single nucleotide;Spermatozoa;DNA
宁夏回族自治区自然科学基金资助项目(NZ14070)
750004宁夏银川市,宁夏医科大学生育力保持教育部重点实验室,医学遗传学与细胞学系(申琴,焦海燕);川北医学院附属医院检验科(马强);宁夏医科大学总医院生殖医学中心(刘春莲)
焦海燕,750004宁夏银川市,宁夏医科大学生育力保持教育部重点实验室,医学遗传学与细胞学系;
E-mail:hyjiao1602@hotmail.com
R 698.2
A
10.3969/j.issn.1007-9572.2016.30.012
2016-03-24;
2016-08-12)

