血清NT-proBNP和cTnI在重症肺炎患儿心肌损害中的变化及临床意义
刘 艳
(湖北民族学院附属民大医院,湖北 恩施 445000)
血清NT-proBNP和cTnI在重症肺炎患儿心肌损害中的变化及临床意义
刘艳
(湖北民族学院附属民大医院,湖北 恩施 445000)
目的探讨血清N末端B型钠尿肽原(NT-proBNP)和心肌肌钙蛋白(cTnI)在重症肺炎患儿心肌损害中的变化及临床意义。方法选取103例重症肺炎患儿根据是否合并心肌损害分为合并组和非合并组,同期选取健康者40例作为对照组,分别于入院4 h(t0)、入院24 h(t1)和病程7 d(t2)时,对照组于体检日,利用酶联免疫吸附试验(ELISA法)检测血清中NT-proBNP和cTnI水平。结果重症肺炎患儿t0~t2时血清NT-proBNP和cTnI水平均高于对照组,合并组患儿t0~t2时血清NT-proBNP和cTnI水平均高于非合并组和对照组,且非合并组均高于对照组,差异有统计学意义(P<0.05);Pearson相关分析显示,重症肺炎患儿t0~t2时血清NT-proBNP水平均与cTnI水平呈正相关(r=0.366,0.323和0.550,P均<0.05);ROC曲线分析显示,重症肺炎患儿t0时血清NT-proBNP水平在预测心肌损害发生曲线下面积0.780[95%CI(0.645,0.916)],血清NT-proBNP水平为1.02 ng/mL时,灵敏度为64.0%,特异度为92.3%,重症肺炎患儿t0时血清cTnI水平在预测心肌损害发生曲线下面积0.856[95%CI(0.766,0.946)],血清cTnI水平为0.30 ng/mL时,灵敏度为72.0%,特异度为88.5%。结论重症肺炎患儿合并心肌损害时血清NT-proBNP和cTnI水平显著升高,可作为早期判定重症肺炎患儿发生心肌损害的指标。
重症肺炎;心肌损害;N末端B型钠尿肽原;心肌肌钙蛋白
重症肺炎作为儿童常见的呼吸道急症,起病急、病情重、危害大、并发症多,是导致儿童死亡的重要原因[1],研究证实,心脏损害是重症肺炎所致常见并发症,且病情重、对患儿危害大[2]。因此,早期发现并积极治疗重症肺炎患儿心脏并发症对促进患儿恢复及改善预后具有重要意义。N末端B型钠尿肽原(NT-proBNP)作为无活性的心室肌细胞分泌的神经内分泌激素,具有半衰期长、含量稳定的特点,已被用作心肌损害诊断及预后判定的指标[3],心肌肌钙蛋白(cTnI)是早期心肌损伤血清指标[4],本研究通过分析重症肺炎患儿血清NT-proBNP和cTnI水平变化,探讨二者在重症肺炎所致心肌损伤早期诊断中的意义,以期为临床实践提供基础资料。
1 临床资料
1.1一般资料选取2014年1月—2015年7月在我院儿科重症监护病房住院治疗的重症肺炎患儿103例,病例纳入标准:①均符合重症肺炎诊断标准[5]。病情重,呼吸系统症状严重,出现全身中毒症状等;②均完成治疗,具有完整的临床资料。排除标准:先天心脏病患儿、严重心血管功能不全者、营养不良及严重佝偻病者、免疫功能障碍者及放弃治疗者。其中男62例,女41例;年龄(2.3±1.2)岁(3个月~5岁)。根据患儿是否合并心肌损害,将患儿分为合并组和非合并组。合并组25例,男14例,女11例;年龄(2.2±1.1)岁。非合并组78例,男48例,女30例;年龄(2.3±1.2)岁。2组一般情况比较差异无统计学意义(P均>0.05)。同期,从我院儿童保健科选取健康者40例作为对照组,年龄1~5(2.3±1.0)岁,排除心脏疾病者、中枢神经系统疾病者,以及重要脏器严重功能障碍者。本研究通过医院伦理委员会批准。
1.2方法重症肺炎患儿分别于入院4 h(t0)、入院24 h(t1)和病程7 d(t2)时,对照组于体检日,分别抽取空腹静脉血5 mL,正常室温下,3 500 r/min离心15 min后,留取血清,利用酶联免疫吸附试验(ELISA法)法对血清中NT-proBNP和cTnI水平进行检测,NT-proBNP试剂盒由上海酶联生物科技有限公司提供,cTnI试剂盒由湖州英创生物科技有限公司提供,所有操作均按试剂盒说明进行,均在标准实验室条件下完成操作。

2 结 果
2.1重症肺炎患儿及对照组血清NT-proBNP和cTnI水平重症肺炎患儿t0~t2时血清NT-proBNP和cTnI水平均高于对照组(P均<0.05);合并组t0~t2时血清NT-proBNP和cTnI水平均高于非合并组和对照组,且非合并组均高于对照组,差异有统计学意义(P<0.05)。见表1。
2.2重症肺炎患儿血清NT-proBNP水平与cTnI水平相关性Pearson相关分析显示,重症肺炎患儿t0~t2时血清NT-proBNP水平均与cTnI水平呈正相关(r=0.366,0.323和0.550,P均<0.05)。
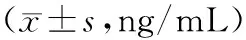
表1 重症肺炎患儿及对照组血清NT-proBNP和cTnI水平
注:①与t0时相比,P<0.05;②与对照组相比,P<0.05;③与非合并组相比,P<0.05。
2.3重症肺炎患儿t0时血清NT-proBNP和cTnI水平在预测心肌损害发生的价值ROC曲线分析显示,重症肺炎患儿t0时血清NT-proBNP水平在预测心肌损害发生曲线下面积0.780[95%CI(0.645,0.916)],随着血清NT-poBNP水平升高,灵敏度逐渐降低,特异度逐渐增加,血清NT-proBNP水平为1.02 ng/mL时,灵敏度为64.0%,特异度为92.3%;重症肺炎患儿t0时血清cTnI水平在预测心肌损害发生曲线下面积0.856[95%CI(0.766,0.946)],随着血清cTnI水平升高,灵敏度逐渐降低,特异度逐渐增加,血清cTnI水平为0.30 ng/mL时,灵敏度为72.0%,特异度为88.5%。见图1。

图1 重症肺炎患儿t0时血清NT-proBNP和cTnI水平 在预测心肌损害发生的价值
3 讨 论
重症肺炎为小儿常见病,是肺炎危重阶段,常伴有呼吸衰竭及其他系统明显受累表现,其中,心肌损伤是较为常见并发症,且导致的心力衰竭是造成患儿死亡的主要原因[6]。重症肺炎患儿并发心肌损伤的机制尚未明确,有研究指出[7],肺炎时细菌、病毒、真菌等对上呼吸道进行侵袭,炎症蔓延到肺部后导致肺泡水肿、充血,引发通气及换气功能障碍,造成低氧血症,导致由缺氧所介导的心肌损伤,同时,病原体及其代谢产物亦可直接对心肌细胞造成损伤。
心肌发生缺血、损伤及坏死时会刺激心肌细胞分泌脑利钠肽(BNP)前体物质[8]。NT-proBNP是BNP前体物质在蛋白酶作用下裂解产物之一,具有性质稳定、半衰期长、便于检测等特点[9],可作为心肌损伤及心力衰竭疾病的诊断及预后判定指标[10]。本研究显示,重症肺炎患儿t0~t2时血清NT-proBNP水平均高于对照组,说明NT-proBNP在重症肺炎患儿血清中出现升高,可能与重症肺炎所致心肌损害、肺动脉高压、心排血量降低等刺激BNP前体物质加速分泌有关[11]。本研究亦显示,合并组t0~t2时血清NT-proBNP水平均高于非合并组和对照组,说明重症肺炎患儿合并心肌损害时会加速NT-proBNP合成及释放,从而导致血清水平升高。
cTnI是心肌损伤特异性诊断指标,被认为是判定心肌损伤程度的“金标准”[12],本研究显示,重症肺炎患儿t0~t2时血清cTnI水平均高于对照组;合并组t0~t2时血清cTnI水平均高于非合并组和对照组,且非合并组均高于对照组,说明cTnI水平在重症肺炎患儿血清中升高,且合并心肌损害时水平升高更为显著。Pearson相关分析显示,重症肺炎患儿t0~t2时血清NT-proBNP水平均与cTnI水平呈正相关,提示NT-proBNP亦可作为反映重症肺炎患儿心肌损害严重程度的指标,动态监测cTnI和NT-proBNP可反映重症肺炎患儿心肌损伤的严重程度和病情的进展变化情况。ROC曲线分析显示,重症肺炎患儿t0时血清NT-proBNP水平在预测心肌损害发生曲线下面积0.780[95%CI(0.645,0.916)],血清NT-proBNP水平为1.02 ng/mL时,灵敏度为64.0%,特异度为92.3%,重症肺炎患儿t0时血清cTnI水平在预测心肌损害发生曲线下面积0.856[95%CI(0.766,0.946)],血清NT-proBNP水平为0.30 ng/mL时,灵敏度为72.0%,特异度为88.5%,说明血清NT-proBNP和cTnI水平可作为早期诊断重症肺炎患儿合并心肌损害的指标,且血清NT-proBNP和cTnI水平越高,在判定合并心肌损害时特异性越高。
综上所述,重症肺炎患儿血清NT-proBNP和cTnI水平升高,且合并心肌损害时升高程度更为显著,可作为早期判定重症肺炎患儿发生心肌损害的指标。
[1]De Pascale G,Bello G,Tumbarello M,et al. Severe pneumonia in intensive care:cause,diagnosis,treatment and management:a review of the literature[J]. Curr Opin Pulm Med,2012,18(3):213-221
[2]Warncke G,Osmers UN,Hauenstein C,et al. Therapeutic hypothermia after cardiopulmonary resuscitation in a 4-month infant[J]. Klin Padiatr,2014,226(4):221-224
[3]Madamanchi C,Alhosaini H,Sumida A,et al. Obesity and natriuretic peptides,BNP and NT-proBNP:mechanisms and diagnostic implications for heart failure[J]. Int J Cardiol,2014,176(3):611-617
[4]Sedaghat-Hamedani F,Kayvanpour E,Frankenstein L,et al. Biomarker Changes after strenuous exercise can mimic pulmonary embolism and cardiac injury-a metaanalysis of 45 studies[J]. Clin Chem,2015,61(10):1246-1255
[5]杨建中,畅毅平,彭鹏,等. 细胞因子IL-9与急性呼吸窘迫综合征患者预后的临床研究[J]. 中华急诊医学杂志,2015,24(8):887-892
[6]陈奕,许国章,马瑞. 2009—2012年浙江省宁波市5岁以下住院儿童肺炎发病情况及病原学特征[J]. 中华预防医学杂志,2014,48(12):1053-1056
[7]黄彩芝,莫丽亚,杨娟,等. 重症肺炎患儿血清N末端脑钠素原和肌钙蛋白I水平变化及意义[J]. 临床儿科杂志,2014,32(8):724-726
[8]Hill SA,Booth RA,Santaguida PL,et al. Use of BNP and NT-proBNP for the diagnosis of heart failure in the emergency department:a systematic review of the evidence[J]. Heart Fail Rev,2014,19(4):421-438
[9]Bajaj A,Rathor P,Sehgal V,et al. Prognostic Value of Biomarkers in Acute Non-massive Pulmonary Embolism:A Systematic Review and Meta-analysis[J]. Lung,2015,193(5):639-651
[10] Lazo M,Rubin J,Clark JM,et al. The association of liver enzymes with biomarkers of subclinical myocardial damage and structural heart disease[J]. J Hepatol,2015,62(4):841-847
[11] Lelli D,Pedone C,Rossi FF,et al. Clinical and echocardiographic characteristics of elderly hospitalized patients with high levels of NT-proBNP without clinical diagnosis of heart failure[J]. Aging Clin Exp Res,2014,26(6):607-613
[12] Streng AS,Jacobs LH,Schwenk RW,et al. Cardiac troponin in ischemic cardiomyocytes:intracellular decrease before onset of cell death[J]. Exp Mol Pathol,2014,96(3):339-345
10.3969/j.issn.1008-8849.2016.29.018
R563.1
B
1008-8849(2016)29-3244-03
2016-03-05

