糖肾安对高糖环境下大鼠肾脏及肾系膜细胞炎性因子ICAM-1表达的影响
胡 爽,王 镁
(1. 辽宁中医药大学,辽宁 沈阳 110032;2. 辽宁中医药大学附属医院,辽宁 沈阳 110032)
论著
糖肾安对高糖环境下大鼠肾脏及肾系膜细胞炎性因子ICAM-1表达的影响
胡爽1,王镁2
(1. 辽宁中医药大学,辽宁 沈阳 110032;2. 辽宁中医药大学附属医院,辽宁 沈阳 110032)

目的探讨糖肾安对高糖环境下大鼠肾脏及肾系膜细胞炎性因子细胞间黏附因子-1(ICAM-1)表达的影响。方法①实验一:50只健康SD大鼠随机分成正常组和造模组,造模组高糖高脂喂养4周后,一次性腹腔注射链脲佐菌素(Streptozotocin,STZ)诱导2型糖尿病模型,成模大鼠随机分为模型组、糖肾安高剂量组、糖肾安中剂量组、糖肾安低剂量组和西药组,各给药组给予相应药物8周后收集肾脏标本。②实验二:大鼠肾系膜细胞株解冻复苏后制成细胞悬液,将其按照实验一分组方法进行分组,各药物干预组在相应含药血清中培养24 h后收集细胞。2组实验采用Western blot、RT-PCR方法检测ICAM-1表达情况。结果①实验一:模型组、糖肾安中剂量组、糖肾安低剂量组及西药组ICAM-1表达量均明显高于正常组(P均<0.05),糖肾安各组及西药组ICAM-1表达量均明显低于模型组(P均<0.05),糖肾安高剂量组ICAM-1表达量明显低于糖肾安中剂量组、糖肾安低剂量组及西药组(P均<0.05)。②实验二:各药物干预组ICAM-1表达量均明显高于正常组(P均<0.05),但明显低于模型组(P均<0.05);糖肾安高剂量组ICAM-1表达量明显低于糖肾安中剂量组、糖肾安低剂量组(P均<0.05)。结论糖肾安可抑制大鼠肾脏及肾系膜细胞炎性因子ICAM-1的表达,减轻肾脏组织病理学改变,其肾脏保护作用可能与抑制ICAM-1表达水平有关。
糖肾安;大鼠;肾脏;肾系膜细胞;ICAM-1
糖尿病性肾脏疾病(Diabetic Kidney Disease,DKD)是糖尿病最严重的并发症之一[1],也是终末期肾病的主要原因[2]。细胞间黏附因子-1(ICAM-1)属于免疫球蛋白超家族成员,通过识别其受体白细胞功能相关抗原-1(LFA-1)等而促进炎症和免疫反应,其与肾脏炎症的病理生理学关系密切[3-5]。本研究通过体内外实验,采用Western blot、RT-PCR方法检测中药糖肾安对实验性2型糖尿病大鼠肾脏及高糖培养下肾系膜细胞炎性因子ICAM-1表达的影响,探讨糖肾安对糖尿病大鼠肾脏保护的作用机制,旨在为其治疗糖尿病肾病提供理论依据。
1 实验资料
1.1实验材料大鼠肾系膜细胞株,由湖南湘雅医学院实验室提供;SPF级雄性健康SD大鼠70只,体质量230~300 g,由沈阳龙元经济动物养殖场提供,动物合格证编号:SCSK(辽)2010-0001。
1.2试剂药品链脲佐菌素(Streptozotocin,STZ)(美国Sigma公司),蛋白裂解液(碧云天生物技术公司),10%胎牛血清(GIBCO公司),ICAM-1引物(Invitrogen生物试剂公司),ICAM-1一抗、二抗(武汉博士德公司),磷酸缓冲盐溶液(PBS),75%乙醇,胰蛋白酶,DMEM培养基(高糖、低糖),厄贝沙坦片(安博维,杭州赛诺菲安万特民生制药有限公司,生产批号:2A292),糖肾安煎剂(由黄芪、茯苓、白术等8味中药组成,购于辽宁中医药大学附属医院,药物水煎过滤浓缩至含生药3 g/mL)。
1.3仪器设备TDL-5-A型离心机(飞鸽牌Anke,上海安亭科学仪器厂),EQ.0603-021型PCR仪(日本TaKaRa公司),Bioshine GelX 1520型凝胶成像系统(美国UVP公司),DK-SA型恒温水浴箱(上海跃进医疗仪器厂),CO2恒温培养箱,倒置显微镜,细胞培养瓶。
1.4实验方法
1.4.1实验一
1.4.1.1分组及动物模型建立取50只健康SD大鼠普通饲料适应性喂养1周后,随机分为正常组8只和造模组42只,造模组用高糖高脂饲料(猪油10%,胆固醇2%,胆酸盐1%,蔗糖20%,普通饲料67%配比)喂养4周。大鼠造模前禁食不禁水12 h,造模组按35 mg/kg一次性左侧腹腔注射1% STZ溶液,正常组注射相应量的柠檬酸-柠檬酸钠缓冲液。72 h后大鼠尾静脉取血测血糖,血糖≥16.7 mmol/L且出现多饮、多食、多尿现象确认为2型糖尿病造模成功。造模过程中无大鼠死亡,3只大鼠未成模,从实验中剔除。
1.4.1.2分组及给药方法将成模大鼠随机分为模型组7只、糖肾安低剂量组8只、糖肾安中剂量组8只、糖肾安高剂量组8只、西药组8只。糖肾安低、中、高剂量组大鼠分别给予糖肾安6 g生药/(kg·d)、18 g生药/(kg·d)、60 g生药/(kg·d)灌胃,西药组给予厄贝沙坦13.5 mg /(kg·d)灌胃,正常组和模型组给予相应量的生理盐水灌胃,各组大鼠均每天灌胃1次,其中糖肾安低剂量组2只死亡,从实验中剔除。
1.4.1.3标本采集连续灌胃8周,在末次灌胃1 h后以10%水合氯醛3 mL/kg腹腔注射麻醉,收集肾脏标本,纵向剖开切取皮质部分,置于冻存管中-80 ℃保存待用。
1.4.2实验二
1.4.2.1细胞复苏及培养大鼠肾系膜细胞株复温后从水浴箱中取出冻存管,用75%乙醇喷洒消毒后开启,吸出细胞悬液,移入离心管内,缓慢加入7~8 mL含10%胎牛血清的细胞培养液,充分混匀,1 000 r/min离心5 min,弃上清液,加入适量细胞培养液,移入细胞培养瓶中培养,次日更换1次培养液继续培养。
1.4.2.2细胞传代将培养瓶置于37 ℃、5% CO2恒温培养箱培养,细胞生长至80%融合时行细胞传代。吸除瓶内旧培养液,以无菌常温PBS缓冲液冲洗1~2次,加入1 mL胰蛋白酶轻轻摇动培养瓶,消化1~3 min后把培养瓶放置于显微镜下观察,倒掉消化液,加入少量含胎牛血清的培养液终止消化反应。吸取瓶内培养液,反复轻轻吹打瓶壁细胞,1 000 r/min离心5 min,弃上清液,加入适量新培养液,等量分种于新培养瓶中。培养条件同前,每2~3 d更换培养液1次,待细胞生长至大部分融合时,可以再次传代,本实验选用3~10代的细胞。
1.4.2.3药物血清制备取健康雄性SD大鼠20只,自由饮食,适应性喂养4 d后,随机分为正常组5只、西药组3只、糖肾安低剂量组4只、糖肾安中剂量组4只、糖肾安高剂量组4只,西药组给予厄贝沙坦13.5 mg/(kg·d)灌胃,每天1次;糖肾安低、中、高剂量组大鼠分别给予糖肾安6 g生药/(kg·d)、18 g生药/(kg·d)、60 g生药/(kg·d)灌胃,上、下午各1次;正常组给予相应量的生理盐水灌胃,每天1次。各组均连续灌胃3 d,在末次灌胃1 h后以10%水合氯醛3 mL/kg腹腔注射麻醉,在无菌条件下经腹主动脉采血,3 000 r/min离心15 min分离血清,56 ℃水浴30 min灭活补体,分装-20 ℃冻存备用。
1.4.2.4药物血清培养细胞实验分为6组:模型组给予10%无药血清0.5 mL+30 mmol/L高糖培养基培养;正常组给予10%无药血清+5 mmol/L低糖培养基培养;糖肾安低剂量组给予10%低剂量血清0.5 mL+30 mmol/L(4.5 mL)高糖培养基培养;糖肾安中剂量组给予10%中剂量血清0.5 mL+30 mmol/L(4.5 mL)高糖培养基培养;糖肾安高剂量组给予10%高剂量血清0.5 mL+30 mmol/L(4.5 mL)高糖培养基培养;西药组给予10%厄贝沙坦血清0.5 mL+30 mmol/L高糖培养基培养。各组培养24 h后收集细胞。
1.4.3检测指标
1.4.3.1大鼠肾脏组织ICAM-1表达情况采用Western blot法检测。取100 mg肾皮质,加入细胞裂解液,冰浴下组织匀浆、离心;取组织裂解蛋白50 μg,经12%SDSPAGE垂直凝胶电泳后,电转移至PVDF膜;5%脱脂奶粉溶液室温封闭1 h;加一抗4 ℃过夜,加二抗室温2 h,以上两步后TBST洗膜10 min×3次;PVDF膜与显色剂反应后扫描,以GAPDH为内参用凝胶图像处理系统分析目标带的净光密度值。
1.4.3.2大鼠肾系膜细胞ICAM-1表达情况采用RT-PCR法检测。取大鼠肾系膜细胞1×107,按TransZol Up试剂盒提供方法提取总RNA,用蛋白核酸分析仪测定OD260和OD280值,计算总RNA纯度。取2.5 μL总RNA作为cDNA合成的模板。扩增参数:94 ℃ 3 min预变性,94 ℃ 30 s、56 ℃ 30 s、72 ℃ 1 min,3个循环后72 ℃延伸5 min。均取10 μL的PCR产物及DNA Marker DL2000标准比较物,置1.5%琼脂糖凝胶电泳,以5 V/cm电压电泳60 min。以凝胶分析系统拍摄、定性定量分析。
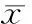
2 结 果
2.1各组大鼠肾脏组织中ICAM-1表达情况正常组肾脏组织中ICAM-1表达量为30.38±4.07,模型组为81.50±5.13,糖肾安低剂量组为67.63±7.46,糖肾安中剂量组为35.88±4.52,糖肾安高剂量组为17.13±2.95,西药组为55.25±5.80。模型组、糖肾安中剂量组、糖肾安低剂量组及西药组ICAM-1表达量均明显高于正常组(P均<0.05),糖肾安各组及西药组ICAM-1表达量均明显低于模型组(P均<0.05),糖肾安高剂量组ICAM-1表达量明显低于糖肾安中剂量组、糖肾安低剂量组及西药组(P均<0.05)。见图1。
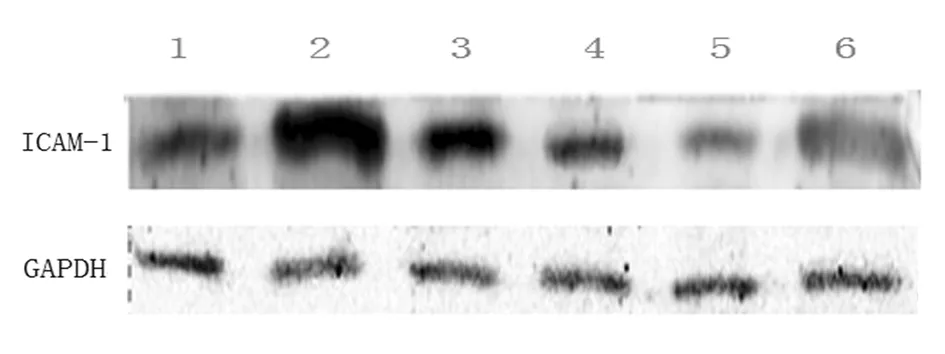
1为正常组;2为模型组;3为糖肾安低剂量组;4为糖肾安中剂量组;5为糖肾安高剂量组;6为西药组 图1 各组大鼠肾脏组织中ICAM-1表达情况
2.2各组大鼠肾系膜细胞ICAM-1表达情况正常组肾系膜细胞ICAM-1表达量为0.25±0.03,模型组为0.62±0.04,糖肾安低剂量组为0.38±0.04,糖肾安中剂量组为0.37±0.05,糖肾安高剂量组为0.30±0.04,西药组为0.31±0.03。各药物干预组ICAM-1表达量均明显高于正常组(P均<0.05),但明显低于模型组(P均<0.05);糖肾安高剂量组ICAM-1表达量明显低于糖肾安中剂量组、糖肾安低剂量组(P均<0.05),但与西药组比较差异无统计学意义(P>0.05)。见图2。
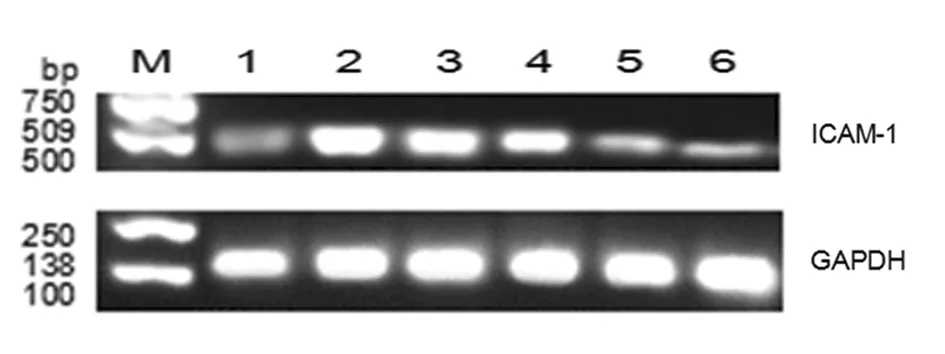
1为正常组;2为模型组;3为糖肾安低剂量组;4为糖肾安中剂量组;5为糖肾安高剂量组;6为西药组 图2 各组大鼠肾系膜细胞ICAM-1表达情况
3 讨 论
黏附分子是介导细胞间或细胞与细胞外基质间相互接触和结合的一类糖蛋白的统称,主要表达于细胞膜表面与细胞外基质中,它参与了机体的免疫应答、炎症发生及创伤愈合、细胞活化等一系列重要生理和病理过程。ICAM-1是其中一种重要的黏附分子,可促进白细胞与血管内皮细胞的黏附及渗出,扩大炎症反应,造成血管病变,导致组织器官发生病理生理的改变[6]。
在DKD发生发展中,ICAM-1可介导内皮细胞、单核细胞或巨噬细胞和淋巴细胞黏附,使炎性细胞游走到肾脏组织,产生细胞因子,增强白细胞的黏附,加重内皮细胞的损伤,造成血管通透性增强、蛋白漏出,形成蛋白尿[7],并引起细胞外基质沉积,肾小球和肾小管间质纤维化[8],因此ICAM-1作为一项重要的指标反映了DKD的早期病变,参与了DKD的发病机制[9]。有报道显示ARB类药物伊贝沙坦能阻止或延缓糖尿病大鼠肾脏的病理损害,降低ICAM-1mRNA的表达水平[10]。
澳大利亚学者通过动物实验发现,患有糖尿病的小鼠与健康小鼠相比,在8月龄时可出现蛋白尿、巨噬细胞浸润症状,而ICAM-1基因敲除的小鼠在6个月和8个月时尿蛋白分别下降77%和85%,肾小球肥大和肾小管损伤得到改善,并可延缓肾脏纤维化进展[11]。长期的临床研究表明,中医中药在防治和延缓DKD的发展上具有一定的作用[12-13]。本研究Western blot及RT-PCR法检测结果显示,ICAM-1在糖尿病模型组表达均明显增强,表明ICAM-1可能在高糖状态下被激活;给予糖肾安干预后,肾脏组织及肾系膜细胞ICAM-1表达量均明显降低。提示糖肾安可抑制高糖环境下糖尿病大鼠肾脏及肾系膜细胞炎性因子ICAM-1的表达,减轻肾脏组织病理学改变,其肾脏保护作用可能与抑制ICAM-1表达水平有关。
[1]Bloomgarden Zachary T. Diabetic nephropathy[J]. Diabetes Care,2008,31(4):823-827
[2]Seaquist ER,Ibrahim HN. Approach to the patient with type 2 diabetes and progressive kidney disease[J]. J C1in Endocrinol Metab,2010,95(7):3103-3110[3]Soetikno V,Sari FR,Veeraveedu PT,et al. Curcumin ameliorates macrophage infiltration by inhibiting NF-kappaB activation and proinflammatory cytokines in streptozotocin induced-diabetic nephropathy[J]. Nutr Metab,2011,8(1):35
[4]Tang SC,Leung JC,Lai KN. Diabetic tubulopathy:an emerging entity[J]. Contrib Nephrol,2011,170:124-134
[5]Fornoni A,Ijaz A,Tejada T,et al. Role of inflammation in diabetic nephropathy[J]. Curr Diabetes Rev,2008,4(1):10-17
[6]高若愚,曲竹秋,常柏. 抵挡汤对糖尿病肾病大鼠肾脏ICAM-1作用的影响[J]. 中国实验方剂学杂志,2012,18(12):143-145
[7]吕永曼,黄晓丽,易艳. 霉酚酸酯对糖尿病大鼠肾间质细胞浸润及肾组织ICAM-1和MCP-1 mRNA表达的影响[J]. 中华肾脏病杂志,2006,22(9):576-577
[8]Wang L J,Zhang L,Yu Y,et al. The protective effects of taurine against early renal injury in STZ-induced diabetic rats,correlated with inbibition of renal LOX-1 mediated ICAM-1 expression[J]. Ren Fail,2008,30(8):763
[9]Xiaoxia Pan,Jianfu Wang,Yanhua Pu,et al. Puerarin regulates kidney gene expression[J]. Med Sci Monit,2015,21:2134-2140
[10] 曾龙驿,舒冏,林可意,等. 伊贝沙坦对糖尿病大鼠肾氧化应激、NF-κB活性和ICAM-1 mRNA表达的影响[J]. 中山大学学报:医学科学版,2008,29(4):402-406
[11] Chow FY,Nikolic-Paterson DJ,Ozols E,et al. Intercelluar adhesion molecule-1 deficiency is protectice against nephropathy in type 2 diabetic db/db mice[J]. Jam Soc Nephrol,2005,16(6):1711-1722
[12] 李洁,杨洪涛,杨波,等. 益气养阴、活血通络法对糖尿病肾病(Ⅲ期)中医证候及尿蛋白影响的研究[J]. 中国中西医结合肾病杂志,2013,14(3):230-232
[13] 殷美琦,刘苏,余江毅. 中成药治疗糖尿病肾病蛋白尿的研究现状[J]. 中国中西医结合肾病杂志,2013,14(2):178-179
Effect of Tangshenan decoction on expression of inflammatory factor ICAM-1 of rat kidney and kidney mesangial cell in high sugar environment
HU Shuang1,WANG Mei2
(1.Liaoning University of Traditional Chinese Medicine,Shenyang 110032,Liaoning, China;2.The Affiliated Hospital of Liaoning University of Traditional Chinese Medicine,Shenyang 110032, Liaoning,China)
Objective It is to explore the effect of Tangshenan decoction on the expression of inflammatory factor ICAM-1 of rat kidney and kidney mesangial cell in high sugar environment. Methods Experiment I:50 SPF healthy SD rats were randomly divided into normal group and model building group,the rats in model building group were fed with high-sugar high-fat diet for 4 weeks,then they were given Streptozotocin by intraperitoneal injection one time to induce type 2 diabetes models.The rat models successfully established were randomly divided into model group,Tangshenan high,medium and low concentration groups,western medicine group which were treated with respective drugs for 8 weeks,then their kidney specimens were collected for observation.Experiment II: The rat renal mesangial cell lines after the thawing recovery were used to make cell suspension,then they were divided according to the method in experiment I. The cells were collected after every drug intervention group was cultured under respective drug-containing serum for 24 h. ICAM-1 expression was detected by Westernblot,RT-PCR. Results Experiment I:The expression of ICAM-1 in the model group,low and middle Tangshenan group,western medicine group were higher than that in normal group(P<0.05);that in Tangshenan groups and western medicine group were significantly lower than that in model group(P<0.05);that in Tangshenan high dose group was lower than that in middle and low dose of Tangshenan groups and western medicine group (P<0.05).Experiment II:The expression of ICAM-1 in every drug intervention group was higher than that in normal group but lower than that in model group(P<0.05);the expression in Tangshenan high dose group was lower than that in middle and low dose of Tangshenan groups(P<0.05). Conclusion Traditional Chinese medicine Tangshenan decoction could inhibit the expression of cell inflammatory factor ICAM-1 in rat kidney and kidney mesangial cell,relieve kidney tissue pathology change. The renal protective effect may be related to regulating ICAM-1 expression level.
Tangshenan decoction;kidney of rats;renal mesangial cells;ICAM-1
胡爽,女,在读硕士,从事中西医结合内分泌代谢研究工作。
王镁,E-mail:wm896464@163.com
沈阳市科技计划项目(F14-231-1-11)
10.3969/j.issn.1008-8849.2016.29.001
R-332
A
1008-8849(2016)29-3193-04
2016-04-25

