万古霉素血药浓度监测和肾毒性及临床疗效关系的研究
蔡云东,费爱华
(上海交通大学医学院附属新华医院,上海 200092)
万古霉素血药浓度监测和肾毒性及临床疗效关系的研究
蔡云东,费爱华
(上海交通大学医学院附属新华医院,上海 200092)

目的探讨万古霉素血药浓度与肾毒性之间的关系,对患者预后的影响及增加肾毒性的危险因素。方法选择符合标准的住院期间静脉用万古霉素且监测血药浓度的患者105例,收集患者性别、年龄、感染部位、科室分布情况、病原学检查情况等资料,统计万古霉素谷浓度、峰浓度及不同谷浓度下肾毒性发生率;根据万古霉素用药期间是否出现肾毒性分为肾损伤组与非损伤组,比较2组万古霉素谷浓度、峰浓度,用药前后血肌酐值、肌酐清除率,合并疾病情况,同时使用抗生素及其他药物情况。结果105例患者共行血药浓度监测125例次,谷浓度<20 mg/L与≥20 mg/L的肾毒性发生率分别为7.57%和46.15%,二者比较差异有统计学意义(P<0.05)。肾损伤组的谷浓度中位数达26.1 mg/L,非损伤组中位数13.2 mg/L,肾损伤组明显高于非损伤组(P<0.05);肾损伤组合并糖尿病比例和使用升压药比例均明显高于非损伤组(P均<0.05)。革兰阳性菌感染者40例经万古霉素治疗后,临床有效率为57.5%;细菌学清除率32.5%,未清除率20%,病原菌转为革兰阴性菌3例,未复查16例。结论高的万古霉素谷浓度可增加肾毒性的风险,谷浓度≥20 mg/L肾毒性发生率明显增加;若患者合并糖尿病或使用升压药,将增加肾毒性的风险。
万古霉素;肾毒性;谷浓度
万古霉素(Vancomysin)主要通过破坏细菌细胞壁肽聚糖的合成发挥作用,尤其对革兰阳性菌及对耐甲氧西林金黄色葡萄球菌(methicillin-resistant staphylococcus aureus,MRSA)感染具有较好的疗效[1]。该药具有一定的肾毒性、耳毒性,个体差异较大,且治疗指数小[2],合理应用万古霉素使血药浓度维持在安全有效的范围内,必须有效地监测万古霉素血药浓度,以制定个体化给药方案。研究证实万古霉素对金葡菌的药效与曲线下面积(area under concentration-time curve,AUC)与最低抑菌浓度(minimum inhibitory concentration,MIC)比值(AUC/MIC)有关[3],谷浓度作为AUC的替代指标,是监测万古霉素血药浓度最准确和实用的方法。美国医院药师协会、美国感染疾病协会和美国感染病药师协会2009年发布了“成人万古霉素治疗药物监测指南”,治疗谷浓度从5~10 mg/L 提高到10~20 mg/L,但同时该指南也指出,万古霉素谷浓度维持在15~20 mg/L的安全性有待进一步研究[4-5]。本研究通过采用回顾性研究方法,探讨万古霉素血药浓度与肾毒性之间的关系,对患者预后的影响及增加肾毒性的危险因素,以指导临床用药。
1 临床资料
1.1一般资料选择新华医院2013年7月1日—2015年8月31日住院期间静脉用万古霉素且监测血药浓度的患者105例,均符合以下标准: ①年龄≥18岁;②接受过静脉万古霉素抗感染治疗≥72 h;③监测万古霉素血药浓度。排除孕产妇者;万古霉素使用<72 h者;血液透析、腹膜透析者;信息资料不全或无法收集资料者。肾毒性判定标准[6]:比基础肌酐水平上升44.2 μmol/L或1.5~2倍;患者在起始用药至结束后72 h内,满足上述肾损伤标准至少2 d。根据万古霉素用药期间是否出现肾毒性分为肾损伤组与非损伤组。
1.2研究方法收集患者性别、年龄、感染部位、科室分布情况、病原学检查情况等资料,统计万古霉素谷浓度、峰浓度及不同谷浓度下肾毒性发生率;比较肾损伤组与非损伤组万古霉素谷浓度、峰浓度,用药前及用药5~7 d后血肌酐值、肌酐清除率,合并疾病情况,同时使用抗生素及其他药物情况。
1.3疗效判定标准根据卫生部颁发的《抗菌药物临床试验指导原则》判定疗效:①临床疗效。痊愈:症状、体征、实验室检查及病原学检查均恢复正常;显效:上述4项中有1项未完全恢复正常;进步:用药后病情有所好转;无效:用药72 h后病情无明显进步或有加重。痊愈、显效和进步总称为临床有效。②细菌学疗效。清除:治疗结束时培养阴性;未清除:治疗结束时培养仍阳性;替换:治疗结束时原致病菌消失,但培养出新的致病菌。
1.4统计学方法数据分析采用SPSS 19.0软件包进行。计量资料采用均数±标准差表示,组间比较采用t检验;计数资料比较采用2检验。P<0.05为差异有统计学意义。
2 结 果
2.1患者基本情况本组男72例(68.57%),女33例(31.43%);年龄(69.0±17.0)岁,其中<60岁者26例(24.76%),≥60岁者79例(75.24%)。ICU:急诊科21例,心胸外科8例,外科3例,老年科2例,神经外科1例;非ICU:急诊科36例,心胸外科9例,神经外科8例,骨科6例,呼吸内科2例,其他科室9例。
2.2患者感染部位肺部感染64例(60.95%),尿路感染12例(11.43%),皮肤软组织感染8例(7.62%),中枢感染5例(4.76%),关节腔感染2例(1.90%),肝脓肿2例(1.90%),肠道感染2例(1.90%),感染性心内膜炎2例(1.90%),胆囊炎1例(0.95%),导管相关感染1例(0.95%),合并感染13例(12.38%)。肺部感染所占比例最高,其次为尿路感染。
2.3患者病原学检查105例患者中有25例未检出病原菌;余80例共检出病原菌109株,其中革兰阳性菌59株(54.13%),以MRSA感染为主,药敏试验提示均敏感,MIC<0.5 μg/mL 11株(18.64%),MIC 1 μg/mL 43株(72.88%),MIC 2 μg/mL 5株(8.47%)。105例患者病原学检查结果见表1。
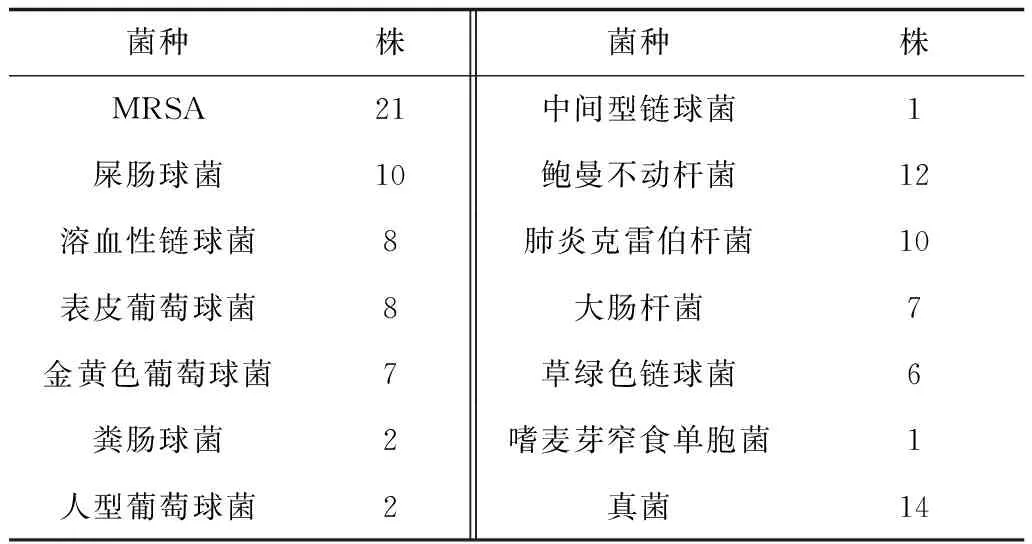
表1 病原学检查结果
2.4万古霉素血药浓度与肾毒性关系本研究105例患者行万古霉素谷浓度监测125例次,峰浓度监测122例次。万古霉素谷浓度为(17.2 ±0.2)mg/L,峰浓度为(33.4±16.6)mg/L。行2次以上监测者占19.05%(19例),首次监测血药浓度过高、过低者分别占49.52%(52例)及29.52%(31例)。谷浓度<10 mg/L、10~20 mg/L、>20~30 mg/L、≥30 mg/L肾毒性发生率分别为4.0%(1/25),9.76%(4/41),42.86%(15/35)和75.00%(3/4)。谷浓度<20 mg/L与≥20 mg/L的肾毒性发生率分别7.57%(5/66)和46.15%(18/39),二者比较差异有统计学意义(P<0.05)。
2.5肾损伤组和非损伤组万古霉素谷浓度、峰浓度及用药前后血肌酐值、肌酐清除率比较2组年龄及用药前血肌酐值、肌酐清除率比较差异均无统计学意义(P均>0.05);肾损伤组用药后血肌酐值显著高于非损伤组(P<0.05),肌酐清除率明显低于非损伤组(P<0.05);肾损伤组的万古霉素谷浓度和峰浓度均显著高于非损伤组(P均<0.05)。见表2。
2.6肾损伤组和非损伤组合并疾病及联合用药情况肾损伤组合并糖尿病比例和使用升压药比例均明显高于非损伤组(P均<0.05);2组合并高血压及恶性肿瘤比例,使用抗生素、利尿剂、他汀类及ACEI/ARB药物比例比较差异均无统计学意义(P均>0.05)。见表3。
2.7革兰阳性菌感染者万古霉素治疗疗效40例证实革兰阳性菌感染者经万古霉素治疗后临床有效23例(57.5%),无效17例(42.5%);细菌学清除13例(32.5%),未清除8例(20%),病原菌转为革兰阴性菌者3例,未复查者16例。
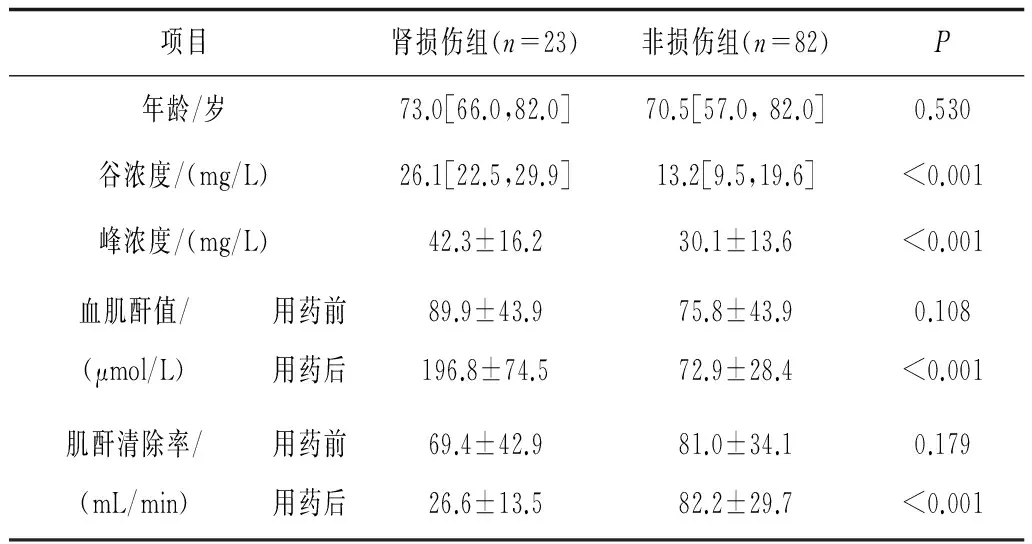
表2 肾损伤组和非损伤组万古霉素谷浓度、峰浓度及 用药前后血肌酐值、肌酐清除率比较
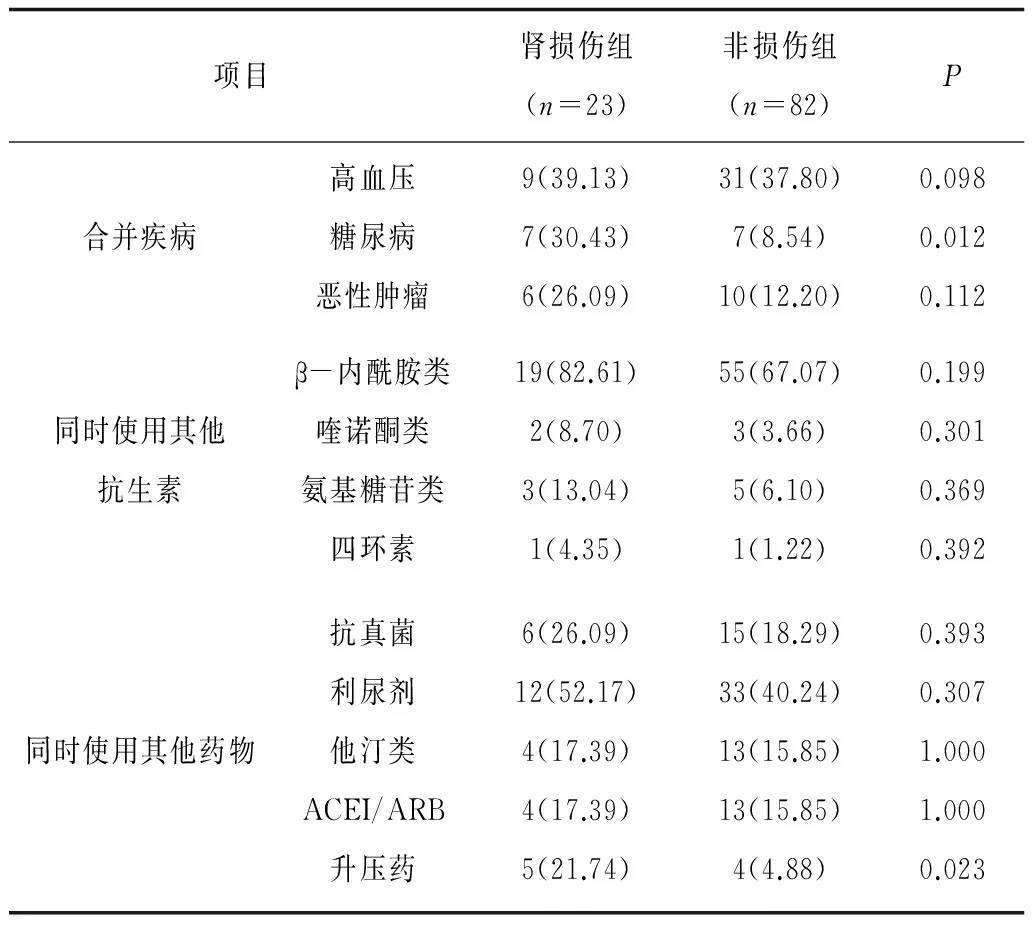
表3 肾损伤组和非损伤组合并疾病及 联合用药情况 例(%)
注:ACEI为血管紧张素转换酶抑制剂;ARB为血管紧张素受体拮抗剂。
3 讨 论
本研究中,血药浓度送检率前3位的是急诊科、心胸外科和神经外科,占总数的79.05%;有55.28%的标本来源于急诊科,提示较高的送检率可能与急诊科收治的患者年龄较大、基础疾病较多、肾毒性风险较高等特点有关。总病例中年龄≥60岁者占75.24%,提示我院对老年人使用万古霉素的安全性比较重视,也符合了美国感染病学会(IDSA)发表的《成人金黄色葡萄球菌(金葡菌)感染万古霉素治疗与监测实践指南》建议常规检测TDM的适应证[7]。谷浓度10~20 mg/L者占44.0%,说明我院使用万古霉素的患者仍有一半以上未能达到指南推荐要求,提示加强血药浓度监测的必要性。总病例中行2次以上监测者占19.05%,首次监测血药浓度过高、过低者分别占49.52%及29.52%,经调整万古霉素剂量后复测谷浓度,有50%的患者达到推荐浓度范围,说明通过血药浓度监测,及时调节万古霉素剂量及时间间隔,可达到推荐的浓度范围。Rybak[8]认为万古霉素谷浓度为4~5倍MIC时有较好的细菌清除率。2006年临床实验室标准化协会(Clinical and Laboratory Standard Institute,CLSI)修改了万古霉素对金葡菌的MIC折点:敏感从≤4 μg/mL降为≤2 μg/mL[9]。本研究共检出病原菌109株,其中革兰阳性菌59株,以MRSA感染为主,药敏试验MIC均≤2 μg/mL,说明我院对于革兰阳性菌感染尤其MRSA感染,万古霉素作为首选抗生素,用药期间及用药后均未发现耐药情况及MIC上升趋势。
万古霉素对葡萄球菌属细菌抗生素后效应为1~2 h[10],应用剂量过高反而会增加毒副作用。2009年发布的“成人万古霉素治疗药物监测指南”指出血药谷浓度维持在15~20 mg/L的安全性资料有限[3-4]。本研究中谷浓度<20 mg/L与≥20 mg/L的肾毒性发生率分别为7.57%和46.15%,肾损伤组的万古霉素血药浓度显著高于非损伤组。可见高的万古霉素谷浓度会增加肾毒性风险,随着谷浓度的升高,肾毒性的发生率有升高趋势,尤其谷浓度≥20 mg/L的患者,肾毒性明显增加。有研究表明,万古霉素肾毒性发生率与联用血管升压药、利尿剂、氨基糖苷类抗生素等药物,合并恶性肿瘤、糖尿病及患者的年龄、体质量、体质状况等相关[11]。本研究中肾损伤组合并糖尿病比例、升压药使用比例均明显高于非损伤组,提示患有糖尿病或使用血管升压药可增加肾毒性的风险,可能与糖尿病患者感染不易控制及肾功能可能受到影响有关;对于使用血管升压药的患者,提示自身循环支持能力较差,各脏器灌注不足,药物易在体内蓄积,易增加肾脏负担,提醒临床医师此类患者需加强对肾功能监测。而2组合并高血压、恶性肿瘤比例,联合应用抗生素、他汀类及ACEI/ARB药物比例比较差异均无统计学意义,与文献[3]相关报道不符,可能因本研究样本量小、合并药物使用的剂量及时间不同、相关疾病严重程度不同有关,但临床上仍需关注此类患者。本研究中达到细菌学清除占32.5%,未清除占20%,临床有效占57.5%,提示由于影响万古霉素临床疗效因素较多,个体差异大,临床上容易疗效不佳。
综上所述,万古霉素已广泛用于治疗耐甲氧西林金黄色葡萄球菌和其他革兰阳性菌感染,应加强监测血药浓度,综合分析多方面因素,特别是老年人、合并糖尿病者、联合使用升压药物者,应适当调整给药方案,以提高疗效并尽可能减少不良反应的发生。但本研究是单中心回顾性研究,存在样本量不够大、不能准确反映人群情况,入选者为成人,且未涉及血液透析者及孕产妇,对此类患者并无指导意义等不足,有待今后对万古霉素安全使用进一步研究。
[1]Levine DP. Vancomycin:A history[J]. Clin Infect Dis,2006,42 (Suppl 1):S5-12
[2]Vandecasteele SJ,De Bacquer D,De Vriese AS. Implementation of a dose calculator for vancomycin to achieve target trough levels of 15-20 microg/mL in persons undergoing hemodialysis[J]. Clin Infect Dis,2011,53(2):124-129[3]Moise-Broder PA,Forrest A,Birmingham MC,et al. Pharmacodynamics of vancomycin and other antimicrobials in patients with Staphylococcus aureus lower respiratory tract infections[J]. Clin Pharmacokinet,2004,43(13):925-942
[4]Rybak M,Lomaestro B, Rotschafer JC,et al. Therapeutic monitoring of vancomycin in adult patients: a consensus review of the American Society of Health-System Pharmacists, the Infectious Diseases Society of America, and the Society of Infectious Diseases Pharmacists[J]. Am J Health Syst Pharm,2009,66(10):887
[5]Cervera C,Castaeda X,de la Maria CG,et al. Effect of vancomycinminimal inhibitory concentration on the outcome of methicillin-susceptible Staphylococcus aureus endocarditis[J]. Clin Infect Dis,2014,58(12):1668-1675
[6]Mehta RL,Kellum JA,Shah SV,et al. Acute KidneyInjury Network:Acute kidney injury network:report of an initiative to improve outcomes inacute kidney injury[J]. Crit Care, 2007, 11(2):R31
[7]Liu C,Bayer A,Cosgrove SE,et al. Clinical practice guidelines by the infectious diseases society of america for the treatment of methicillin-resistant Staphylococcus aureus infections in adults and children: executive summary[J]. Clin Infect Dis, 2011,52(3):285-292
[8]Rybak MJ. The pharmacokinetic and pharmacodynamic properties of vancomycin[J]. Clin Infect Dis, 2006,42 (Suppl 1):S35-39
[9]Tenover FC,Moellering RC Jr. The rationale for revising the Clinical and Laboratory Standards Institute vancomycin minimal inhibitory concentration interpretive criteria for Staphylococcus aureus[J]. Clin Infect Dis,2007,44(9):1208-1215
[10] 汪复,张婴元. 实用抗感染治疗学[M]. 北京:人民卫生出版社,2004:3-75
[11] Minejima E,Choi J,Beringer P,et al. Applying new diagnostic criteria for acute kidney injury to facilitate early identification of nephrotoxicity in vancomycin-treated patients[J]. Antimicrob Agents Chemother,2011,55(7):3278-3283
Analysis the relationship between vancomycin serum concentration and nephrotoxicity or clinical efficiency
CAI Yundong,FEI Aihua
Xin Hua Hospital Affiliated to Shanghai Jiao Tong University School of Medicine
Objective It is to explore the relationship between vancomycin blood concentration and nephrotoxicity, effect on prognosis of patients, and the risk factors for nephrotoxicity. Methods 105 patients according to standard who were treated with vancomycin by intravenous medication during hospitalization and accepted blood concentration determination were selected, their data included age, gender, infection site, department distribution and etiological examination were collected, valley concentration and peak concentration of vancomycin and the occurrence rate of nephrotoxicity were counted. The patients were divided into renal damage group and nonrenal damage group according whether having nephrotoxicity or not during treatment. Valley concentration and peak concentration of vancomycin, serum creatinine (SCr), creatinine clearance(Ccr), the disease complicated and medication of antibiotics or other drugs between the two groups were compared. Results There were 125 cases of 105 patients who were monitored vancomycin in the hospital. The occurrence rates of renal toxicity of valley concentration <20 mg/L and ≥20 mg/L were 7.57% and 46.15% respectively, the difference was statistically significant(P<0.05). Median concentration up to 26.1mg/L in nephrotoxicity group, which was higher than the concentration which was up to 13.2mg/L in non-nephrotoxicity group. The proportion of complicating diabetes and medication with vasopressors in nephrotoxicity group was statistically higher than that in non-nephrotoxicity group. The clinical effective rate was 57.5%, the rate of bacteria clearance was 32.5%, no clearance rate was 20% in 40 patients with gram positive bacterial infection in which 3 patients' infection transform to negative injection, 16 patients had no reexamination. Conclusion High vancomycin serum concentration increases the risk of nephrotoxicity, when the concentration was more than 20 mg/L, the incidence of nephrotoxicity significantly increased. complicating with diabetes or the medication of vasopressors will increase the risk of nephrotoxicity.
vancomycin ; nephrotoxicity; trough concentration;
蔡云东,男,在读硕士,研究方向为脓毒血症。
费爱华,E-mail:feiaihua@medmail.com.cn
上海市科学技术委员会基金项目(13ZR1426500);2013—2014年度国家临床重点专科建设项目
10.3969/j.issn.1008-8849.2016.29.003
R969
A
1008-8849(2016)29-3199-04
2016-04-30

