对菲林试剂检验还原糖实验常见问题的讨论
魏植槐 顾秀秀
对菲林试剂检验还原糖实验常见问题的讨论
魏植槐顾秀秀
一、实验概述
人教版《生物(必修一)》中提及,菲林试剂由甲液(质量浓度为0.1g/mL的NaOH溶液)和乙液(质量浓度为0.05 g/mL的CuSO4溶液)等量混合均匀而成,检验还原糖时必须现配现用。实验时待测组织样液为2 mL,菲林试剂为1 mL,在50℃~60℃温水中加热约2 min即可得到砖红色沉淀[1]。
二、相关问题讨论
1.菲林试剂为什么要现配现用?能否静置一段时间后再使用?
实际上,菲林试剂并非需要现配现用。有研究者取久置一周的菲林试剂的上层清液与还原糖反应,依旧能得到砖红色沉淀,现象明显[2]。另外,文献[3]指出,高浓度的葡萄糖溶液能溶解Cu(OH)2沉淀,之后加热,同样可得到砖红色沉淀;然而此种方法存在弊端:加热过程中Cu(OH)2会析出,继而分解产生黑色CuO,掩盖实验现象的同时阻断反应。总之,现阶段教材强调菲林试剂需要现配现用并不准确。
教材之所以依旧强调现配现用,一是科学教育相关内容存在滞后性,二是受限于学生现阶段的认知水平。为了符合学生的认知规律,教材对这一方面的内容模糊处理,符合发展性教学原则,具有合理性。但是作为教师,则必须明白个中缘由。
(1)菲林试剂中与还原糖反应的有效成分是什么?为什么?
配置菲林试剂时要求NaOH过量,这是因为新生成的Cu(OH)2沉淀能进一步和OH—络合,生成[Cu(OH)4]2—,反应方程式为:Cu(OH)2+2OH—=[Cu(OH)4]2—。[Cu(OH)4]2—氧化还原糖,生成砖红色沉淀,其反应方程式如下:
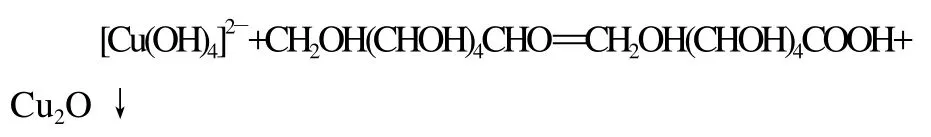
由于K[Cu(OH)4]2—=3×10-23,所以络合物[Cu(OH)4]2—非常稳定,保证了还原糖的氧化反应为均相反应,速度快,现象明显。
(2)Cu2+或者Cu(OH)2不能直接与还原糖发生氧化还原反应吗?
Cu2+在水溶液中会发生水解,只存在于偏酸性环境下。从电极电位看:
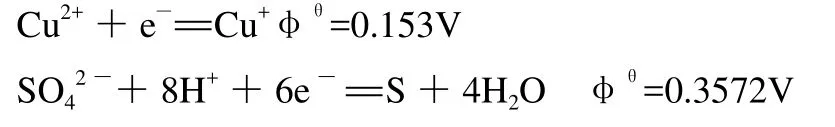
由电极电位可知,此时SO42—起氧化作用,因此,Cu2+不是有效成分[4]。而φθCu(OH)2/Cu2O=—0.080 V,即Cu2+的氧化能力比Cu(OH)2强,所以Cu(OH)2也不是有效成分。综上,Cu2+和Cu(OH)2由于氧化能力不够,无法氧化还原糖。
2.为什么要保证在碱性环境下反应?还原糖被氧化的机理是什么?
文献[5]、文献[6]指出,决定还原糖的氧化过程是糖的烯醇化(以葡萄糖为例,转化过程如图1所示),即还原糖在碱性条件下转化为烯二醇负离子,再被[Cu(OH)4]2-中的Cu2+氧化成羧酸(反应机理如图2所示),烯醇化速率越快,反应越容易进行。
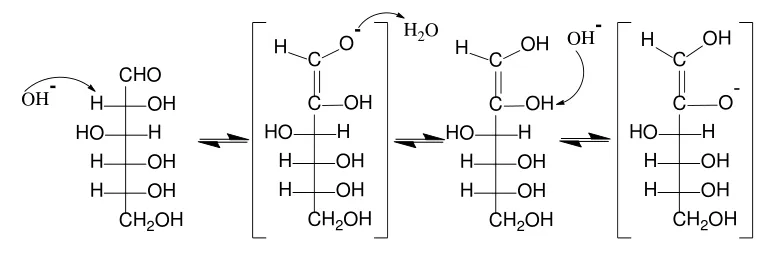
图1 葡萄糖的烯醇化
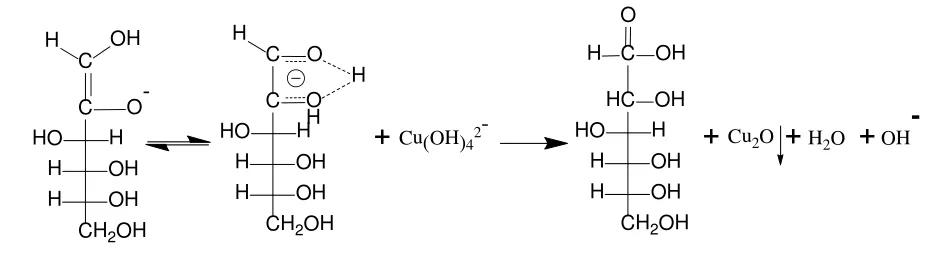
图2 烯二醇负离子与[Cu(OH)4]2-的反应机理
综上,碱性条件能确保还原糖烯醇化成为烯二醇负离子,也确保了[Cu(OH)4]2—的稳定存在。而从生成物的角度,由于Cu2O在偏酸性条件下会迅速发生歧化反应,生成Cu2+和金属Cu,因此也要求体系是碱性环境。
3.什么是还原糖?果糖为什么也属于还原糖?
从字面上理解,还原糖是具有还原性的糖类。由以上分析可知,能发生烯醇化,即含有醛基或者羰基的单糖,均属于还原糖。另外,含醛基或羰基的二糖也属于还原糖。
葡萄糖与果糖在碱性环境下可以相互转化(如图3所示)。碱性的环境下,果糖也可以发生烯醇化,且速率远大于葡萄糖的烯醇化速率[5,6],因此能与菲林试剂发生反应生成砖红色沉淀。这也佐证了NaOH过量有利于还原糖的检测的观点。
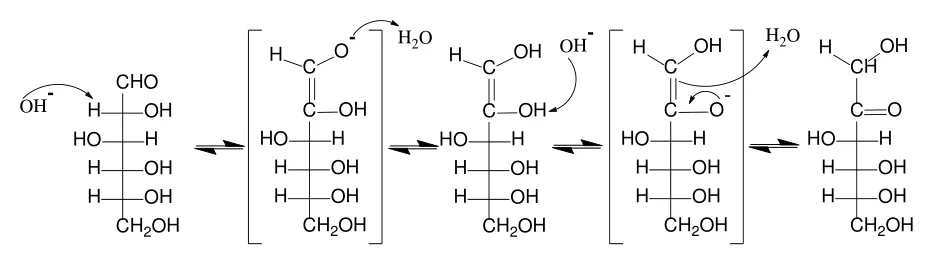
图3 葡萄糖与果糖之间的相互转化
4.为什么要使用水浴加热
笔者通过多次实验发现,有两种情况,直接在酒精灯外焰上加热也能成功。一种是加大还原糖的浓度并在加热前不断振荡,使反应物混合均匀;另一种是在教材原有基础上,使NaOH大大过量。第一种的实验重复率不高,不时会出现黑色沉淀;而第二种则能稳定看到砖红色沉淀。第一种情况是因为高浓度的还原糖能溶解Cu(OH)2,然而强加热的条件下容易析出Cu(OH)2固体,继而分解产生CuO[3]。第二种情况是因为NaOH大大过量,溶液中的Cu(OH)2全部转化为[Cu(OH)4]2—,有较高的热稳定性,保证了反应的顺利进行。
教材之所以强调水浴加热,是因为所用NaOH不仅浓度较低,量也偏小,Cu(OH)2固体依旧存在于体系中,此时使用水浴加热,较为温和,能有效避免受热不均带来的氢氧化铜分解,防止出现黑色的CuO。另外,按照教材所给的量而言,水浴加热能提高实验的成功率,具有非常好的重复性,能保证中学课堂实验的高效进行。那为什么有时候加热无法得到砖红色沉淀,也没有黑色的CuO沉淀生成?
当所用NaOH的量较少时,会发生以下反应:
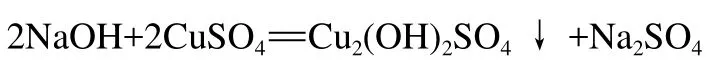
Cu2(OH)2SO4的热稳定性高,水浴加热条件下不易发生分解,也不与还原糖反应。在这种情况下,可以判定试验所加NaOH的量不足,或者是试剂已经变质了。
三、实验改进建议
根据反应机理,只要保证还原糖烯醇化的正常进行以及[Cu(OH)4]2—的存在,实验就能顺利进行。为了保证实验具有较高的重复率,建议在确保试剂不变质的条件下,加大碱和还原糖的用量。另外,为了保证反应平稳进行且受热均匀,建议使用沸水浴加热。
[1] 人民教育出版社生物室.全国普通高级中学教科书生物1册[M]:北京:人民教育出版社,2003.
[2] 杨晓东.新制氢氧化铜若干问题的探究[J].化学教学,2012(9):53-55.
[3] 段昌平.细说氢氧化铜与新制氢氧化铜[J].化学教育,2010,31(12):76-77.
[4] 张应红.新制氢氧化铜与乙醛反应的再研究[J].化学教育,2007(8):51-52.
[5] 张殷全.还原糖试验与烯醇化的关系[J].大学化学,1990,5(6):11-13.
[6] 杨旭东.为什么果糖比葡萄糖的银镜反应速率快[J].化学教学,2006(6):63-64.
魏植槐,在读硕士研究生,中教二级。新疆乌鲁木齐市第一中学,830002
顾秀秀,在读硕士研究生,中教二级。新疆师范大学附属中学,830000

