海带多糖酶法降解及其产物生物活性的研究
谢瑾,林宗毅,王智荣,张少敏,崔春,*
(1.华南理工大学食品科学与工程学院,广东广州510640;2.广东环境保护职业技术学院,广东广州528216)
海带多糖酶法降解及其产物生物活性的研究
谢瑾1,林宗毅1,王智荣1,张少敏2,崔春1,*
(1.华南理工大学食品科学与工程学院,广东广州510640;2.广东环境保护职业技术学院,广东广州528216)
以酸法提取的海带多糖为原料,分别用胰酶、果胶酶、木瓜蛋白酶、纤维素酶及植物水解蛋白酶对海带多糖进行降解,并测定了酶解产物的抗氧化性及胆酸盐吸附率。研究表明,酶解处理显著提高了其ABTS自由基清除能力和还原力,但降低了海带粗多糖的胆酸盐吸附能力和DPPH自由基清除力。其中胰酶和木瓜蛋白酶酶解分别使LPA-C[在液料比30∶1(mL/g),pH2.0,提取时间3h,温度120℃条件下提取所得的多糖]的ABTS IC50值由空白样的1.01 mg/mL,下降为0.80 mg/mL和0.89 mg/mL;还原力A0.5值(还原力吸光值为0.500时的样品浓度)从1.61 mg/mL下降到1.51 mg/mL和1.53mg/mL;使LPA-Y[在液料比25∶1(mL/g),pH2.0,提取时间2h,温度100℃条件下提取所得的多糖]的ABTSIC50值从3.55mg/mL下降为2.23mg/mL和2.88mg/mL;还原力A0.5值从9.56mg/mL下降到5.50mg/mL和4.69mg/mL。
海带多糖;柠檬酸提取;酶解;抗氧化性;胆酸盐吸附能力
海带是一种具有食用和药用的大型经济海藻,生长快、产量高,富含维生素、氨基酸、微量元素和矿物质等营养元素及多糖类物质,其含有的多糖成分具有多种生理功能[1]。相关研究表明,海带多糖的生物活性功能主要包括免疫调节、抗菌抗病毒、抗血凝和降血脂等[2]。海带中主要有3种多糖,即褐藻胶(algin)、褐藻糖胶(fucoidan)和褐藻淀粉(laminaran),褐藻胶和褐藻糖胶是细胞壁的填充物质,而褐藻淀粉存在于细胞质中。相关研究表明,褐藻胶是褐藻共有的一种细胞间多糖,由α-1,4-β古罗糖醛酸(G)和β-1,4-D甘露糖醛酸(L)为单体构成的嵌段共聚物;褐藻糖胶是褐藻细胞壁外层含有的特殊藻胶,是褐藻细胞分泌产生的黏性物质,是α-L岩藻糖4-硫酸酯组成的多聚物;褐藻淀粉,也是一种细胞内多糖,主要由β-1,3-D葡萄糖组成[3]。诸多文献报道,植物多糖经过酶法降解后,生理活性显著提高[4],如贾俊强等[5]用α-淀粉酶对蛹虫草多糖进行酶解,夏新奎[6]等利用α-淀粉酶对3种分级薤白多糖进行酶法修饰,最后均发现,经酶法修饰后的多糖的抗氧化活性都得到了显著地提高。
本试验以两种柠檬酸法提取海带粗多糖为原料,分别采用胰酶、果胶酶、木瓜蛋白酶、纤维素酶及植物水解蛋白酶对粗多糖进行酶法降解,并考察其产物的抗氧化性及胆酸盐吸附率。本研究可为功能性海带多糖的开发提供理论指导。
1 材料与方法
1.1材料与仪器
海带:采购于广西北海,清洗后晒干,粉碎过40目筛,置于干燥器中储存备用;柠檬酸、葡萄糖、过硫酸钾、三氯乙酸、无水乙醇、磷酸二氢钠、磷酸氢二钠、糠醛等(分析纯):广州市金华大化学试剂有限公司;浓硫酸(分析纯):江苏强盛功能化学股份有限公司;Trolox、DPPH、ABTS荧光素钠盐(FL)等(分析纯:美国Sigma公司;胰酶(45 000 U/g):重庆市全新祥盛生物制药有限公司;果胶酶(35 000 U/g)、纤维素酶(120 000 U/g):潍坊康地恩生物科技有限公司;木瓜蛋白酶(500000U/g):美国Sigma公司;植物水解蛋白酶(50 000 U/g):广州邦铭贸易有限公司。
酶标仪:美国Thermo公司;DFT200型手提式高速万能粉碎机:温岭市林大机械有限公司;GT7C2A立式杀菌锅:温州市安福防腐机械厂;pHS-3E型pH计:北京雷磁仪器公司;GL-21M高速冷冻离心机:长沙湘仪离心机仪器有限公司;RE-52AA旋转蒸发仪:上海生物有限公司;Unico UV-2000型紫外可见分光光度计:尤尼科仪器有限公司;电热恒温水浴锅:上海福玛实验设备有限公司。
1.2试验方法
1.2.1制备粗海带多糖
海带干粉→按液料比30∶1(mL/g)加入柠檬酸溶液(pH=2),温度120℃,提取3 h→取上清液,用氢氧化钾调pH至中性→浓缩→醇沉(乙醇最终浓度为80%)→4℃静置8 h→取沉淀物→复溶沉淀物→海带柠檬酸提多糖溶液LPA-C
海带干粉→按液料比25∶1(mL/g)加入柠檬酸溶液(pH=2),温度100℃,提取2 h→取上清液,用氢氧化钾调pH至中性→浓缩→醇沉(乙醇最终浓度为80%)→4℃静置8 h→取沉淀物→复溶沉淀物→海带柠檬酸提多糖溶液LPA-Y
1.2.2海带粗多糖的酶解
参照游丽君等[7]的方法将LPA-Y及LPA-C配置成5 mg/mL的浓度,取50 mL置于锥形瓶中,调节pH至各种酶的最优pH[1,8-9](胰酶pH7.5,果胶酶pH4.2,木瓜蛋白酶pH6.0,植物水解酶蛋白酶pH3.4,纤维素酶pH5.0)。分别加入样品所含多糖质量1%的胰酶、果胶酶、木瓜蛋白酶、纤维素酶及植物水解蛋白酶及不添加酶(空白)。在50℃中水浴振荡,水解4 h,在沸水浴中加热灭酶10 min,冷却离心(4 800 r/min,20 min)后取上清液即为多糖酶解液样品。
1.2.3ABTS自由基清除能力测定
将等量混合ABTS水溶液(14 mmol/L)和过硫酸钾K2S2O8水溶液(4.9 mmol/L),在室温避光条件下静置12 h~16 h。测定时,用50%乙醇溶液将ABTS稀释,使其在734 nm时吸光度在0.70±0.02范围内,形成ABTS自由基测定液。将0.1 mL样品用ABTS自由基测定液稀释至3 mL,准确振荡30 s,测定在30℃下反应20 min后在734 nm处的吸光值Ai。对照组A0是以0.1 mL水作同样处理[10-11]。清除率/%=(1-Ai/A0)×100
1.2.4还原力测定
将2 mL磷酸盐缓冲液(pH6.6)和2 mL 1%(g/mL)的铁氰化钾溶液混合,再加入2 mL样品或2 mLTrolox。将混合物在50℃下保温20 min后加入2 mL 10%(g/mL)的TCA,混合后以3 000 r/min离心10 min,取上清液2 mL与2 mL蒸馏水以及0.4 mL 0.1%(g/mL)氯化铁在试管中反应,静置10 min后测定其在700 nm处的吸光度值[10]。用A0.5(还原力吸光值为0.500时的样品浓度)表示还原力大小。
1.2.5胆酸盐吸附率测定
参照周小理等[11]的方法,做适当修改。准确配置浓度为0、0.4、0.8、1.2、1.6、2 mg/mL的胆酸盐标准溶液。分别移取胆酸盐标准液1 mL于具塞试管中,加入6 mL 45%硫酸,混匀,加入1 mL0.3%糠醛,混匀,置65℃恒温水浴中反应30 min,冷却至室温后,于620 nm波长处测吸光度,绘制标准曲线。配制4 mg/mL牛磺胆酸钠溶液,加入2 mg/mL的多糖样品,以蒸馏水作为空白对照,于37℃恒温下反应1 h后,5 000 r/min离心分离10 min。准确移取1 mL上清液,进行胆酸盐含量的测定,于620 nm波长处测吸光度,由标准曲线确定其胆酸盐的质量浓度。再根据添加多糖样品及空白溶液中胆酸盐的浓度差计算苦荞水溶性蛋白纯化物对胆酸盐的吸附量。
1.2.6DPPH自由基清除能力测定
参照Blois等[12]的方法,并进行一定的修改。配制DPPH自由基的乙醇溶液(0.2 mmol/L,溶于无水乙醇),并将海带多糖溶液按一定的梯度稀释。将2 mL DPPH及2 mL海带多糖稀释溶液在试管振荡混匀,在室温下避光静置30 min,在517 nm处测量其吸光度值Ai;用2 mL无水已醇与2 mL蒸馏水充分震荡混匀调零;对照试验以2 mL DPPH与2 mL无水乙醇震荡混匀在测定波长517 nm处的吸光度值Ac,2 mL海带多糖溶液和2 mL无水乙醇震荡混匀后的吸光值为Aj。海带多糖对DPPH自由基清除能力用清除率R表示:R/%=[1-(Ai-Aj)/Ac]×100。IC50值为自由基清除率R达到50%时的样品浓度。
2 结果与分析
2.1海带多糖酶解对ABTS自由基清除能力的影响ABTS自由基清除法被广泛用于生物样品的总抗氧化能力测定。酶解对LPA-C和LPA-Y的ABTS自
由基清除率的影响见图1、图2。

图1 酶解对LPA-C的ABTS自由基清除率的影响Fig.1The effect of enzymatic hydrolysis on ABTS radical scavenging activity rate of LPA-C
由图1和图2可知,从LPA-C和LPA-Y两个的空白样的IC50值分别为1.01 mg/mL和3.54 mg/mL。胰酶和木瓜蛋白酶显著降低了LPA-C和LPA-Y的ABTS IC50值,即大幅增强了其ABTS自由基的清除能力。纤维素酶对LPA-C的ABTS自由基清除能力的提高较对LPA-Y的明显,果胶酶和植物水解酶对LPAY的ABTS自由基清除效果仅略差于胰酶和木瓜蛋白酶,但对LPA-C的ABTS自由基清除能力并没有显著性的影响。据相关文献报道[13],用蛋白酶水解多糖,不易破坏多糖的立体结构和生物活性,同时能使糖蛋白和蛋白聚糖中游离的蛋白质水解,可得到纯度较高的多糖,有利于提高多糖的抗氧化活性。

图2 酶解对LPA-Y的ABTS自由基清除率的影响Fig.2The effect of enzymatic hydrolysis on ABTS radical scavenging activity rate of LPA-Y
2.2海带多糖酶解对还原力的影响
抗氧化剂是通过自身的还原作用给出电子而清除自由基的,还原能力越强,抗氧化性越强,因此可通过测定还原能力来说明抗氧化活性的大小[14]。酶解对LPA-C和LPA-Y的还原力影响见图3、图4。
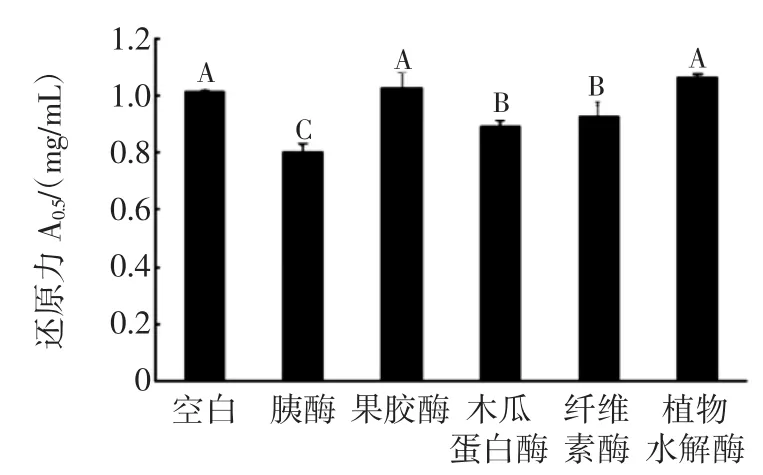
图3 酶解对LPA-C的还原力的影响Fig.3The effect of enzymatic hydrolysis on reducing power of LPA-C

图4 酶解对LPA-Y的还原力的影响Fig.4The effect of enzymatic hydrolysis on reducing power of LPA-Y
由图3可知,酶解对于LPA-C还原力的影响与ABTS自由基清除能力的影响结果类似,胰酶、木瓜蛋白酶和纤维素酶对LPA-C的还原力提高效果远高于其他两种酶,其酶解多糖的A0.5值分别从空白的1.61 mg/mL下降到1.51、1.53 mg/mL和1.54 mg/mL。图4中可看出,5种酶作用海带多糖后,其还原力都出现了较为明显的提升,其中胰酶、木瓜蛋白酶和纤维素酶的作用效果最为明显,胰酶样和木瓜蛋白酶样A0.5值分别为5.50、4.69 mg/mL,相比空白下降了近一半。因此,结合ABTS自由基清除能力的测定结果可推测,pH可能影响了酶解效果,同时酶自身催化活性及酶解位点不同,也会使得水解后的多糖分子结构和分子量大小存在差异,表现出不同的抗氧化能力。酸提取后的多糖多为杂多糖,纯度不高,即多糖与蛋白质或者其他物质结合在一起[15],经蛋白酶、纤维素酶及果胶酶等水解后,能获得纯度较高的低分子多糖,相应的抗氧化活性也得到改善。
2.3多糖酶解对胆酸盐吸附能力的影响
胆酸盐吸附率考察的是活性物质与肠道内胆汁酸结合形成络合物的能力[16]。酶解对LPA-C和LPA-Y胆盐吸附率的影响见图5、图6。

图5 酶解对LPA-C胆酸盐吸附率的影响Fig.5The effect of enzymatic hydrolysis on cholate adsorption rate of LPA-C
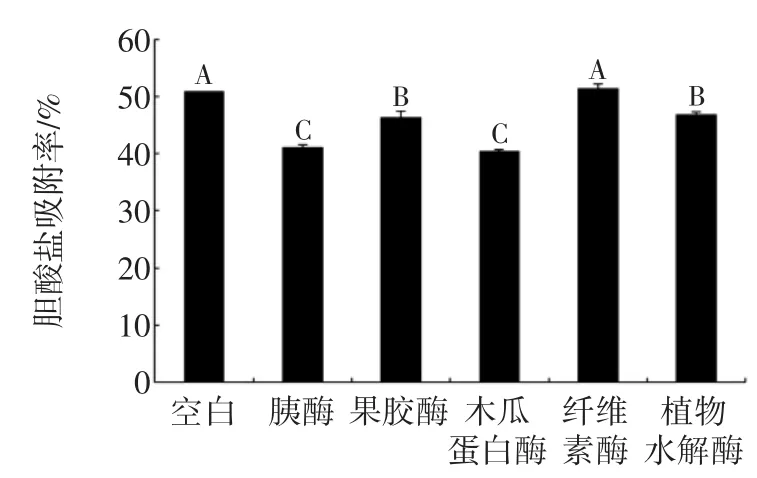
图6 酶解对LPA-Y胆酸盐吸附率的影响Fig.6The effect of enzymatic hydrolysis on cholate adsorption rate of LPA-Y
由图5可知,LPA-C经过不同酶的酶解处理以后,胆酸盐吸附率均出现了不同程度的下降,其中木瓜蛋白酶样和植物水解酶样下降不明显,胰酶、果胶酶以及纤维素酶酶解样品下降明显。由图6可知,LPA-Y经过不同酶的酶解处理,纤维素酶水解样品与空白样的胆酸盐吸附率接近,其他4种酶的多糖酶解液胆酸盐吸附率都出现了明显的下降,其中胰酶和木瓜蛋白酶的多糖酶解液胆酸盐吸附率下降了近10%。酶解后多糖胆酸盐吸附能力下降可能是由于酶的降解作用,使一些本来容易与胆酸盐形成络合的官能团如糖醛酸等减少,也可能是由于酶解过程中多糖降解改变了多糖的分子量,引起胆酸盐吸附率的下降。
2.4多糖酶解对DPPH自由基的影响
酶解对LPA-C和LPA-Y的DPPH自由基清除能力的影响见图7、图8。
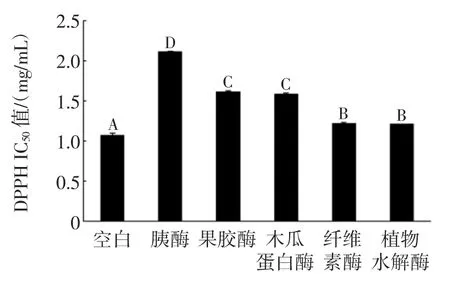
图7 酶解对LPA-C的DPPH自由基清除能力的影响Fig.7The effect of enzymatic hydrolysis on DPPH radical scavenging activity of LPA-C
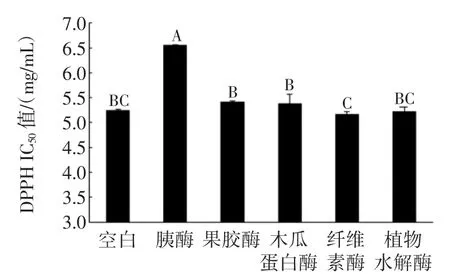
图8 酶解对LPA-Y的DPPH自由基清除能力的影响Fig.8The effect of enzymatic hydrolysis on DPPH radical scavenging activity of LPA-Y
由图7、图8可知,经过酶解处理后,LPA-C和LPA-Y的DPPH自由基清除能力均有不同程度的下降,且变化趋势较为相似。LPA-C和LPA-Y的DPPH自由基清除能力经胰酶处理后均显著地下降,其IC50值分别由空白的1.07 mg/mL增加到2.11 mg/mL,由空白样的5.24 mg/mL增加到6.55mg/mL。对LPA-Y来说,其他4种酶处理的多糖样品的DPPH自由基清除能力无明显变化。
3 结论
酶解提高了LPA-C和LPA-Y的ABTS自由基清除能力及其还原力,其中胰酶和木瓜蛋白酶效果最好,使LPA-C的ABTS IC50值由1.01 mg/mL,下降为0.80 mg/mL和0.89 mg/mL,使LPA-Y ABTS IC50值从3.55 mg/mL下降为2.23 mg/mL和2.88 mg/mL,使LPA-C的还原力A0.5值从空白的1.61 mg/mL下降到1.51 mg/mL和1.53 mg/mL,LPA-Y的还原力A0.5值从空白的9.56 mg/mL下降到5.50 mg/mL和4.69 mg/mL。相反地,酶解降低了LPA-C和LPA-Y的胆酸盐吸附率,其中胰酶和木瓜蛋白酶对胆酸盐吸附率的影响较大,同时也降低了LPA-C和LPA-Y的DPPH自由基清除能力,其中胰酶作用效果最为明显,其酶解后多糖的分质量大小及单糖组成变化还有待进一步的研究。
[1]王海仁,席振乐.酶法生产海带多糖[J].精细与专用化学品,2002,10(22):15-17
[2]卢茳虹,林宗毅,崔春,等.柠檬酸提取海带渣中多糖及其抗氧化活性与结构的研究[J].食品工业科技,2012(23):93-96
[3]李德远,徐现波,熊亮,等.海带的保健功效及海带生理活性多糖研究现状[J].食品科学,2002,23(7):151-154
[4]赵前程,滕钊,汪秋宽,等.复合酶法提取海带多糖的研究[J].沈阳农业大学学报,2007,38(2):220-223
[5]贾俊强,沈健,陈炼,等.蛹虫草多糖的酶法修饰及其抗氧化活性[J].食品科学,2013,34(1):114-120
[6]夏新奎,豆成林.薤白多糖的酶法修饰及其抗氧化活性[J].食品工业,2015(1):185-188
[7]游丽君,刘钧发,冯梦莹,等.酶法水解金针菇多糖及其产物特性分析[J].现代食品科技,2013,29(7):1486-1490
[8]刘轲,王琪琳.海带硫酸多糖的提取、纯化及其理化分析[J].中国生化药物杂志,2002,23(3):114-116
[9]Lee H S,Suh J H,Suh K H.Preparation of antibacterial agent from seaweed extract and its antibacterial effect[J].JOURNAL-KOREAN FISHERIES SOCIETY,2000,33(1):32-37
[10]Ahmadi F,Kadivar M,Shahedi M.Antioxidant activity of Kelussia odoratissima,Mozaff.in model and food systems[J]Food chemistry,2007,105(1):57-64
[11]Yang B,Zhao M,Shi J,et al.Effect of ultrasonic treatment on the recovery and DPPH radical scavenging activity of polysaccharides fromlonganfruitpericarp[J].FoodChemistry,2008,106(2):685-690
[12]Blois M S.Antioxidant determinations by the use of a stable free radical[J].1958(181):1199-1200
[13]孟志芬,祝勇,张怀.木瓜蛋白酶酶解法捉取大枣多糖的工艺研究[J].河南科技学院学报(自然科学版),2006,34(3):49-50
[14]李朝阳,刘魁,韩忠宵,等.大蒜多糖的酶法提取及其抗氧化性研究[J].食品科学,2008,29(1):117-120
[15]游丽君,刘钧发,冯梦莹,等.酶法水解金针菇多糖及其产物特性分析[J].现代食品科技,2013,29(7):1486-1490
[16]黄昆.山杏仁多肽的制备及其对胆酸盐络合能力的研究[D].北京:北京林业大学,2013
Enzymatic Hydrolysis of Polysaccharides from Laminaria japonica and Studies on Its Product Activity
XIE Jin1,LIN Zong-yi1,WANG Zhi-rong1,ZHANG Shao-min2,CUI Chun1,*
(1.School of Food Sciences and Engineering,South China University of Technology,Guangzhou 510640,Guangdong,China;2.Guangdong Environmental Protection Engineering Vocational College,Guangzhou 528216,Guangdong,China)
The polysaccharides extracted by acid solution from Laminaria japonica were hydrolyzed by trypsin,papain,pectinase,cellulase and plant hydrolysis protease,respectively.The bile salt adsorption capacity and antioxidant activity of hydrolysates were also investigated.The results indicated that after enzymatic hydrolysis,their ABTS radical scavenging ability and reducing power were all improved significantly,while the bile salt adsorption capacity and DPPH radical of the polysaccharide decreased.Trypsin and papain lowered the ABTS IC50value and reducing power A0.5value(the concentration of polysaccharide when the absorbance value of reducing power test was 0.500)of LPA-C(the polysaccharide were extracted from Laminaria japonica under the condition of the 30∶1(mL/g)solvent-material ratio,pH2.0,extraction time 3 h and the Extraction temperature of 120℃)and LPA-Y(the polysaccharide were extracted from Laminaria japonica under the condition of the 25∶1(mL/g)solvent-material ratio,pH2.0,extraction time 2 h and the extraction temperature of 100℃)of LPA-C decreased from 1.01 mg/mL to 0.80 mg/mL and 0.89 mg/mL,and the ABTS IC50value of LPA-Y decreased from 3.55 mg/mL to 2.23 mg/mL and 2.88 mg/mL.The reducing power A0.5value of LPA-C decreased from 1.61 mg/mL to 1.51 mg/mL and 1.53mg/mL,and from 9.56 mg/mL to 5.50 mg/mL and 4.69 mg/mL.
Laminaria japonica polysaccharides;citric acid extraction;enzymatic hydrolysis;antioxidant activities;bile salt adsorption capacity
10.3969/j.issn.1005-6521.2016.20.007
国家863项目(2014AA093602)
谢瑾(1991—),女(汉),硕士研究生,从事食品生物技术方向研究。
崔春(1978—),男,教授,博士,从事食品生物技术方向研究。
2015-12-15

