H5亚型高致病性禽流感病毒抗原性变异分析
蒋文明,李金平,侯广宇,彭 程,刘 朔,王素春,张玉新,陈继明
(1.中国动物卫生与流行病学中心,山东青岛 266032;2.唐山市动物卫生监督所,河北唐山 063000)
H5亚型高致病性禽流感病毒抗原性变异分析
蒋文明1,李金平1,侯广宇1,彭 程1,刘 朔1,王素春1,张玉新2,陈继明1
(1.中国动物卫生与流行病学中心,山东青岛266032;2.唐山市动物卫生监督所,河北唐山063000)
为深入了解我国H5亚型高致病性禽流感病毒的抗原性变异情况及其规律,对我国2012—2015年分离的H5亚型高致病性禽流感病毒进行了HA基因的扩增、测序与遗传进化分析。结果发现这些流行毒株主要分布在第2.3.2.1分支、第2.3.4.4分支和第7.2分支。制备流行毒株的单因子阳性血清,与相应疫苗株进行交叉血凝抑制试验,计算抗原相关系数,并对各分支流行毒与相应疫苗之间的HA1主要抗原位点差异进行分析。结果表明,Re-4、Re-5、Re-6、Re-7、Re-8疫苗株之间的血凝抑制抗原相关系数在0.17~0.67之间,表明不同分支之间的抗原性有较大差异。随着时间的推移,分支内流行毒与疫苗之间的血凝抑制抗原相关性差异会越来越大,抗原性变异程度增加,这与HA1主要抗原位点差异分析的结果一致。因此,要取得理想的防控效果,必须及时更新疫苗,使用与流行毒匹配性更好的疫苗。这些数据为深入了解H5亚型高致病性禽流感病毒的抗原变异和对该病毒的防控提供了技术支持。
H5;禽流感病毒;抗原性;变异;疫苗
1996年,我国首次从广东省的鹅中分离到H5N1亚型高致病性禽流感病毒(Avian infl uenza virus,AIV)A/goose/Guangdong/1/96。2003年以来,尤其是2004年,我国暴发了多起H5亚型高致病性禽流感疫情,给养禽业造成了巨大损失。为此,2005年底,我国开始实施全面免疫政策[1]。2006年,我国先后推出了Re-1疫苗和针对第7分支的Re-4疫苗;2008年,推出针对第2.3.4分支病毒的Re-5疫苗。随着病毒抗原性的不断变异,原有疫苗的保护效率下降,不足以对新出现的病毒或变异株提供足够的保护。2012年,我国推出了针对第2.3.2.1分支Re-6疫苗;2014年,推出针对第7.2分支的Re-7疫苗,替换原来的Re-4疫苗。2010年开始,第2.3.4分支的病毒开始出现较大变异[2-4],其血凝抑制滴度(Re-5标准阳性血清),与Re-5本身相比差异较大,导致Re-5疫苗对其保护效果较差。尤其2013年以来,多地暴发了由该分支病毒引起的高致病性禽流感疫情,WHO/OIE/FAO H5N1进化工作组将该变异株分支命名为第2.3.4.4分支[5]。2014年底,农业部批准了针对该分支病毒的Re-8疫苗,2016年获准开始使用。
疫苗与流行毒的匹配性是评估疫苗效果最重要的因素。鉴定疫苗株与流行毒之间抗原匹配性最好的方法是免疫攻毒试验,但由于对实验条件要求较高,因此最初常常通过血凝抑制试验或病毒中和试验数据,分析不同分离株之间的抗原相关性[6]。
目前,第2.3.2.1分支、第2.3.4.4分支和第7.2分支是在我国流行的3个主要分支。为更深入了解我国H5亚型高致病性AIV抗原性的变异情况,本研究利用交叉血凝抑制试验,对近年来在我国流行的3个分支病毒进行了抗原性分析,为深入了解H5亚型AIV抗原性变异情况及其规律以及防控提供技术支持。
1 材料与方法
1.1病毒
2012—2015年H5亚型AIV分离株(12G44、12R266、12G162、12NX1440、12A319、12R357、 12J206、12L101、12S280、13Y170、13Y125、13R177、13R21、13K145、14Weifang、14J3275、14G1778、14Yunnan、14A1652、14A1661、14Qingdao、14Rizhao、15J2408、15A2435、15G2076、15Yantai、15J2448、15J2016)共28株由本室分离保存,其中“12”“13”“14”“15”分别代表毒株分离于2012年、2013年、2014年和2015年。
1.2主要试剂
QIAamp Viral RNA Mini Kit购 自 Qiagen公司;HiScript II One Step RT-PCR Kit、DL2000 Plus Marker购自Vazyme公司;禽流感病毒H5亚型血凝抑制试验抗原(Re-4、Re-5、Re-6、Re-7、Re-8)与阳性血清购自哈尔滨维科生物技术开发公司;SPF鸡胚购自济南斯帕法斯家禽有限公司。
1.3引物
扩增HA基因的通用引物根据已发表的文献合成[7]。
1.4病毒RNA提取
用QIAamp Viral RNA Mini Kit提 取 病 毒RNA,置-70 ℃保存备用。
1.5一步法RT-PCR扩增HA基因
按照HiScript II One Step RT-PCR Kit说明书配置44.0 μL RT-PCR预混液,包括25.0 μL 2 × RTPCR Buffer,引物各2.0 μL(10 μmol/L),2.5 μL Enzyme Mix,12.5 μL ddH2O,加入6.0 μL RNA模板。RT-PCR反应条件为50 ℃反转录30 min,94 ℃预变性5 min,然后进行30个循环(94 ℃变性30 s、57 ℃退火30 s、72 ℃延伸2 min),最后72 ℃延伸7 min。利用QIAxcel毛细管电泳系统进行片段分析,PCR产物送上海生工进行测序鉴定。
1.6HA基因遗传进化分析
利用Clustal W软件将本试验中各分离株的HA基因序列与参考株HA基因序列进行比对,再用MEGA5.05软件对其HA1亚单位部分的序列进行谱系分析。谱系分析的参数设置如下:采用Neighbor-joining计算方法,核苷酸变异设为Kimura 2-parameter模式,各位点变异速率设为Gamma分布(Gamma参数为2.0)。Bootstrap值的计算设置为1 000个重复。
1.7流行毒株单因子阳性血清制备
1.7.1灭活抗原的制备。每个谱系选取每年流行毒2~3株,用无菌生理盐水10 000倍稀释后,接种10日龄SPF鸡胚,0.1 mL/枚,37 ℃孵化,收取接种12 h后死亡鸡胚的尿囊液,加入0.3%福尔马林溶液,2~8 ℃灭活48 h。检测HA效价,如HA效价低于28,应离心后浓缩至28以上。
1.7.2流行毒株灭活疫苗制备。取按1.7.1方法制备的流行毒灭活抗原,按96:4的比例加入吐温-80,充分混合使吐温-80完全溶解作为水相,然后按1:2比例加入油相(含矿物油94份和司本-80 6份)在匀浆机内以适当的速度匀浆乳化,检验。
1.7.3流行毒株单因子阳性血清制备。取1.7.2制备的各毒株灭活疫苗,分别免疫3~5周龄的SPF鸡,0.5mL/只,免疫后21日采血,分离血清,检测效价后备用。
1.8交叉血凝抑制试验
以Re-6标准阳性血清和第2.3.2.1分支流行毒株单因子阳性血清对第2.3.2.1分支的病毒进行交叉血凝抑制试验;以Re-4、Re-7标准阳性血清和第7.2分支流行毒株单因子阳性血清对第7.2分支的病毒进行交叉血凝抑制试验;以Re-5、Re-8标准阳性血清和第2.3.4.4分支流行毒株单因子阳性血清对第2.3.4.4分支的病毒进行交叉血凝抑制试验,根据公式R=(r1×r2)1/2,计算抗原间的相关性:其中R=两株间抗原性差异,r1=甲病毒对乙血清的血凝抑制滴度/甲病毒对甲血清的血凝抑制滴度,r2=乙病毒对甲血清的血凝抑制滴度/乙病毒对乙血清的血凝抑制滴度。
1.9抗原位点分析
根据已发表的H5亚型AIV的抗原位点[8-9],分析各分离株HA1基因的抗原位点变化,并与相应疫苗株HA氨基酸序列比对。
2 结果
2.1HA基因的扩增与测序
如图1所示,对分离毒株的HA基因进行RTPCR扩增,均获得了与预期大小一致的目的片段。HA片段测序、Blast分析表明,所有毒株均为H5亚型高致病性AIV。
图1 HA基因的RT-PCR扩增
2.2HA基因遗传进化分析
如图2所示,我国H5亚型AIV主要流行谱系为第2.3.4.4分支、第2.3.2.1c分支和第7.2分支,其对应的疫苗分别为Re-8、Re-6和Re-7。其中,第2.3.4.4分支又可细分为第2.3.4.4a、第2.3.4.4b、第2.3.4.4c、第2.3.4.4d四个小分支。这四个小分支在我国均有流行,Re-8疫苗株属于第2.3.4.4d分支。
2.3HI试验
各疫苗株之间的交叉血凝抑制试验和抗原相关性结果(表1和表2)表明,Re-4、Re-5、Re-6、Re-7、Re-8之间的血凝抑制抗原相关系数在0.17~0.67之间,Re-4和Re-5疫苗株之间的抗原相关系数为0.667≈0.67,二者抗原性有小的差异(0.5≤ R<0.67),其他各疫苗株之间抗原性差异显著(R<0.5)。
第2.3.2.1分支不同毒株的抗原相关性结果(表3)表明,分支内各毒株之间的血凝抑制抗原相关系数在0.24~0.94之间,14A1622、15J2448、15Yantai与Re-6疫苗株之间抗原性差异显著(R<0.5)。
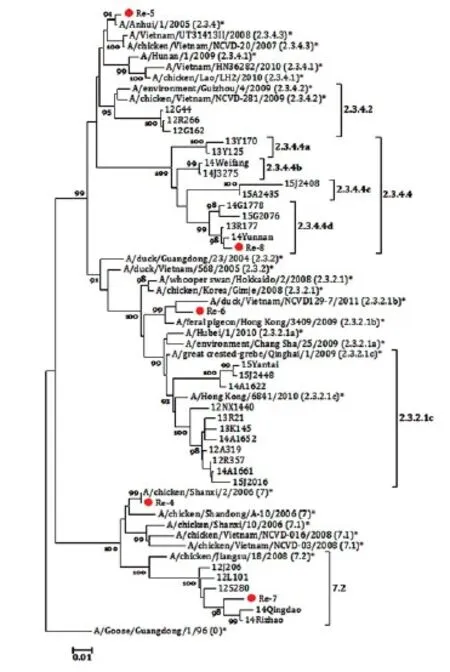
图2 H5亚型AIV HA1基因遗传进化分析
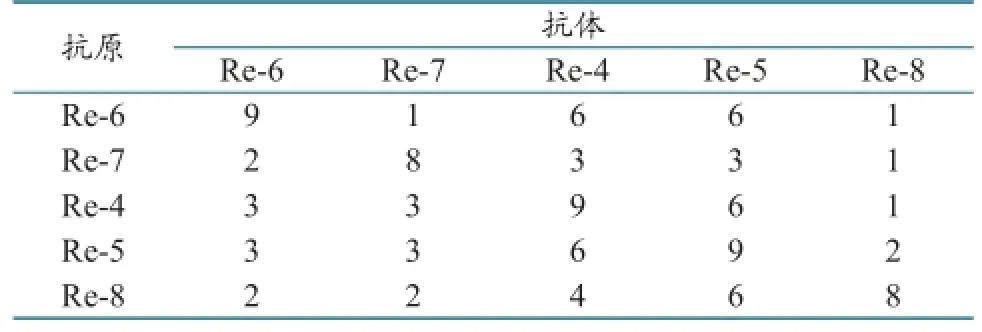
表1 各疫苗株之间交叉血凝抑制试验结果(Log2)
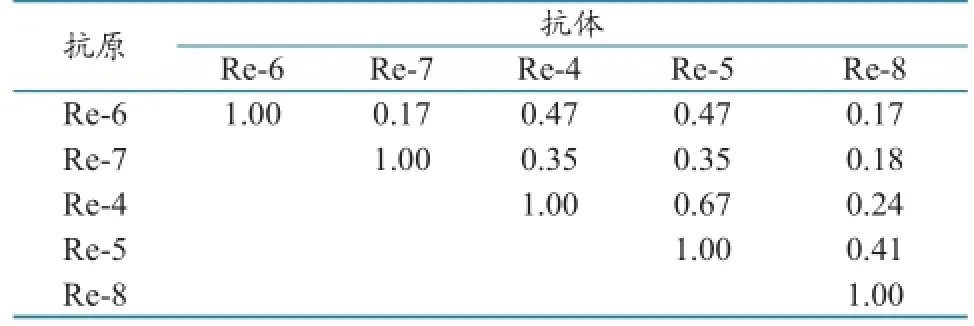
表2 各疫苗株之间的血凝抑制抗原相关系数(R)
第2.3.4.4分支不同毒株的抗原相关性结果(表4)表明,分支内各毒株之间的血凝抑制抗原相关系数在0.29~0.94之间,Re-5与Re-8之间抗原性差异显著(R<0.5)。12G44和12G162与Re-5之间抗原性无差异(0.67≤R≤1.5),与Re-8之间抗原性差异显著(R<0.5)。13R177、13Y170、14Yunnan、14G1778、15G2076、15J2408与Re-5之间抗原性有差异,与Re-8之间抗原性无差异。
第7.2分支不同毒株的抗原相关性结果(表5)表明,分支内各毒株之间的血凝抑制相关系数在0.17~0.94之间,Re-4与Re-7之间抗原性差异显著(R<0.5)。12S280、12L101、14Qingdao、14Rizhao与Re-4之间抗原性有差异,与Re-7之间抗原性无差异。
2.4抗原位点分析
表6为第2.3.2.1分支流行毒株与Re-6 HA1主要抗原位点分析结果,各流行毒株与Re-6 HA1主要抗原位点差异4~11个。相比2012年和2013年分离株,2014年和2015年分离株主要抗原位点变异数量增多,变异程度增加。
表7为第2.3.4.4分支流行毒株与Re-5和Re-8 HA1主要抗原位点分析结果,各流行毒与Re-5 HA1主要抗原位点差异4~13个,Re-8与Re-5 HA1主要抗原位点差异11个。12G44和12G162与Re-5 HA1主要抗原位点仅差异4个,2013—2015年流行毒与Re-5 HA1主要抗原位点差异10~13个,与Re-8 HA1主要抗原位点差异1~6个。
表8为第7.2分支流行毒株与Re-4和Re-7 HA1主要抗原位点分析结果,各流行毒与Re-4 HA1主要抗原位点差异12~16个,与Re-7 HA1主要抗原位点差异3~6个,Re-7与Re-4 HA1主要抗原位点差异15个。
3 讨论
2010年之前,我国主要流行第2.3.4和第7分支的H5亚型AIV,疫苗防控方面主要免疫Re-1、Re-4和Re-5。随着AIV的不断变异,2012年之后,主要流行谱系变为第2.3.2.1分支、第7.2分支和第2.3.4.4分支,疫苗也更新为Re-6、Re-7、Re-8。Re-4、Re-5、Re-6、Re-7、Re-8各疫苗株之间的血凝抑制抗原相关系数在0.17~0.67之间,表明不同分支之间的抗原性有较大差异,因此必须使用匹配相应分支的疫苗才能取得理想的防控效果。
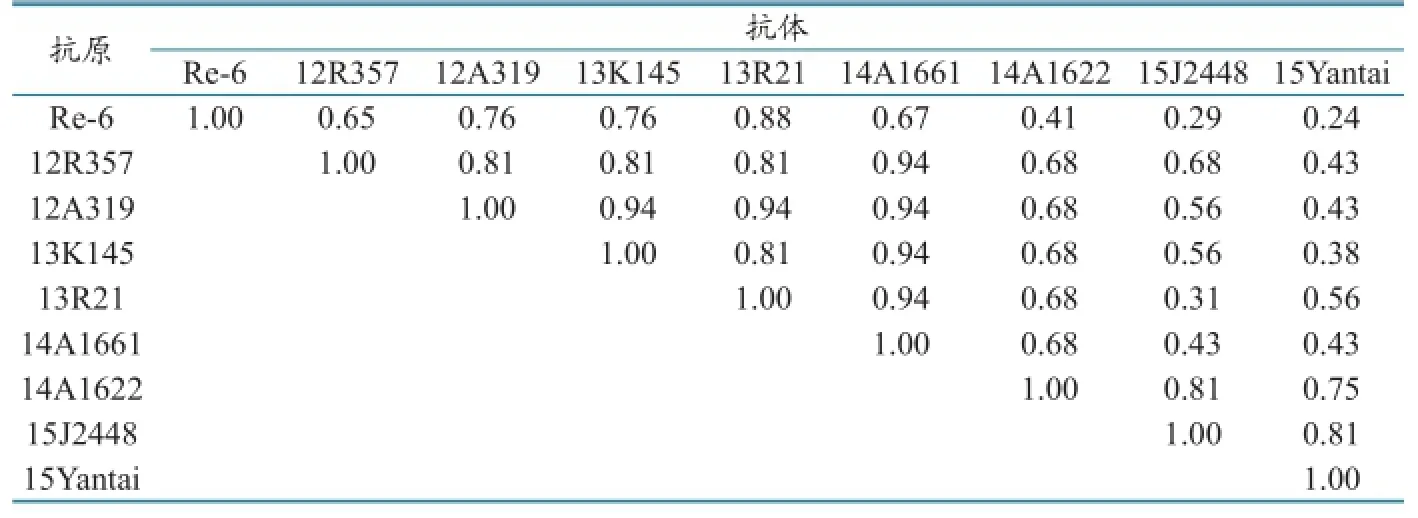
表3 第2.3.2.1分支不同毒株之间的血凝抑制抗原相关系数(R)
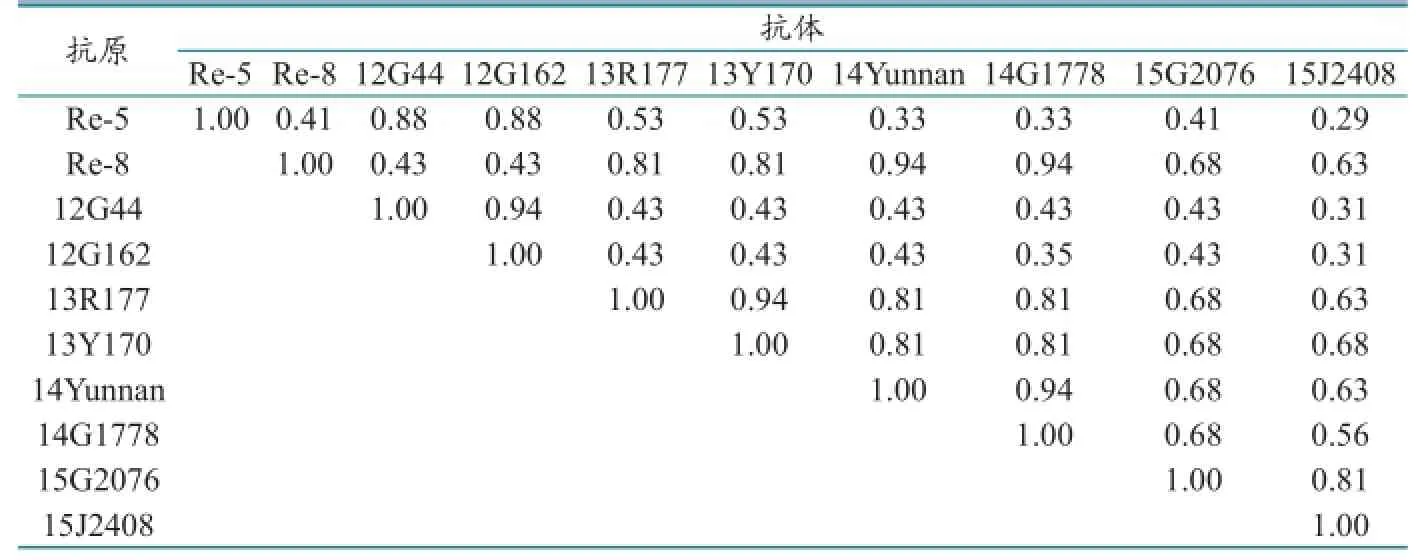
表4 第2.3.4.4分支不同毒株之间的血凝抑制抗原相关系数(R)
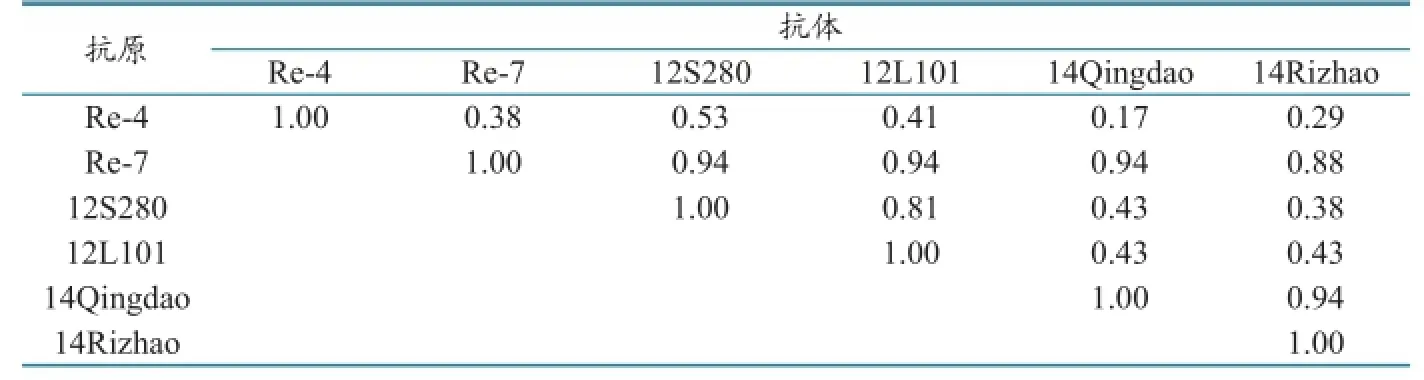
表5 第7.2分支不同毒株之间的血凝抑制抗原相关系数(R)
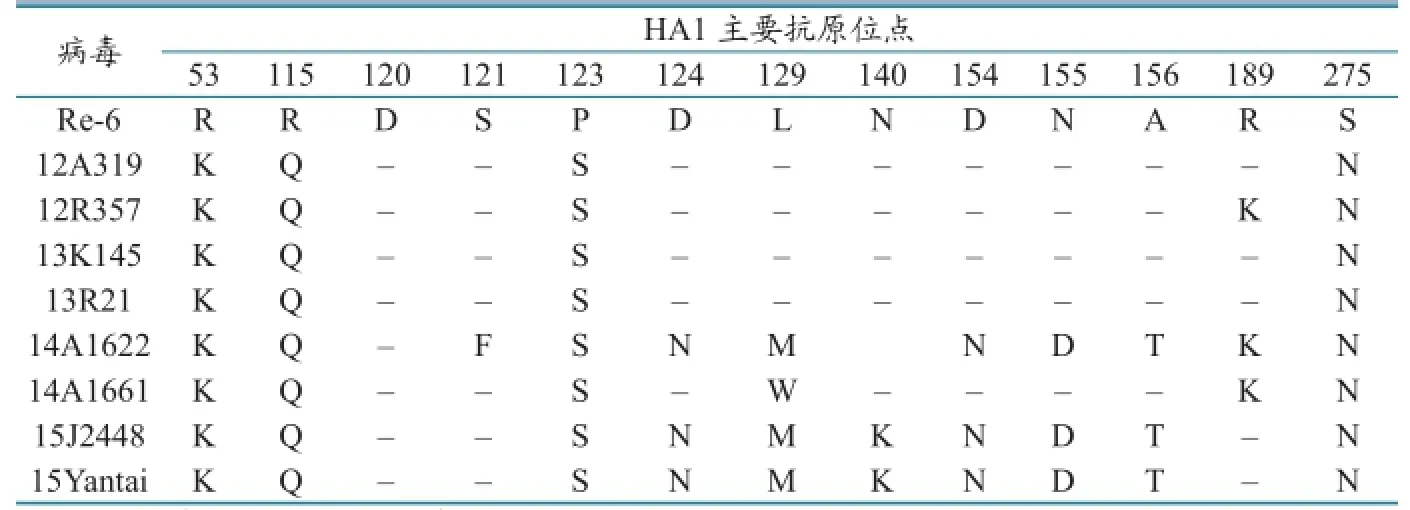
表6 第2.3.2.1分支流行毒株与Re-6疫苗株HA1主要抗原位点的差异分析
第2.3.2.1分支内各毒株之间的血凝抑制抗原相关性分析表明,随着时间的推移,流行毒抗原变异加剧,与Re-6疫苗株的抗原相关性差异越来越大,导致Re-6的免疫效果下降,继而导致相关疫情的发生。HA1主要抗原位点分析结果也验证了这一点。随着时间的推移,相比Re-6疫苗,流行毒主要抗原位点变异数量增多,变异程度增加。
Re-5与Re-8疫苗株之间的抗原相关系数为0.41,差异显著,二者有11个HA1主要抗原位点的差异。2012年分离株12G44和12G162属于第2.3.4.2分支,与Re-5较近,而与Re-8较远。2013年之后的流行毒与Re-5的抗原性差异越来越大,导致了多起相关疫情的发生。这些流行毒与Re-8的血凝抑制抗原无差异,因此针对第2.3.4.4分支病毒的Re-8疫苗应该可以取得较好的免疫防控效果。
Re-4与Re-7疫苗株之间的抗原相关系数为0.38,差异显著,二者有15个HA1主要抗原位点的差异。2006年Re-4开始使用,2014年被Re-7取代。随着时间的推移,2012年之后的流行毒与Re-4抗原性差异显著,而与Re-7之间抗原性无明显差异,这可能与Re-7使用时间较短有关。
交叉血凝抑制试验、抗原相关性分析和HA1主要抗原位点分析表明,随着时间的推移,流行毒与疫苗株之间的抗原相关性差异会越来越大,抗原性变异程度加剧。以前的分析表明[10],疫苗免疫后病毒变异速度会加快,导致病毒免疫逃避的发生,进而病毒分支增多,临床上需要更多的疫苗进行防控,而后导致病毒的变异分化进一步加剧,使得禽流感防控更加困难。
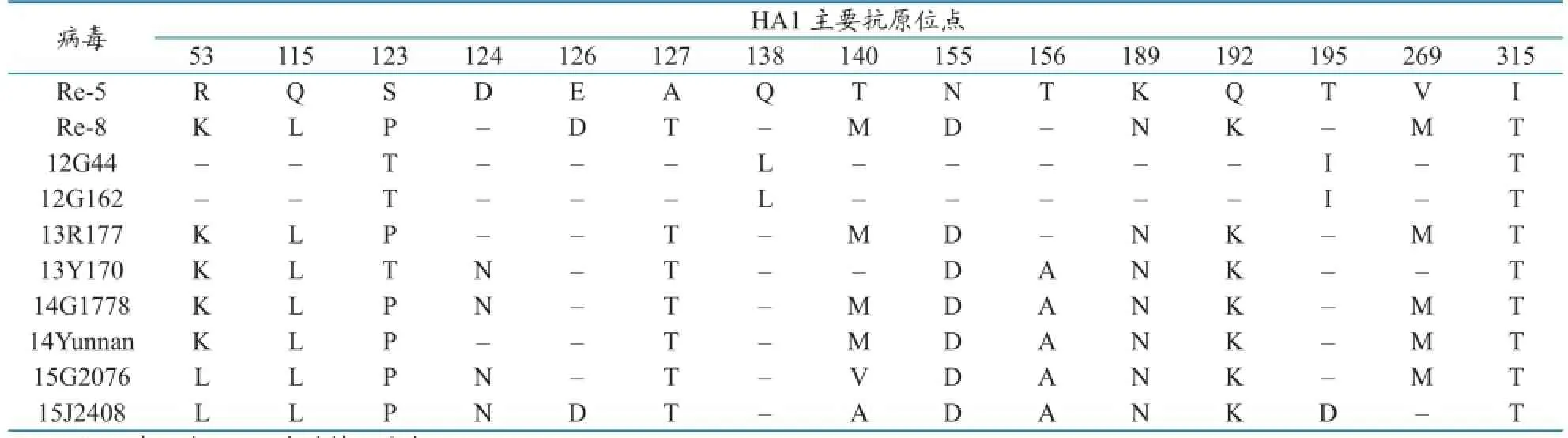
表7 第2.3.4.4分支流行毒株与Re-5和Re-8疫苗株HA1主要抗原位点的差异分析
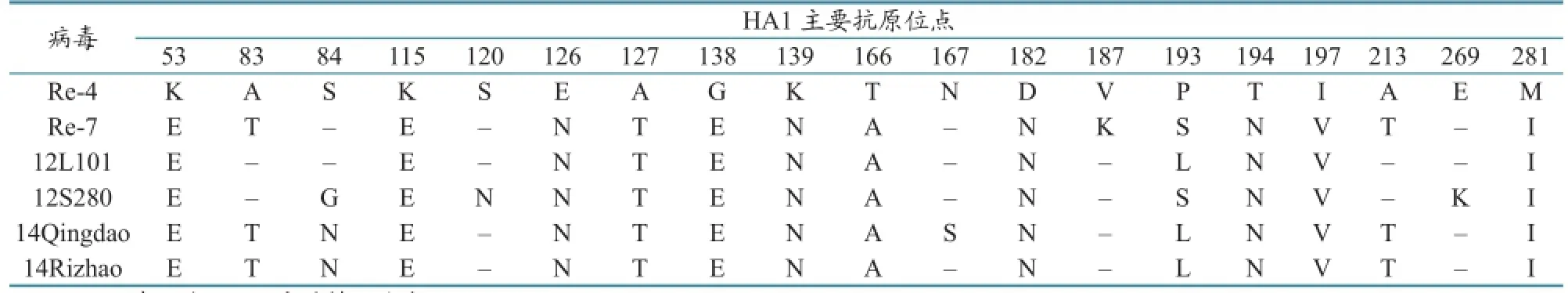
表8 第7.2分支流行毒株与Re-4和Re-7疫苗株HA1主要抗原位点的差异分析
因此,要取得理想的防控效果,必须及时更新疫苗,使用与流行毒匹配性更好的疫苗才能取得理想的防控效果,我们之前的结果也验证了这一结论[11]。同时,政府要研究建立适合我国国情的禽流感防控消除计划,适时启动全面免疫退出计划的第一步,争取早日实现有效控制和消灭禽流感的目的。
[1] 蒋文明,陈继明. H5N1亚型禽流感疫苗研究进展及其效率影响因素[J]. 中国动物检疫,2015,32(11):61-65.
[2] Gu M,Zhao G,Zhao K,et al. Novel Variants of Clade 2.3.4 Highly Pathogenic Avian Infl uenza A(H5N1)Viruses,China[J]. Emerg Infect Dis,2013,19(12):2021-2024.
[3] Zhao K,Gu M,Zhong L,et al. Characterization of three H5N5 and one H5N8 highly pathogenic avian infl uenza viruses in China[J]. Vet Microbiol,2013,63(3/4):351-357.
[4] Zhong L,Zhao Q,Zhao K,et al. The antigenic drift molecular basis of the H5N1 infl uenza viruses in a novel branch of clade 2.3.4[J]. Vet Microbiol,2014,71(1/2):23-30.
[5] World Health Organization/World Organisation for Animal Health/Food and Agriculture Organization(WHO/OIE/FAO)H5N1 Evolution Working Group. Revised and updated nomenclature for highly pathogenic avian infl uenza A (H5N1)viruses[J]. Influenza Other Respir Viruses,2014,8(3):384-388.
[6] Steel J, Burmakina S V, Thomas C, et al. A combination in-ovo vaccine for avian influenza virus and Newcastle disease virus[J]. Vaccine,2008,26(4):522-531.
[7] Hoffmann E,Stech J,Guan Y,et al. Universal primer set for the full-length amplifi cation of all infl uenza A viruses[J]. Arch Virol,2001,146:2275-2289.
[8] Kaverin N V,Rudneva I A,Govorkova E A,et al. Epitope mapping of the hemagglutinin molecule of a highly pathogenic H5N1 infl uenza virus by using monoclonal antibodies[J]. J Virol, 2007,81:12911-12917.
[9] Velkov T,Ong C,Baker M A,et al. The antigenic architecture of the hemagglutinin of infl uenza H5N1 viruses[J]. Mol Immunol,2013,56:705-719.
[10] 蒋文明,侯广宇,王素春,等. H5N6 亚型禽流感病毒反向遗传疫苗株的构建及免疫保护试验[J]. 中国动物检疫,2015,32(1):64-67.
(责任编辑:朱迪国)
Analysis on Antigenic Variation of H5 Subtype Highly Pathogenic Avian Infl uenza Virus
Jiang Wenming1,Li Jinping1,Hou Guangyu1,Peng Cheng1,Liu Shuo1,Wang Suchun1,Zhang Yuxin2,Chen Jiming1
(1.China Animal Health and Epidemiology Center,Qingdao,Shandong 266032;2.Tangshan Animal Health Supervision Institution,Tangshan,Hebei 063000)
To further understand the situation of antigenic variation of H5 subtype highly pathogenic avian influenza viruses and its regularity,the HA genes of H5 subtype highly pathogenic avian infl uenza viruses isolated from 2012 to 2015 were amplifi ed,sequenced and analyzed with genetic evolution. It was showed that the epidemic strains were mainly distributed into the clades 2.3.2.1,7.2 and 2.3.4.4. The single factor positive sera against pandemic strains were prepared and cross hemagglutination inhibition tests were done with standard positive sera against corresponding vaccines. The relativity of antigen index was calculated and the differences of major antigen sites in HA1 genes between popular strains and corresponding vaccine strains were analyzed. The results showed that the relativity of hemagglutination inhibition antigen index of Re-4,Re-5,Re-6,Re-7,Re-8 was between 0.17~0.67,indicated that the antigenicities between the different clades had big differences. With the passage of time,the relativity of hemagglutination inhibition antigen between popular strains and vaccine strains in one clade will be more and more low,the degree of antigenic variation will increase. It was consistent with the results of variance analysis of the main antigen sites in HA1 region. In order to obtain ideal control effect,vaccines must be updated timely,so as to make them are more married with popular strains. These data will provide technical support for understanding the antigenic variation and the prevention and control of this virus.
H5;avian infl uenza virus;antigenicity;variation;vaccine
S852.65
A
1005-944X(2016)09-0027-06
10.3969/j.issn.1005-944X.2016.09.009
青岛市科技计划(14-2-4-105-jch);中国动物卫生与流行病学中心创新基金(2015IF-0003YM)

