重组质粒pEGFP-C3-HCVc的构建及在RBE细胞中的表达
曾 兵 蔡灿锋 辛海洋 周泉波 周佳佳 程 帝 曾 军 唐超明
1 广州医科大学附属第六医院普外科(清远 511518) 2 中山大学孙逸仙纪念医院胆胰外科(广州 510120)
Zeng Bing, Cai Canfeng, Xin Haiyang, et al.
Department of General Surgery, The sixth affiliated hospital of Guangzhou Medical University, Qinyuan 511518, China
Zeng Bing, Zhou Quanbo, Zhou Jiajia, et al.
Department of pancreatobiliary Surgery, Sun Yat-sen Memorial Hospital of Sun Yat-sen University, Guangzhou 510120, China
重组质粒pEGFP-C3-HCVc的构建及在RBE细胞中的表达
曾兵1,2蔡灿锋1辛海洋1周泉波2周佳佳2程帝2曾军1唐超明1
1广州医科大学附属第六医院普外科(清远 511518) 2中山大学孙逸仙纪念医院胆胰外科(广州 510120)
目的构建重组pEGFP-C3-HCVc真核表达载体,并建立稳定表达HCVc基因的肝内胆管癌细胞株RBE-core。方法采用PCR钓取目的基因HCVc,并克隆入pEGFP-C3的多克隆位点,构建pEGFP-C3-HCVc重组质粒。经过双酶切及测序验证后,采用脂质体将pEGFP-C3-HCVc质粒转染到RBE细胞中,经2周G418 (200 μg/mL) 筛选后进行单克隆挑选及扩大培养,建立稳定表达HCVc的胆管癌细胞株RBE-core。采用RT-PCR和Western blot验证HCVc在RBE-core中的表达情况。结果PCR成功钓取HCVc基因,大小约573 bp,并插入pEGFP-C3载体HindⅢ和BamHⅠ多克隆位点;双酶切及测序证实目的基因HCVc正确连接到pEGFP-C3的多克隆位点。RT-PCR和Western blot分别在573 bp处和34 KD左右检测到相应的阳性条带。结论成功构建重组质粒pEGFP-C3-HCVc,并在胆管癌细胞RBE中获得稳定表达。
HCVc肝内胆管癌RBE
ZengBing,CaiCanfeng,XinHaiyang,etal.
DepartmentofGeneralSurgery,ThesixthaffiliatedhospitalofGuangzhouMedicalUniversity,Qinyuan511518,China
ZengBing,ZhouQuanbo,ZhouJiajia,etal.
DepartmentofpancreatobiliarySurgery,SunYat-senMemorialHospitalofSunYat-senUniversity,Guangzhou510120,China
慢性丙型肝炎病毒感染是HCV相关肝脏肿瘤发生的重要病因之一[1-2]。丙型肝炎病毒核心蛋白(Hepatitis C virus core protein, HCVc)作为HCV基因组编码的结构蛋白之一,在有关HCV众多研究领域中受到广泛的关注[3-5]。本研究旨在构建HCVc真核表达载体,并在RBE细胞中稳定表达,为探讨HCV 致癌发生发展的机制以及药物的开发和临床应用等提供重要的实验依据。
1 材料与方法
1.1材料HCV阳性血清取自中山大学孙逸仙纪念医院丙型肝炎患者,血清分离后保存于-80℃备用。人肝内胆管癌细胞株RBE购自中国科学院典型培养物保藏委员会细胞库。p-EGFP载体由本实验室保存。Lipofectamine 2000及胎牛血清(FBS)购自美国Invitrogen公司。Trizol、Oligo dT、DNA polymerase、DNTPs及DNAaseⅠ购自TakaRa公司。T4 DNA Ligase、RNase H、HindⅢ、BamHⅠ、PCR产物回收试剂盒、胶回收试剂盒及质粒小提试剂盒购自DONGSHENG BIOTECH。G418购自Sigma公司。HCVc抗体购自Santa Cruz,硝酸纤维素膜(PVDF)购自Millipore公司。
1.2HCVc目的基因片段的扩增用酚—氯仿方法从HCV患者血清中提取基因组DNA,溶于35μl DEPC水中,-20℃保存备用。根据HCVc基因的cDNA序列设计引物,并引入HindIII和BamHI酶切位点(下划线部分)以及保护碱基(斜体部分)。上游引物:5′-CCCAAGCTTAGCA-CGAATCCTAAACCTCAAAG-3′;下游引物:5′-CGCGGATCCCTAGGCTGAAGCGGGCACAG-3′。PCR反应条件:预变性 94℃ 5 min,变性94℃ 30s,退火55℃30 s,延伸72℃ 40 s,总共33个循环,延伸72℃ 5 min。DNA凝胶回收试剂盒回收PCR产物,PCR反应产物经琼脂糖凝胶电泳检测。
1.3pEGFP-C3-HCVc质粒的构建分别取PCR回收产物和pEGFP-C3载体各15 μl用HindⅢ与BamHⅠ双切,37℃酶切2 h,反应体系如下:ddH2O 27 μl,Buffer 5 μl,HCV回收产物/pEGFP-C3载体15 μl,HindⅢ和BamHⅠ1.5 μl,总体系50 μl。目的基因与载体的连接按下列反应体系:ddH2O 3 μl,酶切回收的PCR产物(HCVc) 3 μl,酶切回收的pEGFP-C3载体2 μl,Ligase Buffer 1 μl,T4 DNA Ligase 1 μl,总体系10 μl,反应条件为16℃ 2 h。
1.4质粒的转化、提取及鉴定将6 μl连接产物加入至30 μl DH5α感受态细胞中按下列条件转化:冰浴30 min,42℃水浴热休克90 s,冰浴2 min,加入200 μl LB培养基,37℃、200 r/min振荡培养1 h。转化好的菌液涂布于含卡那霉素(25 μg/mL)的LB平板表面,倒置转移入37℃生化培养箱过夜培养。挑选单克隆,提取质粒,并进行酶切,琼脂糖凝胶电泳,凝胶成像系统成像和测序鉴定。
1.5质粒的转染真核表达质粒pEGFP-C3-HCVc经鉴定后, 采用Lipofectamine 2000将pEGFP-C3-HCVc转染于RBE细胞。转染具体步骤参照试剂说明书进行, 以空载体转染细胞(RBE-vector)作为对照组。转染24 h后, 胰酶消化接种于10 cm培养皿进行单克隆培养。接种第2 d细胞贴壁后加入200 μg/μl G418筛选。待2周左右阳性细胞克隆长出后,荧光显微镜下Mark笔标记,进行单克隆挑选,并扩大培养,培养过程中继续用200 μg/μl G418维持,获得稳定表达HCVc的胆管癌细胞株RBE-core。
1.6RT-PCR和Western blot检测HCVc在RBE中的表达用Trizol提取RNA经行PCR扩增,扩增产物用琼脂糖凝胶电泳,凝胶成像系统成像检测HCVc mRNA的表达。RIPA裂解液提取总蛋白,SDS-聚丙烯酰胺凝胶电泳后,转印至PVDF膜上。脱脂奶粉封闭2 h后,HCVc抗体(1∶400)于4℃孵育过夜,二抗(1∶5000)室温孵育1 h,ECL化学发光法显影,检测HCVc融合蛋白的表达。
2 结 果
2.1HCVc目的基因的扩增用酚—氯仿方法从HCV患者血清中提取基因组DNA作为PCR扩增模板,更好的保留了基因组DNA的完整信息。提取的DNA纯度为2.05,符合实验要求。PCR产物经1%琼脂糖凝胶电泳,UVP凝胶成像系统成像,显示一大小约573bp的条带,与预期大小符合(图1)。
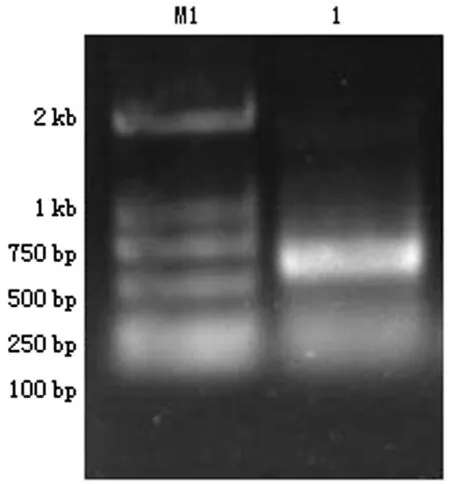
M1:DNA Marker;1:HCV PCR扩增产物
2.2重组质粒pEGFP-C3-HCVc的鉴定挑选阳性克隆,提取重组质粒。重组质粒经HindⅢ和BamHⅠ双酶切后,1%琼脂糖凝胶电泳分离,UVP凝胶成像系统成像,可见大小约573bp(HCVc)和5kb(pEGFP-C3)左右两条带(见图2)。质粒测序结果与Gene Bank中所提供的下列一致,表明重组质粒构建成功。
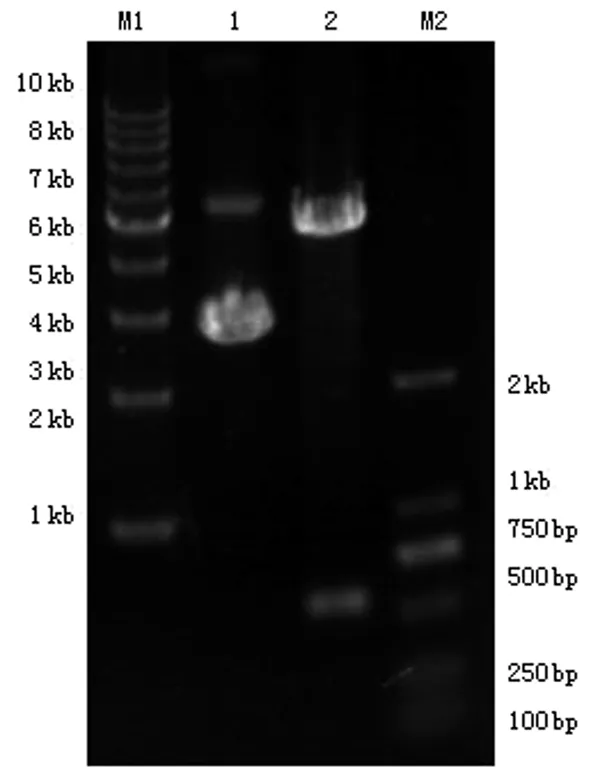
M1、M2:DNA Marker;1-2:分别为pEGFP-C3-HCVc质粒与酶切后产物
2.3稳定表达HCVc基因RBE-core细胞株的鉴定重组质粒pEGFP-C3-HCVc转染RBE细胞,G418稳定筛选,挑取单克隆扩大培养(图3A),荧光显微镜下显示荧光主要分布在胞浆区,此外在细胞核中也有表达(图3B);RT-PCR检测发现RBE-core细胞有相应条带显示,而对照组为阴性(图3C);Western blot检测发现,在34KD左右见pEGFP-C3-HCVc融合蛋白的表达(图3D),表明HCVc基因在RBE细胞中获得稳定表达。
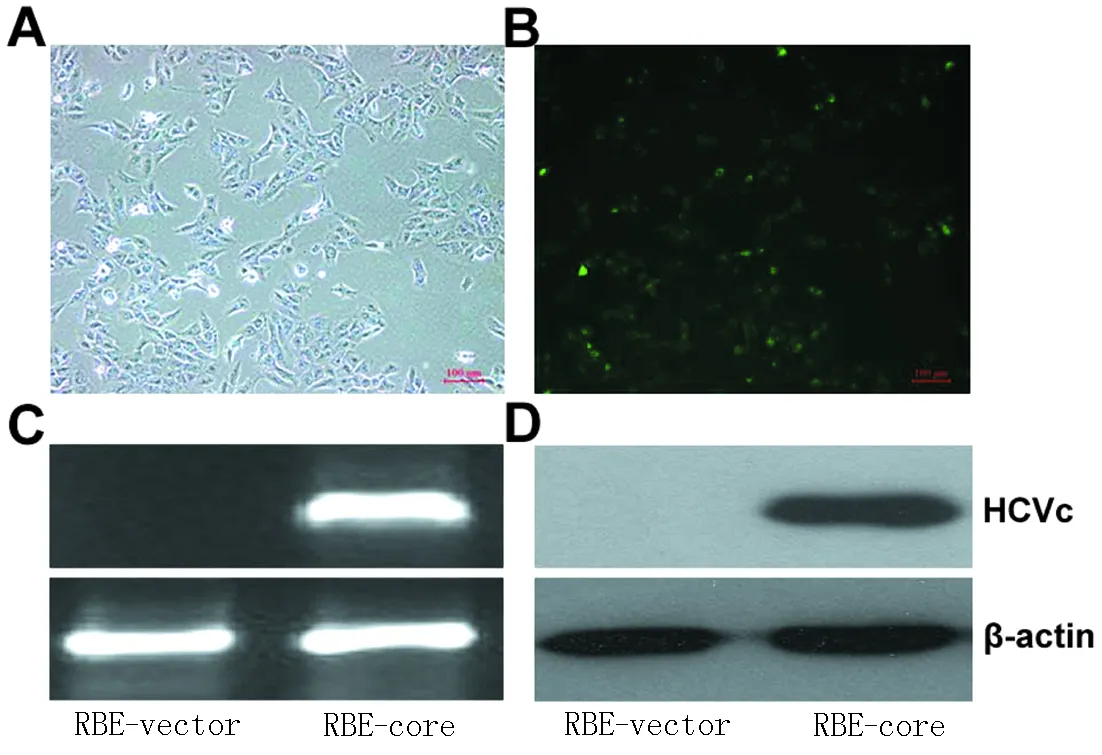
图3(A、B) RBE-core细胞形态及HCVc在细胞中的表达;(C、D) RT-PCR和Western blot分别检测HCVc mRNA和蛋白在RBE-core细胞中的表达。
3 讨 论
丙型肝炎病毒(Hepatitis C virus,HCV)于1989年被发现和鉴定,被归为黄病毒科肝炎病毒属,为有包膜的单股正链RNA病毒。HCV呈全球性流行,全球约有1.7亿人感染HCV,每年新发病型肝炎病例约为3.5万例[6]。
HCVc是HCV基因组编码的核心结构蛋白,是丙型肝炎病毒编码区的最保守区域之一,具有DNA结合基序、核定位信号区及磷酸化位点,能够通过反式调控机制作用于宿主细胞基因组启动子,转录激活和抑制基因的表达[7],通过影响细胞周期[5]、细胞凋亡[8]、染色体损伤和基因突变[9]、转录因子以及信号转导通路,在肿瘤的发生发展过程中发挥重要作用。如影响P53、hnRNP K、pRb的活性,上调c-Myc的表达,影响Fas介导的细胞凋亡,以及活化STAT3、MAPK/ERK信号转导通路等[9-10]。
目前,多项研究显示HCV感染与肝内胆管癌的发生密切相关[11-12]。我们前期研究亦发现HCVc能够活化STAT3通路,促进细胞周期进展和抑制细胞凋亡[13],然而HCVc的具体致癌机制尚不清楚。由于瞬时转染技术很大程度上限制了细胞信号转导通路的深入研究,因此,建立稳定表达HCVc基因的细胞对进一步探讨HCVc的致癌机制具有重要意义。重组质粒pEGFP-C3-core带有绿色荧光蛋白基因EGFP,瞬时转染细胞后,表达HCVc基因的细胞在荧光显微镜下能够发出绿色荧光。通过稀释种板,在荧光显微镜下标记带有绿色荧光的单克隆,然后进行挑选和扩大培养及G418筛选,不仅有利于建立稳定表达HCVc基因的细胞株,而且在传代培养过程中可以在荧光显微镜下监测HCVc基因的表达情况。以上优势是pcDNA系列载体所不具备的。
因此,我们采用基因调取的方法从HCV患者血清中扩增出HCVc基因片段,通过双酶切连接到pEGFP-C3上,成功构建了pEGFP-C3-core重组质粒。通过脂质体转染的方法,我们将重组质粒转染到肝内胆管癌细胞株RBE中,并通过单克隆挑选后扩大培养和G418筛选的方法获得稳定表达HCVc基因的细胞株RBE-core。荧光显微镜显示,HCV基因稳定表达与RBE细胞,主要分布在细胞质中,另外在细胞核中也有表达。RT-PCR和Western blot结果显示,经过筛选后的细胞能够稳定表达HCVc,表明RBE-core稳定表达细胞株建立成功,这为进一步研究HCVc在HCV相关肝脏肿瘤发生发展中的作用提供了重要实验条件。
[1] BARTOSCH B TR, BLUM HE, et al. Hepatitis C virus-induced hepatocarcinogenesis[J]. J Hepatol, 2009, 51(4):810- 820.
[2] SEMPOUX C, JIBARA G, WARD SC, et al. Intrahepatic cholangiocarcinoma: new insights in pathology[J]. Semin Liver Dis, 2011, 31(1):49- 60.
[3] ZENG B, LI Z, CHEN R, et al. Epigenetic regulation of miR-124 by hepatitis C virus core protein promotes migration and invasion of intrahepatic cholangiocarcinoma cells by targeting SMYD3[J]. FEBS Lett, 2012, 586(19):3271-3278.
[4] KWAK J, SHIM JH, TIWARI I, et al. Hepatitis C virus core protein inhibits E6AP expression via DNA methylation to escape from ubiquitin-dependent proteasomal degradation[J]. Cancer Lett, 2016, 380(1):59- 68.
[5] TAN Y, LI Y. HCV core protein promotes hepatocyte proliferation and chemoresistance by inhibiting NR4A1[J]. Biochem Biophys Res Commun, 2015, 466(3):592-598.
[6] KOZIEL MJ, PETERS MG. Viral hepatitis in HIV infection[J]. N Engl J Med, 2007, 356(14):1445-1454.
[7] MOON J, KAOWINN S, CHO IR, et al. Hepatitis C virus core protein enhances hepatocellular carcinoma cells to be susceptible to oncolytic vesicular stomatitis virus through down-regulation of HDAC4[J]. Biochem Biophys Res Commun, 2016, 474(3):428- 434.
[8] LIU C, QU A, HAN X, et al. HCV core protein represses the apoptosis and improves the autophagy of human hepatocytes[J]. Int J Clin Exp Med, 2015, 8(9):15787-15793.
[9] MACHIDA K, TSUKAMOTO H, LIU JC, et al. c-Jun mediates hepatitis C virus hepatocarcinogenesis through signal transducer and activator of transcription 3 and nitric oxide-dependent impairment of oxidative DNA repair[J]. Hepatology, 2010, 52(2):480- 492.
[10] NAKAMURA H, AOKI H, HINO O, et al. HCV core protein promotes heparin binding EGF-like growth factor expression and activates Akt[J]. Hepatol Res, 2011, 41(5):455- 462.
[11] El-SERAG HB, ENGELS EA, LANDGREN O, et al. Risk of hepatobiliary and pancreatic cancers after hepatitis C virus infection: A population-based study of U.S. veterans[J]. Hepatology, 2009, 49(1):116-123.
[12] LEE CH, CHANG CJ, LIN YJ, et al. Viral hepatitis-associated intrahepatic cholangiocarcinoma shares common disease processes with hepatocellular carcinoma[J]. Br J Cancer, 2009, 100(11):1765-1770.
[13] ZHOU JJ, CHEN RF, DENG XG, et al. Hepatitis C virus core protein regulates NANOG expression via the stat3 pathway[J]. FEBS Lett, 2014, 588(4):566-573.
Construction of recombinant plasmid of pEGFP-C3-HCVc and its expression in RBE cells
ObjectiveTo construct a recombinant plasmid of pEGFP-C3-HCVc containing hepatitis C virus core protein, and establish the HCVc-expressing cell line RBE-core.MethodsThe HCVc gene was amplified by PCR and cloned into HindⅢ and BamHⅠsite of pEGFP-C3 plasmid. The recombinant plasmid of pEGFP-C3-HCVc was confirmed by sequencing. RBE cells were transfected with the recombinant plasmid by using Lipofectamine 2000, and then performed G418 (200 μg/mL) selection after 2 weeks. The expressing of HCVc gene in RBE cells was confirmed by RT-RCR and western blot.ResultsThe recombinant plasmid of pEGFP-C3-HCVc was successfully constructed. RT-PCR and western blot detected a 573bp and 34KD bland, indicating the stably expressing of HCVc in RBE cells.ConclusionThe recombinant plasmid of pEGFP-C3-HCVc is stabled expressing in RBE cells,which provides support for the further study.
Hepatitis C Virus core protein; Intrahepatic cholangiocarcinoma; RBE
国家自然科学基金(81401996);广东省自然科学基金(2015A030310099)
曾兵,E-mail:zengbing2007@163.com
10.3969/j.issn.1000-8535.2016.05.003
2016- 06-30)

