过表达Rip2对人胰腺癌细胞Panc-1凋亡的影响*
杨文欣, 周 晗, 梁若龙, 胡巢凤
(暨南大学医学院病理生理学系,国家中医药管理局病理生理学实验室,广东 广州 510632)
过表达Rip2对人胰腺癌细胞Panc-1凋亡的影响*
杨文欣▲, 周 晗▲, 梁若龙, 胡巢凤△
(暨南大学医学院病理生理学系,国家中医药管理局病理生理学实验室,广东 广州 510632)
目的: 观察受体相互作用蛋白2(Rip2)对人胰腺癌细胞Panc-1凋亡的影响。方法:采用JetPRIME试剂分别将pEGFP-C2和pEGFP-Rip2质粒转染入Panc-1细胞,实验分为对照组、pEGFP-C2组和pEGFP-Rip2组。转染后培养细胞48 h,采用流式细胞术检测细胞凋亡率;Western blot检测细胞Rip2水平及凋亡相关蛋白Bax、胞浆细胞色素c(Cyt-c)和Bcl-2蛋白表达;比色法检测细胞caspase-3的活性。结果:转染pEGFP-Rip2细胞Rip2蛋白表达明显增加。流式细胞术检测表明,pEGFP-Rip2组的细胞凋亡率明显高于对照组和pEGFP-C2组。与对照组和pEGFP-C2组相比,pEGFP-Rip2组的Bax和胞浆Cyt-c蛋白表达明显升高,而Bcl-2蛋白水平则显著降低。并且,pEGFP-Rip2组细胞caspase-3活性明显高于对照组和pEGFP-C2组。结论:过表达Rip2能诱导Panc-1细胞凋亡,其作用机制可能与Rip2上调Bax以及胞浆Cyt-c蛋白表达,下调Bcl-2蛋白水平,增加caspase-3活性,从而激活内源性凋亡途径有关。
受体相互作用蛋白2; 细胞凋亡; Panc-1细胞
近年来的研究表明,NOD 样受体(NOD-like receptors,NLRs)为胞浆内的模式识别受体,可识别微生物高度保守相似的结构,发挥独特的天然免疫功能。NLRs主要有3个功能结构域组成:C末端是含有亮氨酸的重复序列,可识别病原相关分子模式;中间的核苷酸结合位点;N末端是能与下游衔接蛋白衔接的结构域[1-2]。受体相互作用蛋白2(receptor-interacting protein 2,Rip2)是部分NLRs家族成员(如NOD1和NOD2等)信号通路的下游衔接分子,可激活NF-κB,促进多种炎症因子的产生[3-4]。McCarthy等[5]研究发现,过表达Rip2能诱导人乳腺癌细胞MCF-7凋亡,但其作用机制尚不清楚。近来有研究发现,Rip2对B 细胞性非霍奇金淋巴瘤(B-cell non-Hodgkin’s lymphoma,B-NHL)细胞株Ramos细胞和胶质母细胞瘤细胞株U87MG具有明显的促增殖作用,在Ramos细胞中,Rip2通过非经典NF-κB通路的活化及可能协同经典NF-κB通路参与NF-κB介导的抗凋亡作用[6]。这表明Rip2的作用具有细胞特异性,对细胞的生存和凋亡起着双向调控的作用。国内外对Rip2功能研究多集中在其介导的炎症反应,对其在凋亡中的作用及机制鲜有报道。因此,本实验主要研究过表达Rip2对人胰腺癌细胞Panc-1凋亡的影响,并进一步探讨Rip2的作用机制,为临床治疗胰腺癌寻找新的靶点。
材 料 和 方 法
1 材料
人胰腺癌细胞Panc-1由中山大学中山医学院惠赠;pEGFP-C2空质粒为本实验室保存物品;pEGFP-Rip2重组质粒由本实验室构建。RPMI-1640细胞培养基、PBS、青霉素和链霉素为含HyClone产品;细胞转染试剂JetPRIME购自Polyplus;Annexin V-PE/7-AAD和caspase-3活性检测试剂盒购自Biovision;Rip2多克隆抗体为Santa Cruz产品;Bax、Bcl-2、细胞色素c(cytochrome c,Cyt-c)和GAPDH抗体购自Cell Signaling Technology;胎牛血清购于Biological Industries;其它生化试剂为进口分装或国产分析纯产品。
2 方法
2.1 Panc-1细胞培养及质粒转染 细胞采用10%胎牛血清的RPMI-1640细胞培养基培养,同时加入1×105U/L 青霉素和 100 mg/L 链霉素,在37 ℃、5% CO2培养箱中进行细胞培养。以每孔7×104细胞接种于24孔板中,培养过夜后进行质粒转染。转染时将质粒及转染试剂JetPRIME加入培养板中,左右摇晃使其更加均匀,置于培养箱中培养6~8 h后换新鲜的完全培养基,再继续培养48 h。实验分对照(control)组: 培养细胞不做任何处理;pEGFP-C2组: pEGFP-C2空质粒转染至细胞内; pEGFP-Rip2组:pEGFP-Rip2重组质粒转染至细胞内。
2.2 流式细胞术检测细胞凋亡 每孔加入不含EDTA的胰酶,消化后用EP管小心收集细胞,用PBS洗涤细胞2次。每管细胞加入200 μL 1×binding buffer重悬细胞,再在每管细胞重悬液中加入5 μL Annexin V-PE,混匀后于室温下避光孵育15 min。之后每管加入5 μL 7-AAD吹打混匀后即可用流式细胞仪检测细胞凋亡率。为保证实验结果准确,染色后4 h内用流式细胞仪检测。
2.3 Western blot检测蛋白表达 用含0.25% EDTA的胰酶消化细胞,收集Panc-1细胞,用预冷的PBS洗涤2次,加入100 g/L PMSF的细胞裂解液和1 μL PMSF蛋白酶抑制剂,吹打混匀,之后置于冰上孵育30 min,4 ℃ 12 000 r/min离心30 min,收集上清。此外,收集各组细胞于EP管中。每管加入胞浆蛋白提取试剂A 80 μL,混匀后孵育20 min。然后每管加入胞浆蛋白提取试剂B 5 μL,混匀后16 000 r/min离心5 min,上清为要提取的胞浆蛋白。BCA蛋白定量测定试剂盒检测蛋白浓度。
用SDS-PAGE分离蛋白后,将蛋白通过电转移的方式转移至硝酸纤维薄膜上,再置于封闭液中进行封闭1 h, 用特异性抗体检测Rip2、Bax和Bcl-2蛋白的表达,以GAPDH作为蛋白内参照。采用蛋白条带灰度值来表示其相对表达量。
2.4 比色法测定caspase-3活性 收集各组细胞, 用PBS洗涤细胞1次,加入细胞裂解液重悬细胞,冰上孵育15 min,取少量样品测蛋白浓度。将50 μL细胞重悬液转移到96孔板中,每孔加入含10 mmol/L DTT的2 × reaction buffer 50 μL及1 mmol/L (DEVD-pNA)5 μL。混匀后37 ℃避光孵育2 h,在多功能酶标仪400/405 nm处测定各孔吸光度(absorbance,A)值,根据样品蛋白浓度计算出每一样品的A值,再将该A值与对照组A值相比计算出各组细胞caspase-3的相对活性。
3 统计学处理
数据采用SPSS 13.0软件进行统计学分析,计数资料用均数±标准差(mean±SD)表示。多组间比较用单因素方差分析(ono-way ANOVA),组间均数两两比较采用Bonferroni检验。以P<0.05为差异有统计学意义。
结 果
1 各组细胞形态变化
用倒置显微镜观察各组细胞形态的变化。如图1所示,转染pEGFP-C2空质粒后48 h,细胞形态和大小与对照组类似,细胞呈多角形,未发现转染前后细胞形态有明显变化。转染pEGFP-Rip2重组质粒后48 h,可见部分细胞形态从多角形变成细长形。
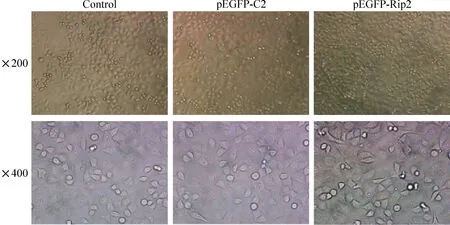
Figure 1.The changes of cellular morphology in different groups.
图1 各组细胞形态的变化
2 Western blot检测重组质粒转染前及转染后Rip2蛋白的表达
Western blot检测细胞的Rip2蛋白的表达情况。结果发现与control组和pEGFP-C2组比较,pEGFP-Rip2重组质粒转染Panc-1细胞48 h后Rip2蛋白的表达明显增高,差异有统计学意义(P<0.01);而control组与pEGFP-C2组相比,Rip2蛋白的表达差异无统计学意义。上述实验证明pEGFP-Rip2重组质粒成功转入Panc-1细胞并表达Rip2蛋白,见图2。
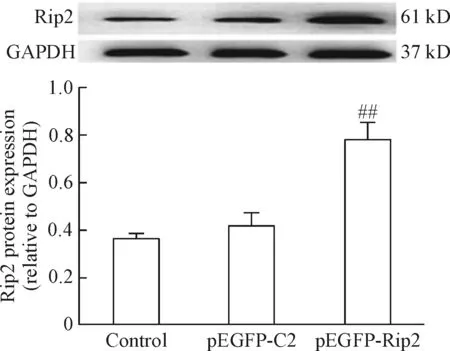
Figure 2.The protein expression levels of Rip2 in the Panc-1 cells with different treatments. Mean±SD.n=3.##P<0.01vscontrol and pEGFP-C2 groups.
图2 各组Panc-1细胞Rip2蛋白的表达水平比较
3 流式细胞术检测各组的细胞凋亡率
Annexin-V/7-AAD双染后,用流式细胞术检测各组的细胞凋亡率。Q3区表示活细胞,Q1区是坏死细胞,Q4区为早期凋亡细胞,Q2区代表晚期凋亡细胞。实验发现pEGFP-Rip2组的细胞凋亡率(Q2+Q4)明显高于control组和pEGFP-C2组(P<0.01);而control组与pEGFP-C2组比较,2组间细胞凋亡率的差异无统计学意义,见图3。
4 Rip2对Panc-1细胞Bax和Bcl-2蛋白表达的影响
实验结果如图4所示,与control组和pEGFP-C2组比较,pEGFP-Rip2组细胞的Bax和胞浆Cyt-c蛋白表达明显升高(P<0.01);而control组和pEGFP-C2组比较,Bax和胞浆Cyt-c蛋白表达的差异无统计学意义。此外,pEGFP-Rip2组细胞的Bcl-2蛋白表达明显低于control和pEGFP-C2组(P<0.01);而control组和pEGFP-C2组比较,Bcl-2蛋白表达的差异无统计学意义。
5 Rip2增加Panc-1细胞caspase-3的活性
与control组和pEGFP-C2组比较,pEGFP-Rip2组细胞caspase-3的活性明显增高(P<0.01);而control组和pEGFP-C2组相比,caspase-3活性的差异无统计学意义,见图5。
讨 论
凋亡又称细胞的程序性死亡,是在生理条件下发生的细胞死亡。细胞凋亡与机体的生、老、病、死息息相关,是机体维持内环境稳态的一个重要手段。当遇到各种刺激时机体启动自杀保护措施,主动清除功能异常的、多余的或者是与机体不相适应的细胞,通过调节细胞增殖与死亡之间的平衡以达到调节机体内环境稳态的目的;一旦这种平衡被打破就会伴随着各种疾病的发生。如凋亡受阻,某些细胞异常增殖,就会导致癌症等疾病的发生;如凋亡过度,会导致神经退行性变等。
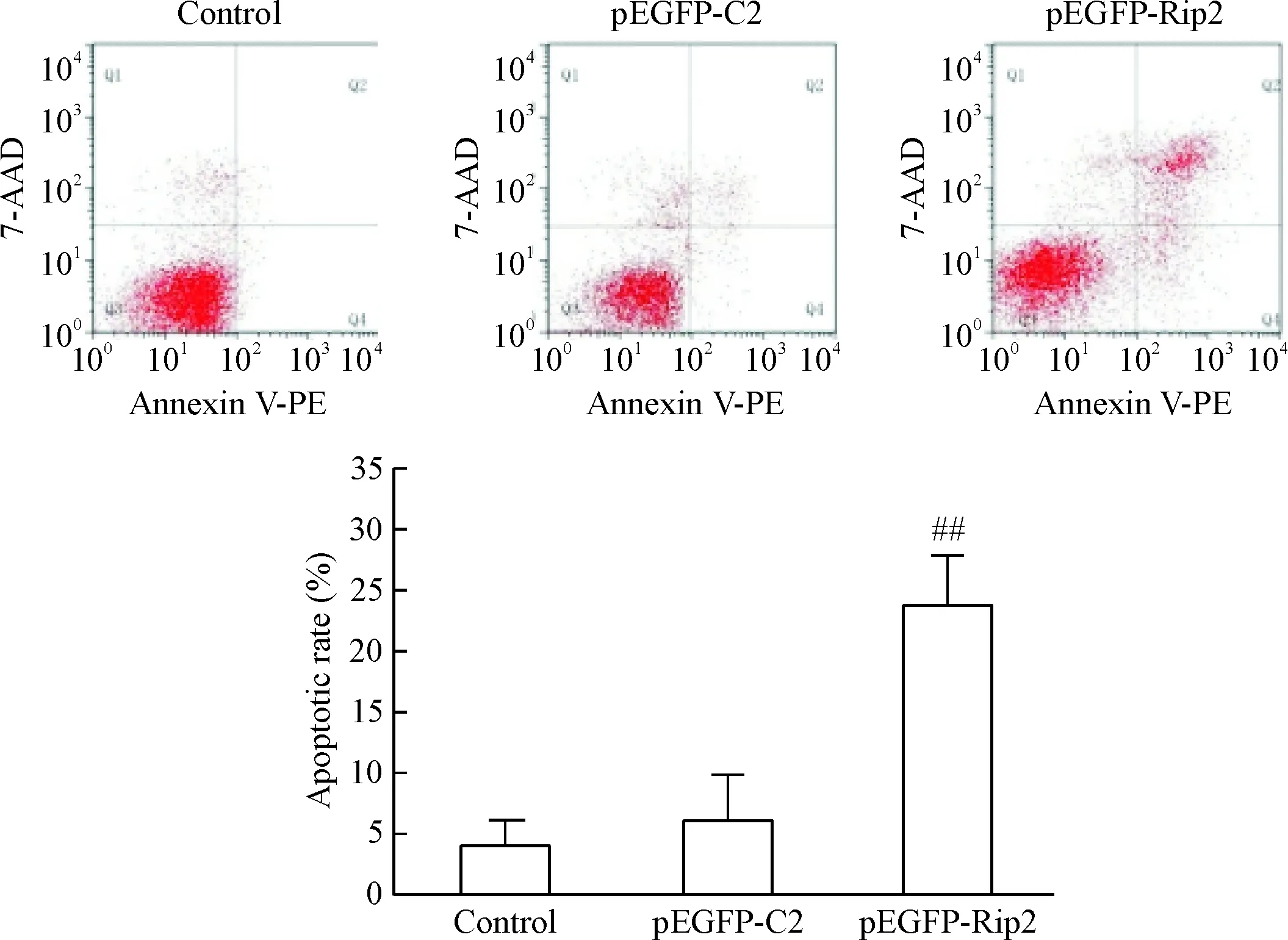
Figure 3.The effect of Rip2 overexpression on the apoptotic rate of Panc-1 cells. Mean±SD.n=3.##P<0.01vscontrol and pEGFP-C2 groups.
图3 Rip2过表达对Panc-1细胞凋亡率的影响
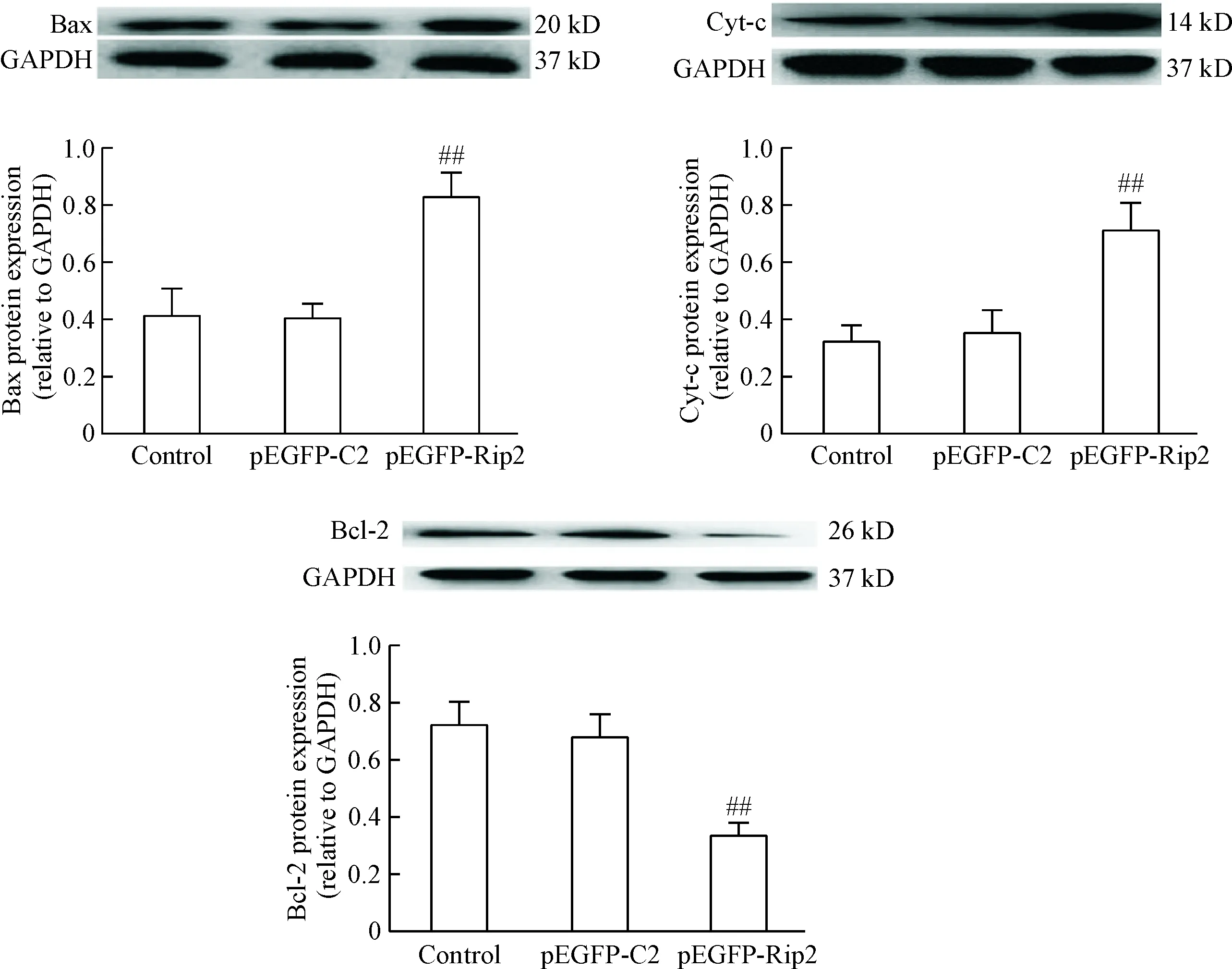
Figure 4.The effect of Rip2 overexpression on the protein expression of Bax, cytoplasmic Cyt-c and Bcl-2 in the Panc-1 cells. Mean±SD.n=3.##P<0.01vscontrot and pEGFP-C2 groups.
图4 Rip2过表达对Panc-1细胞Bax、胞浆Cyt-c和Bcl-2蛋白表达的影响
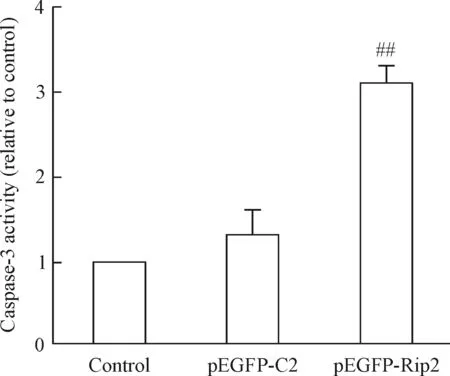
Figure 5.Rip2 overexpression enhanced caspase-3 activity in the Panc-1 cells. Mean±SD.n=3.##P<0.01vscontrol and pEGFP-C2 groups.
图5 Rip2过表达促进Panc-1细胞caspase-3活性增强
Rip2属于Rips家族的一员,大量文献报道Rip2与固有免疫、适应性免疫和炎症反应有密切关系,其中也有报道其与细胞凋亡和增殖有关[7]。但是Rip2在不同细胞中具有促凋亡和抗凋亡的不同效应,具有细胞特异性。因此,本实验主要研究Rip2是否促进人胰腺癌细胞Panc-1凋亡以及其作用机制。本实验采用了对细胞毒性小、操作简单而且转染效率高的阳离子聚合物JetPRIM试剂盒对Panc-1细胞进行瞬时转染,转染48 h后用Western blot检测各组细胞Rip2蛋白表达情况。结果发现转染pEGFP-Rip2重组质粒组的细胞Rip2蛋白表达明显高于对照组和pEGFP-C2组;而对照组与pEGFP-C2组比较,细胞Rip2蛋白表达差异无统计学意义,说明pEGFP-Rip2质粒成功转入Panc-1细胞。由于本实验所用的质粒带有绿色荧光蛋白,我们采用红色荧光染料PE标记的Annexin V与7-AAD双染进行流式术检测各组细胞凋亡率。Annexin V-PE/7-AAD双染时可用来区分存活的细胞、坏死细胞或早期和晚期凋亡细胞[8]。流式细胞术检测结果显示,转染pEGFP-Rip2质粒组细胞凋亡率明显高于对照组和pEGFP-C2组;而转染空质粒pEGFP-C2组则对细胞凋亡率无明显影响。以上实验证明Rip2能诱导人胰腺癌细胞Panc-1凋亡。Bax和Bcl-2都属于Bcl-2家族成员,家族成员分两类,一类是具有抗凋亡作用的蛋白,如Bcl-2、Bcl-xL等,另外一类是具有促凋亡作用的蛋白,如Bax、Bak、Bid等。当Bcl-2等抗凋亡分子的作用受到促凋亡分子的抑制,导致胞浆中Bax等被激活并定位于线粒体膜上,线粒体膜电位降低,使线粒体膜通透性改变,释放促凋亡物质,如Cyt-c,进而激活下游的细胞凋亡关键蛋白酶caspase-3,激活内源性凋亡途径,导致细胞凋亡[9-11]。本实验用Western blot法检测各组细胞Bax和Bcl-2蛋白的表达,发现与对照组和pEGFP-C2组相比,在转染pEGFP-Rip2重组质粒组的细胞中Bax和胞浆Cyt-c蛋白水平明显增高;而Bcl-2蛋白水平显著降低。同时,我们用比色法检测了凋亡执行蛋白酶caspase-3的活性,实验结果表明,转染pEGFP-Rip2重组质粒组的caspase-3活性明显高于对照组和pEGFP-C2组;而对照组和pEGFP-C2组相比,caspase-3的活性无统计学差异。
综上所述,Rip2能够诱导人胰腺癌细胞Panc-1凋亡;其作用机制可能与Rip2上调Bax和胞浆Cyt-c蛋白表达,下调Bcl-2蛋白表达,增加caspase-3活性,从而激活内源性凋亡途径有关。随着进一步探讨Rip2的促凋亡作用机制,将为临床治疗胰腺癌及其它肿瘤寻找新的靶点。
[1] Takeuchi O, Akira S. Pattern recognition receptors and inflammation[J]. Cell, 2010, 140(6):805-820.
[2] Barbé F, Douglas T, Saleh M. Advances in Nod-like receptors (NLR) biology[J]. Cytokine Growth Factor Rev, 2014, 25(6):681-697.
[3] Argast GN, Fausto N, Campbell JS. Inhibition of RIP2/RICK/CARDIAK activity by pyriminyl imidazole inhibitors of p38 MAPK[J]. Mol Cell Biochem, 2005, 268(1-2):129-140.
[4] Hasegawa M, Fujimoto Y, Lucas PC, et al. A critical role of RICK/RIP2 polyubiquitination in Nod-induced NF-κB activation[J]. EMBO J, 2008, 27(2):373-383.
[5] McCarthy JV, Ni J, Dixit VM. RIP2 is a novel NF-κB-activating and cell death-inducing kinase[J]. J Biol Chem, 1998, 273(27):16968-16975.
[6] 蔡 欣. RIP2调控NF-κB通路促进B-NHL细胞抗凋亡作用机制研究[D].北京:中国人民解放军军事医学科学院,2012.
[7] Humphries F, Yang S, Wang B, et al. RIP kinases: key decision makers in cell death and innate immunity[J]. Cell Death Differ, 2015, 22(2):225-236.
[8] Yu X,Zhou X,Fu C,et al. Celastrol induces apoptosis of human osteosarcoma cells via the mitochondrial apoptotic pathway[J]. Oncol Rep, 2015, 34(3):1129-1136.
[9] 刘 俊,张雪林,任永生,等.BARF1表达下调通过活化caspase依赖的线粒体通路诱导EBV阳性胃癌细胞凋亡[J]. 中国病理生理杂志, 2015, 31(11):1970-1978.
[10]Chauhan D, Hideshima T, Rosen S, et al. Apaf-1/cytochromec-independent and Smac-dependent induction of apoptosis in multiple myeloma (MM) cells[J]. J Biol Chem, 2001, 276(27):24453-24456.
[11]Green DR, Kroemer G. The pathophysiology of mitochondrial cell death[J]. Science, 2004, 305(5684):626-629.
(责任编辑: 卢 萍, 罗 森)
Effect of Rip2 overexpression on apoptosis in human pancreatic cancer cell line Panc-1
YANG Wen-xin, ZHOU Han, LIANG Ruo-long, HU Chao-feng
(DepartmentofPathophysiology,KeyLaboratoryofPathophysiology,StateAdministrationofTraditionalChineseMedicine,SchoolofMedicine,JinanUniversity,Guangzhou510632,China.E-mail:thcf@jnu.edu.cn)
AIM: To observe the effect of receptor-interacting protein 2 (Rip2) overexpression on human pancreatic cancer cell line Panc-1. METHODS: pEGFP-C2 and pEGFP-Rip2 plasmids were respectively transfected into the Panc-1 cells using JetPRIME reagent. The cells were divided into control group, pEGFP-C2 group and pEGFP-Rip2 group. The apoptosis in the cells was detected 48 h after transfection by flow cytometry. Rip2 level and the expression of apoptosis-related proteins, Bax, cytoplasmic cytochrome c (Cyt-c) and Bcl-2, were analyzed by Western blot. The activity of caspase-3 was measured by colorimetric method. RESULTS: Rip2 protein expression significantly increased in the cells transfected with control and pEGFP-C2 plasmids. The apoptotic rate in pEGFP-Rip2 group was higher than that in control group and pEGFP-C2 group, whereas no significant difference of apoptotic rate was observed between control group and pEGFP-C2 group. The protein expression of Bax and cytoplasmic Cyt-c was remarkably increased and the protein expression of Bcl-2 was obviously decreased in pEGFP-Rip2 group as compared with control group and pEGFP-C2 group. The activity of caspase-3 in pEGFP-Rip2 group was obviously increased as compared with control group and pEGFP-C2 group. CONCLUSION: Overexpression of Rip2 is able to induce apoptosis in the Panc-1 cells, and the mechanism may be related to the up-regulation of Bax and cytoplasmic Cyt-c protein expression, down-regulation of Bcl-2 protein expression and enhancement of caspase-3 activity, thus activating intrinsic apoptotic pathway.
Receptor-interacting protein 2; Apoptosis; Panc-1 cells
杂志网址: http://www.cjpp.net
1000- 4718(2016)09- 1584- 05
2016- 05- 01
2016- 08- 24
广东省自然科学基金资助项目(No. S2012010008161)
△通讯作者 Tel: 020-85228079; E-mail: thcf@jnu.edu.cn
▲并列第1作者
R730.23
A
10.3969/j.issn.1000- 4718.2016.09.009

