RNA结合蛋白HuR在胃癌中的表达和临床意义
张小风 彭佑共 谢飞 裴芝皆 李晓晖
胃癌(Gastric carcinoma,GC)是最常见的消化道肿瘤之一。在我国,早期胃癌的诊治率低于10%,进展期胃癌根治术后5 年生存率在30%左右[1-2]。临床的实践表明,胃癌的发病与治疗仍存在“三高”和“三低”,即发病率高、死亡率高、转移率高以及早诊断率低、切除率低、5 年生存率低。作为高发病率和高死亡率的恶性肿瘤之一,胃癌的发病机制迄今尚未能证明某单一因素可以作为胃癌的病因,胃癌在早期症状模糊和非特异性,与良性胃溃疡的症状相似,因此容易被患者忽略或药物治疗而掩盖,等到确诊时80%~90%为进展期,出现淋巴结转移甚至是远处转移,失去根治性切除的机会,故预后差,生存率低。胃癌的淋巴转移是胃癌的主要转移途径,早期胃癌发生淋巴结转移率近20%,进展期胃癌的淋巴转移率高达70%左右。研究表明,胃癌的淋巴转移是影响早期胃癌预后的重要因素[3-4]。因此,探讨胃癌转移的相关因素,早期预测淋巴结转移风险,寻找新的治疗思路,阻断肿瘤转移的发生对提高患者生存率具有十分重要的临床意义。
1 资料与方法
1.1 研究对象
收集荆门市第二人民医院2011 年1 月—2012 年6 月胃癌手术切除患者75 例。男性34 例,女性41 例;年龄36~78 岁,平均年龄(49.0±1.7)岁。其中有淋巴结转移者36 例,无淋巴结转移者39 例。根据美国癌肿联合委员会(AJCC)2016 年胃癌TNM 分期(第八版更新)进行分期[5]:Ⅰ期30 例,Ⅱ期26 例,Ⅲ期15 例,Ⅳ期4 例。
1.2 方法
兔抗人多克隆HuR 抗体,购自上海奕驰生物科技有限公司。免疫组化试剂盒(PV-8000):购自北京中杉金桥生物技术有限公司,根据试剂盒推荐的方法检测HuR 蛋白的表达。
1.3 结果判定
参照Delellis[6]、饶鸿艳[3]等人提供的免疫组化半定量积分法来判断免疫组化结果。免疫组织化学结果由染色强度和染色频率两者来评估,0~1 分为阴性,2~3 分为阳性。4~5 分,表示阳性(++);6~7 分,表示阳性(+++)。HuR 在胞浆与胞核均有分布,阳性物质均呈黄-棕色颗粒。
1.4 统计学方法
SPSS13.0 统计软件进行分析,计数资料采用χ2检验,相关分析采用Spearman 相关分析和Cox 回归分析,生存分析采用Kaplan-Meier 曲线法和Log rank 检验。以P<0.05 表示有统计学意义。
2 结果
2.1 HuR 在胃癌组织中的表达
HuR 表达为粗细不一的淡黄或棕褐色颗粒,HuR 在肿瘤细胞中表达阳性,在癌旁间质细胞也有少量表达。在75 例胃癌组织标本中,49 例(65.3%)组织胞浆HuR 表达阳性,64 例(85.3%)胞核表达阳性。有2 例(2.7%)组织胞浆和胞核均未检测到HuR表达。见表1。
2.2 胃癌组织中HuR 的表达与临床病理特征的关系
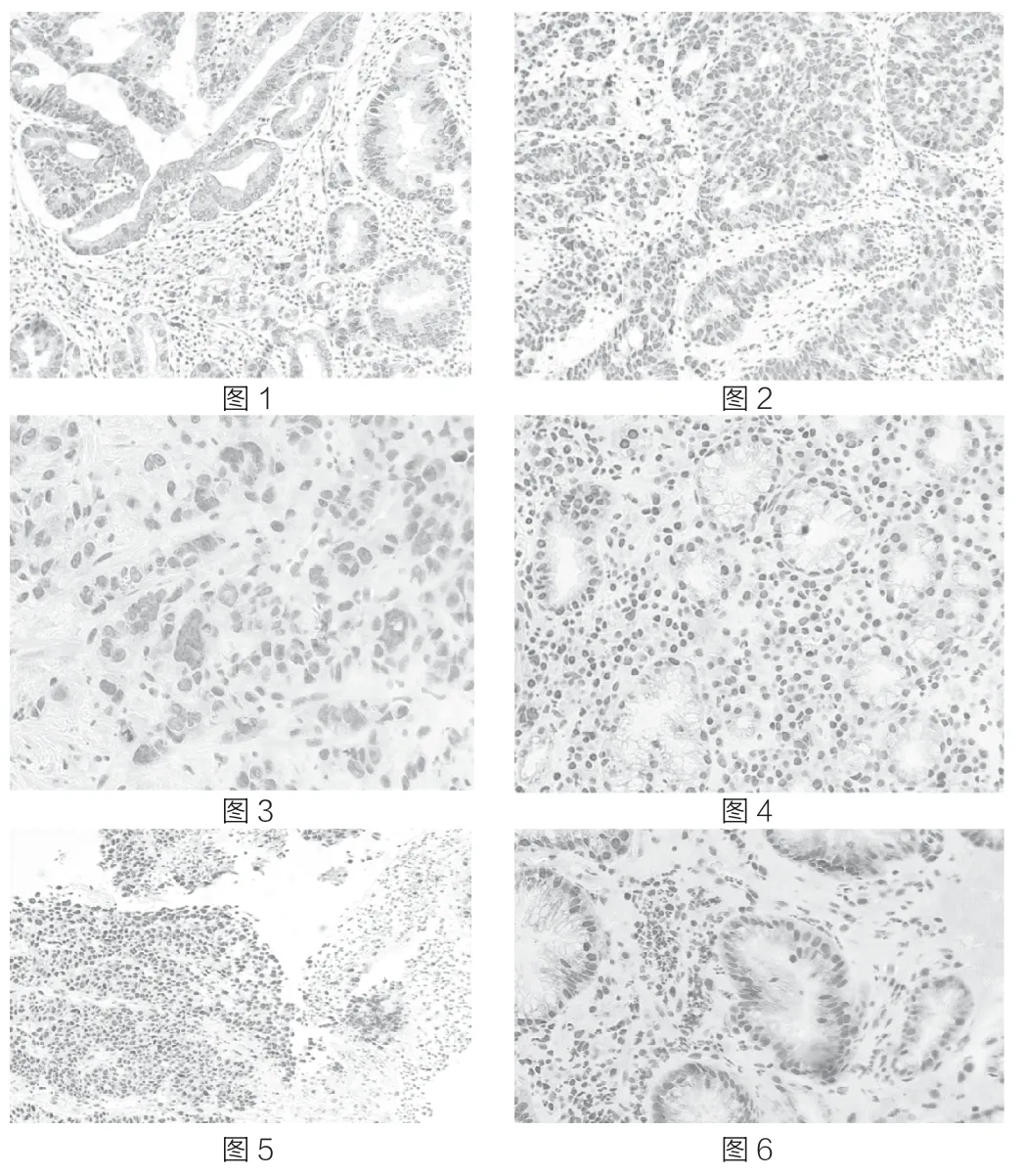
图1 HuR 胞浆、胞核均强阳性表达×10;图2 HuR 胞浆弱阳性、胞核强阳性表达×10;图3 HuR 胞浆阴性、胞核弱阳性表达×40;图 4 HuR 胞浆、胞核均阴性表达×10;图5 HuR 胞浆阴性、胞核强阳性表达×10;图6 HuR 胞浆、胞核均弱阳性表达×40
在本研究中,胞浆HuR 表达水平与肿瘤大小、胃癌临床分期和淋巴结转移、远处转移明显相关(P<0.05),然而与患者的年龄、性别、组织学类型和组织分化程度无相关性(P>0.05)。此外,胞核HuR 表达与所有的临床病理学特征间均无相关性(P>0.05)(表1)。
进一步将单因素分析中具有统计学意义的变量纳入COX 多因素分析模型,结果表明,HuR 胞浆阳性(HR=1.854,95%CI=1.018-3.875;P=0.044)、肿瘤大小(HR=1.303;95%CI=1.256-3.404;P=0.012)、临床分期(HR=3.607;95%CI=1.729-7.526;P=0.001)是影响胃癌患者预后的独立因素(表2)。以上结果提示,通过免疫组化检测HuR 胞浆表达可以预测胃癌患者术后预后情况。
3 讨论
胃癌其生物学行为具有很高的直接浸润性和早期转移倾向的特点。然而,对于胃癌细胞经过淋巴道转移的研究,却相对滞后。因此,本文主要目的,通过分析HuR 在胃癌组织中的表达,来研究其对胃癌淋巴转移的影响,并为临床治疗胃癌提供新的思路。
HuR 与肿瘤的发生和生长;ELAV 家族包括HuR、HuB、HuC和HuD。HuR 基因定位于染色体19q13.2,此处编码众多原癌基因产物;正常情况下,HuR 主要表达在细胞核,但在低氧、放射性损伤和细胞因子等刺激下可从细胞核转运到细胞浆,通过RNA 识别基序(RRM)与多种mRNA3’端非翻译区(3’UTR)的富含AU 碱基的序列(ARE)结合,使mRNA 从胞核转运至胞浆的过程中保护mRNA 免受核酸酶降解,从而增加mRNA 的稳定性。多种分子的mRNA,如介导细胞增殖的细胞周期蛋白cyclinA、cyclinB等都含有ARE,均接受ARE 结合蛋白(AUBP)的调控。HuR 通过与ARE 结合,增加上述因子mRNA 的稳定性从而上调该因子蛋白的表达发挥相应的生物学效应;最初于1990 年在小细胞肺癌患者血清中被检测到,后来研究发现,HuR 在肝癌、乳腺癌、卵巢癌、结肠癌中表达异常[7-8]。HuR 通过促炎性因子和血管生成因子,如TNF-α、COX-2 和 VEGF 等,来调节关键的致癌过程[9-10]。Shang等[11]研究表明,HuR 的生物学作用是增强mRNA 的稳定性。HuR非常重要、十分广泛的作用是在转录后水平调控真核细胞基因表达,也是唯一可以增强mRNA 稳定性的ELAV 家族蛋白;不仅参与了生物发育等正常生命活动,也在肿瘤发生、发展过程中发挥着重要作用
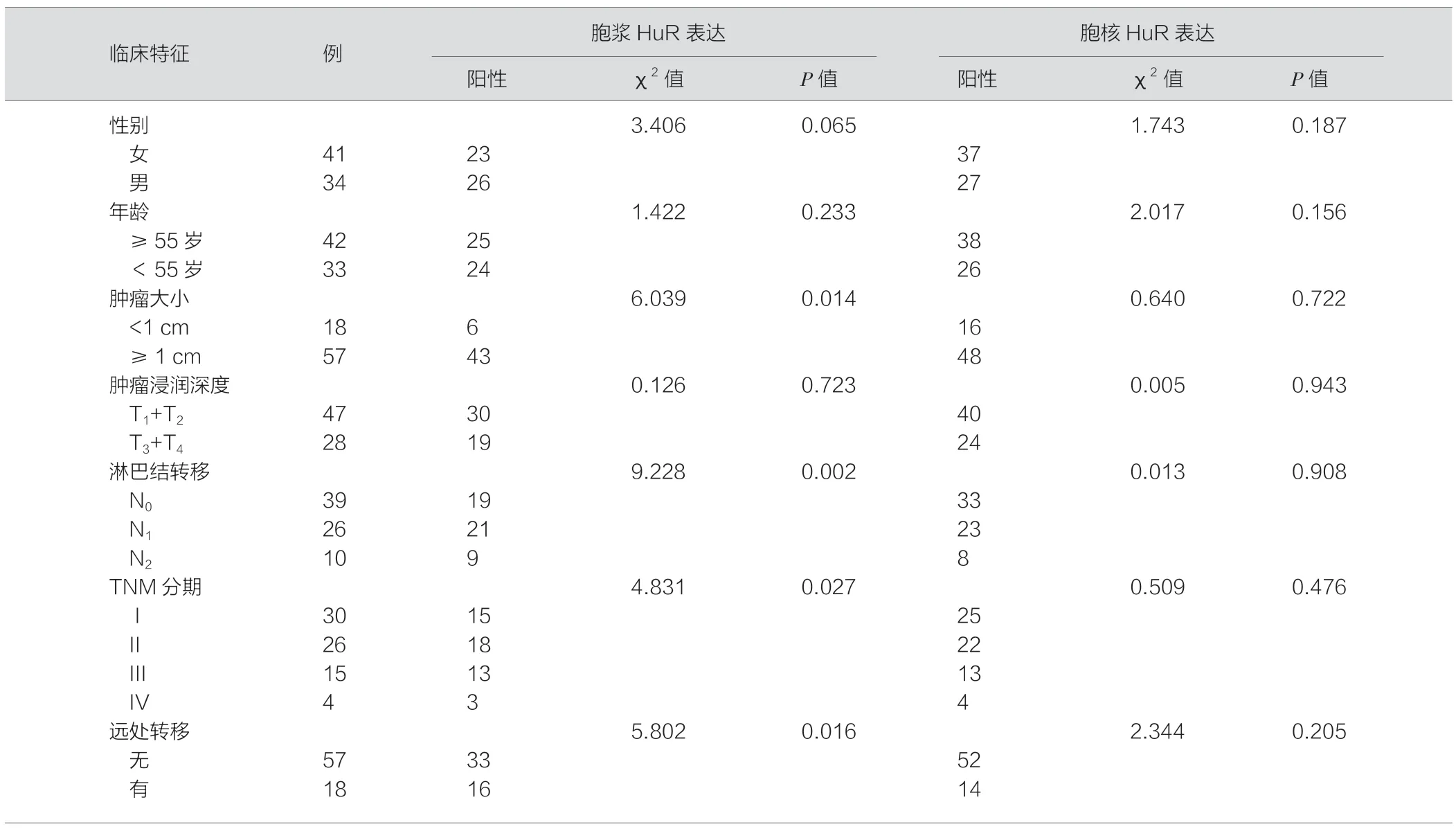
表1 HuR 在胃癌中的表达及与临床病理特征的关系(例)
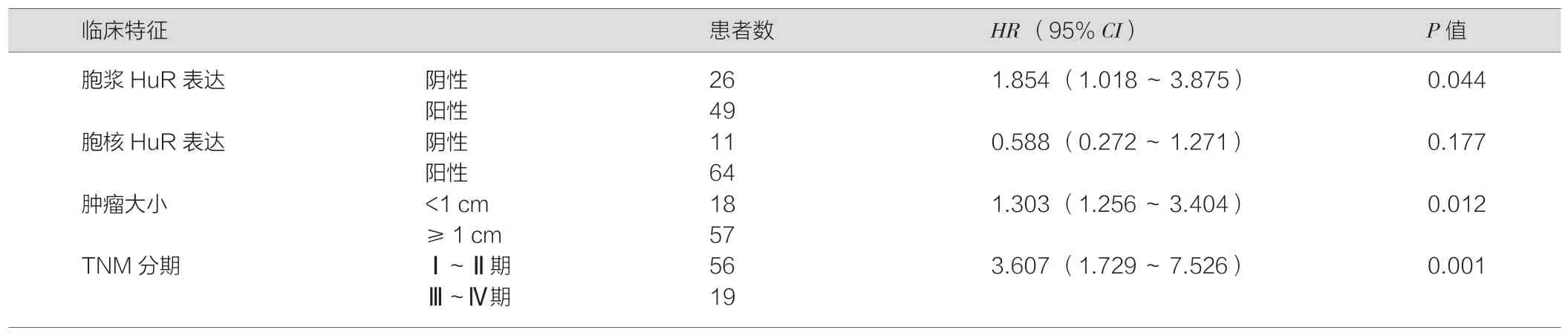
表2 75 例胃癌患者总生存率的COX 模型多因素分析
HuR 在胃癌组织中的表达及其对胃癌浸润、转移的影响。在沈耿等的研究中[12],发现胞浆HuR 表达而不是胞核HuR 表达与VEGF-C 表达显著相关。在多种人类肿瘤中,VEGF-C 表达与淋巴结转移和临床分期密切相关,是评价患者预后的重要因素。HuR 通过调控mRNAs 稳定性,使上皮细胞生长因子、粒细胞集落刺激因子的表达增加,促进细胞增殖。HuR 能稳定并且增加低氧诱导因子(HIα-1)、血管内皮生长因子(VEGF)和环氧化酶-2(COX-2)的mRNAs 的表达,间接促进血管生成。因此,能确保肿瘤细胞的氧供与营养需要,从而促进肿瘤的生长、转移与侵袭[13-14]。本研究发现75例胃癌中胞浆HuR阳性表达者为49例,共阳性率65.3%,胞浆HuR 表达阳性与胃癌肿瘤大小(P=0.014)、淋巴结转移(P=0.002)、TNM 分期(P=0.027)、远处转移(P=0.016)均显著相关。进而说明:胞浆HuR 表达越强,HuR 的高表达,可能促进胃癌组织细胞的生长,胃癌的肿瘤越大;胞浆HuR 表达越强,HuR 的高表达,可能促进胃癌细胞的淋巴结转移,淋巴结转移越多;胞浆HuR 表达越强,HuR 的高表达,可能促进胃癌细胞的远处转移,远处转移越多;以上结果进一步证实了HuR 在肿瘤的发生、发展、转移中存在着相关性。推测HuR 正是通过多种方式,参与胃癌的淋巴管生成、肿瘤增殖,进而促进肿瘤的浸润和转移。
综上所述,根据胞浆HuR 在恶性肿瘤中的过表达和它们的生物学功能以及在肿瘤的发生、发展、转移中存在着相关性;胞浆HuR 表达越强,HuR 的高表达,可能促进胃癌组织细胞的生长,可能促进胃癌细胞的淋巴结转移,可能促进胃癌细胞的远处转移。因此,胞浆HuR 在胃癌中呈高表达,胞浆HuR 而不是胞核HuR表达与胃癌的肿瘤大小、淋巴结转移、TNM 分期、远处转移呈显著正相关。在临床上是否可以考虑通过抑制胞浆HuR 的表达,阻止胃癌组织细胞的生长、淋巴结转移、远处转移等治疗新思路、研究新方向。

