戴氏绿僵菌多糖对糖尿病模型小鼠血糖和免疫功能的影响①
肖代敏 吕纯莉 肖建辉 曹 喻 张志敏 刘 民
(遵义医学院附属医院医学检验科,遵义563099)
·临床免疫学·
戴氏绿僵菌多糖对糖尿病模型小鼠血糖和免疫功能的影响①
肖代敏吕纯莉肖建辉②曹喻张志敏③刘民④
(遵义医学院附属医院医学检验科,遵义563099)
目的:探讨戴氏绿僵菌多糖对糖尿病模型小鼠血糖和免疫功能的影响。方法:采用连续多次小剂量腹腔注射链脲佐菌素(STZ)建立Ⅰ型糖尿病模型,观察模型小鼠体重变化,检测空腹血清葡萄糖,免疫器官(脾脏、胸腺)指数,腹腔巨噬细胞吞噬能力,脾淋巴细胞增殖及血清中免疫球蛋白IgG、补体C3、C4的含量等。结果:戴氏绿僵菌多糖能够改善模型小鼠体重;降低模型小鼠血糖含量,中、高剂量的多糖均能显著提高模型小鼠T、B淋巴细胞的增殖能力(P<0.01);高剂量能显著提高模型小鼠脾脏指数和血清中IgG、C3、C4的含量(P<0.01);中、高剂量能显著提高模型小鼠胸腺指数及腹腔巨噬细胞吞噬能力(P<0.01)。结论:戴氏绿僵菌多糖可增强STZ诱导的Ⅰ型糖尿病模型小鼠的免疫功能和降低Ⅰ型糖尿病模型小鼠血糖含量。
戴氏绿僵菌;多糖;糖尿病模型;链脲佐菌素
虫草是一种稀有的药用真菌,在食品、医药卫生等领域具有重要价值的真菌资源,我国是世界上虫草分布最多的国家,前期研究表明,虫草具有广泛的生物活性,多糖是虫草中主要的活性成分之一,具有抗肿瘤、抗氧化、降血脂、血糖等生物活性[1-7]。戴氏虫草(cordyceps taii Liang&Liu)及其无性型-戴氏绿僵菌(Metarhizium taii Liang&Liu)是一种新发现的虫草,以往研究其具有抗肿瘤、抗氧化及抗突变活性。从免疫学视角观察探讨内分泌代谢异常,尤其对糖尿病与免疫关系的深入剖析是当今该研究领域的重要动向[8]。胰岛素依赖型糖尿病(IDDM)是一种以胰岛β细胞损伤为主要特征的器官特异性自身免疫性疾病,链脲佐菌素(Streptozotoxin,STZ)是目前广泛采用的糖尿病模型化学诱导剂[9]。本文在前期研究基础上,以多次小剂量注射STZ诱导的糖尿病模型小鼠,首次探讨戴氏绿僵菌多糖的免疫功能调节活性。
1 材料与方法
1.1材料
1.1.1戴式绿僵菌多糖由本实验室提取、分离,并经紫外、红外光谱、葡聚糖凝胶柱和GC-MS联用仪分析鉴定[10]。
1.1.2实验动物昆明小鼠,雄性,SPF级[许可证号:SCXK(渝)20070003],三军大动物中心,6周龄,18~22 g。
1.1.3实验药品及器材全自动生化分析仪(日本,Olympus,AU2700);CO2培养箱,全自动酶标仪;MTS细胞繁殖定量检测试剂盒(上海杰美基因医药科技有限公司 GMS10043)。EZ-SepTMMouse 1×淋巴细胞分离液(深圳,达科为生物技术有限公司);刀豆蛋白(ConA,美国,Sigma公司);脂多糖(LPS,美国,Sigma公司);胎牛血清(杭州四季清生物公司);5%鸡红细胞混悬液(自制);链脲佐菌素(STZ,Sigma,18883-664)。
1.2方法
1.2.1试剂配制柠檬酸盐缓冲液:柠檬酸2.1 g,超纯水100 ml,配成A液;柠檬酸钠2.94 g,超纯水100 ml,配成B液。链脲佐菌素配制液:用时将A、B液按1∶1混合,调节pH至4.2~4.5,配制成1%的STZ溶液,新鲜配制,避光,30 min内注射完毕。多糖溶液:按400 mg/kg日剂量,灌胃0.5 ml/只计算(高剂量)。 按200 mg/kg日剂量,灌胃0.5 ml/只计算(中剂量)。按100 mg/kg日剂量,灌胃0.5 ml/只计算(低剂量)。3种浓度的多糖液用生理盐水配制,每周1次,4℃保存。
1.2.2糖尿病模型建立雄性昆明种小鼠58只,1周,建模前将小鼠禁食(不禁水)8 h,称量其空腹体重,断尾取血测血糖浓度。选取血糖浓度为3.5~5.5 mmol/L小鼠随机选取10只作为正常对照组,其余按照前期筛选的模型条件进行建模。链脲佐菌素(STZ):枸橼酸盐缓冲液pH4.2~4.5,新鲜配制1%,过滤除菌,30 min注射完毕,采用连续5次小剂量给药法,腹腔注射50 mg/kg,连续4 d,72 h后禁食不禁水12 h,断尾测空腹血糖,大于11.1 mmol/L作为模型建立成功。对血糖升高不明显的再加强注射一次,剂量同前[10]。
1.2.3实验动物分组及给药将小鼠随机分为五组:空白组、模型组、多糖高剂量组、多糖中剂量组、多糖低剂量组,空白组10只,其余各组12只,适应性喂养1周,除空白组外,其他各组腹腔注射(1.2.1)筛选确定的STZ溶液剂量,空白组注射同剂量的柠檬酸盐缓冲液,注射完毕后72 h测各组空腹血糖,并称量各组小鼠体重,对于血糖值低于8.0 mmol/L的小鼠以相同剂量再加强注射一次。各组开始灌胃相应的药物。空白组每日灌胃相同体积生理盐水,多糖三个剂量组每日灌胃相应剂量的多糖液进行干预,连续3周,实验前禁食12 h,眼眶取血后处死小鼠,测定其腹腔巨噬细胞吞噬率和指数、脾淋巴细胞增殖率及计算脾脏、胸腺指数及其他各项免疫指标,并于开始灌胃前及灌胃后每隔3 d称量一次各组小鼠体重。
1.2.4腹腔巨噬细胞吞噬鸡红细胞试验模型建成后,小鼠处理前30 min注射5%鸡红细胞生理盐水悬液0.8 ml,0.5 h后,用乙醚将老鼠麻醉至昏迷,摘除眼球取血于2 ml的EP管中,离心,取上清测定血糖、IgG、C3、C4。颈椎脱臼处死,经腹腔注射生理盐水2 ml,吸出腹腔洗液0.5~1 ml,滴于载玻片上,于37℃孵化箱中温孵30 min,然后用生理盐水漂洗、晾干,用甲醛溶液固定,瑞氏染液染色5 min,用蒸馏水漂洗、晾干,在显微镜下镜检,计数。记录100个巨噬细胞中吞噬了鸡红细胞的数量和吞有鸡红细胞的巨噬细胞数目,并按下式求出巨噬细胞吞噬率及吞噬指数:吞噬百分率( %) = 吞噬鸡红细胞的巨噬细胞数/计数的巨噬细胞数× 100%;吞噬指数=被吞噬的鸡红细胞/计数的巨噬细胞数[11]。
1.2.5小鼠免疫器官重量测定小鼠末次给药24 h后,将小鼠颈椎脱臼处死,解剖小鼠,取其脾脏和胸腺,吸干表面血污,精密称量,将称量所得的质量换算成各脏器对应的指数[12]。
1.2.6小鼠淋巴细胞增殖实验断颈处死小鼠,浸入75%的乙醇中浸泡5~10 min,在超净台中无菌取出小鼠脾脏,放入装有5 ml EZ-SepTMMouse 1X 淋巴细胞分离液的一次性平皿中。用镊子固定尼龙网,然后用注射器活塞轻轻研磨小鼠脾脏,使得分散的单细胞透过尼龙网(200目)进入淋巴细胞分离液中。把悬有脾脏细胞的分离液立即转移到离心管中,离心前再覆盖上大约 200 μl 的1640 培养基。2 500 r/min离心30 min。吸出淋巴细胞层(培养基层下,分离液上),用10 ml PBS洗涤,2 500 r/min离心10 min。倾倒上清液,加入1 ml完全1640悬液,计数调节制成1.0×107ml-1的脾细胞悬液,细胞培养采用96孔培养板,每孔加入脾细胞悬液100 μl,平行3个复孔,然后加入使得孔最终浓度为5 μg/ml的脂多糖(LPS)和刀豆蛋白(ConA)液10 μl,同时做不加ConA和LPS的阴性对照孔(用10 μl 1640代替),空白对照只加完全1640,37℃,5%CO2培养箱中培养48 h,于培养结束前4 h加入MTS,每孔10 μl(按MTS使用说明书进行),在490 nm处测OD值。
1.2.7小鼠空腹血糖、IgG、C3、C4含量测定小鼠眼眶取血,离心取血清,用全自动生化分析仪测定血清葡萄糖、IgG、补体C3、C4含量。
2 结果
2.1MTP对STZ诱导糖尿病模型各组小鼠体重变化结果模型建立后,前10 d各组小鼠体重均缓慢增加;之后趋于平稳, 模型组15 d开始下降。而其他各组小鼠体重仍缓慢增加,但均低于正常对照组。如图1。
2.2小鼠脾脏和胸腺的指数小鼠脾脏和胸腺指数见表1。由表可知,模型组脾脏指数和胸腺指数均低于其他各组,其中脾脏指数与高剂量组有显著性差异;而胸腺指数与中、高剂量组均有统计学意义;提示MTP有提高模型小鼠脾脏指数和胸腺指数的作用,并存在一定的剂量依赖关系。
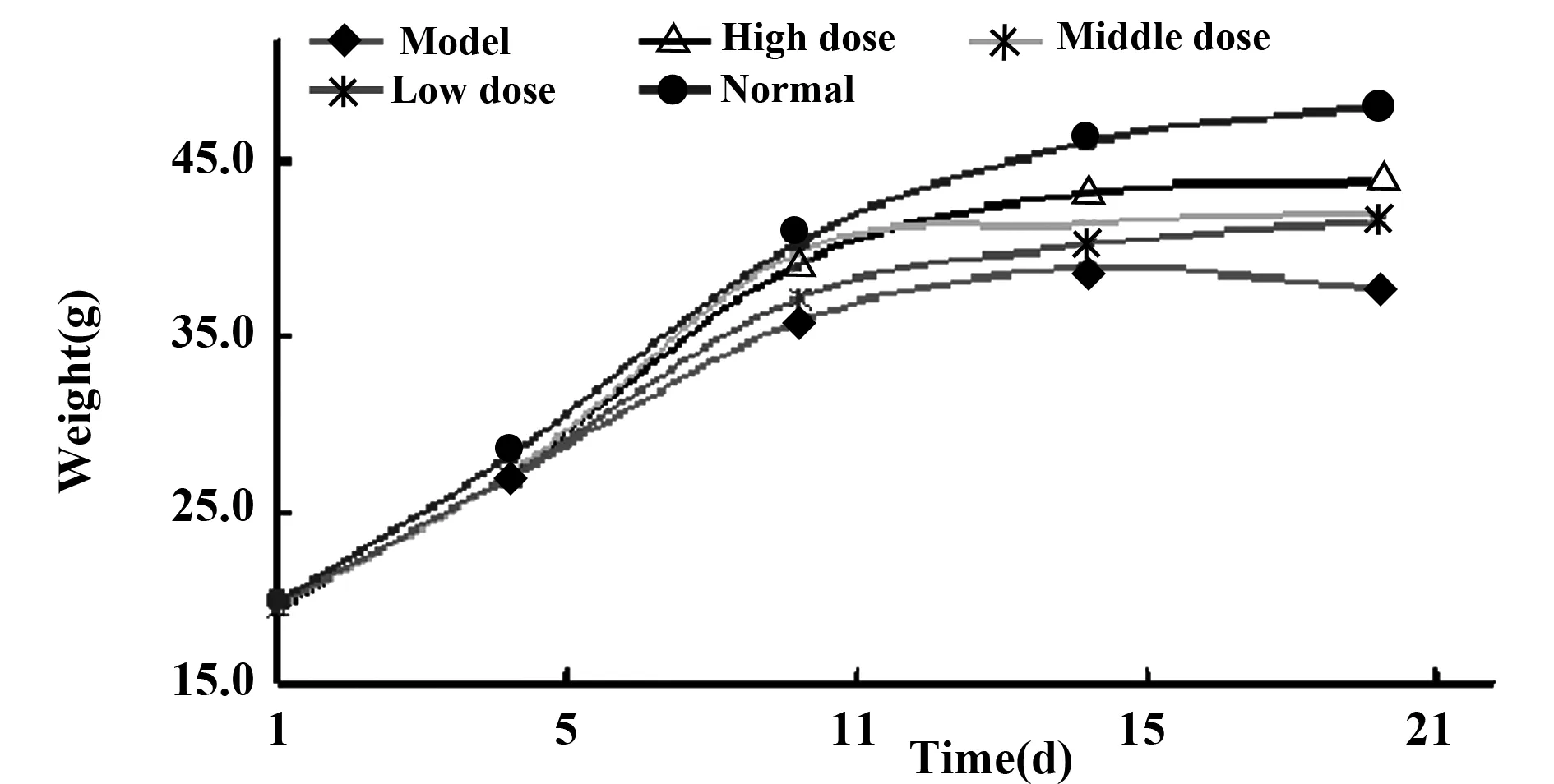
图1 小剂量多次注射STZ诱导糖尿病模型小鼠各组体重变化Fig.1 Body weight changs about diabetes model mice induced by low dose and multiple injections of STZ
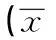
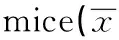
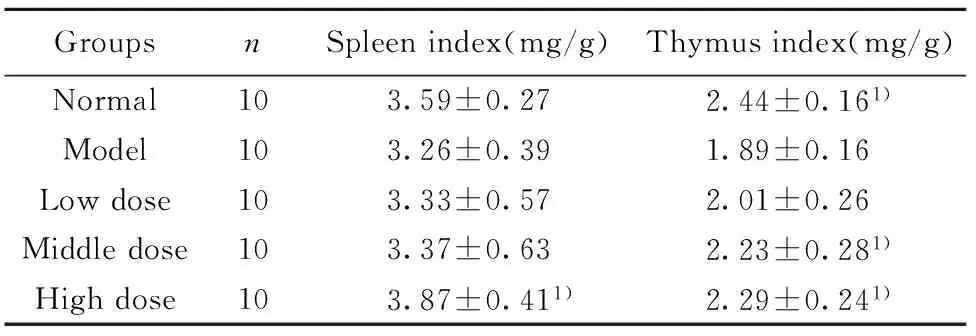
GroupsnSpleenindex(mg/g)Thymusindex(mg/g)Normal103.59±0.272.44±0.161)Model103.26±0.391.89±0.16Lowdose103.33±0.572.01±0.26Middledose103.37±0.632.23±0.281)Highdose103.87±0.411)2.29±0.241)
Note:There was significant difference compared with the model group,1)P<0.05.
2.3小鼠血清IgG、C3、C4含量及血糖测定模型组血清IgG含量最低,正常对照组含量最高,低、中、高剂量组依次上升,且中、高剂量组均高于模型组,提示MTP有提高血清IgG含量的作用,并且达到一定剂量能够对糖尿病模型的IgG进行提高,其高剂量组与模型组比较有显著性差异(P<0.05)。见表2。
2.4腹腔巨噬细胞吞噬能力试验所有剂量的MTP组其吞噬指数均高于正常对照组与模型组,且其根据含量依次上升,吞噬百分率也都高于模型组,但仅高剂量组大于正常对照组,且中、高剂量组与模型组比较有显著性差异(P<0.05),提示MTP达到一定剂量后对糖尿病小鼠的腹腔巨噬细胞吞噬能力有提升。见表3。
2.5小鼠淋巴细胞增殖三种不同剂量的多糖均能提高模型小鼠T、B淋巴细胞的增殖能力,呈梯度增加。中、高剂量组与模型组相比有显著性差异(P<0.05),提示MTP达到一定剂量后对糖尿病小鼠的T、B淋巴细胞增殖均有提升。见表4。
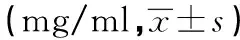
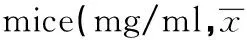
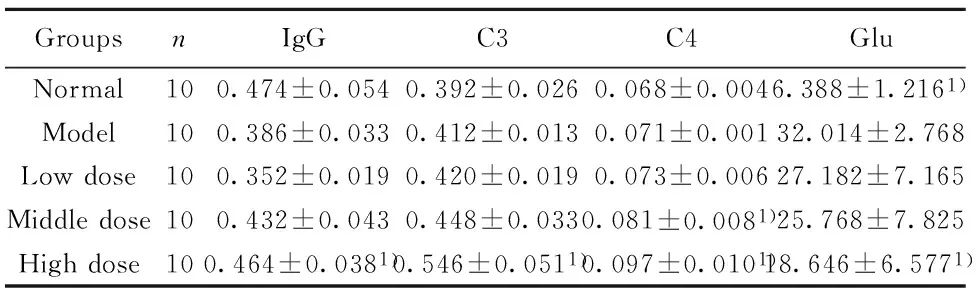
GroupsnIgGC3C4GluNormal100.474±0.0540.392±0.0260.068±0.0046.388±1.2161)Model100.386±0.0330.412±0.0130.071±0.00132.014±2.768Lowdose100.352±0.0190.420±0.0190.073±0.00627.182±7.165Middledose100.432±0.0430.448±0.0330.081±0.0081)25.768±7.825Highdose100.464±0.0381)0.546±0.0511)0.097±0.0101)18.646±6.5771)
Note:There was significant difference compared with the model group,1)P<0.05.
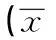
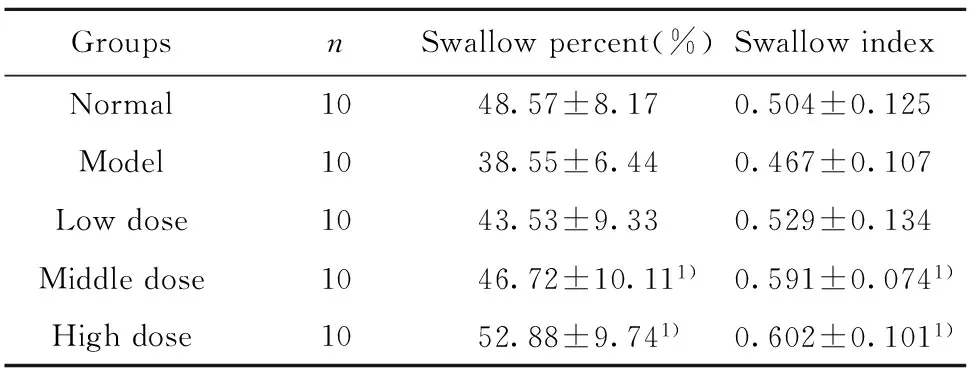
GroupsnSwallowpercent(%)SwallowindexNormal1048.57±8.170.504±0.125Model1038.55±6.440.467±0.107Lowdose1043.53±9.330.529±0.134Middledose1046.72±10.111)0.591±0.0741)Highdose1052.88±9.741)0.602±0.1011)
Note:There was significant difference compared with the model group,1)P<0.05.
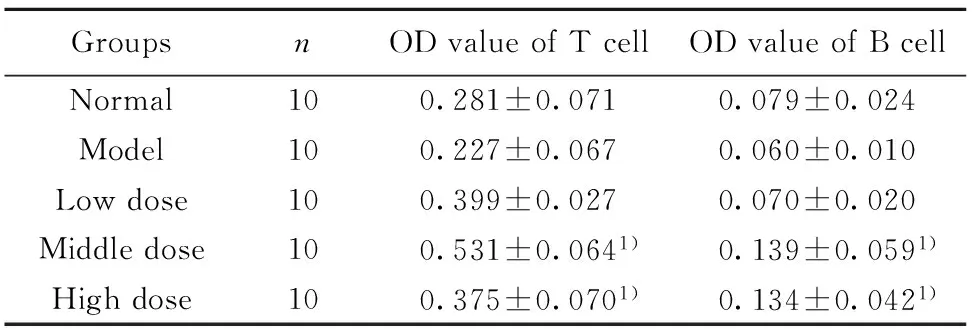
GroupsnODvalueofTcellODvalueofBcellNormal100.281±0.0710.079±0.024Model100.227±0.0670.060±0.010Lowdose100.399±0.0270.070±0.020Middledose100.531±0.0641)0.139±0.0591)Highdose100.375±0.0701)0.134±0.0421)
Note:There was significant difference compared with the model group,1)P<0.05.
3 讨论
糖尿病免疫学研究的根本目的在于从免疫学角度揭示糖尿病的病因及发病机制,从而洞察糖尿病临床表型的本质,为糖尿病分型诊断和免疫干预提供理论基础和实践策略,最终实现对其有效的预防和治疗[13]。多次小剂量注射STZ诱导IDDM的机制主要是通过自发释放NO直接损伤胰岛细胞,使胰岛蛋白质释放并提呈给免疫细胞,进而介导自身免疫应答,最终导致IDDM的发生。本次试验糖尿病模型建模成功,随机血糖与空腹血糖都达到糖尿病诊断标准,小鼠均出现“三多一少”症状。随时间延长,模型组体重较正常组变化明显,经过灌胃不同剂量M.taii多糖进行干预后,各组体重及免疫器官均有所改善,尤其以高剂量组较为明显(见图1,表1);机体免疫系统是由非特异性免疫、体液免疫和细胞免疫共同构成的防御系统。单核巨噬细胞的吞噬能力是衡量机体非特异性免疫功能的重要指标之一[14],巨噬细胞能识别、吞噬和消除病原微生物及机体衰老的细胞,分泌特定的细胞因子,参与机体的炎症反应,通过加工处理提呈抗原,启动特异性免疫应答,对肿瘤细胞的细胞毒作用、细胞因子分泌和抗原释放,有抵御病原体和癌细胞侵袭的作用[15];用血清中免疫球蛋白含量及产生抗体能力高低作为评价动物体液免疫正常与否的指标之一[16],IgG是血液和胞外液的主要抗体成分,占血清总Ig的75%~80% ,发挥重要免疫学效应。在机体中起到抗感染、中和病毒的作用。当IgG含量增加时,机体的免疫功能会随之提高。本实验经M.taii多糖灌胃后,各多糖组的腹腔巨噬细胞吞噬能力、脾淋巴细胞增殖能力和血清中IgG含量等均与模型组有不同程度的改善,并呈现一定的剂量依赖关系,其中,中、高剂量多糖组小鼠腹腔巨噬细胞吞噬能力、脾淋巴细胞增殖能力和高剂量组血清中IgG含量具有统计学意义(P<0.05)。
本文通过小剂量多次注射链脲佐菌素(STZ)诱导建立I型糖尿病模型,并通过灌胃不同剂量的戴氏绿僵菌多糖进行干预,观察其免疫调节功能的活性,结果表明,戴氏绿僵菌多糖可增强胰岛素依赖型糖尿病(IDDM)模型小鼠的细胞和体液免疫功能。
[1]Xiao JH,Liang ZQ,Liu AY,etal.Immunosuppressive activity of polysaccharides from Cordyceps gunnii mycelia in mice in vivo / vitro [J].J Food Agric Env,2004,2 (3&4):69-74.
[2]Xiao JH,Zhong JJ.Secondary metabolites from Cordyceps species and their antitumor activity studies [J].Recent Patents Biotechnol,2007,1 (2):123-127.
[3]Xiao JH,Zhong JJ.Inhibitory effect of polysaccharides produced by medicinal macrofungus Cordyceps jiangxiensis on cancer cells via apoptotic pathway and cell cycle arrest [J].J Food Agric Env,2008,6(2):61-67.
[4]Xiao JH,Xiao DM,Sun ZH,etal.Antioxidative potential of polysaccharide fractions produced from traditional Chinese medicinal macrofungus Cordyceps jiangxiensis in vitro [J].African J Biotechnol,2011,10(34):6601-6615.
[5]Xiao JH,Xiao DM,Chen DX,etal.Polysacch-arides from the medicinal mushroom cordyceps taii show antioxidant and immunoenhancing activities in a D-galactose-induced aging mouse mode[J].Evid-Based Compl Alt Med,2012,1:1-15.
[6]Xiao JH,Xiao DM,Sun ZH,etal.Chemical compositions and antimicrobial property of three edible and medicial Cordyceps species[J].J Food Agric Env,2009,7(3&4):91-100.
[7]肖代敏,肖建辉,孙中华,等.戴氏绿僵菌抗微生物潜力的评估[J].中草药,2010,33(6):952-957.
[8]周智广.再谈糖尿病免疫学研究的趋向[J].中国糖尿病杂志,2007,15(9):513-514.
[9]杨巍,刘丹,于春雷,等.STZ诱导小鼠糖尿病模型中T、B淋巴细胞功能的变化[J].临床免疫学,2006,22(8):754-757.
[10]肖代敏,张志敏,吕纯莉,等.戴氏绿僵菌多糖对衰老模型小鼠免疫功能的影响[J].中国老年学杂志,2016,36(11):2625-2627.
[11]孙囝,郭林海,文旭娟,等.瑞士乳杆菌及其发酵产物对小鼠免疫功能的促进作用[J].营养学报,2009,31(4):392-395.
[12]刘建文.药理实验方法学新技术与新方法(第一版)[M].北京:化学工业出版社,2003:21-91.
[13]周智广.糖尿病免疫学研究:机遇、挑战与希望[J].中华糖尿病杂志,2010,2(1):1-4.
[14]龚非力.医学免疫学(第二版)[M].北京:科学出版社医学出版分社,2004:171-174.
[15]Peter JH,Gieseler R,Thiele B,etal.Dendritic cells:from ontogenetic orphans to myelomonocytie descendants[J].Immunol Today,1996,17(6):273-278.
[16]罗玉芳,杨静华,孙靖.先天性X-链免疫缺陷型CBA/N系小鼠血清中IgG成分的检测[J].上海实验动物科学,1988,8(2):101-104.
[收稿2015-11-05修回2016-03-06]
(编辑张晓舟)
Effect of Metarhiziun taii polysaccharide on serum glucose and immune function of diabetic mellitus model mics
XIAO Dai-Min,LÜ Chun-Li,XIAO Jian-Hui,CAO Yu,ZHANG Zhi-Min,LIU Min.
Clinical Laboratory,Affiliated Hospital of Zunyi Medical College,Zunyi 563099,China
Objective:To investigate the effects of Metarhiziun taii polysaccharide on the immunity activity of the diabetic mellitus model mouse.Methods: To build stables type Ⅰ diabetic model mouse by intraperitoneal injecting small dose streptozotocin (STZ) continuously.Then observeing weight changes,detecting empty stomach serum glucose,immune organ index(include spleen and thymus),peritoneal macrophage phagocyte ability,spleen lymphocyte multiplication and immunoglobulin IgG′s and complement C3,C4 content in blood serum of the diabetic rats.Results: The weight of model mouse had been improved by Metarhiziun taii polysaccharide,serum glucose had been improved degrade of the ability of model mouse.T,B lymphocyte proliferation had been increased obviously by middle and high dose polysaccharid,spleen index,IgG′s and C3,C4 content in blood serum of the diabetic rats could be improved by high dose distinctively.Thymus index and the capacity of peritoneal macrophage phagocyte would enhanced by middle and high dose polysaccharide inject.Conclusion: The immune function and serum glucose of type Ⅰ diabetic mode rats could be improved by intragastriced Metarhiziun taii polysaccharide.
Metarhiziun taii;Polysaccharide;Diabetic mellitus model;STZ
10.3969/j.issn.1000-484X.2016.09.020
,E-mail:zzm_zhangzhimin@126.com,遵义医学院医学遗传学教研室,遵义563000。
肖代敏(1975年-),男,硕士,副教授,主要从事中草药药性实验研究,E-mail:372422022@qq.com。
R285.5
A
1000-484X(2016)09-1338-04
①本文为贵州省科技厅基金(黔科合J字[2009]2148号)和贵州省科技厅联合基金(黔科合J字LKZ[2011]35号)项目。
②遵义医学院附属医院转化医学中心,遵义563000。
④遵义医学院检验系,遵义563000。

