鼠伤寒沙门菌SL1344株cya基因缺失株生物学特性的检测①
刘莎莎 贾艳艳 张春杰 陈松彪 廖成水 杨亚东 王二鑫 程相朝
(河南科技大学动物疫病与公共卫生重点实验室,洛阳471003)
·免疫学技术与方法·
鼠伤寒沙门菌SL1344株cya基因缺失株生物学特性的检测①
刘莎莎贾艳艳②张春杰陈松彪廖成水杨亚东王二鑫程相朝
(河南科技大学动物疫病与公共卫生重点实验室,洛阳471003)
目的:探索鼠伤寒沙门菌cya(adenylate cyclase,cya)基因的功能及其缺失株减毒的初步机制。方法:对鼠伤寒沙门菌SL1344株cya基因缺失株的耐酸碱能力、耐盐性、运动性、生物被膜成分、对上皮细胞黏附、侵袭以及细胞毒性等生物学特性进行检测。结果:cya缺失株的耐酸碱性、耐盐性以及运动能力较亲本菌株有明显降低;生物被膜成分测定结果显示cya缺失株不表达纤维素和菌毛;同时与亲本菌株相比cya缺失株对上皮细胞的黏附和侵袭能力发生了显著的降低,且对细胞毒性的影响弱于亲本菌株。结论:上述结果表明cya基因功能与细菌的运动能力、细胞膜的渗透能力、生物被膜的形成及毒力密切相关,从而为鼠伤寒沙门菌cya基因功能及其缺失株减毒机制的进一步研究提供了理论参考,这也必将有助于研发以减毒鼠伤寒沙门菌为载体的口服疫苗。
SL1344cya缺失株;运动性;生物被膜;黏附;侵入
鼠伤寒沙门菌(Salmonella typhimurium)属于革兰氏阴性菌,是引起人畜发病和食物源性污染的重要微生物[1,2],其宿主极其广泛,全世界每年感染数量约占沙门菌感染量的17%,具有重要的公共卫生学意义。cya(adenylate cyclase,cya)基因编码环化腺苷酸合成酶,最早是在大肠杆菌分解代谢产物阻遏过程中被鉴定义的,随后发现它属于细菌的转录激活蛋白[3]。环腺苷酸(cAMP)是广谱的第二信使,由环化腺苷酸酶合成。cAMP能够激活由crp编码的cAMP受体蛋白(CRP),目前已知的大肠杆菌的7个总调控蛋白中,cAMP受体蛋白是最重要的一个,负责调控一半以上转录的起始。CRP由cAMP激活并在CRP的一段特殊DNA序列处结合形成CRP-cAMP复合体,该特殊序列位于不同操纵子转录起始点的上游,然后其通过与RNA聚合酶相互作用,从而提高其与启动子的结合能力,介导转录起始[4]。细菌缺失cya时也就失去了生成cAMP的能力,因此在一定程度上影响细菌的各种生理活动和物质代谢[5]。本实验室的前期研究中发现猪霍乱沙门菌C78-1Δcya缺失株[6]对小鼠的毒力比C500疫苗菌株低约1.7倍,鼠伤寒沙门菌SL1344Δcya缺失株[7]对小鼠毒力较亲本菌株相比发生了明显的降低,以上结果均说明cya基因缺失后均能够使毒力发生显著的降低,但其减毒机制目前尚不是十分清楚。
因此本实验以前期构建的SL1344Δcya菌株为研究对象,对缺失株进行运动性、耐酸碱性、耐盐性、生物被膜成分和对上皮细胞的侵入、黏附、毒性、增殖的影响等方面进行研究,为鼠伤寒沙门菌cya基因功能及其缺失株减毒机制的进一步研究以及将其开发成疫苗活载体奠定理论基础。
1 材料与方法
1.1材料
1.1.1菌种和质粒鼠伤寒沙门菌SL1344强毒株由南京农业大学惠赠,鼠伤寒沙门菌SL1344Δcya[7]缺失株、宫颈癌上皮细胞系(HeLa细胞)均由河南科技大学动物与疫病公共卫生实验室构建并保存。
1.1.2主要试剂胎牛血清购自杭州四季青公司;DMEM培养基购自Gibco公司;刚果红、考马斯亮蓝、胰蛋白酶、双抗均购自Sigma 公司;Triton X-100 购自Sangon 公司;胰蛋白胨、酵母浸出物等购自英国OXOID公司。
1.2方法
1.2.1缺失菌株SL1344Δcya的运动性检测参照He等[8]方法并加以改进,按照涂板计数方法计算亲本株与缺失株的CFU/ml,使用灭菌PBS将其调整至相同的初始浓度(106CFU/ml),并分别吸取2 μl培养好的细菌菌液滴到含0.3%琼脂的LB半固体平板上,置于细菌恒温培养箱中培养,48 h后观察结果。
1.2.2缺失菌株SL1344Δcya耐酸碱性检测参照陈松彪等[9]方法,将缺失菌株及亲本菌株调至相同的初始浓度,并分别将其按照1∶100的比例转接到不同pH(2~14)梯度的LB液体培养基中,置于恒温培养箱中培养12 h后,测定菌液在OD600nm下的吸光度值。
1.2.3缺失菌株SL1344Δcya的耐盐性检测参照陈等[9]方法将缺失菌株及亲本菌株调至相同的初始浓度,并按照1∶100的比例分别转接至含不同NaCl(0%~8%)浓度的LB液体培养基中,置于恒温培养箱中培养12 h后,测定菌液在OD600nm下的吸光度值。
1.2.4缺失菌株SL1344Δcya的生物被膜主要成分测定参照Peng等[10,11]的方法并加以改进,将培养好的菌液取2 μl滴于含有40 mg/L刚果红和20 mg/L的考马斯亮蓝LB(无NaCl)平板,在28℃ 条件下培养48 h,观察细菌的菌落形态。
1.2.5缺失菌株SL1344Δcya对HeLa细胞的黏附和侵入试验参照Zhu等[10]的方法以每孔1×105细胞数将细胞接种于24 孔板内并将其置于37℃、5%CO2细胞培养箱中培养16 h;感染前用无抗生素的DMEM培养基将培养好的细菌(OD600=0.4)洗三次,按100∶1 的细菌/细胞比例加入细胞培养板,800 r/min离心10 min,置于37℃、5%CO2细胞培养箱中作用2 h;PBS 洗3次,加入300 μl的胰酶消化细胞5 min,再加入700 μl 5%BSA-PBS 吹匀,稀释涂板,培养24 h后计数,以黏附的细菌数/接种细菌数计算黏附率。侵入试验步骤同前,在PBS洗3次后,加入含100 μg/ml庆大霉素的DMEM培养基作用90 min,PBS洗3次,再加入1 ml 0.1%的Triton X-100的PBS吹匀,PBS稀释涂板,以侵入的细菌数/接种细菌数计算侵入率。
1.2.6缺失株SL1344Δcya对HeLa细胞增殖的影响和毒性的检测参照陈松彪等[9]的方法并加以改进,用胰酶将HeLa细胞消化计数后按每孔5×103、1×104个细胞数加入至96孔板中,并放置37℃、5%CO2细胞培养箱中培养24 h后,按照100∶1(细菌数∶细胞数)的比例分别加入亲本株与缺失株,参照MTT细胞毒性和细胞增殖检测试剂盒说明书分别取培养3、6、9、12、24 h的细胞液测定其OD570值。
1.3数据处理利用SPSS软件将试验组与对照组(亲本株与空白对照组)数据进行统计学分析,每次试验重复2个孔,每个试验重复3次,即样本数为6。
2 结果
2.1缺失菌株SL1344Δcya的运动性检测通过将两种细菌在0.3%琼脂的半固体平板上培养48 h后观察,亲本菌株SL1344能够形成较明显的运动圈(图1A),而SL1344Δcya缺失菌株不能形成运动圈,说明cya基因缺失后能够影响菌株的运动性(图1B)。
2.2缺失菌株SL1344Δcya耐酸碱性检测将缺失菌株和亲本菌株在不同pH值的LB液体培养基中培养,在培养后12 h测定OD600nm下的吸光度值(图2),结果表明缺失菌株对酸碱度的耐受性较亲本菌株相比发生了下降。
2.3缺失菌株SL1344Δcya盐的耐受性检测将缺失菌株和亲本菌株在不同盐浓度的LB培养基中培养,分别在培养后12 h测定OD600nm下的吸光度值(图3),结果表明缺失菌株对不同盐浓度的耐受性均低于亲本菌株。
2.4缺失菌株SL1344Δcya的生物被膜主要成分测定在刚果红和考马斯亮蓝的无盐 LB 平板上培养后,野生株SL1344呈红色粗糙型菌落(图4A),而cya缺失株呈白色光滑型菌落(图4B),说明缺失株的菌毛和纤维素的表达减少。
2.5缺失菌株SL1344Δcya对HeLa细胞的黏附和侵入的测定当HeLa细胞在细胞板铺满后,以细菌∶细胞=100∶1接种缺失菌株和亲本菌株后,结果表明cya基因缺失后细菌的黏附和侵入都较亲本菌株相比发生了显著的下降。见图5。

图1 SL1344(A)和SL1344Δcya(B)在0.3%琼脂平板上的运动型观察Fig.1 SL1344(A) and SL1344Δcya(B) swimming zones through 0.3% LB agar
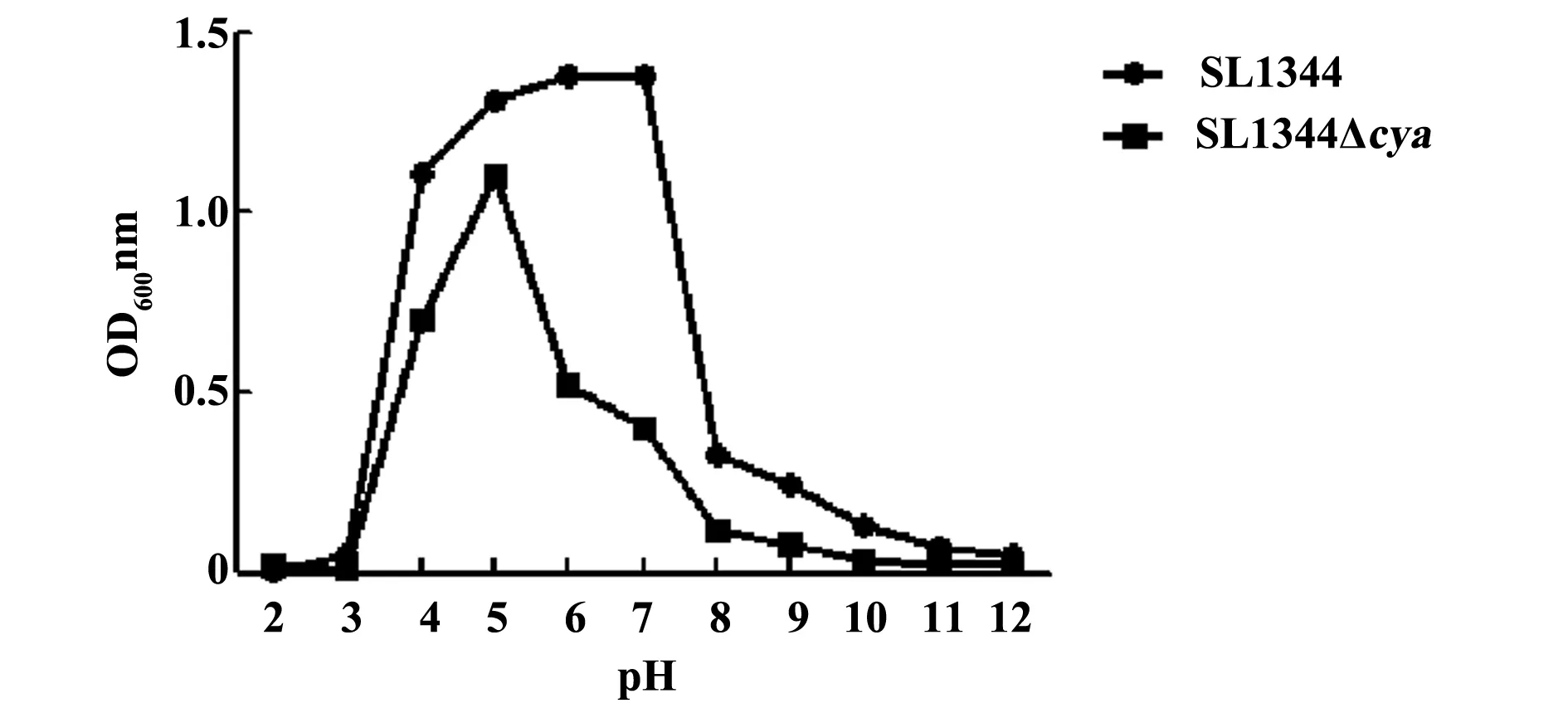
图2 SL1344和SL1344Δcya在不同pH值的LB培养基中的吸光度值测定Fig.2 Absorbance of SL1344 and SL1344Δcya mutant at different pH in LB medium
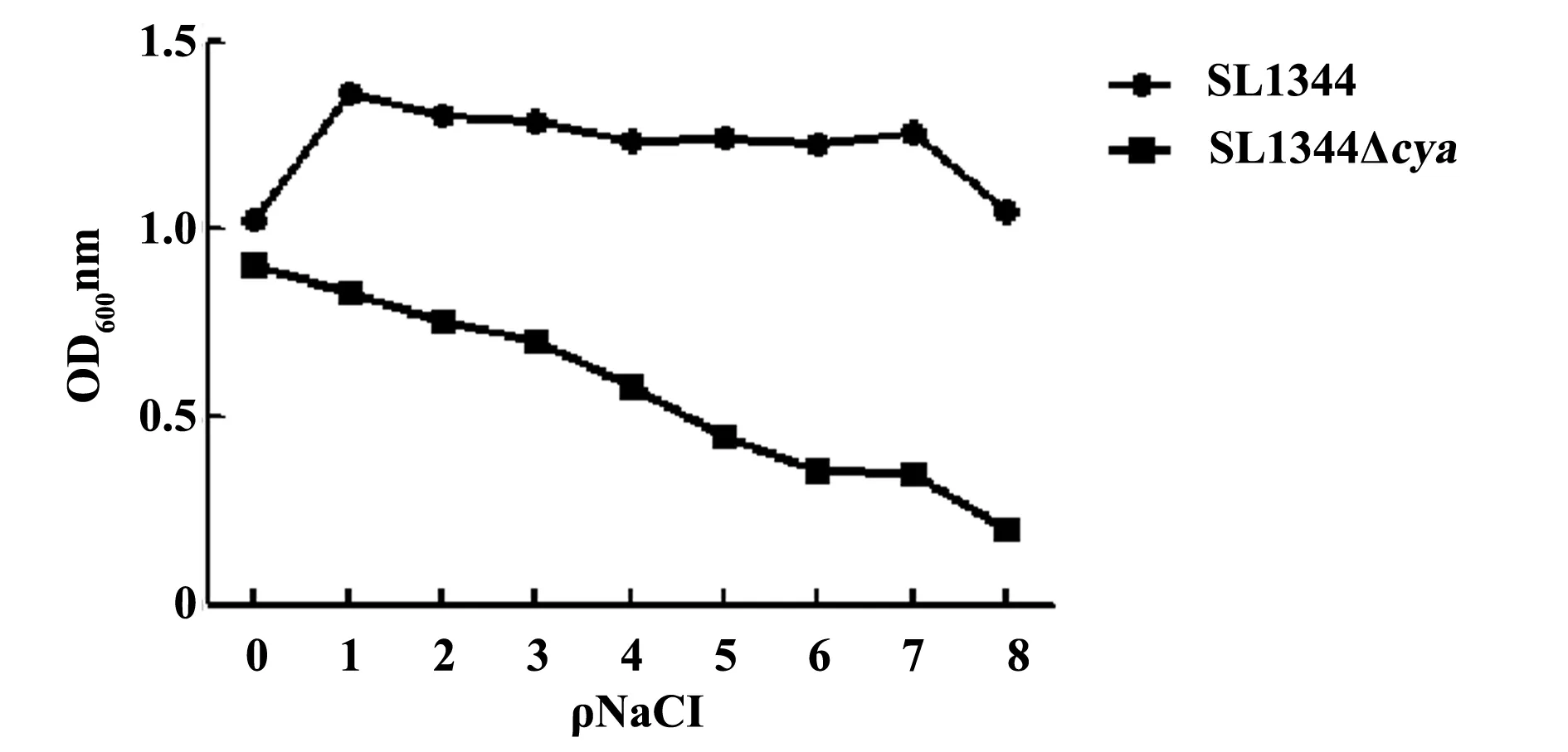
图3 SL1344和SL1344Δcya在不同盐浓度的LB培养基中的吸光度值测定Fig.3 Absorbance of SL1344 and SL1344Δcya at different salt concentrations in LB medium
2.6缺失菌株SL1344Δcya对HeLa细胞的毒性及增殖的影响取培养后不同时间点的细胞,按照试剂盒说明书测定OD570值。图6结果表明cya基因缺失株与亲本株相比,对HeLa细胞的毒性明显降低,但cya基因缺失株对细胞增殖的影响程度与亲本株相比也有明显的降低。

图4 SL1344(A)和SL1344Δcya(B)基因缺失株在刚果红和考马斯亮蓝的无盐平板上的形态Fig.4 Morphotypes of SL1344 and SL1344Δcya mutant grown on plates of LB no-salt agar supplemented with Congo red and Coomassie brilliant blueG

图5 亲本SL1344和SL1344Δcya缺失株的细胞黏附(A)和侵入(B)Fig.5 Adherence(A) and (B)invasion assay to cells by SL1344 and SL1344Δcya mutantNote: *.P<0.05.

图6 SL1344Δcya和SL1344对HeLa细胞的毒性(A)及对HeLa细胞增殖的影响(B)Fig.6 Toxicity of SL1344Δcya and SL1344 to HeLa cell(A) and proliferation of SL1344Δcya and SL1344 on HeLa cell(B)Note: *.P<0.05.
3 讨论
近年来对沙门菌毒力基因研究的深入,以开发减毒沙门菌疫苗为目标的基因大致可以分为两大类,一类与营养代谢有关,另一类与毒力相关。cya基因主要编码环化腺苷酸合成酶,和cAMP受体蛋白形成的二元复合物对许多基因和操纵子的转录是必不可少的[10],在本实验室的前期研究中发现cya基因缺失后会影响细菌的一些糖酵解作用,但会使其毒力发生降低,但仍然具有较好的免疫原性[6],李静等[11]报道构建的SL1344Δcya缺失株载体平衡致死系统能够有效地呈递外源基因,有潜力作为鼠伤寒沙门菌疫苗活载体的候选菌株,尚珂等[12]构建猪霍乱沙门菌C78-1ΔcyaΔcrpΔasd毒力较亲本菌株相比显著降低,但仍具有较好的免疫原性,有潜力作为疫苗候选菌株。但是对于缺失cya基因后对细菌其他方面生物学特性影响暂不十分清楚。因此本实验以鼠伤寒沙门菌cya基因缺失株为研究对象,分别对缺失株和亲本菌株进行运动性、耐酸碱性、耐盐性、生物被膜成分和对上皮细胞的黏附、侵入、毒性及增殖的影响方面进行研究。
对鼠伤寒沙门菌SL1344Δcya基因缺失株进一步的生物学特性研究结果表明,细菌缺失cya基因后在半固体琼脂平板上形成的运动圈较亲本菌株相比发生了显著的降低,说明该基因缺失后会影响细菌的运动性,我们推测该基因缺失后可能会影响细菌鞭毛和菌毛相关蛋白的形成,是否是由于这种机制引起的尚需要进一步的验证;耐酸碱性以及耐盐性结果表明:cya基因缺失后其对酸碱性以及盐的耐受性较亲本菌株相比均发生了下降,说明cya基因会影响细菌细胞膜的渗透性。
沙门菌生物被膜的主要成分为卷曲菌毛和纤维素,在刚果红和考马斯亮蓝平板上能够形成四种形态的菌落[13]:(1)红色干燥粗糙型,表示该细菌可产生菌毛和纤维素;(2)棕色干燥粗糙型,表示该细菌只产生菌毛;(3)粉色干燥粗糙型,表示该细菌只产生纤维素;(4)白色光滑型,表示该细菌不产生菌毛和纤维素。在本试验中cya缺失菌株的生物被膜主要成分测定表明:该基因缺失后影响菌毛和纤维素的表达,故缺失菌株在刚果红平板上呈现白色光滑的菌落形态,从而有可能影响其生物被膜的形成,从而影响其毒力,这与本实验室的前期试验结果相类似,即cya基因缺失株可能是通过影响生物被膜的形成从而达到减毒的目的,紧接着我们又进行了该基因缺失株对上皮细胞的黏附和侵入试验,发现cya基因缺失后会影响其对上皮细胞的黏附和侵入能力,并且通过对HeLa细胞的毒性与增殖的影响实验也显示出缺失cya基因后对细胞的毒性与亲本株相比有明显的降低,对细胞增殖的影响程度也有所下降。
综上所述,cya基因缺失后使细菌失去了流动性的能力;在刚果红和考马斯亮蓝的无盐 LB 平板上对生物被膜成分测定结果表明cya缺失株呈白色光滑型菌落,菌毛和纤维素的表达减少;对上皮细胞的黏附和侵入试验结果表明cya基因缺失株对上皮细胞的黏附和入侵能力与亲本菌株相比均发生了显著的降低。为进一步研究鼠伤寒沙门菌cya基因功能及其缺失株减毒机制的进一步研究以及将其开发成疫苗活载体奠定理论基础。
[1]Velez E,Castillo N,Mesón O,etal.Study of the effect exerted by fructo-oligosaccharides from yacon(Smallanthus sonchifolius) root our in an intestinal infection model with Salmonella Typhimurium [J].Br J Nutr,2013,109(11):1971-1979.
[2]Dougan G,John V,Palmer S,etal.Immunity to salmonellosis [J].Immunol Rev,2011,240(1):196-210.
[3]Huang YK,Chu C,Wu CH,etal.Evaluation of Gram-negative bacterial infection by a stable and conjugative biolu minescence plasmid in a mouse model[J].J Biomed Sci,2014,21(1):78-81.
[4]张红艺,阚飙.cAMP受体蛋白在细菌中的转录调控作用研究进展[J].生物技术通讯,2009,28(1):94-98.
[5]Stapleton M,Haq I,Hunt DM,etal.Mycobacterium tuberculosis cAMP receptor protein(Rv3676) differs from the Escherichia coli paradigm in its cAMP binding and DNA binding properties and transcription activation properties[J].J Biol Chem,2010,285(10):7016-7027.
[6]张俊峰,张春杰,程相朝,等.猪霍乱沙门菌缺失株ΔcyaC78-1和ΔcrpΔcyaC78-1的构建及其生物学特性比较[J].中国兽医科学,2014,44(8):781-788.
[7]余祖华,陈松彪,张春杰,等.五铢鼠伤寒沙门菌基因缺失株的生物学特性比较[J].中国兽医学报,2015,35(8):1275-1279.
[8]He Y,Xu T,Fossheiml E,etal.FliC,a flagellin protein,is essential for the growth and virulence of fish pathogen Edwardsiella tarda[J].PLoS One,2012,7(9):e45070.
[9]陈松彪,张春杰,陈慧敏,等.鼠伤寒沙门菌crp基因缺失株SL1344Δcrp生物学特性的测定[J].中国兽医科学,2015,45(7):729-733.
[10]黄骏,陈素娟,黄凯,等.鸡白痢沙门氏菌生物被膜形成相关基因rpoE的鉴定[J].微生物学报, 2015,55(2):156-163.
[11]李静,陈松彪,余祖华,等.鼠伤寒沙门菌SL1344株环化腺苷酸合成酶缺失株平衡致死系统的构建及其雏鸡免疫保护试验[J].微生物学报,2015,55(7):942-948.
[12]尚珂,张俊峰,程相朝,等.减毒猪霍乱沙门菌Δcrp-ΔcyaΔasdC78-1(pYA3493)宿主-载体平衡致死系统的构建及其生物学特性研究[J].中国免疫学杂志,2015,31(3):358-363.
[13]董洪燕,彭大新,焦新安,等.肠炎沙门氏菌鸡源株ompR基因缺失株的构建及生物学特性与亲本株的比较[J].微生物学报,2011,51(9):1256-1262.
[收稿2016-01-27修回2016-03-01]
(编辑倪鹏)
Characterization of a Salmonella typhimurium SL1344 cya mutant strain
LIU Sha-Sha,JIA Yan-Yan,ZHANG Chun-Jie,CHEN Song-Biao,LIAO Cheng-Shui,YANG Ya-Dong,WANG Er-Xin,CHENG Xiang-Chao.
The Key Lab of Animal Disease and Public Health,Henan University of Science and Technology,Luoyang 471003,China
Objective:To explore the function of thecyagene and the preliminary mechanism of attenuated strain.Methods: The biological characteristics ofcyamutant in acid and alkali resistant,salt resistance,motility,biofilm components,poisonous to the cells of epithelial cell adhesion,invasion were analysis.Results: The mobility capabilities,acid and alkali resistance and salt tolerance ofcyamutant were significantly lower than the parent strain;the composition testing revealed that thecyamutant did not produce cellulose,curli and biofilm;at the same time the adhesion and invasion to epithelial cells ofcyamutant had a prominent depression,and the toxicity to HeLa cells was weaker than the parent strain.Conclusion: The function ofcyagene is closely related to athletic ability,penetration of cell membrane,the formation biofilm and virulence.It will provide a theory reference to the functional research of Salmonella typhimuriumcyagene and the mechanism of attenuated strain.This will contribute to the development of oral vaccine using attenuated Salmonella typhimurium as vector.
SL1344cyamutant;Motility;Biofilm;Adhere;Invade
10.3969/j.issn.1000-484X.2016.09.016
刘莎莎(1991年-),女,硕士,主要从事人畜共患病的诊断和防治研究,E-mail:15515319853@163.com。
及指导教师:张春杰(1964年-),女,博士,教授,硕士生导师,主要从事动物疫病防控和分子免疫学方面的研究,E-mail:cjzhang@sina.com。
S852.612
A
1000-484X(2016)09-1319-04
①本文受国家自然科学基金(31572489)和河南省重点科技攻关项目(152102110078)资助。
②共同第一作者。

