IL-10+IL-4能提高M2巨噬细胞表型和嗜酸性粒细胞的迁移①
童晓鹏 杨 波 门连超 张群辉
(西藏民族大学,咸阳712082)
IL-10+IL-4能提高M2巨噬细胞表型和嗜酸性粒细胞的迁移①
童晓鹏杨波门连超张群辉
(西藏民族大学,咸阳712082)
目的:研究论证IL-10是否能通过诱导IL-4来提高M2。方法:用C57BL/6J鼠中的骨髓细胞诱导M-CSF诱导的骨髓源巨噬细胞,利用小鼠全基因组版本进行转录,进而嗜酸性粒细胞的迁移实验,体内巨噬细胞的转移实验。结果:研究发现在M-CSF诱导的BMDMs中通过IL-4、IL-10及IL-4+IL-10诱导来分析M2巨噬细胞,IL-10通过IL-4来提高M2a标志物的表达,此外,IL-4和IL-10诱导产生CCL24时起协同作用。在GM-CSF诱导的BMDMs中CCL24的表达提高。CCL24是CCR3的激动剂和嗜酸性粒细胞的趋化因子。在体外,IL-4+IL-10激活的巨噬细胞产生大量的CCL24,并且能提高嗜酸性粒细胞的迁移。这个过程能被抗CCL24抗体抑制。IL-4+IL-10激活的巨噬细胞转移到C57BL/6J小鼠的腹膜,这能增加嗜酸性粒细胞浸润腹膜腔。结论:IL-4+IL-10激活的巨噬细胞能增强M2a巨噬细胞相关基因的表达,提高CCL24的产生和嗜酸性粒细胞的浸润,导致嗜酸性粒细胞相关疾病的发生。
IL-4;IL-10;CCL24;嗜酸性粒细胞;M2a巨噬细胞
巨噬细胞是先天性免疫细胞,在维持稳态、组织重塑和宿主防御中发挥着重要的作用[1]。不同的微环境,巨噬细胞的功能和分化受各种因子的影响。这些因子包括:细胞因子、趋化因子和TLRs[2]。分化的巨噬细胞可以分为M1和M2。IFN-γ和TLR激动剂能诱导经典活化的巨噬细胞和M1。而M2巨噬细胞能通过各种刺激诱导。例如:M2a通过IL-4或IL-13诱导[3,4];M2b通过IL-1或LPS免疫复合物进行诱导[5];M2c通过IL-10或糖皮质激素进行诱导[6,7]。虽然通过单一的细胞因子能诱导出很多巨噬细胞表型,但是有一些巨噬细胞亚群需要复合细胞因子进行诱导[8]。
在体内分化的M2巨噬细胞能诱导Th2和嗜酸性粒细胞浸润,这两种细胞与过敏和蠕虫感染相关[4,9]。同时有研究表明:IL-4诱导的M2a巨噬细胞能促进Mrc1(也叫作CD206)、精氨酸酶1(Arg1)、Chi313和Retnla表达,产生CCL17、CCL22和CCL24;IL-10通过STAT3途径诱导IL-4Rα的表达,从而导致精氨酸酶1的表达增强[10,11]。虽然这些研究表明:M2巨噬细胞在体内的嗜酸性粒细胞浸润时发挥着重要的作用,但是对于IL-4是否单独赋予嗜酸性粒细胞浸润的能力这一问题,依旧不清楚。有研究表明:体内细胞因子的组合可以通过M2巨噬细胞能诱导Th2细胞应答和嗜酸性粒细胞浸润。这些细胞因子有IL-13+胸腺基质淋巴细胞(TSLP)、IL-4/IL-13+IL-33[12,13]。但这些研究是否对于M2巨噬细胞直接在体内诱导嗜酸性粒细胞,这一问题依旧不清楚。因为当M2巨噬细胞转移到动物内,诱导嗜酸性粒细胞时,并没有这种现象。
研究试图证明IL-10是否通过用IL-4诱导提高M2巨噬细胞表型。结果证明:IL-10诱导IL-4Rα表达和提高精氨酸酶1的表达;以及IL-10提高M2a巨噬细胞相关的基因表达,提高CCL24的产量以及能在体外提高用IL-4诱导的M2巨噬细胞来促进嗜酸性粒细胞迁移。因此,进一步证实,IL-4+IL-10诱导的M2巨噬细胞能在小鼠体内诱导嗜酸性粒细胞浸润。
1 材料与方法
1.1材料
1.1.1试剂从R&D Systems(明尼阿波利斯,MN,USA)得到重组小鼠细胞因子。用Pepro技术得到重组人细胞因子(普林斯顿,NJ,USA)。LPS(L4391)从西格玛-奥德里奇获得(路易斯,MO,USA)。抗体从BD公司(富兰克林湖,新泽西州,USA)、eBioscience(Sa Diego,CA,USA) 以及 AbD Serotec(Oxford,UK)购买。用市售试剂盒ELISA测定鼠的CCL24(DY528,研发系统)。
1.1.2实验动物C57BL/6J和BALB/c鼠从查尔斯河实验室购买(日本)。
1.2方法
1.2.1巨噬细胞的培养用C57BL/6J鼠中的骨髓细胞在RPMI1640中培养7 d来诱导M-CSF诱导的骨髓源巨噬细胞。其RPMI1640中成分包括10%的胚胎牛血清、100 U/ml青霉素、100 μg/ml的链霉素和巨噬细胞集落刺激因子(50 ng/ml)。用GM-CSF(10 ng/ml)来替代M-CSF来诱导GM-CSF诱导的骨髓源巨噬细胞。先天性巨噬细胞来源于C57BL/6J鼠腹腔液。巯基乙酸盐诱导的巨噬细胞的获得方法:在C57BL/6J鼠腹膜内注射2 ml 3%的巯基乙酸,3 d后取其腹腔液。酵母多糖诱导的巨噬细胞获得方法:在C57BL/6J鼠腹膜内注射1 mg酵母多糖,24 h后取其腹腔液。为了诱导巨噬细胞表型,巨噬细胞用LPS(10 ng/ml)+IFN-γ(50 ng/ml),IL-4(10 ng/ml),IL-1β(10 ng/ml),IL-10(10 ng/ml)、TGF-β(10 ng/ml)和IL-4+IL-10分别进行刺激。控制组的巨噬细胞孵化24 h。
1.2.2PCR的定量分析根据说明书,细胞的裂解和纯化总RNA使用 Qiagen microRNeasy系统(Qiagen,希尔登,德国)。总RNA反转录cDNA合成试剂盒使用SuperScript Vilo cDNA synthesis kit(生命科技,卡尔斯巴德,CA,USA);定量PCR检测方法使用Taqman(通用探针库,罗氏,朋茨博格,德国)。用β肌动蛋白(β-actin)水平作为标准化控制;倍数表示使用ΔCT方法计算。引物使用Arg1(NM_007482.3;forward,ggcaaggtgatggaagagac;reverse,aggtgaatcggccttttctt;probe,#3),CCL24(NM_019577.4;forward,cctctgtccctgaacttgga;reverse,tcccagctggtctgtcaaa;probe,#64),大鼠抵抗素样α(Retnla)(NM_020509.3;forward,ttgggagatccaga-gtggag;reverse,cagtggtccagtcaacgagtaa;probe,#96),IL-4Rα(NM_001008700.3;forward,gagaggacaacc-ctgcagaa;reverse,caggatgttgatcgggaag;probe,#64),Mrc1(NM_008625.2;forward,caacccaagg-gctcttctaa;reverse,ggcacctatcacaatcaggag;probe,#18),β肌动蛋白(NM_007393.3;forward,tcaacaccccagccatgta;reverse,gtggtacgaccagaggcatac;probe,#64)。
1.2.3流式细胞仪细胞在冰冻的流式细胞仪(00-4222-26,eBioscience)中进行冲洗。然后,用Fc块(CD16/CD32抗体)孵化5 min。加入每个抗体,在孵化30 min,再次用流式细胞仪冲洗。用MACSquant (美天旎,贝尔吉施格拉德巴赫,德国)获取数据,用FlowJo(树星,亚什兰,OH,USA)分析数据。
1.2.4芯片分析RNA提取试剂盒分离使用Rneasy mini kit(Qiagen)。利用小鼠全基因组版本进行转录谱2.0阵列(G4846A,安捷伦科技,圣克拉拉,CA,USA)。对基因芯片进行扫描(Agilent Technologies),数据提取时利用Feature Extraction软件版本9.5.1,然后分析使用GeneSpring GX软件进行分析,版本12.6(Agilent Technologies)。继第75个百分位移位正常化后,探头列表在信号强度值的基础上,来排除所有样本中基因表达非常低水平的基因(最低点设置为20%)。主成分分析是分配数据的一般变量到一组简化的主成分变量。当平均倍数的变化调节至少为2时,基因被定义为差异调节。
1.2.5体外嗜酸性粒细胞的迁移实验 BALB/c小鼠在第0、1、6、8和14天时,皮下注射稀释10倍的豚草花粉提取物(Torii Pharmaceutical,Tokyo,Japan)进行致敏。在第20天时,将稀释10倍的豚草花粉提取物进行腹腔注射。在注射48 h后进行腹腔液收集。腹腔液的嗜酸性粒细胞通过阴性选择的Thy1.2和B220 MACS磁珠进行分选。嗜酸性粒细胞加入到ChemoTx系统(106-5,神经探针,马里兰州,美国)上室。将以下几组加入到ChemoTx系统下室。这些组分别为:CCL24组(A);用IL-4、IL-10和IL-4+IL-10刺激BMBMs的上清液72 h组(B);用10 ng/ml的IL-4、IL-10、IL-4+IL-10刺激BMBMs的上清液72 h和不加细胞因子的10 μg/ml同型对照抗体(14-4321-81,eBioscience)组及抗CCL24抗体(mab528,研发系统)组(C);仅有细胞因子组(10 ng/ml的IL-4、IL-10、IL4+IL-10)(D)。在刺激1 h后,测量迁移到下室的细胞采用celltiterglo(Promega公司,麦迪逊,WI,USA)。
1.2.6体内巨噬细胞的转移C57BL/6J小鼠腹腔注射5×106同系的巨噬细胞,分别用PBS(溶剂对照),10 ng/ml IL-4,10 ng/ml IL-10和IL-4 + IL-10培养24 h,并且用1 μl的5-氯甲基二已酸荧光素(CMFDA;Life Technologies)标记0.5 h。注射生理盐水(没转移组)。12 h后,使用流式细胞仪检测腹膜液。从分析中去除CMFDA+(称为FITC+)细胞,以此来消除细胞转移。通过FlowJo分析腹膜液细胞中嗜酸性粒细胞(Siglec-F+/CD115+)和单核细胞/巨噬细胞(CD115+)的比率,而腹膜液细胞中嗜酸性粒细胞和单核细胞/巨噬细胞(CD115+)的比率是通过乘以腹腔液细胞总的比例来计算的。
1.3数据分析 数据采用非配对的双尾t检验进行计算,其组间统计结果以P≤ 0.05为差异有统计学意义。
2 结果
2.1骨髓源巨噬细胞中,IL-10诱导IL-4Rα表达为了说明M2巨噬细胞在转录方面的特点,用LPS+IFN-γ,IL-4、IL-1β、IL-10和TGF-β刺激BMDMs 24 h,而BMDMs是由M-CSF诱导得到的(在这里,除非有说明,BMDMs一般指M-CSF诱导的BMDMs)。然后用芯片进行分析。与之前的报道相似[10,11],我们发现用IL-10诱导的IL-4Rα表达增加。用IL-10刺激BMDMs产生的IL-4Rα是不刺激BMDMs的14.2倍。用LPS+IFNγ刺激的BMDMs产生的IL-4Ra最多为2.7倍,见图1。另一方面,所有的组中,IL-10Rα的表达没有明显改变(数据未显示)。我们证实:用实时定量PCR进行测定,得出的结果如下:用IL-10刺激骨髓源巨噬细胞产生的IL-4Rα基因的表达高于用其他细胞因子刺激产生的(图2A)。流式细胞仪分析的结果与上述一致:在BMDMs中,IL-10以剂量依赖的方式促进IL-4Rα蛋白的表达(图2B、C)。
2.2用IL-4+IL-10刺激BMDMs促进M2a相关基因的表达IL-10诱导IL-4Rα表达与先前报道的一致[10,11]。因此,我们评价IL-10是否可以通过IL-4诱导来提高M2巨噬细胞相关基因的表达。微阵列证实:转录与IL-4、IL-10和IL-4+IL-10刺激的巨噬细胞相关。主要成分分析结果显示:巨噬细胞极化与转录水平的改变相关,而且这些表达谱不同于其他巨噬细胞的表达(图3A)。但是,IL-4+IL-10刺激的巨噬细胞与控制组相比,其具有较大量的差异表达基因,这些差异基因与IL-4刺激的巨噬细胞相同(图3B)。
接下来,我们用微阵列数据进一步分析M2a相关的基因。在图4中,用IL-4+IL-10刺激的BMDMs中有25个表达上调的基因,其中,包括用IL-4刺激BMDMs时表达上调的基因13个。然而仅有4个基因是IL-10刺激BMDMs的基因。在这些基因中,用IL-4刺激BMDMs诱导M2a巨噬细胞相关基因(Retnla、Arg1、Chil313)与之前的报道一致[10,11]。除了IL-4以外,IL-10单独诱导的基因的效果没这么明显,IL-10能进一步诱导M2a巨噬细胞相关基因。IL-4和IL-10能协同诱导产生CCL8、CCL22、CCL24。用IL-4+IL10刺激BMDMs对比用IL-4刺激BMDMs时,CCL17的表达没有升高。
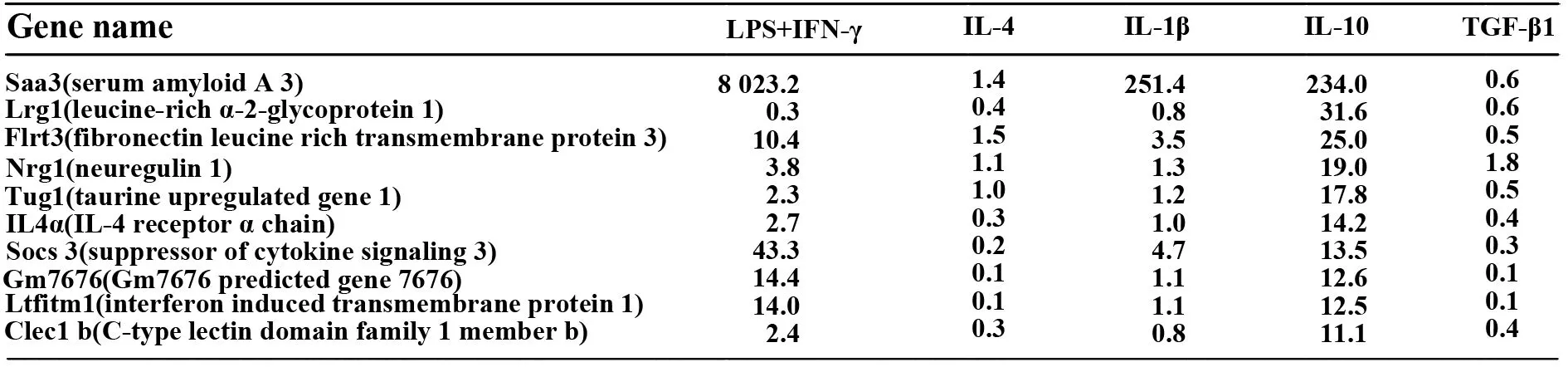
图1 10个IL-10诱导M2c巨噬细胞中上调基因的列表Fig.1 List of 10 most highly upregulated genes in IL-10-induced M2c macrophages
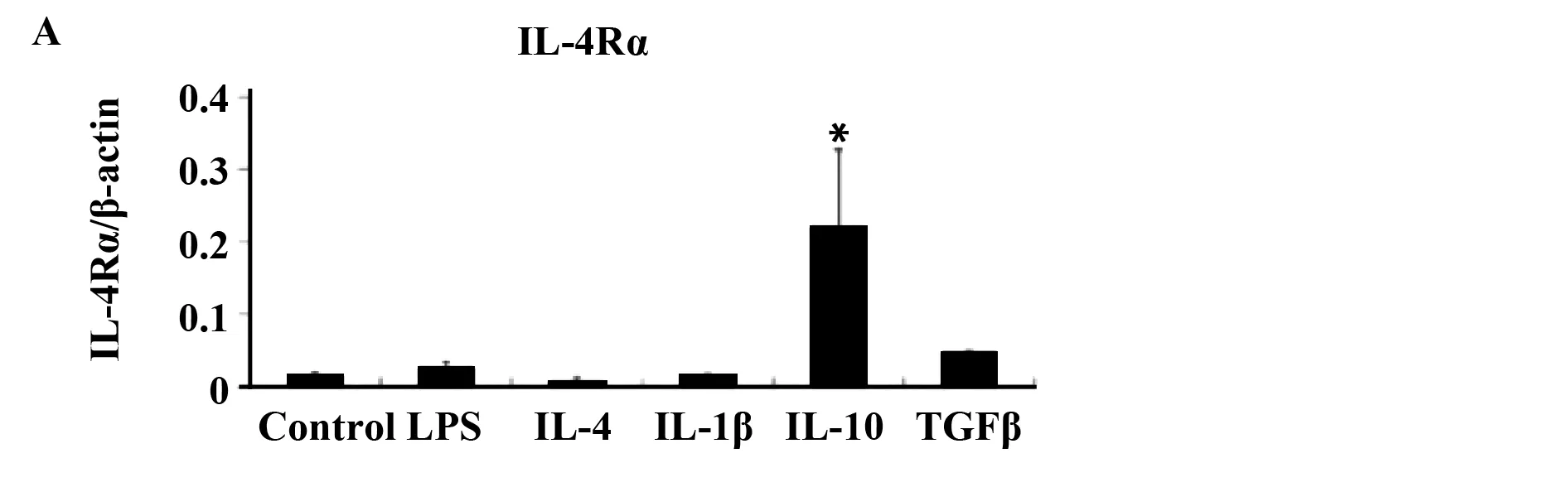
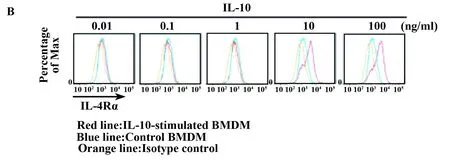
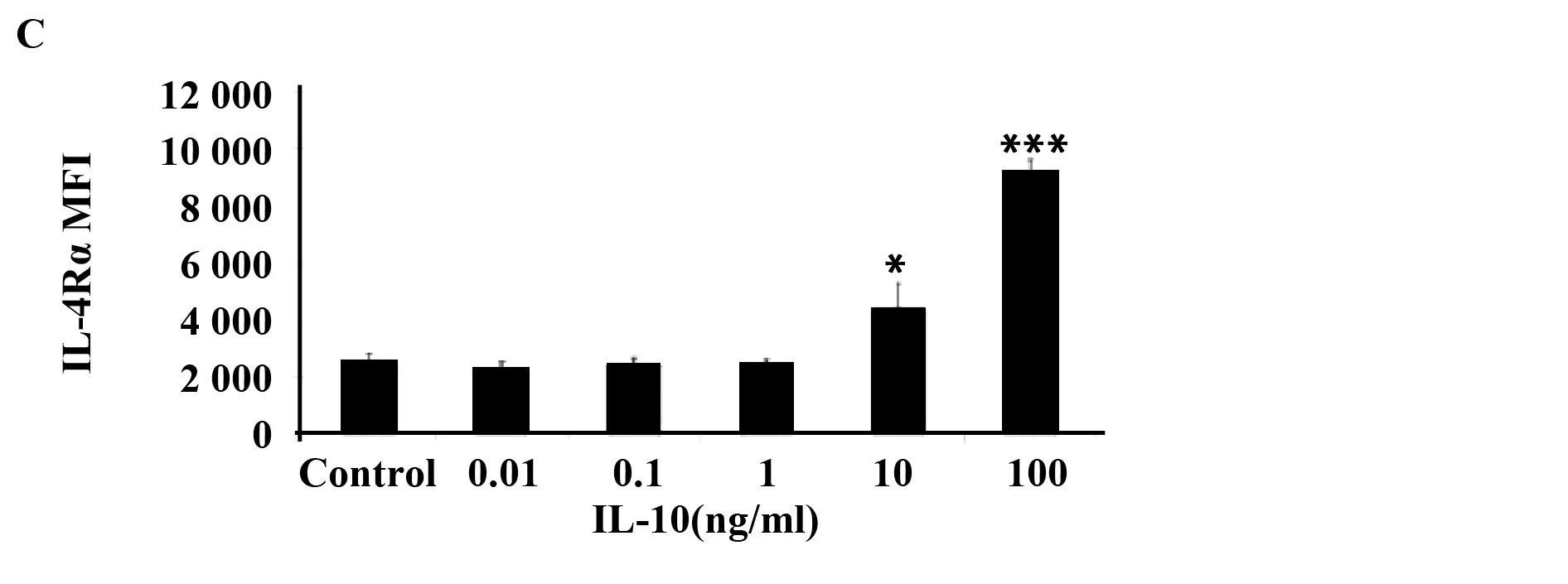
图2 IL-10提高骨髓源巨噬细胞中IL-4Rα的表达Fig.2 IL-10 enhances IL-4Rα expression in BMDMNote: BMDMs were stimulated for 24 h. IL-4Rα gene expression in BMDMs was determined using real-time PCR (A). The IL-4Rα protein level was determined using flow cytometry (B). One of three representative experiments,in which similar results were obtained,is shown. The histogram shows IL-4Rα mean fluorescence intensity (MFI) in BMDMs (C). *.P≤ 0.05 and ***.P≤ 0.001.
用实时定量PCR测定M2a的标志物时,发现Arg1、Retnla、Mrc1的表达都是增加的(图5A、C)。在IL-4+IL-10刺激的BMDMs时,CD206(Mrc1)蛋白表达也很高(图5D、E)。总之,数据表明:IL-4和IL-10在促进Arg1、Retnla和Mrc1表达时具有协同作用。
2.3用IL-4+IL-10刺激BMDMs和来源不同的巨噬细胞,可以促进CCL24和Arg1的表达根据微阵列(图4)和PCR(图6A)的结果可知:在与用IL-4或IL-10单独诱导相比较中,CCL24在用IL-4和IL-10刺激由M-CSF诱导的BMDMs中表达明显增加。因此,检测培养基中的CCL24蛋白质。图6B表明:IL-4+IL-10以协同的方式刺激BMDMs时分泌CCL24。
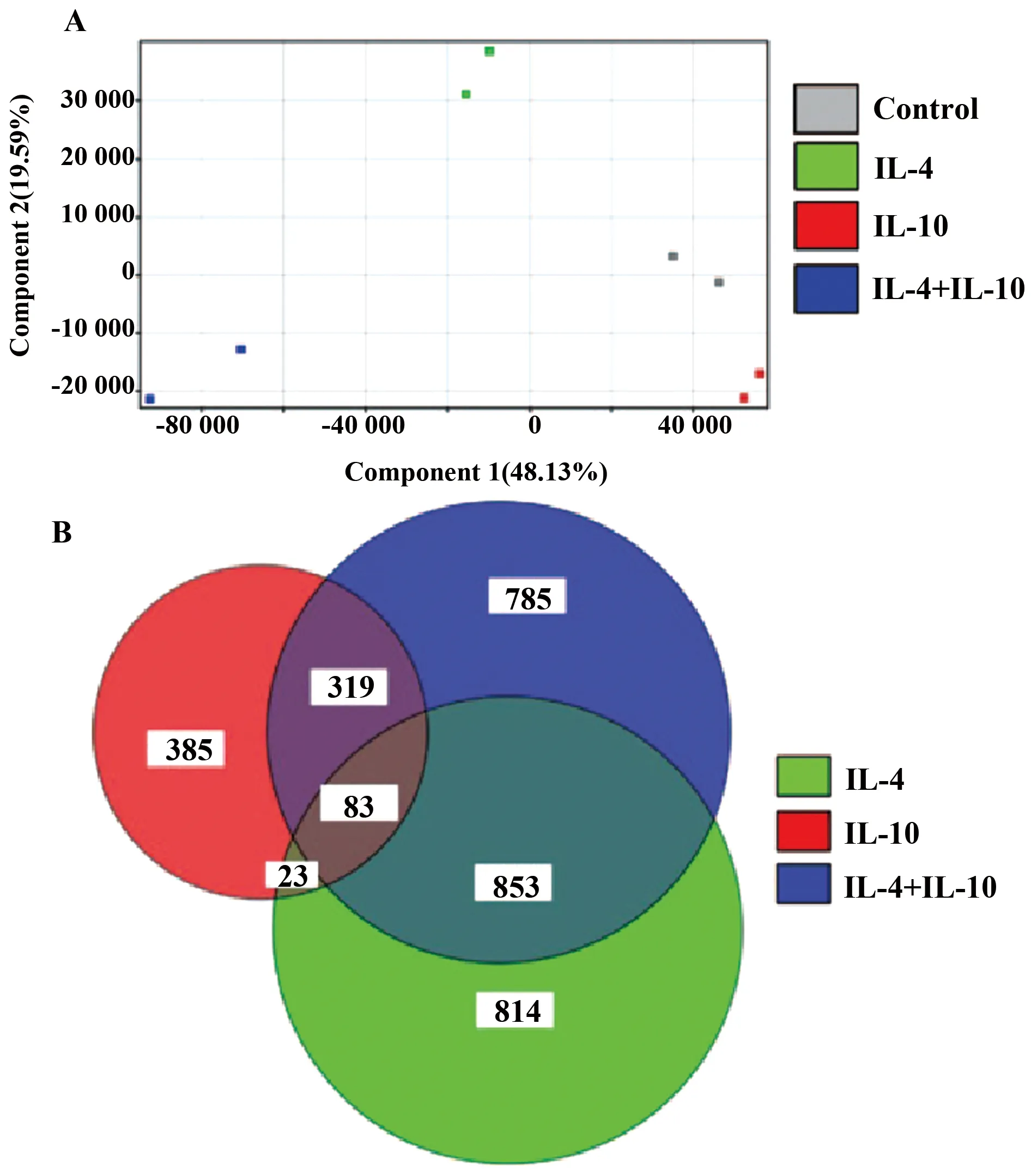
图3 巨噬细胞各亚型主要基因的趋势微阵列分析Fig.3 Microarray analysis of macrophage subtypes showed characteristic gene signature betwe-en subtypesNote: RNA was extracted from stimulated BMDMs and analyzed using microarrays. The sample trend between the subtypes is shown in a scatter plot (A). The number of differentially expressed genes compared with control in each portion of a Venn diagram is shown (B).
检测通过M-CSF和GM-CSF诱导的BMDMs是否具有协调效应。在GM-CSF诱导BMDMs时,IL-4能单独诱导CCL24基因轻微的表达,而IL-10单独作用时则没有这种效应。但是IL-4和IL-10联合诱导时,在GM-CSF诱导的BMDMs效应要明显高于在M-CSF诱导的效应(图6A)。接下来考虑IL-4和IL-10联合刺激的效应在不同来源的巨噬细胞上是否有相似的影响。在酵母多糖诱导、巯基乙酸诱导和先天小鼠腹腔的巨噬细胞中IL-4和IL-10联合使用比单独用IL-4或IL-10诱导产生CCL24的基因更多(图6C、D)。
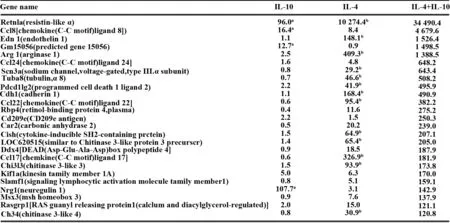
图4 IL-4+IL-10诱导的骨髓源巨噬细胞中25个上调的基因Fig.4 List of 25 most highly upregulated genes in IL-4 + IL-10-stimulated BMDMsNote: a. The 25 most highly upregulated genes in IL-10-stimulated BMDMs;b. The 25 most highly upregulated genes in IL-4-stimulated BMDMs.

图5 IL-10上调IL-4刺激的骨髓源巨噬细胞中M2a巨噬细胞标志物的表达Fig.5 IL-10 enhanced M2a macrophage marker expression in IL-4-stimulated BMDMsNote: Gene expression of the M2a macrophage markers-Arg1 (A), Retnla (B) and Mrc1 (C)were determined using real-time PCR. The CD206 (Mrc1) protein level was determined by flow cytometry (D). One of three representative experiments, in which similar results were obtained, is shown.The histogram shows the mean fluorescence intensity (MFI) of CD206 (E).*.P≤ 0.05 and **.P≤ 0.01.
Arg1是M2a的一种基因。测量Arg1是因为我们推测:除了M-CSF诱导的BMDMs以外,IL-10不仅能提高CCL24的量,也能提高巨噬细胞中M2a相关的基因。在GM-CSF诱导的BMDMs、酵母多糖诱导和巯基乙酸诱导的巨噬细胞与IL-4或IL-10单独诱导时,IL-4和IL-10组合能诱导促进更多的Arg1基因表达(图6E、F)。
2.4在体外,用IL-4+IL-10刺激BMDMs促进嗜酸性粒细胞迁移CCL24通过它的受体CCR3[14,15]使得嗜酸性粒细胞趋化。CCL24促进嗜酸性粒细胞迁移呈剂量性依赖。这个过程依赖EC50 10 ng/ml(图7A)。 用10 ~100 ng/ml的IL-4和IL-10诱导BMDMs能产生10 ng/ml的CCL24(图6B)。因此,我们检测在培养液中的CCL24是否能促进嗜酸性粒细胞的迁移。
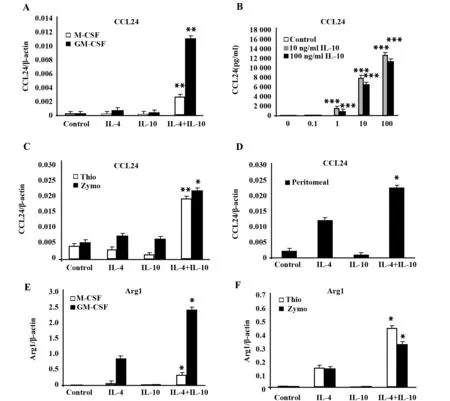
图6 IL-10上调IL-4刺激的骨髓源巨噬细胞以及不同来源巨噬细胞中CCL24以及Arg1的表达Fig.6 IL-10 enhanced CCL24 and Arg1 expression in IL-4-stimulated BMDMs and macrophages from different sourcesNote: Gene expression of the M2a macrophage markers CCL24 (A,C,D) and Arg1 (E,F) in M-CSF- and GM-CSF-stimulated BMDMs (A,E); thioglycolate- and zymosan-elicited peritoneal macrophages (shown as Thio and Zymo) (C,F) and naive peritoneal macrophages (D) was determined using real-time PCR. CCL24 in culture supernatant from M-CSF-induced BMDMs was determined using ELISA (B). *.P≤ 0.05,**.P≤0.01 and ***.P≤ 0.001.
IL4+IL-10刺激培养液中的BMDMs促进嗜酸性粒细胞的迁移。而单独用IL-4或IL-10刺激则没有这种效应(图7B)。接下来,检测CCL24对嗜酸性粒细胞迁移的作用。10 μg/ml的抗-CCL24抗体能抑制IL-4+IL-10诱导的BMDMs的嗜酸性粒细胞的迁移(图7C)。另一方面,IL-4、IL-10或IL-4+IL-10自身不能影响嗜酸性粒细胞的迁移(图7D)。这些结果表明:在BMDMs中,IL-4+IL-10通过CCL24的诱导促进嗜酸性粒细胞的迁移。
2.5IL-4+IL-10刺激BMDMs转移到体内来诱导嗜酸性粒细胞的浸润因为IL-4+IL-10刺激的BMDMs能产生大量的CCL24,能促进嗜酸性粒细胞在体外迁移。实验观察到CCL24有能力促进嗜酸性粒细胞在体内浸润。为了验证这种可能性,用IL-4、IL-10、IL-4+IL-10刺激BMDMs,同时用CMFDA进行标记,然后,转移到C57BL/6J鼠中的腹膜中。 Siglec-F作为腹腔中嗜酸性粒细胞的标志物,因为腹腔中的巨噬细胞不表达这种物质[16,17]。CD115不仅可以作为单核/巨噬细胞的标志物[18,19],而且能消除在嗜酸性粒细胞比例中潜在污染的单核细胞。嗜酸性粒细胞和单核/巨噬细胞浸润到腹膜腔中24 h后进行转移分析(图8A)。在腹腔液中,只有接受转移的IL-4+IL-10刺激BMDMs的鼠中可以看见Siglec-F+/CD115-嗜酸性粒细胞群增加(图8B和C)。而此时的CD115+单核/巨噬细胞的数量没有明显的变化(图8D、E)。在体外转移受刺激的巨噬细胞对总细胞没有显著的影响(图8F)。这些结果表明:IL-4+IL-10刺激的BMDMs相对于单独的IL-4或IL-10刺激的BMDMs而言,前者促进嗜酸性粒细胞在体内迁移。
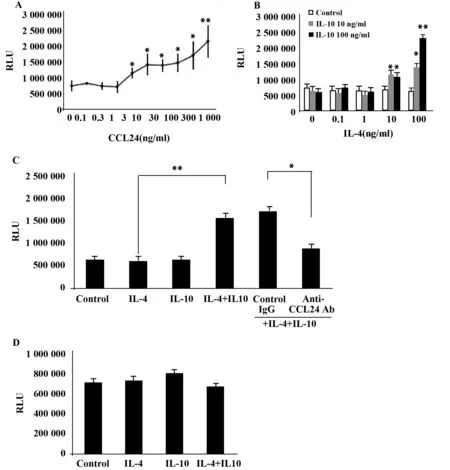
图7 IL4+IL-10体外刺激巨噬细胞促进嗜酸性粒细胞的迁移Fig.7 IL-4+IL-10-stimulated macrophages increased eosinophil migration in vitroNote: Eosinophils were added into the upper side of a chemotaxis chamber. CCL24 (A),culture supernatant of BMDMs stimulated for 72 h (B),culture supernatant of BMDMs stimulated for 72 h with or without isotype control or anti-CCL24 antibody (C) or only cytokine (D) was added to the lower side of the chamber. After 1 h incubation,migrated eosinophils were quantified using the CelltiterGlo Luminescent Cell Viability Assay.*.P≤ 0.05 and **.P≤ 0.01.
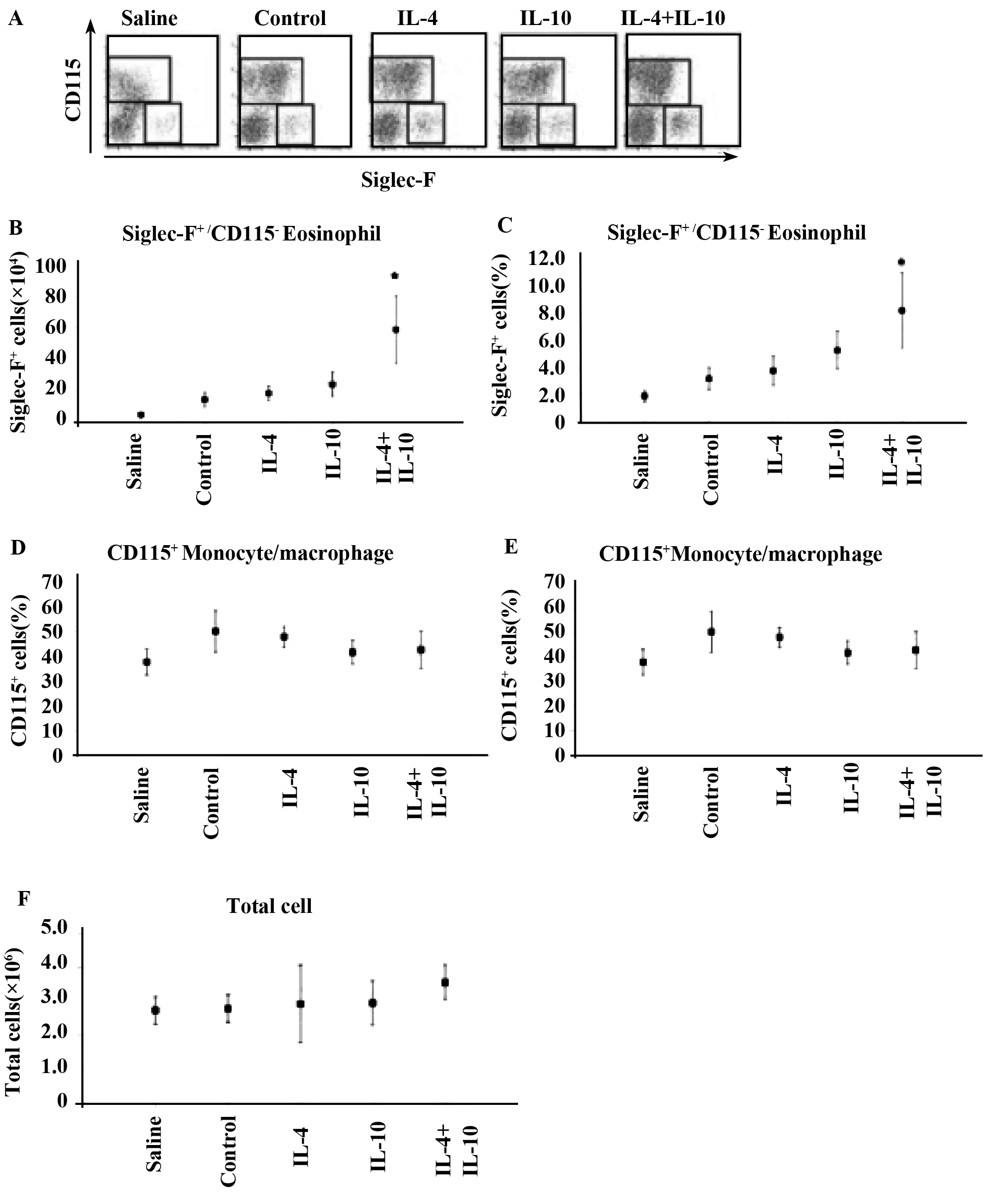
图8 IL-4+IL-10刺激BMDMs转移到体内来诱导嗜酸性粒细胞的浸润Fig.8 Transfer of IL-4+IL-10-stimulated BMDMs into peritoneum increased eosinophil infiltration in vivoNote: Peritoneal fluids were collected and analyzed using FACS (A). The percentage of Siglec-F+/CD115-cells (C) and CD115+cells (E)(cells in the boxes shown in the dot plots in A) were measured. The number of Siglec-F+/CD115-cells (B) and CD115+cells (D) was calculatedby multiplying the number of total cells (F) and their ratio. *.P≤ 0.05.
3 讨论
研究表明:在体外,IL-4和IL-10联合使用相比单独使用IL-4或IL-10而言,前者能促进M2a相关的基因表达,而且能促进体内嗜酸性粒细胞的浸润。之前对IL-4和IL-10分别诱导M2巨噬细胞已经进行了广泛的研究[8,20,21]。这表明:IL-4刺激的M2a巨噬细胞能高表达Arg1和Retnla。这两种物质与寄生虫感染相关[9],并且能产生CCL17和CCL22[6,22],而且也是Th2细胞的趋化因子。据报道,IL-10能通过STAT3途径促进IL-4Rα表达,进而促进Arg1的表达[10,11]。但是,这些研究在M2巨噬细胞分化中不能说明组合的IL-4和IL-10在M2a相关基因的表达的效应。因此,组合的IL-4和IL-10对巨噬细胞表型的效应依旧不清楚。
在其他研究中用微数列证实:IL-10刺激M2c巨噬细胞能表达IL-4Rα[8]。同样,用微阵列分析也表明:IL-10促进BMDMs中的IL-4Rα的表达。用PCR和FACS检测进一步表明:IL-4Rα在mRNA和蛋白质的水平表达提高。虽然IL-4+IL-10刺激巨噬细胞的表达不同于用IL-4或IL-10刺激的巨噬细胞。但是IL-10作用的效应有一种趋势:促进M2a相关基因的表达,这些基因包括:Retnla、Arg1、Chi313和Mrc1。IL-4+IL-10协同刺激巨噬细胞能产生CCL24和CCL8。CCL24和Arg1的增强作用,不仅在BMDMs中起作用,而且在不同来源的巨噬细胞中也起作用。
本研究试图证明:通过IL-4或IL-10刺激巨噬细胞产生的CCL24是否能都诱导嗜酸性粒细胞在体外迁移。因为CCL24通过受体CCR3可以作为嗜酸性粒细胞的趋化因子[14,15]。微数列实验表明CCL24的协同诱导,所以在影响嗜酸性粒细胞迁移的众多因素中,从抗CCL24的结果中可以知道(图5C),通过IL-4+IL-10诱导巨噬细胞产生的CCL24是嗜酸性粒细胞迁移的一种很重要的因子。虽然证明了CCL24的重要性,但是它依旧需要进一步证实其他因素对于嗜酸性粒细胞迁移的作用。
在体内,在卵清蛋白诱导的过敏性气道疾病模型中的M2巨噬细胞高表达CCL24和CCL8。此外,CCL24参与嗜酸性粒细胞过敏反应[23,24]。CCL8作为CCR8的配体,其与Th2细胞浸润到炎性皮肤有关[25]。因此,预期M2巨噬细胞诱导嗜酸性粒细胞,并且Th2在局部浸润。但是,研究并没有表明:在体外实验中,通过M2巨噬细胞使嗜酸性粒细胞的活化迁移,在体内实验中,通过M2巨噬细胞转移使嗜酸性粒细胞产生局部浸润。本实验的结果表明:IL-4+IL-10联合诱导的M2巨噬细胞确实能促进嗜酸性粒细胞在体内浸润,也表明IL-4和IL-10的组合确实在过敏反应中发挥着重要的作用。
这些结果表明:在IL-10和IL-4作用下,对M2巨噬细胞的分化、细胞因子产生和嗜酸性粒细胞浸润具有重要的增强作用。
[1]Mosser DM,Edwards JP.Exploring the full spectrum of macrophage activation[J].Nat Rev Immunol,2008,8(12):958-969.
[2]Taylor PR,Martinez-Pomares L,Stacey M,etal.Macrophage receptors and immune recognition[J].Annu Rev Immunol,2005,23:901-944.
[3]Higuchi H,Shoji T,Murase Y,etal.Siglec-9 modulated IL-4 responses in the macrophage cell line RAW264[J].Biosci Biotechnol Biochem,2015,80(3):1-9.
[4]Gao S,Zhou J,Liu N,etal.Curcu min induces M2 macrophage polarization by secretion IL-4 and/or IL-13[J].J Mol Cell Cardiol,2015,85:131-139.
[5]Palsson-McDermott EM,Curtis AM,Goel G,etal.Pyruvate kinase M2 regulates Hif-1alpha activity and IL-1beta induction and is a critical determinant of the warburg effect in LPS-activated macrophages[J].Cell Metab,2015,21(1):65-80.
[6]Avdic S,Cao JZ,McSharry BP,etal.Human cytomegalovirus interleukin-10 polarizes monocytes toward a deactivated M2c phenotype to repress host immune responses[J].J Virol,2013,87(18):10273-10282.
[7]Schebesch C,Kodelja V,Muller C,etal.Alternatively activated macrophages actively inhibit proliferation of peripheral blood lymphocytes and CD4+T cells in vitro[J].Immunology,1997,92(4):478-486.
[8]Zhang S,Kim CC,Batra S,etal.Delineation of diverse macrophage activation programs in response to intracellular parasites and cytokines[J].PLoS Negl Trop Dis,2010,4(3):e648.
[9]Yeung OW,Lo CM,Ling CC,etal.Alternatively activated(M2) macrophages promote tumour growth and invasiveness in hepatocellular carcinoma[J].J Hepatol,2015,62(3):607-616.
[10]Rai RK,Vishvakarma NK,Mohapatra TM,etal.Augmented macrophage differentiation and polarization of tumor-associated macrophages towards M1 subtype in listeria-ad ministered tumor-bearing host[J].J Immunother,2012,35(7):544-554.
[11]Biswas A,Bhattacharya A,Kar S,etal.Expression of IL-10-triggered STAT3-dependent IL-4Ralpha is required for induction of arginase 1 in visceral leishmaniasis[J].Eur J Immunol,2011,41(4):992-1003.
[12]Han H,Headley MB,Xu W,etal.Thymic stromal lymphopoietin amplifies the differentiation of alternatively activated macrophages[J].J Immunol,2013,190(3):904-912.
[13]Yin H,Li X,Hu S,etal.IL-33 accelerates cutaneous wound healing involved in upregulation of alternatively activated macrophages[J].Mol Immunol,2013,56(4):347-353.
[14]Pope SM,Zimmermann N,Stringer KF,etal.The eotaxin chemokines and CCR3 are fundamental regulators of allergen-induced pulmonary eosinophilia[J].J Immunol,2005,175(8):5341-5350.
[15]Siddiqui S,Secor EJ,Silbart LK.Broncho-alveolar macrophages express chemokines associated with leukocyte migration in a mouse model of asthma[J].Cell Immunol,2013,281(2):159-169.
[16]Feng YH,Mao H.Expression and preli minary functional analysis of Siglec-F on mouse macrophages[J].J Zhejiang Univ Sci B,2012,13(5):386-394.
[17]Satoh T,Takeuchi O,Vandenbon A,etal.The Jmjd3-Irf4 axis regulates M2 macrophage polarization and host responses against hel minth infection[J].Nat Immunol,2010,11(10):936-944.
[18]Breslin WL,Strohacker K,Carpenter KC,etal.Mouse blood monocytes:standardizing their identification and analysis using CD115[J].J Immunol Methods,2013,390(1-2):1-8.
[19]Fujieda Y,Manno A,Hayashi Y,etal.Inflammation and resolution are associated with upregulation of fatty acid beta-oxidation in Zymosan-induced peritonitis[J].PLoS One,2013,8(6):e66270.
[20]Martinez FO,Gordon S,Locati M,etal.Transcriptional profiling of the human monocyte-to-macrophage differentiation and polarization:new molecules and patterns of gene expression[J].J Immunol,2006,177(10):7303-7311.
[21]Houser BL,Tilburgs T,Hill J,etal.Two unique human decidual macrophage populations[J].J Immunol,2011,186(4):2633-2642.
[22]Lacey DC,Achuthan A,Fleetwood AJ,etal.Defining GM-CSF-and macrophage-CSF-dependent macrophage responses by in vitro models[J].J Immunol,2012,188(11):5752-5765.
[23]Provost V,Larose MC,Langlois A,etal.CCL26/eotaxin-3 is more effective to induce the migration of eosinophils of asthmatics than CCL11/eotaxin-1 and CCL24/eotaxin-2[J].J Leukoc Biol,2013,94(2):213-222.
[24]Radinger M,Johansson AK,Sitkauskiene B,etal.Eotaxin-2 regulates newly produced and CD34 airway eosinophils after allergen exposure[J].J Allergy Clin Immunol,2004,113(6):1109-1116.
[25]Islam SA,Chang DS,Colvin RA,etal.Mouse CCL8,a CCR8 agonist,promotes atopic dermatitis by recruiting IL-5+ T(H)2 cells[J].Nat Immunol,2011,12(2):167-177.
[收稿2015-11-27]
(编辑张晓舟)
IL-10 and IL-4 enhance phenotype of M2 macrophages and eosinophil migration
TONG Xiao-Peng,YANG Bo,MEN Lian-Chao,ZHANG Qun-Hui .
Xizang Minzu University,Xianyang 712082,China
Objective:To clarify whether IL-10 enhanced the M2 phenotype induced by IL-4.Methods: M-CSF induced bone marrow-derived macrophages (BMDMs) were generated from C57BL/6J mice bone marrow cells.The RNA transcriptional profile was evaluated using the Mouse Whole Genome.We performed in vitro eosinophil migration assay and in vivo macrophage transfer.Results: The results showed that IL-10 enhanced gene expression of M2a markers induced by IL-4 in M-CSF-induced BMDMs.Moreover,IL-4 and IL-10 synergistically induced CCL24 (Eotaxin-2) production.Enhanced CCL24 expression was also observed in GM-CSF-induced BMDMs and zymosan-elicited,thioglycolate-elicited and naive peritoneal macrophages.CCL24 was a CCR3 agonist and an eosinophil chemoattractant.In vitro,IL-4+IL-10-stimulated macrophages produced a large amount of CCL24 and increased eosinophil migration,which was inhibited by anti-CCL24 antibody.IL-4+IL-10-stimulated (but not IL-4 or IL-10 alone) macrophages transferred into the peritoneumof C57BL/6J mice increased eosinophil infiltration into the peritoneal cavity.Conclusion: These results demonstrate that IL-4+IL-10-simulated macrophages have enhanced M2a macrophage-related gene expression,CCL24 production and eosinophil infiltration-inducing activity,thereby suggesting theircontribution to eosinophil-related diseases.
IL-4;IL-10;CCL24;Eosinophil;M2a macrophage
10.3969/j.issn.1000-484X.2016.09.014
童晓鹏(1980年-),男,医学博士,副教授,主要从事免疫学方面的研究,E-mail:88021470@qq.com。
R392.12
A
1000-484X(2016)09-1309-07
①本文为国家自然科学基金(81560732)和西藏自治区自然科学基金项目(2015ZR-13-18)。

