靶向REST基因TALEN质粒的快速构建与活性检测
张殿宝,赵 峰,张 涛,林学文,王 瑞,施 萍,庞希宁,3
(中国医科大学1.基础医学院干细胞与再生医学研究室,沈阳110122;2.第一临床学院全科医学教研室,沈阳110001;3.科学实验中心,沈阳110122)
靶向REST基因TALEN质粒的快速构建与活性检测
张殿宝1,赵峰1,张涛1,林学文1,王瑞1,施萍2,庞希宁1,3
(中国医科大学1.基础医学院干细胞与再生医学研究室,沈阳110122;2.第一临床学院全科医学教研室,沈阳110001;3.科学实验中心,沈阳110122)
目的针对人REST基因设计并构建特异性类转录激活因子效应物核酸酶(TALEN)质粒,快速获得具有较高突变效率的TALEN。方法根据REST的序列信息设计TALEN靶位,使用单元组装的方法快速构建TALEN质粒,在293T细胞中进行活性检测并计算突变效率。结果针对REST设计并成功构建5个TALEN质粒,组成6对TALEN并实现基因打靶,其中L1和R3组合的突变效率达到60.9%。结论成功获得了靶向人REST基因的高效TALEN,为进一步研究REST的基因功能及其在相关疾病中的作用奠定基础。
REST;类转录激活因子效应物核酸酶;质粒构建;活性检测
RE1沉默性转录因子(RE 1-silencing transcription factor,REST),也称为神经元限制性沉默因子(neuron restrictive silencer factor,NRSF),是一个锌指转录因子,能够识别并结合特定的RE1(repressor element 1)序列,通过招募组蛋白去乙酰化酶(HDACs)等转录共抑制因子抑制靶基因的转录[1]。REST最初发现的功能是抑制非神经细胞中神经基因的表达,近年来研究[2-3]发现REST在神经系统和非神经系统的发育、肿瘤形成、细胞分化及退行性疾病中都发挥重要作用。
类转录激活因子效应物核酸酶(transcription activator-like effector nuclease,TALEN)自2010年应用于基因组定点编辑,具有设计简便、特异性好和脱靶率低等优点[4]。TALEN由DNA结合结构域和切割结构域组成,结合结构域中的重复可变残基(repeat variable diresidue,RVD)决定了与DNA结合的特异性,将设计好的结合结构域与Fok I核酸酶融合形成1个TALEN分子,1对TALEN分子与靶位点结合以后,Fok I二聚化切断DNA双链,激活DNA修复通路,进行非同源末端连接或同源重组,实现基因组定点修饰[5]。本研究针对人REST基因设计并构建5个TALEN质粒,检测不同组合的突变效率,获得最优方案。
1 材料与方法
1.1TALEN靶位点的设计
根据NCBI数据库(https://www.ncbi.nlm.nih.gov)中REST(Gene ID:5978)的基因信息,获取REST的2个转录本(NM_001193508.1、NM_ 005612.4)序列及编码信息,使用DNASTAR Lasergene.v7.1辅助设计TALEN靶位点,并遵循以下规则:在2个转录本中编码区的共同区域设计TALEN靶位,并尽量接近翻译起始位点;TALEN单臂结合位点DNA长度为14~18 bp,左臂与右臂之间spacer长度为15~21 bp;TALEN结合的DNA序列5′端的前1个碱基为T。为了优化基因打靶效率,本研究针对TALEN共设计5条TALEN序列,包括2条左臂(L1和L2)和3条右臂(R1、R2和R3)。将不同的左臂与不同的右臂组合,可以组成6对靶向REST的TALEN。
1.2TALEN重组质粒构建
以应用最广泛的4种RVD构建TALEN质粒,分别为NI、NG、HD和NN。这4种RVD分别与A、T、C和G相对应,根据RVD与碱基的对应关系,使用Si-DanSai公司TALEN试剂盒中的模块构建TALEN质粒。将设计好的TALEN识别序列3′端最后1位T去除,从5′端依次将每1~2个碱基作为1个模块,共分成9个模块并按从1至9编号。将试剂盒中的对应模块每个取1.5μL,加入PCR管中,并加入相应的骨架载体、溶液1、2和3,最后加水补至20μL,混匀后瞬时离心。在PCR仪(Biometra,Tprofessional)中运行以下程序:37℃,5 min和16℃,10 min运行15个循环,80℃酶灭活10 min,12℃保温1 min。加入溶液4和5后继续在PCR仪中37℃孵育1 h。将产物进行常规的热激法转化GBE180感受态细胞(SiDan-Sai),使用卡那霉素筛选,次日挑取24个单菌落小摇16 h,使用质粒小量提取试剂盒(Omega Bio-Tek,Plasmid Mini Kit I)提取质粒,使用微量分光光度计(Thermo,NanoDrop 2000C)检测核酸浓度和质量。
1.3TALEN质粒的鉴定与制备
使用核酸内切酶BamHI和PstI(Fermentas,Fast-Digest)双酶切TALEN质粒,之后进行琼脂糖凝胶电泳。将酶切鉴定插入片段大小正确的质粒测序(诺赛基因),测序正向引物序列为:5′-CTCCCCTTCAGCT GGACAC-3′;测序反向引物序列为:5′-AGCTGGGC CACGATTGAC-3′。测序结果使用NCBI的tblastx比对,将测序鉴定序列正确的TALEN质粒和pEGFPN1质粒分别转化DH5α感受态细胞(鼎国生物),中摇后使用无内毒素质粒中量提取试剂盒(Omega Bio-Tek,Endo-Free Plasmid Midi Kit)提取质粒,经浓度和质量检测后用于后续转染。
1.4细胞培养与转染
293T细胞来自ATCC,使用添加10%胎牛血清(Hyclone)的DMEM培养液(Hyclone),培养于CO2细胞培养箱。将对数生长期的细胞接种于6孔板,次日使用Lipofectamine 2000转染,每孔转染一对TALEN左臂与右臂质粒各2 μg,pEGFP质粒0.5 μg。同时设无TALEN质粒组,作为药物筛选的阴性对照。继续培养24 h后使用倒置荧光显微镜(Zeiss,Observer A1)观察EGFP表达情况,评估其转染效率。使用2 μg/mL的嘌呤霉素对培养24 h的打靶细胞进行药物筛选,约3 d后阴性对照细胞全部死亡,之后使用无抗生素的培养基继续培养3 d。
1.5靶位点的突变分析
胰酶消化后离心收集TALEN打靶的细胞,使用血液组织细胞基因组提取试剂盒(天根生化)提取细胞基因组DNA,使用特异性引物PCR(Promega,GoTaq®Hot Start Green Master Mix)扩增打靶位点,将PCR产物测序,检测套峰情况。REST上游引物为:5′-GATGCCGGTTGGGGATAACA-3′;REST下游引物为:5′-TGGTGTTTCAGGTGTGCTGT-3′。将PCR产物进行T-A克隆(Takara,pMD-19T),转化培养后挑取25个克隆测序,经blast比对后计算突变效率,通过序列比对分析突变位点的突变类型。
2 结果
2.1TALEN靶位点的设计
根据TALEN设计原则在REST基因编码区中搜索合适的靶位点,设计TALEN序列,如图1所示。其中,左臂L1结合位点序列为:5′-CGTAGAACCTCAGCCTGT-3′,使用L15载体骨架,模块拆分为CG1、TA2、GA3、AC4、C5、TC6、AG7、CC8和TG9;左臂L2结合位点序列为:5′-AGAACCTCAGCCTGTA-3′,使用L14载体骨架,模块拆分为AG1、A2、AC3、C4、T5、CA6、GC7、CT8和GT9;右臂R1结合位点序列为:5′-TTGAACTGTAAATATCT-3′,使用R11载体骨架,模块拆分为TT1、GA2、A3、CT4、GT5、AA6、A7、TA8和TC9;右臂R2结合位点序列为:5′-TTGAACTGTAAATATCTG-3′,使用R13载体骨架,模块拆分为T1、TG2、AA3、CT4、GT5、AA6、AT7、AT8和CT9;右臂R3结合位点序列为:5′-GAACTGTAAATATCTGGA-3′,使用R10载体骨架,模块拆分为GA1、A2、CT3、GT4、AA5、AT6、AT7、CT8和GG9。
2.2TALEN质粒的构建与鉴定
根据TALEN的结合位点,计算各TALEN质粒的长度,以及酶切得到的片段长度。其中,L1的结合位点为18 bp,长度为6 791 bp;L2的结合位点为16 bp,长度为6 587 bp;R1的结合位点为17 bp,长度为5 424 bp;R2的结合位点为18 bp,长度为5 526 bp;R3的结合位点为17 bp,长度为5 424 bp。双酶切筛选片段大小与目的相符的重组TALEN质粒,如图2所示,L1-2、L2-1、R1-4、R2-1、R2-2和R3-1的片段大小正确,M为1 kb DNA Ladder。将酶切鉴定长度正确的质粒进行测序鉴定,拼接后进行比对,序列均100%正确。
2.3TALEN对REST基因的突变效率
荧光显微镜观察GFP表达评估转染效率,发现细胞转染效率约为70%。检测左臂和右臂组合形成的6对TALEN对REST的突变效率,在PCR产物测序结果中均出现套峰,L1与R3组合的典型套峰,提示该TALEN具有较高的突变效率,见图3。PCR产物克隆后进行单克隆测序,将测序成功的序列比对后计算突变率,见表1。其中,L1和R3组合的TALEN突变效率最高,达到60.9%。
2.4REST靶位点的突变分析
在L1与R3组合的TALEN组中,共获得14个突变克隆,经序列比对分析,发现其中插入突变1个、缺失突变9个、缺失和碱基置换突变同时存在的4个,最大的缺失突变碱基数为35 bp(图4),提示该TALEN能够满足敲除靶基因REST的要求。

图1 REST基因中TALEN靶位点的设计Fig.1 The design o f TALEN targeting sites in REST gene

图2 双酶切筛选片段大小正确的TALEN质粒Fig.2 TALEN plasm ids were screened by doub le digestion

图3 TALEN(L1与R3组合)敲除REST后,基因组PCR产物测序峰图Fig.3 DNA sequencing peak for PCR products of genom e targeted by TALEN(L1 and R3)

表1 TALEN对REST的突变效率Tab.1 The mutation efficiencies of TALENs for REST knockout
3 讨论
打靶位点的设计是影响TALEN效率的关键因素[6],本研究从靶位设计上尽量提高打靶的准确性和成功率。在遵循TALEN设计的经典规则基础上,针对REST不同的剪接异构体的共同区域设计打靶位点,防止REST的功能由不同的异构体补偿。而且,在打靶位点设计前,使用PCR扩增了基因组中的靶位点并进行测序,一方面验证了引物的特异性,另一方面检测目的细胞基因组中是否存在多态性位点,以保证TALEN的结合与切割效率。
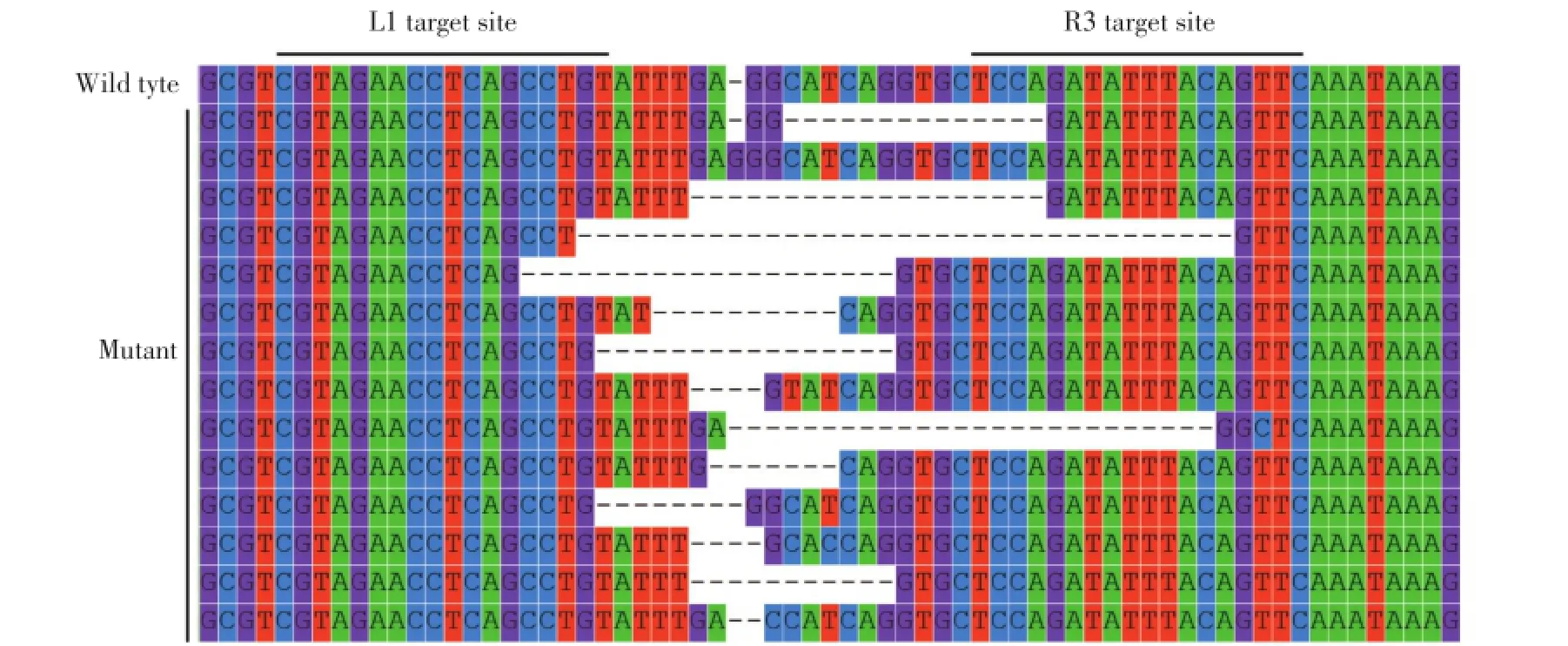
图4 REST靶位点突变分析Fig.4 Mutant analysis of the targe t site in REST
TALEN中重复单元的序列具有很高的保守性,串联克隆的难度随之提高[7]。目前,分子克隆的方法是构建TALEN质粒的主要途径,应用较为广泛的方法主要有Golden Gate克隆法、酶切连接法、单元组装法和id-TALE法等,但是这些方法均需要耗费较多的时间和人力物力成本[4]。本研究中将单元模块文库和酶切连接结合起来,一步构建重组TALEN质粒,快速获得了5条序列正确的靶向REST基因的TALEN质粒,提高了TALEN构建的效率和便捷性。
REST作为一个作用广泛的转录抑制因子[8],文献中未见针对该基因特异性TALEN的报道。本研究中构建了5条TALEN质粒,组合形成6对TALEN敲除人REST基因,并证明了不同左臂和右臂的组合在293T细胞中的活性,突变效率从9.5%至60.9%不等。对效率最高的L1与R3组合的突变进行分
析,发现主要以缺失突变为主,能够满足基因敲除的要求。本研究中得到的TALEN可用于构建REST敲除细胞株,研究REST在目的细胞中的作用及机制。
[1]NOH KM,HWANG JY,FOLLENZI A,et al.Repressor element-1 silencing transcription factor(REST)-dependent epigenetic remodeling is critical to ischemia-induced neuronal death[J].Proc Natl Acad Sci USA,2012,109(16):E962-971.DOI:10.1073/ pnas.1121568109.
[2]ROCKOWITZ S,LIEN WH,PEDROSA E,et al.Comparison of REST cistromes across human cell types reveals common and context-specific functions[J].PLoS Comput Biol,2014,10(6):e1003671.DOI:10.1371/journal.pcbi.1003671.
[3]张殿宝,王瑞,庞希宁,等.EGF对HaCaT细胞中神经元限制性沉默因子表达的影响[J].基础医学与临床,2013,33(11):1496-1497.
[4]张殿宝,施萍,庞希宁.人工核酸酶用于基因组定点编辑的研究进展[J].基础医学与临床,2013,33(12):1634-1637.
[5]SMITH C,GORE A,YAN W,et al.Whole-genome sequencing analysis reveals high specificity of CRISPR/Cas9 and TALEN-based genome editing in human iPSCs[J].Cell Stem Cell,2014,15(1):12-13.DOI:10.1016/j.stem.2014.06.011.
[6]LIN Y,FINE E J,ZHENG Z,et al.SAPTA:a new design tool for improving TALE nuclease activity[J].Nucleic Acids Res,2014,42(6):e47.DOI:10.1093/nar/gkt1363.
[7]HUANG P,XIAO A,TONG X,et al.TALEN construction via"Unit Assembly"method and targeted genome modifications in zebrafish[J].Methods,2014,69(1):67-75.DOI:10.1016/j.ymeth.2014.02.010.
[8]KELLIS M,WOLD B,SNYDER MP,et al.Defining functional DNA elements in the human genome[J].Proc Natl Acad Sci USA,2014,111(17):6131-6138.DOI:10.1073/pnas.1318948111.
(编辑于溪)
Fast Construction and Activity Detection of TALEN Plasm ids for REST Gene Knockout
ZHANG Dianbao1,ZHAO Feng1,ZHANG Tao1,LIN Xuewen1,WANG Rui1,SHI Ping2,PANG Xining1,3
(1.Department of Stem Cells and Regenerative Medicine,College of Basic Medical Science,China Medical University,Shenyang 110122,China;2.Department of General Practice,The First Clinical College,China Medical University,Shenyang 110001,China;3.Science Experiment Center,China Medical University,Shenyang 110122,China)
Objective To design and construct TALEN plasmids for human REST gene knockout.Methods The target sites of TALEN were designed according to the transcripts of REST,and the recombinant plasmids were constructed by unit assembly method.The mutagenic activities of TALENs were determined in 293T cells.Results Five TALEN plasmids were constructed,and REST gene targeting was achieved by 6 pairs of TALENs.The mutation efficiency of the combination of L1 and R3 was 60.9%.Conclusion Effective TALEN for human REST knockout was constructed,which can benefit to the gene function study of REST in related diseases.
REST;TALEN;vector construction;activity detection
Q783
A
0258-4646(2016)10-0883-04
10.12007/j.issn.0258-4646.2016.10.004
国家重点基础研究发展计划(2012CB518103);沈阳市干细胞与再生医学重点实验室(F15-157-1-00);沈阳市科学技术计划(F14-201-4-00)
张殿宝(1986-),男,讲师,博士.
庞希宁,E-mail:pangxining@126.com
2016-04-05
网络出版时间:
网络出版地址

