EGFR激活突变型非小细胞肺癌HGF/MET异质性表达及其临床意义
张树玲,孙 鑫,孙 丽,熊志成,孙 婧,马洁韬,韩琤波
(中国医科大学附属盛京医院第一肿瘤科,沈阳110022)
·论著·
EGFR激活突变型非小细胞肺癌HGF/MET异质性表达及其临床意义
张树玲,孙鑫,孙丽,熊志成,孙婧,马洁韬,韩琤波
(中国医科大学附属盛京医院第一肿瘤科,沈阳110022)
目的分析不同表皮生长因子受体(EGFR)突变状态,外显子19(E19)缺失(del)和外显子21(E21)L858R基因突变蛋白表达与HGF和MET表达的相关性及其与患者预后和生存之间的关系。方法S-P免疫组化染色法检测55例EGFR突变的非小细胞肺癌(NSCLC)患者切片中E19 del或E21 L858R、MET和HGF 4种蛋白的表达。Kaplan-Meier绘制生存曲线,log-rank比较生存差异。结果EGFR突变蛋白阳性者HGF和MET蛋白表达阳性率明显高于EGFR突变蛋白阴性者(P<0.05)。HGF表达阴性者与阳性者比较,其总生存期及无病生存期明显延长(P=0.035和P=0.003)。术后复发或晚期使用表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)治疗患者(n=29)中,HGF阴性组较HGF阳性组无疾病进展生存期和总生存期有延长趋势(P= 0.19和P=0.10),但差异无统计学意义。结论HGF可作为EGFR敏感突变NSCLC患者复发和预后生存的判定指标。在EGFR敏感突变的基础上联合HGF指标检测可进一步精确预测EGFR-TKI的疗效和预后生存。
非小细胞肺癌;表皮生长因子受体;酪氨酸激酶抑制剂;肝细胞生长因子;MET;激活/敏感突变
肺癌目前是世界上癌症相关死亡的首要疾病[1],非小细胞肺癌(non-small cell lung cancer,NSCLC)占肺癌的80%左右,5年生存率仅15%左右[2]。目前,早期和部分局晚期NSCLC主要采取以手术为主的综合治疗,而其余约70%的NSCLC患者确诊时已是晚期,失去手术治疗机会,放化疗是其主要治疗手段。随着对肺癌驱动基因的不断认识,分子靶向药物得以研发和临床使用,表皮生长因子受体(epidermal growth factor receptor,EGFR)尤被关注。EGFR敏感突变的NSCLC患者对表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitors,EGFR-TKI)高度敏感,有效率达70%左右,无疾病进展生存期(progression-free survival,PFS)和总生存期(overall survival,OS)有所延长,中位PFS达9~13个月,中位OS达20~30个月[3-5]。然而,治疗有效的患者就个体而言对药物的反应性不同,且都将不可避免的产生继发耐药,耐药的机制包括EGFR T790M突变、MET基因扩增、肝细胞生长因子(hepatocyte growth factor,HGF)过度表达和小细胞肺癌转化等[6-7]。值得关注的是,T790M突变、HGF/MET通路的异常激活可能在原发性和继发性耐药中都发挥了重要作用[8-9]。研究显示,合并T790M突变的患者比单纯EGFR敏感突变的患者对EGFR-TKI治疗的客观反应率下降,且PFS明显缩短[10]。而合并HGF/MET通路异常激活的患者对EGFR-TKI治疗反应较差,且疗效持续时间短[8,11]。
因此,本研究通过分析肺癌患者HGF和MET蛋白异质性表达与临床病理特征、EGFR突变类型及其蛋白表达之间的相关性,以及其与预后生存之间的关系,探讨在EGFR敏感突变生物标记物的基础上联合HGF和MET蛋白表达能否进一步精确预测EGFR-TKI疗效和预后生存。
1 材料与方法
1.1临床资料
收集我院于2005年5月至2014年4月间经病理确诊且行EGFR基因检测的肺腺癌患者130例,其中野生型38例,敏感突变型92例。收集130例患者未经治疗时癌胚抗原(carcinoembryonic antigen,CEA)基线值,观察不同EGFR基因状态下CEA基线水平差异。根据患者病理组织完整情况,最终55例E19或E21敏感突变患者纳入免疫组织化学实验,其中E19 del突变35例,E21 L858R突变20例,手术切除患者50例。对术后患者,根据分期给予辅助性放化疗治疗。其中,术后复发进展及不可手术共29例,使用了EGFR-TKI类药物一线或多线治疗。随访截止至2015年3月20日。
1.2免疫组化检测E19 del-EGFR、E21 L858REGFR、HGF和MET蛋白表达
兔抗人E19 del、E21 L858R、MET、HGF蛋白抗体分别购自美国Cell Signaling Technology公司和美国Santa Cruz公司,通用型二抗由盛京医院病理实验室惠赠。55例组织标本均经4 μm连续切片,分别应用HGF、MET抗体以及对应的E19 del或E21 L858R蛋白抗体进行S-P法免疫组化染色。
1.3免疫组化结果评定
细胞质或细胞膜呈清晰黄褐色颗粒为阳性表达,其中E19 del EGFR蛋白、E21 L858R EGFR蛋白和MET蛋白主要表达于肿瘤细胞,而HGF蛋白在肿瘤细胞及间质细胞中均有表达。参照既往方法[8]并略作修改,随机观察5个高倍镜(×400)视野,根据阳性细胞百分率和染色强度进行半定量分析。染色强度:无染色0分,轻度染色1分,中度染色2分,重度染色3分;阳性细胞数<10%记0分,10%~<25%记1分,25%~<50%记2分,≥50%记3分。2项指标积分之和0~1分为阴性病例(-),2~3分为弱阳性病例(+),≥4分为强阳性病例(2+),后两者统称为阳性。
1.4统计学分析
应用SPSS 19.0统计软件进行统计学分析。采用χ2检验和Fisher确切概率法进行组间和组内比较,生存曲线采用Kaplan-Meier方法绘制,log-rank检验比较生存差异。采用Cox回归比例风险模型进行多因素分析,确定影响预后生存因素。P<0.05为差异有统计学意义。
2 结果
2.1E19或E21突变蛋白MET蛋白表达
4种蛋白表达存在个体差异。E19和E21蛋白表达阳性率分别为60.0%(21/35)和65.0%(13/20);HGF蛋白阳性表达率为29.1%(16/55);MET蛋白阳性表达率为23.6%(13/55)。见图1。
2.2HGF/MET异质性表达与临床病理学特征间的关系
55例EGFR突变患者中,HGF和MET蛋白的表达与患者年龄、性别等无关(均P>0.05),而2种蛋白表达的阳性率在EGFR突变蛋白阳性表达患者中显著高于阴性表达患者,HGF及MET蛋白的表达与EGFR突变蛋白表达存在弱正相关性(r=0.068,P= 0.038;r=0.065,P=0.039)。见表1。
2.3血清CEA基线水平与EGFR突变或蛋白表达、HGF和MET蛋白表达之间的关系
对于130例突变状态已知的患者,CEA基线水平与EGFR突变与否、突变类型以及EGFR蛋白表达阳性与否无关(r=0.695,P>0.05;r=0.732,P>0.05;r=0.698,P>0.05),而在55例突变患者中,CEA基线水平与HGF和MET表达亦无关(r= 0.109,P=0.097)。
2.4EGFR激活突变、MET及HGF蛋白异质性表达与患者预后的关系
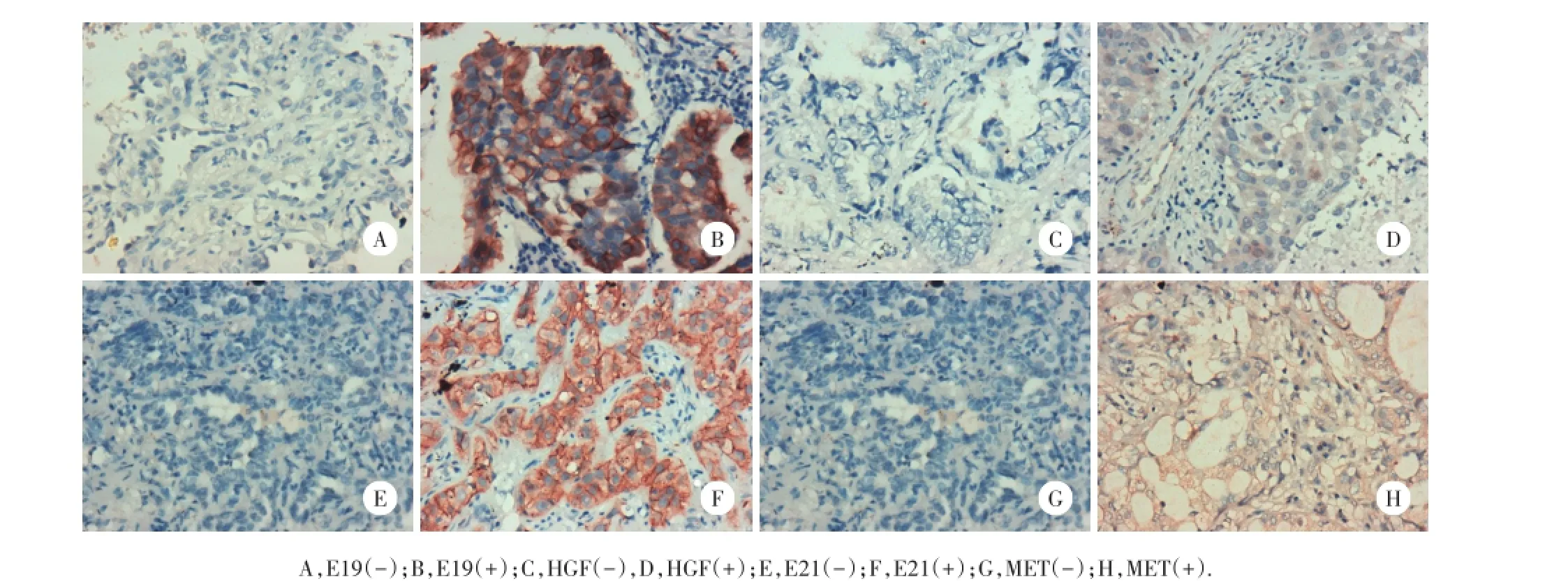
图1 E19和E21激活突变EGFR蛋白、HGF和MET蛋白表达的免疫组化结果×400Fig.1 Immunohistochem istry of E19 de l-EGFR,E21 L858R-EGFR,HGF and MET protein expression×400
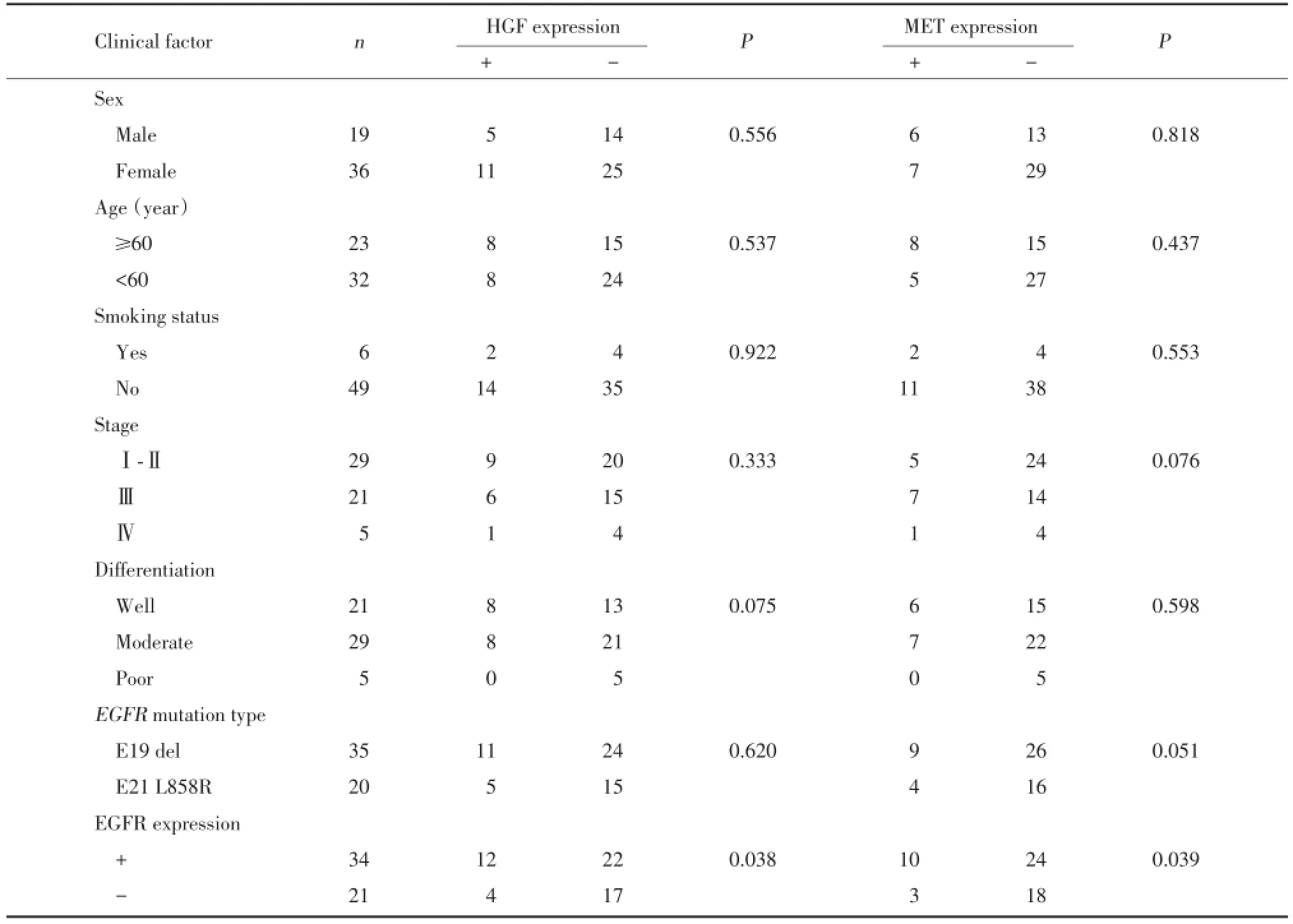
表1 EGFR突变肺癌患者临床病理学特征与HGF/MET蛋白表达间的关系Tab.1 Relationship between heterogeneous expression o f MET and HGF proteins and clinicopathological characteristics o f patients with EGFR m utations
55例EGFR突变患者中位OS为42个月。单因素分析结果显示,HGF表达、分化程度及分期是影响OS的重要因素,HGF表达、分期是影响无病生存期(disease-free survival,DFS)的重要因素。多因素分析结果显示,HGF是影响OS、DFS的独立预后因素之一(表2)。55例突变患者中,HGF表达阴性者OS明显好于阳性患者,中位OS分别为46和27个月(P=0.035)。50例手术患者中,HGF表达阴性患者DFS均好于阳性患者,中位DFS分别为26和18个月(P=0.003)。对于复发或晚期应用EGFR-TKI类药物者,HGF表达阴性组与阳性组比较,其PFS(18和14个月,P=0.19)及OS(48和28个月,P=0.10)均有延长趋势,但无统计学差异。见图2。
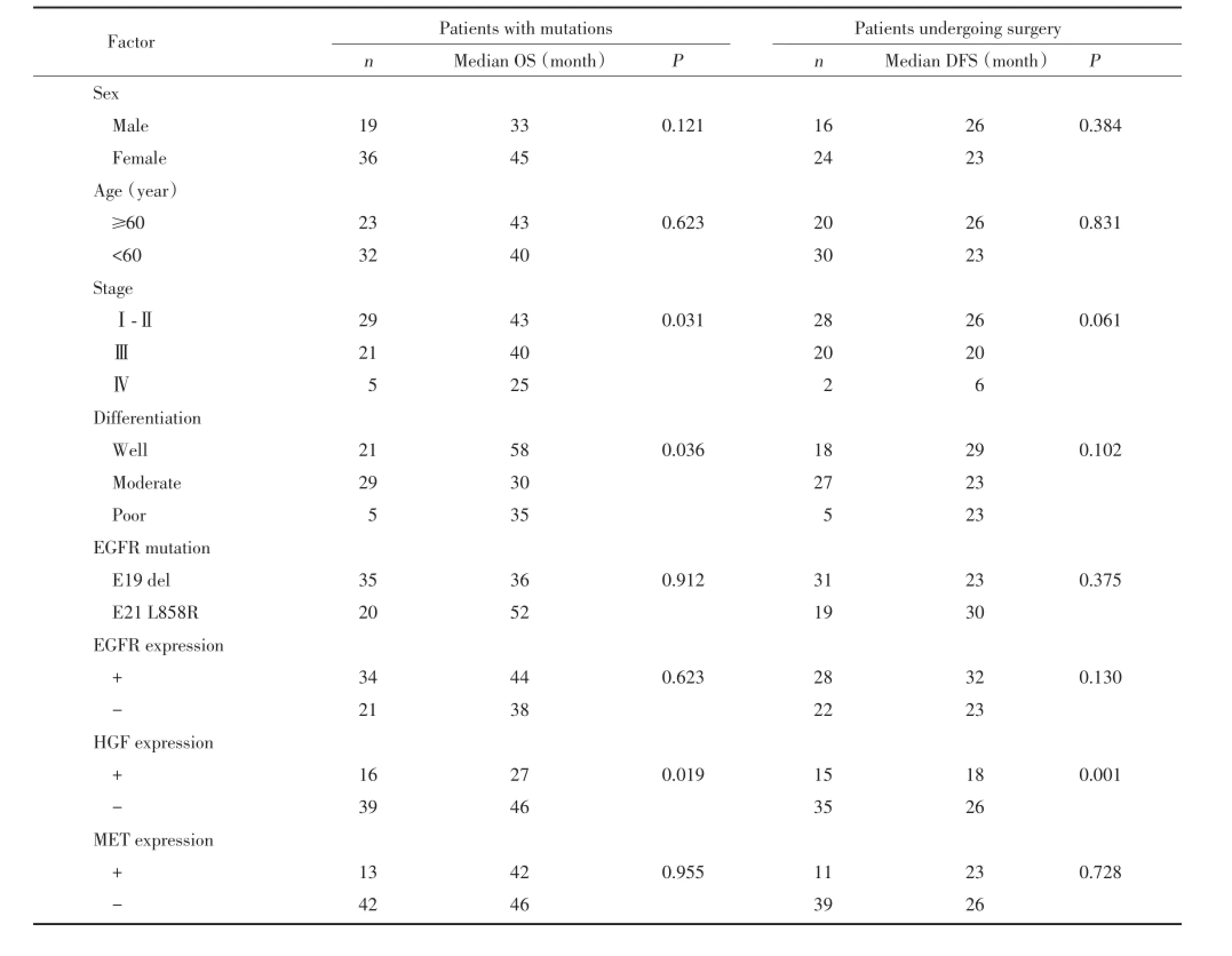
表2 患者预后与临床因素的关系Tab.2 Relationship between clinica l factors and patient prognosis
3 讨论
研究[8-9,12]显示,HGF可介导继发性耐药的发生,而另有研究[13]发现,HGF在EGFR-TKI原发性耐药及继发性耐药患者的病理组织中均有表达,这提示HGF可能也参与了原发性耐药。本研究显示,HGF蛋白是患者OS和DFS的独立预后因素之一,HGF阴性者与阳性组比较,其OS和DFS显著延长(P< 0.05)。而对于经TKI治疗的患者,HGF阴性与阳性者比较,其PFS和OS有延长趋势,同时阴性患者客观缓解率明显高于阳性患者(75%和33%,P= 0.032),提示HGF可能是EGFR-TKI原发性耐药以及疾病客观缓解率不一的重要原因之一,联合HGF蛋白检测可能会更好的预测EGFR-TKI疗效和预后生存,然而限于有限的样本数和回顾性研究,亟待进一步扩大样本量并进行治疗前后对比研究加以证实。
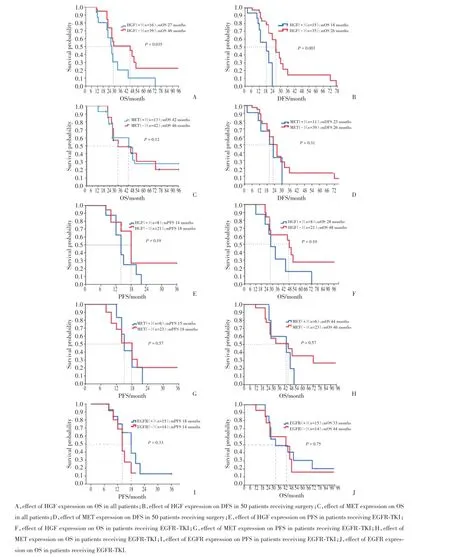
图2 不同蛋白表达对生存的影响Fig.2 Effec ts of different prote in expressions on su rvival
HGF作为MET的天然配体,通过与MET结合后激活下游的信号通路,促进细胞增殖。HGF可能通过激活旁路途径、促进MET基因扩增等途径引起EGFR-TKI耐药[14-15]。本研究中,EGFR突变患者未经治疗前HGF阳性表达率仅为29%,与文献报道的原发性耐药患者阳性率一致,但低于耐药后HGF蛋白的表达率(61%)[13]。原因可能是患者用药前肿瘤间质中的HGF可能处于一种低表达状态,当受到EGFR药物持续作用后,肿瘤微环境产生变化,从而分泌大量HGF,这也是导致继发性耐药一种模式。
约20%的EGFR敏感突变NSCLC患者对TKI治疗原发性耐药,而有效的患者也极少完全缓解,而是不同程度的部分缓解。目前对此的解释是肿瘤异质性以及不同患者癌组织细胞中EGFR敏感突变的丰度或比例不同所致,EGFR突变丰度高的患者对EGFR-TKI更为敏感[16]。另外,不同位点突变对TKI的反应不同,E19 del突变患者在PFS和(或)OS上明显优于E21 L858R突变患者[17],本研究中应用TKI治疗的患者,不同突变类型患者在生存上并无显著差异,可能跟病例数有限有关。
MET诱导的耐药与MET的激活有关,即HGF与MET结合后引起的受体-配体激活途径和MET二聚体激活途径[18-19],激活细胞内多种信号通路如PI3K/AKT、MAPK及Stat3通路等,引起肿瘤的增殖、侵袭和转移。本研究发现HGF与MET的表达在空间及表达量上并不完全一致,这也证实了MET诱导的耐药不单依赖于HGF与MET结合的激活途径。一项荟萃分析提示:MET蛋白高表达量者,预后相对差[20]。本研究显示,MET蛋白异质性表达对患者生存及预后的影响并无统计学差异。与既往文献不符,这可能与本研究病例数较少有关。
血清CEA是肺癌诊断和预后判定的肿瘤标志物之一。本研究中,130例已知EGFR基因状态已知的患者基线CEA水平与EGFR突变类型、是否突变、突变蛋白表达和HGF表达均无关。至于是否可以通过连续监测血清中CEA水平来预测EGFR-TKI的疗效及耐药发生,需要进一步研究来证实。
综上,HGF是影响患者生存的独立预后因素之一,阴性表达者其OS、DFS显著延长。而应用EGFRTKI治疗的晚期EGFR敏感突变者,HGF异质性表达可能与EGFR-TKI治疗的原发性耐药或治疗反应不一有关,HGF表达可能是EGFR-TKI疗效和生存预测因素之一。因此,对EGFR突变患者增加HGF蛋白检测可以更好的预测EGFR-TKI疗效和预后生存。但由于本研究的样本量较小,可能存在偏倚,需要扩大样本量来进一步验证。
[1]TORRE LA,BRAY F,SIEGEL RL,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.DOI:10.3322/ caac.21262.
[2]WISTIBA II,GELOVANI JG,JACOBY JJ,et al.Methodological and practical challenges for personalized cancer therapies[J].Nature Rev Clin Oncol,2011,8(3):135-141.DOI:10.1038/nrclinonc.2011.2.
[3]FUKUOKA M,WU YL,THONPRASERT S,et al.Biomarker analyses and final overall survival results from a phaseⅢ,randomized,open-label,first-line study of gefitinib versus carboplatin/paclitaxel in clinically selected patients with advanced non-small-cell lung cancer in Asia(IPASS)[J].J Clin Oncol,2011,29(21):2866-2874.DOI:10.1200/JCO.2010.33.4235.
[4]INOUE A,KOBAYASHI K,MAEMONDO M,et al.Updated overall survival results from a randomized phaseⅢtrial comparing gefitinib with carboplatin-paclitaxel for chemo-naive non-small cell lung cancer with sensitive EGFR gene mutations(NEJ002)[J].Ann Oncol,2013,24(1):54-59.DOI:10.1093/annonc/mds214.
[5]ZHOU C,WU YL,CHEN G,et al.Final overall survival results from a randomised,phaseⅢstudy of erlotinib versus chemotherapy as firstline treatment of EGFR mutation-positive advanced non-small-cell lung cancer(OPTIMAL,CTONG-0802)[J].Ann Oncol,2015,26(9):1877-1883.DOI:10.1093/annonc/mdv276.
[6]NURWIDYA F,TAKAHASHI F,MURAKAMI A,et al.Acquired resistance of non-small cell lung cancer to epidermal grow th factor receptor tyrosine kinase inhibitors[J].Respir Investig,2014,52(2):82-91.DOI:10.1016/j.resinv.2013.07.007.
[7]POPAT S,WOTHERSPOON A,NUTTING CM,et al.Transformation to"high grade"neuroendocrine carcinoma as an acquired drug resistance mechanism in EGFR-mutant lung adenocarcinoma[J]. LungCancer,2013,80(1):1-4.DOI:10.1016/j.lungcan.2012.12.019.
[8]YAMADA T,TAKEUCHI S,KITA K,et al.Hepatocyte growth factor induces resistance to anti-epidermal growth factor receptor antibody in lung cancer[J].J Thorac Oncol,2012,7(2):272-280. DOI:10.1097/JTO.0b013e3182398e69.
[9]MATSYMOTO K,NAKAMURA T.Hepatocyte growth factor and the Met system as a mediator of tumor-stromal interactions[J].Int J Cancer,2006,119(3):477-483.DOI:10.1002/ijc.21808.
[10]LEE Y,LEE GK,LEE YS,et al.Clinical outcome according to the level of preexisting epidermal growth factor receptor T790M mutation in patients with lung cancer harboring sensitive epidermal growth factor receptor mutations[J].Cancer,2014,120(14):2090-2098.DOI:10.1002/cncr.28711.
[11]RAGHAV KP,GONZALEA-ANGULO AM,BLUMENSCHEIN
GR,et al.Role of HGF/MET axis in resistance of lung cancer to contemporary management[J].Transl Lung Cancer Res,2012,1(3):179-193.DOI:10.3978/j.issn.2218-6751.
[12]YAMADA T,MATSUMOTO K,WANG W,et al.Hepatocyte growth factor reduces susceptibility to an irreversible epidermal growth factor receptor inhibitor in EGFR-T790M mutant lung cancer[J].Clin Cancer Res,2010,16(1):174-183.DOI:10.1158/ 1078-0432.CCR-09-1204.
[13]YANO S,YAMADA T,TAKEICHI S,et al.Hepatocyte growth factor expression in EGFR mutant lung cancer with intrinsic and acquired resistance to tyrosine kinase inhibitors in a Japanese cohort[J].J Thorac Oncol,2011,6(12):2011-2017.DOI:10.1097/ JTO.0b013e31823ab0dd.
[14]TURKE AB,ZEJNULLAHU K,WU YL,et al.Preexistence and clonal selection of MET amplification in EGFR mutant NSCLC[J]. Cancercell,2010,17(1):77-88.DOI:10.1016/j.ccr.2009.11.022.
[15]TOYOOKA S,DATE H,UCHIDA A,et al.The epidermal growth factor receptor D761Y mutation and effect of tyrosine kinase inhibitor[J].Clin Cancer Res,2007,13(11):3431.DOI:10.1158/1078-0432.CCR-07-0070.
[16]ZHAO ZR,WANG JF,LIN YB,et al.Mutation abundance affects the efficacy of EGFR tyrosine kinase inhibitor readministration in non-small-cell lung cancer with acquired resistance[J].Med Oncol,2014,31(1):810.DOI:10.1007/s12032-013-0810-6.
[17]SHENG M,WANG F,ZHAO Y,et al.Comparison of clinical outcomes of patients with non-small-cell lung cancer harbouring epidermal growth factor receptor exon 19 or exon 21 mutations after tyrosine kinase inhibitors treatment:a meta-analysis[J].Eur J Clin Pharmacol,2015,72(1):1-11.DOI:10.1007/s00228-015-1966-0.
[18]GOYAL L,MUZUMDAR MD,ZHU AX.Targeting the HGF/c-MET pathway in hepatocellular carcinoma[J].Clin Cancer Res,2013,19(9):2310-2318.DOI:10.1158/1078-0432.CCR-12-2791.
[19]TROVATO M,TORRE ML,RAGONESE M,et al.HGF/c-met system targeting PI3K/AKT and STAT3/phosphorylated-STAT3 pathways in pituitary adenomas:an immunohistochemical characterization in view of targeted therapies[J].Endocrine,2013,44(3):735-743.DOI:10.1007/s12020-013-9950-x.
[20]GUO B,CEN H,TAN X,et al.Prognostic value of MET gene copy number and protein expression in patients with surgically resected non-small cell lung cancer:a meta-analysis of published literatures[J].PloS One,2014,9(6):e99399.DOI:10.1371/journal. pone.0099399.
(编辑陈姜)
Heterogenous Expression of HGF/MET in Non-small Cell Lung Cancer Harboring EGFR Activating Mutations and Their Clinical Significances
ZHANG Shuling,SUN Xin,SUN Li,XIONG Zhicheng,SUN Jing,MA Jietao,HAN Chengbo
(Department of Oncology,Shengjing Hospital,China Medical University,Shenyang 110022,China)
Objective To analyze the correlation between the expression of HGF,MET and exon 19(E19)deletion(del)and exon 21(E21)L858R mutations or protein expression,and to explore the relationship between these factors and clinicopathological features and survival in patients harboring activating mutations in the epidermal growth factor receptor(EGFR)gene.Methods The expression of E19 del or E21 L858R,MET and HGF proteins was quantitated by S-P immunohistochemical analysis with specific antibodies in tumor specimens from 55 non-small cell lung cancer(NSCLC)patients who harbored activating EGFR mutations.Kaplan-Meier was adopted to draw the survival curve,and log-rank was used to compare the survival difference.Results Positive expression rates of HGF and MET proteins in patients with EGFR mutation were significantly higher than those in patients without EGFR mutation(P<0.05).Patients with negative expression of HGF had a significantly increased median disease-free survival(P=0.003)and overall survival(P=0.035)compared with those with positive expression of HGF.29 patients with EGFR mutation who either experienced recurrence after surgery or were initially diagnosed as an advanced disease received epidermal growth factor receptor tyrosine kinase inhibitors(EGFR-TKI)therapy in first-line or subsequent lines.Patients with negative expression of HGF had a trend towards significance in both progression-free survival and overall survival compared with those with positive expression of HGF(P=0.19 and P= 0.10,respectively).Conclusion HGF might be used as an indicator in patients with non-small cell lung cancer patients harboring activating mutations in EGFR to determine recurrence,prognosis and survival.On the basis of sensitive mutations in EGFR gene,HGF can be used for further accurately prediction of EGFR-TKI efficacy and survival.
non-small cell lung cancer;epidermal growth factor receptor;tyrosine kinase inhibitors;hepatocyte growth factor;MET;sensitive mutations
R734.2
A
0258-4646(2016)10-0865-07
10.12007/j.issn.0258-4646.2016.10.001
国家自然科学基金(81372531);辽宁省高等学校杰出青年学者成长计划(F11-262-9-11)
张树玲(1985-),女,医师,硕士.
韩琤波,E-mail:hanchengbo@sj-hospital.org
2016-05-10
网络出版时间:
网络出版地址

