人重组WNT5a联合顺铂对舌鳞状细胞癌Tca-8113细胞活性的影响及其机制
赵子明,汪洪宇,胡 静,张 卓,郑华川,黄克强
(锦州医科大学1.附属第二医院口腔科,辽宁锦州121001;2.附属第一医院骨科,辽宁锦州121001;3.中心实验室,辽宁锦州121001;4.附属第一医院肿瘤基础与转化实验室,辽宁锦州121001)
人重组WNT5a联合顺铂对舌鳞状细胞癌Tca-8113细胞活性的影响及其机制
赵子明1,汪洪宇2,胡静3,张卓4,郑华川4,黄克强1
(锦州医科大学1.附属第二医院口腔科,辽宁锦州121001;2.附属第一医院骨科,辽宁锦州121001;3.中心实验室,辽宁锦州121001;4.附属第一医院肿瘤基础与转化实验室,辽宁锦州121001)
目的观察人重组WNT5a蛋白(rWNT5a)联合顺铂对舌鳞状细胞癌Tca-8113细胞活性的影响并初步探寻其分子机制。方法MTT检测rWNT5a+顺铂对Tca-8113细胞增殖的影响,TUNEL法检测rWNT5a+顺铂对Tca-8113细胞凋亡的影响,Western blot检测WNT通路相关蛋白β-catenin、GSK3β、LEF-1及自噬相关蛋白Beclin1和LC3Ⅱ的表达,免疫荧光观察WNT5a表达的变化。结果rWNT5a+顺铂组与顺铂或rWNT5a单独处理组相比,明显抑制舌癌细胞增殖并促进其凋亡(P<0.05)。舌鳞状细胞癌中顺铂组与空白对照组相比,激活了自噬相关蛋白Beclin1和LC3Ⅱ(P<0.05),而rWNT5a+顺铂组与顺铂组相比,明显抑制了自噬相关蛋白Beclin1和LC3Ⅱ的表达(P<0.05)。顺铂组与空白对照组相比,明显上调WNT通路相关蛋白β-catenin、GSK3β、LEF-1的表达(P<0.05)。rWNT5a+顺铂组或rWNT5a组与顺铂组相比,明显抑制了WNT通路相关蛋白β-catenin、GSK3β、LEF-1(P<0.05)。结论舌鳞状细胞癌Tca-8113细胞中应用rWNT5a+顺铂比单独应用顺铂明显抑制舌癌细胞增殖并促进其凋亡,其内在机制可能与rWNT5a调控WNT通路和抑制自噬有关。
舌鳞状细胞癌;人重组WNT5a蛋白;顺铂;WNT通路;自噬
口腔鳞状细胞癌为常见的癌症,在全世界排第6位[1]。尽管近年手术技术、放射治疗技术、化疗技术有所提高,但总的来说该病的5年生存率仍然只有50%,近几十年内没有显著提高[2]。舌鳞状细胞癌是最严重口腔鳞状细胞癌,具有增长迅速和容易局部及远端转移的特点,是最具破坏性的口腔上皮癌。口腔鳞状细胞癌因其高增殖和侵袭性已被认定为是全球公众健康的一个重要威胁[3]。WNT信号通路激活在发育、组织稳态和再生过程中发挥重要作用[4]。在许多人类癌细胞都存在WNT通路调节紊乱,此通路在细胞形态和细胞分化过程中起重建作用。WNT通路分为经典WNT通路和非经典WNT通路,经典WNT通路通常指需要激活βcatenin蛋白的WNT/β-catenin途径,而不包含在经典通路范围里的非依赖β-catenin的WNT信号通路概括为非经典WNT通路。有证据表明调控WNT通路可以调节细胞新陈代谢,包括肿瘤细胞重构的过程[5-8]。
细胞自噬即为细胞“自己吃自己的”的现象,是通过溶酶体来清除细胞内受损变性的蛋白及失去功能的细胞器,将其分解为氨基酸、脂肪酸等物质,为细胞的再循环和再利用提供基础;有大量研究表明细胞自噬促进了鳞癌细胞对化疗药物抵抗性,通过抑制鳞癌细胞自噬提高了其对化疗药物敏感性[9-10]。本研究中我们使用人重组WNT5a蛋白(human recombinant WNT5a protein,rWNT5a)联合顺铂处理,观察其对舌鳞癌细胞WNT通路的调控、自噬和凋亡的影响,为舌癌生物治疗和化疗增敏提供科学的实验依据。
1 材料与方法
1.1研究对象
舌鳞状细胞癌细胞系Tca-8113购于中国生命科学院。所有细胞用DMEM培养基在10 cm培养皿、5%CO2、37℃下培养。细胞用0.05%的胰蛋白酶消化,细胞重新铺板培养12 h,用15 μmol/L顺铂或者20 ng/mL rWNT5a处理Tca-8113细胞,48 h后收样,用于各种检测。
1.2仪器与试剂
DMEM培养基、PBS及胰蛋白酶购自美国Hyclone公司;rWNT5a、GSK3β抗体购于美国NOVUS公司;β-catenin、LEF-1、LC3Ⅱ、Beclin1、WNT5a抗体购于美国Abcam公司;TUNEL染色试剂盒购于德国Roche公司;顺铂、β-actin抗体、MDC染色试剂盒购于美国Sigma公司;荧光倒置相差显微镜购自德国Leica公司;CO2培养箱购自美国Fisher Scientific公司。
1.3实验方法
将Tca-8113细胞分为空白对照组、顺铂组(15 μmol/L)、顺铂(15 μmol/L)+rWNT5a(20 ng/mL)组、rWNT5a(20 ng/mL)组,收样用于MTT和TUNEL检测、MDC染色、Western blot检测。
1.4MTT
细胞以5×103/孔均匀接种到96孔板,除去外周孔的中间60个孔,在无菌环境37℃培养12 h。顺铂或rWNT5a处理后,10μL MTT溶液(5 mg/m L)替代血清,37℃孵育4 h。除去MTT溶液,培养皿加150μL DMSO处理,避光条件下摇晃15 min,快速溶解已形成的甲赞晶体,于波长570 nm检测吸光度值。
1.5TUNEL染色
TUNEL(TMR red标记)细胞死亡原位杂交检测试剂盒购于德国Roche公司,制备单细胞悬液,细胞以1×105/mL密度被接种到培养皿中。贴壁后按分组处理细胞,培养48 h后PBS洗3次,在室温(25℃)用4%多聚甲醛固定40 min,PBS冲洗3次,每次3 min,弃PBS加入现配的混合液(酶溶液∶标记溶液= 1∶9),37℃避光孵育1 h。在室温避光的条件下PBS清洗3次,每次3 min,用DAPI(1∶1 000)溶于PBS处理细胞5 min,再用PBS清洗3次,每次3 min,即可显微镜下观察。在200倍的荧光显微镜下观察一个视野中TUNEL染色阳性细胞数平均值评估细胞凋亡程度。随机选取6~8个TUNEL染色的区域,对TUNEL阳性的细胞进行计数,并计算平均值。
1.6MDC染色检测
细胞24孔板培养12 h,更换培养基加入顺铂或rWNT5a继续培养48 h。黑暗环境中,用最终浓度为0.05 mmol/L的MDC甲醇溶液处理Tca-8113细胞,37℃下作用30 min。然后用PBS冲洗2次,用4%多聚甲醛固定30 min。用荧光显微镜Leica DMI4000B观察。
1.7Western blot分析
各实验组处理后,收集细胞蛋白,用含有PMSF的裂解液裂解细胞。收集上清,4℃、12 000r/min高速离心20 min。蛋白使用SDS-PAGE电泳分离并转到PVDF膜上。牛血清白蛋白溶液封闭1h后,一抗4℃过夜孵育,二抗室温孵育1 h,ECL发光法上机检测。一抗如下:β-catenin(1∶25),GSK-3β(1∶1 000),LEF-1(1∶1 000),LC3Ⅱ(1∶1 000),Beclin1(1∶1 000),β-actin(1∶2 000)。
1.8统计学分析
采用SPSS 19.0软件进行统计分析,数据以x±s表示,对照组和各实验组均数的比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1rWNT5a和顺铂联合显著抑制Tca-8113细胞增殖并诱导其凋亡
通过MTT法检测了空白对照组、顺铂组、顺铂+ rWNT5a组、rWNT5a组的吸光度值,rWNT5a组和顺铂+rWNT5a组与空白对照组相比吸光度值明显减少,表明rWNT5a组和顺铂+rWNT5a组比空白对照组Tca-8113细胞生存率明显降低,顺铂+rWNT5a组比顺铂组Tca-8113细胞生存率明显降低(P<0.05),见图1A。TUNEL法检测舌鳞癌细胞凋亡情况,结果显示顺铂+rWNT5a组凋亡率明显高于顺铂组或rWNT5a组(P<0.05),见图1B、1C。
2.2顺铂联合rWNT5a对舌鳞癌Tca-8113细胞自噬小体表达的影响
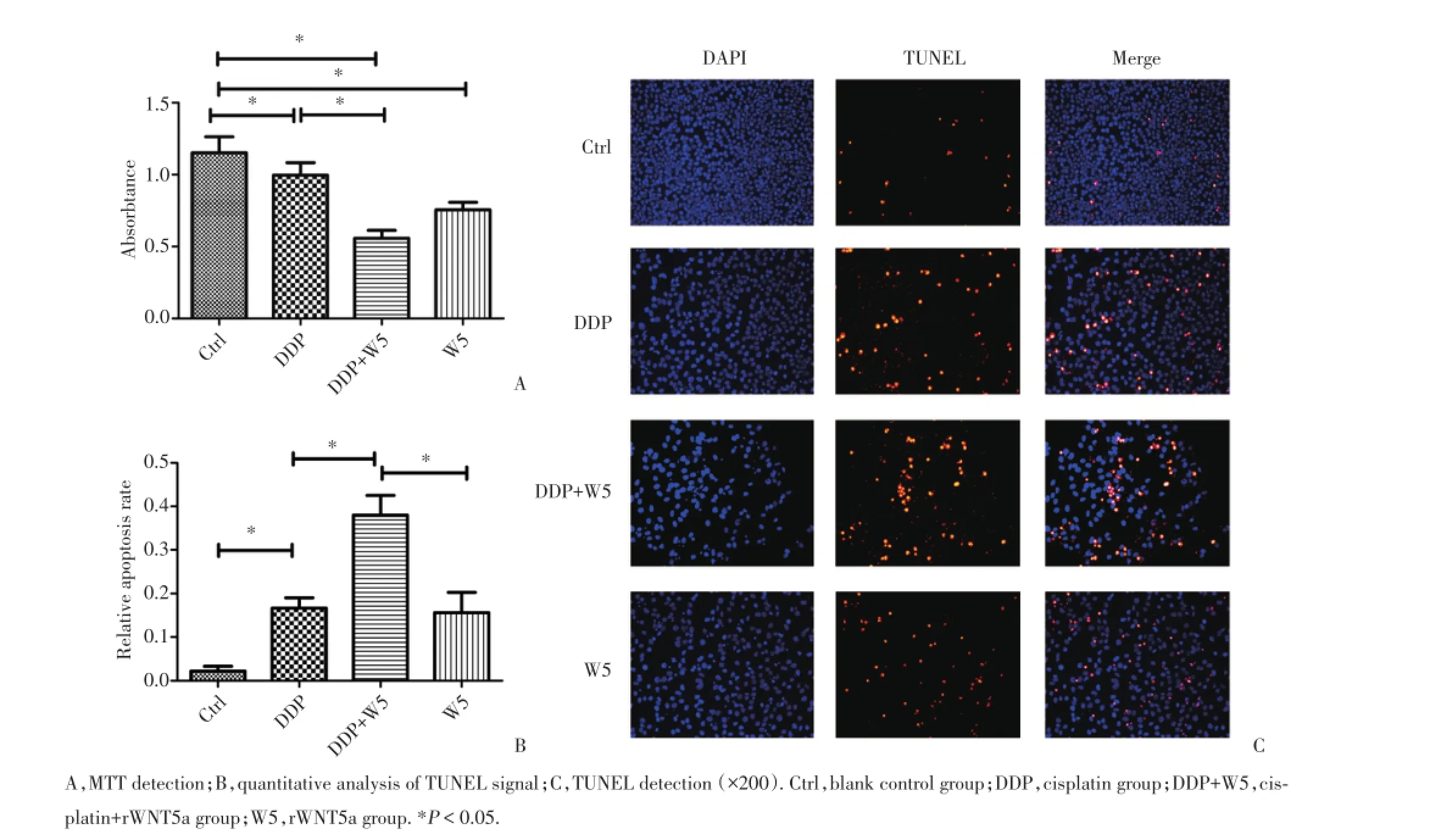
图1 rWNT5a联合顺铂对Tca-8113细胞增殖和凋亡的影响Fig.1 The effects of rWNT5a and cisp latin on pro liferation and apop tosis of Tca-8113 cells
MDC染色可以荧光标记自噬小体,我们通过MDC染色检测了自噬小体在细胞内表达,发现自噬小体存在于Tca-8113细胞质中(图2A)。通过Image J软件进行荧光强度统计分析,结果表明顺铂明显上调了自噬小体表达(P<0.05),顺铂+rWNT5a组中顺铂诱导的自噬激活明显抑制(P<0.05),rWNT5a组与空白对照组相比自噬小体无明显差异,见图2B。
2.3rWNT5a可抑制顺铂激活经典WNT通路和自噬相关蛋白表达
顺铂上调Tca-8113细胞内的经典WNT信号通路相关蛋白β-catenin、GSK3β和LEF-1以及自噬相关蛋白LC3Ⅱ和Beclin1表达。然而,rWNT5a组和顺铂+rWNT5a组与顺铂组相比,β-catenin、GSK3β和LEF-1以及LC3Ⅱ和Beclin1表达均抑制,见图3、图4。
3 讨论
顺铂是临床治疗口腔癌常用药物,但患者长期用药往往产生耐药,使其化疗效果变差,甚至癌细胞会产生抗药突变。经典WNT通路中的关键蛋白β-catenin作为转录因子,常常与GSK3β、LEF-1相互作用,激活WNT靶基因,WNT信号通路及其众多的下游效应器调节多种与肿瘤相关的生物学过程,包括肿瘤形成、增殖、肿瘤细胞凋亡、衰老、分化、转移及代谢。有研究在头颈部鳞状细胞癌中发现过量的WNT/β-catenin信号相关蛋白表达[11],其信号通路激活可能与头颈部鳞状细胞增殖密切相关。
细胞自噬是一种溶酶体分解代谢过程,通过定期清除损伤、老化和多余的自我成分来保护细胞和维持组织稳态。在正常细胞中,自噬可以通过促进蛋白质聚集体的预防性消除和抑制氧化线粒体,防止基因突变和癌变。癌基因和抑癌基因的突变导致自噬功能失调。放化疗引起自噬上调,这有利于癌细胞在营养缺乏和低氧情况存活。LC3Ⅱ是形成自噬溶酶体膜的重要组成部分,LC3Ⅱ表达水平一定程度上反映细胞自噬程度,Beclin1是调控自噬途经的关键蛋白[12],与经典PI3K结合,诱发自噬的起始[13]。
本研究发现在人舌鳞状细胞癌Tca-8113细胞中,通过MTT和TUNEL技术观察rWNT5a+顺铂对舌癌细胞凋亡影响,发现rWNT5a+顺铂组与顺铂组或rWNT5a组相比明显抑制舌癌细胞增殖并诱导其细胞凋亡。为进一步探究分子机制,本研究通过Western blot检测WNT通路相关蛋白和自噬相关蛋白,结果发现顺铂组明显激活经典WNT通路相关蛋白β-catenin、GSK3β和LEF-1,而rWNT5a组或顺铂+rWNT5a组明显抑制WNT通路β-catenin、GSK3β和LEF-1表达。同时,rWNT5a+顺铂组与顺铂组相比抑制自噬相关蛋白Beclin1和LC3Ⅱ表达,自噬小体形成与2种蛋白表达水平结果一致,提示LC3Ⅱ是实现舌鳞状细胞癌自噬的标志蛋白,二者单独和联合使用诱导舌鳞状细胞癌自噬是依赖Beclin1的经典途径。凋亡相关检测说明顺铂联合rWNT5a在舌鳞状细胞癌细胞系产生了有效的抗肿瘤作用,WNT5a可能是口腔鳞状细胞癌发生发展过程中起重要作用的关键基因,其机制可能与调控WNT通路及抑制自噬有关。在口腔鳞状细胞癌中WNT5a信号通路相互作用机制还有待进一步研究。

图2 MDC染色检测Tca-8113各组细胞自噬小体表达Fig.2 The level of autophagosome of Tca-8113 ce lls in each group as determined by MDC staining

图3 Western blot检测β-catenin、GSK-3β、LEF-1、LC3Ⅱ、Bec lin1蛋白的表达Fig.3 The expressions of β-catenin,GSK-3β,LEF-1,LC3Ⅱ,and Beclin1 as determ ined by Western b lot
总之,口腔鳞状细胞癌中应用rWNT5a+顺铂明显促进舌鳞状细胞癌Tca-8113细胞的凋亡并抑制其增殖,其内在机制可能与调控WNT通路和抑制自噬有关,两者联合使用将大大推动舌鳞状细胞癌生物治疗和综合治疗发展。

图4 WNT通路蛋白和自噬相关蛋白灰度值的统计分析Fig.4 Statistica l analysis of the gray-level value of WNT signaling protein and autophagy related protein
[1]PARKIN DM,BRAY F,FERLAY J,et al.Estimating the world cancer burden:Globocan 2000[J].Int J Cancer,2001,94(2):153-156.DOI:10.1002/ijc.1440.
[2]COOPER JS,PAJAK TF,FORASTIERE AA,et al.Postoperativeconcurrent radiotherapy and chemotherapy for high-risk squamouscell carcinoma of the head and neck[J].N Engl J Med,2004,350(19):1937-1944.DOI:10.1056/NEJMoa032646.
[3]AMIT M,YEN TC,LIAO CT,et al.Improvement in survival of patients with oral cavity squamous cell carcinoma:an international collaborative study[J].Cancer,2013,119(24):4242-4248.DOI:10.1002/cncr.28357.
[4]VOGEL A,RODRIGUEZ C,WARNKEN W,et al.Dorsal cell fate specified by chick Lmx1 during vertebrate limb development[J]. Nature,1995,378(6558):716-720.DOI:10.1038/378716a0.
[5]LEE SY,JEON HM,JU MK,et al.Wnt/Snail signaling regulates cytochrome C oxidase and glucose metabolism[J].Cancer Res,2012,72(14):3607-3617.DOI:10.1158/0008-5472.CAN-12-0006.
[6]SHERWOOD V,CHAURASIYA SK,EKSTROM EJ,et al.WNT5A-mediated beta-catenin-independent signalling is a novel regulator of cancer cell metabolism[J].Carcinogenesis,2014,35(4):784-794. DOI:10.1093/carcin/bgt390.
[7]PATE KT,STRINGARI C,SPROWL-TANIO S,et al.Wnt signaling directs a metabolic program of glycolysis and angiogenesis in colon cancer[J].EMBO J,2014,33(13):1454-1473.DOI:10.15252/ embj.201488598.
[8]YANG L,PEREZ AA,FUJIE S,et al.Wnt modulates MCL1 to control cell survival in triple negative breast cancer[J].BMC Cancer,2014,14:124.DOI:10.1186/1471-2407-14-124.
[9]SAIYIN W,WANG D,LI L,et al.Sequential release of autophagy inhibitor and chemotherapeutic drug with polymeric delivery system for oral squamous cell carcinoma therapy[J].Mol Pharm,2014,11(5):1662-1675.DOI:10.1021/mp5000423.
[10]全海英,周丽佳,李昴迪,等.氯喹增强口腔癌CAL-27细胞对顺铂化疗敏感性的观察[J].上海口腔医学,2015,24(1):30-36.
[11]LEETHANAKUL C,PATEL V,GILLESPIE J,et al.Distinct pattern of expression of differentiation and growth-related genes in squamous cell carcinomas of the head and neck revealed by the use of laser capture microdissection and cDNA arrays[J].Oncogene,2000,19(28):3220-3224.DOI:10.1038/sj.onc.1203703.
[12]KLIONSKY DJ,ABDALLA FC,ABELIOVICH H,et al.Guidelines for the use and interpretation of assays for monitoring autophagy[J].Autophagy,2012,8(4):445-544.DOI:10.1080/ 15548627.2015.1100356.
[13]KIHARA A,KABEYA Y,OHSUMI Y,et al.Beclin-phosphatidylinositol 3-kinase complex functions at the trans-Golgi network[J].EMBO Rep,2001,2(4):330-335.DOI:10.1093/embo-reports/kve061.
(编辑陈姜)
Effects of Human Recombination Protein WNT5a Combined with Cisplatin on Cell Viability and Its Underlying Mechanism in Tongue Squamous Cell Carcinoma Tca-8113 Cells
ZHAO Ziming1,WANG Hongyu2,HU Jing3,ZHANG Zhuo4,ZHENG Huachuan4,HUANG Keqiang1
(1.Department of Orthodontics,The Second Affiliated Hospital of Jinzhou Medical University,Jinzhou 121001,China;2.Department of Orthopedics,The First Affiliated Hospital of Jinzhou Medical University,Jinzhou 121001,China;3.Department of Central Laboratory,Jinzhou Medical University,Jinzhou 121001,China;4.Department of Tumor Foundation and Transformation Laboratory,The First Affiliated Hospital of Jinzhou Medical University,Jinzhou 121001,China)
Objective To investigate the effects of human recombinant WNT5a(rWNT5a)combined with cisplatin on cell viability of tongue squamous cell carcinoma Tca-8113 cells,and explore its underlying molecular mechanism.M ethods After the exposure to rWNT5a and cisplatin,the cell proliferation and cell apoptosis of Tca-8113 was determined by MTT and TUNEL staining,respectively.The expression of β-catenin,GSK3β,LEF-1,Beclin1,and LC3II was evaluated by Western blot.WNT5a expression was detected by immunofluorescence as well.Results The combination of rWNT5a and cisplatin remarkably inhibited the proliferation and induced apoptosis of Tca-8113 cells(P<0.05).Cisplatin increased the autophagy related proteins LC3Ⅱand Beclin1 in Tca-8113 cells indicating activation of autophagy(P<0.05),while rWNT5a significantly inhibits the expressions of LC3Ⅱand Beclin1 suggesting that rWNT5a weaken level of autophagy(P<0.05).Cisplatin significantly activated expressions of WNT/β-catenin signaling proteins(β-catenin,GSK3β,and LEF-1)(P<0.05).However,rWNT5a or combination of rWNT5a and cisplatin significantly reduced the expressions of β-catenin,GSK3β,and LEF-1 in comparison to cisplatin treatment(P<0.05),while it was the converse for WNT5a.Conclusion The combination of rWNT5a with cisplatin can obviously promote apoptosis and inhibit proliferation of tongue squamous cell carcinoma,and its underlying molecular mechanism may related to the regulation of WNT signaling and blocking of autophagy in Tca-8113 cells.
tongue squamous cell carcinoma;human recombinant WNT5a protein;cisplatin;WNT signal pathway;autophagy
R781.5
A
0258-4646(2016)10-0871-06
10.12007/j.issn.0258-4646.2016.10.002
国家自然科学基金(81172371,81472544)
赵子明(1989-),女,医师,硕士.
黄克强,E-mail:hkq9@163.com
2016-03-10
网络出版时间:
网络出版地址

