严格厌氧发酵体系在线尾气监测系统的设计及在梭菌生产生物能源丁醇的应用
赵倩倩,杜广庆,陈丽杰,薛闯,白凤武
(大连理工大学生命科学与技术学院,辽宁 大连 116023)
严格厌氧发酵体系在线尾气监测系统的设计及在梭菌生产生物能源丁醇的应用
赵倩倩,杜广庆,陈丽杰,薛闯,白凤武
(大连理工大学生命科学与技术学院,辽宁 大连 116023)
目前关于有氧或微氧的乙醇发酵的尾气检测系统已经建立,但是对于丙酮丁醇梭菌等严格厌氧菌发酵尾气的在线监测鲜见文献报道。因此,本研究以丙酮丁醇梭菌生产丁醇的严格厌氧发酵体系为研究对象,研究了传统有氧或微氧尾气检测方法在丙酮丁醇梭菌厌氧发酵体系中的检测结果,设计并建立了适合厌氧菌发酵的尾气在线监测系统,对丙酮丁醇梭菌的发酵过程实时监测。在建立有效的厌氧发酵尾气分析系统的条件下,比较了丙酮丁醇梭菌在游离细胞条件下和高细胞密度条件下的发酵性能。相比较于游离发酵,高细胞密度发酵的发酵周期明显缩短,丁醇生产强度显著提高。丁醇最高产量为15.4g/L,生产强度0.64g/(L·h),分别比对照组提高了12.4%和106%,CO2和H2最高产气速率分别提高60%和9%,产气量分别提高了20.7%和41.3%。尾气分析系统采集的气体数据为丙酮丁醇梭菌的代谢分析提供了重要依据。
尾气在线监测;厌氧发酵;高密度细胞发酵;丁醇;生物燃料
近几年来,国内的原油生产量已经跟不上国家经济飞速发展的步伐,寻找石油燃料的可替代燃料成为一项紧迫的任务[1]。丁醇,不仅是一种重要有机化工原料,同时又是具有极大潜力的新型生物燃料[2]。与乙醇相比,生物丁醇具有高燃烧值、高辛烷值、方便运输、水溶性低、无需改造发动机、与汽油配伍性能好等优点,面对日益严峻的环境和石油资源紧缺问题,用生物丁醇作为燃料逐渐取代石油成为国际学术界和工业界的研究热点[3-4]。
发酵生产丁醇的常用菌种为丙酮丁醇梭菌(Clostridium acetobutylicum),是一株严格厌氧菌。除了产溶剂之外,也同时代谢产生CO2和H2[5]。在丙酮丁醇梭菌的代谢过程中,CO2与发酵状态及菌体生长情况相关[6],H2与菌体发酵代谢过程中NADH的生成和铁氧化还原蛋白密切相关[7-8],因此对发酵尾气进行实时定量检测对了解丙酮丁醇梭菌的代谢过程,以及进一步利用过程工程和代谢工程手段对丙酮丁醇梭菌生产进行调控和菌株改造有重要的指导意义。
目前关于有氧或微氧的乙醇发酵的尾气检测系统已经建立,例如作者课题组建立了应用于自絮凝酵母乙醇发酵体系的在线颗粒尺度和尾气 CO2检测,并用于代谢通量分析(metabolic flux analysis)中[9],但是这些适用于有氧或微氧体系的在线尾气方法是否也适用于严格厌氧发酵体系不得而知。对于丙酮丁醇梭菌等严格厌氧菌发酵尾气的在线监测鲜见文献报道。因此,本研究以丙酮丁醇梭菌生产丁醇的严格厌氧发酵体系为研究对象,研究了传统有氧或微氧尾气检测方法在丙酮丁醇梭菌厌氧发酵体系中的检测结果,设计并建立了适合厌氧菌发酵的尾气在线监测系统,对丙酮丁醇梭菌的发酵过程实时监测。并且在梭菌游离细胞和固定化高密度发酵体系进一步比较了厌氧尾气在线监测分析方法,结合丙酮丁醇梭菌生产丁醇的发酵性能分析,阐明了发酵过程液体和气体代谢产物的变化过程。该研究对于深入研究丙酮丁醇梭菌厌氧发酵过程机理,优化、控制发酵过程,以及提高溶剂产量具有重要的意义。
1 实验材料和方法
1.1 菌种
本实验室-80℃冰箱保存的丙酮丁醇梭菌(Clostridium acetobutylicum ATCC 55025)。
1.2 培养基
种子培养基:20g/L葡萄糖,4g/L酵母粉,2g/L胰蛋白胨,微量元素和维生素参照文献[4]。
发酵培养基:80g/L葡萄糖,1g/L酵母粉,0.5g/L KH2PO4,0.5g/L K2HPO4,2.2g/L乙酸铵,维生素(1mg/L对氨基苯甲酸,1mg/L维生素 B1和0.01mg/L维生素H),矿物盐类(0.01g/L MnSO4·H2O,0.2g/L MgSO4·7H2O,0.01g/L NaCl ,0.01g/L FeSO4·7H2O)。
种子培养基和发酵培养基均在 121℃、15min灭菌前通20min氮气除氧。
1.3 尾气分析系统
多组分尾气分析仪是由西安智琦公司生产,用于检测 ABE发酵产生的尾气。尾气分析仪包括IRME-M型红外线气体分析仪、电化学氧分析仪和HYME-G型氢分析仪,可分别检测CO2、O2和H2。尾气分析仪内有可对气体进行干燥过滤的装置(硅胶颗粒填充),可以去除气体中的杂质和水蒸气。气体总流量由气体流量计(CS200,七星华创电子,北京)测定。CO2、H2、O2气体浓度数据使用组态王6.55软件记录监测。3种气体产气速率和气体总量计算方法一样,以CO2为例。
式中,VCO2-n表示第n小时CO2产气速率。n=1时,C1表示第10min的气体浓度,V1表示前10min的气体体积。

1.4 丙酮丁醇梭菌发酵
游离批次发酵:将100mL的种子加入到1.4L发酵培养基中,在37℃和150r/min下进行发酵。通过自动添加氨水(25%)维持pH在5.0以上。
高细胞密度固定化发酵:纤维床反应器(FBB)由采用50mm×400mm,体积250mL的玻璃柱,和内置钢丝固定的棉毛巾组成。将100mL的种子 培养基加入到1.4L发酵培养基中,37℃,150r/min,pH通过自动添加氨水维持在5.0以上。发酵进行到大约24h即菌体OD值为4.3时,通过蠕动泵将罐内的液体循环加到纤维床反应器上,使菌体固定到纤维床反应器上。发酵后的废液用蠕动泵抽离,加入新鲜的发酵培养基开始下一轮批次发酵。
1.5 分析方法
菌体OD值采用酶标仪(Thermo Spectronic,美国)620nm下检测。
葡萄糖浓度通过生物传感器(SBA-50,科学院生物研究所,山东)检测。
产物溶剂浓度用气相色谱Agilent 6890A GC测定。色谱条件为:毛细管色谱柱 HP-INNOWAX(30m×0.25mm×0.50µm),柱温 100℃,进样温度250℃;FID检测器温度300℃;H2流速40mL/min,空气流速400mL/min,N2流速30mL/min;进样量为0.1µL;分流比为50∶1。用异丁醇作为内标物进行定量。
乙酸和丁酸使用Waters 1525高效液相色谱测定。色谱分离条件:Aminex HPX-87H 有机酸分析柱(30cm×7.8mm;Bio-Rad,Hercules),柱温50℃,检测波长为 210nm,进样量为 20μL。流动相为50mmol/L的H2SO4,流速为0.5mL/min。
2 实验结果与讨论
2.1 丙酮丁醇厌氧发酵尾气监测系统的设计
有氧发酵的尾气在线分析系统相当于内嵌式(in situ)气体检测系统,装置图如图1所示。由尾气分析仪内部的泵提供循环动力,将发酵罐、尾气分析仪和进出气管组成一个循环回路。同时发酵产生的尾气通过自然排出发酵罐后由气体流量计测定。该装置已经成功应用于自絮凝酵母乙醇发酵体系的尾气在线监测中。
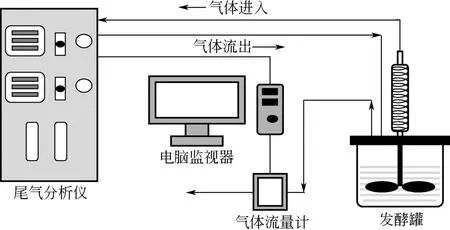
图1 有氧或微氧发酵尾气在线监测装置图
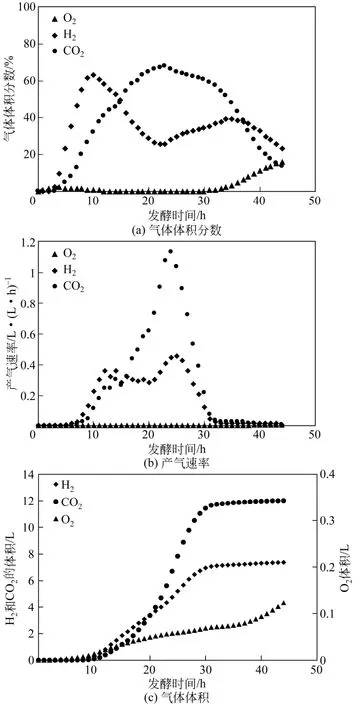
图2 有氧或微氧发酵尾气在线体系监测丙酮丁醇梭菌游离发酵气体图
采用图1装置进行丙酮丁醇梭菌厌氧游离发酵实验和尾气在线监测,所得气体分析数据如图2所示。图2(a),发酵初期0~10h,氧气体积分数逐渐上升,第 3h时,氧气体积分数为 3%。发酵中期氧体积分数最低只有0.08%,但发酵末期30h之后,氧气体积分数高达20%。图2(c)中,氧气体积升至123.7mL。分析原因主要有:发酵初期和发酵末期产气量小,罐内气压小,尾气分析仪和发酵罐组成的循环回路中的气体循环速率为28.5L/h,远大于菌体自产气体速率[图 2(b)],气体循环的影响造成了发酵初期和末期的氧气含量上升。发酵中期 10~30h,CO2和H2的产气速率逐渐增大,产气速率峰值分别为1.13L/(L·h)和0.46L/(L·h),远大于气泵的气体循环速率,气体循环虽然在此时期受干扰可能性小,但对于厌氧菌的整体发酵有较大影响。
为了避免由于气体循环导致的尾气检测系统进氧气干扰厌氧发酵过程,设计监测装置,如图3。在尾气分析仪和发酵罐之间连接锥形瓶 1,从发酵罐中排出的尾气通过冷凝管排入锥形瓶1后,气体会在尾气分析仪和锥形瓶1中形成回路,用于分析尾气的浓度。同时,锥形瓶2与气体流量计连接,气体从锥形瓶1排出后会进入锥形瓶2,再被气体流量计测量,记录发酵过程的气体流速和气体总量。锥形瓶1和锥形瓶2均液封,防止气体回流,从而确保发酵过程不受外界空气干扰。
采用图3装置进行丙酮丁醇梭菌厌氧游离发酵和尾气在线监测,所得气体分析数据如图4所示。图4(a),发酵初期氧气浓度最高仅为2%,发酵终点,氧气体积分数仅为 0.35%。图 4(c),最终进氧量仅为5.9mL,小于图1装置的进氧量123.7mL,说明装置的气密性得到很大改善。改良前装置发酵总产气量为21.0L,H2为7.4L,CO2为12.5L[图2(c)],改良后装置发酵总产气量为 34.9L,H2为 13.9L,CO2为19.3L[图4(c)],改良之后的装置总产气量、CO2产气量和H2产气量分别提高 66.2%、87.8%、54.4%,也可以从侧面说明装置气密性得到完善,可以用于厌氧菌的发酵实验。
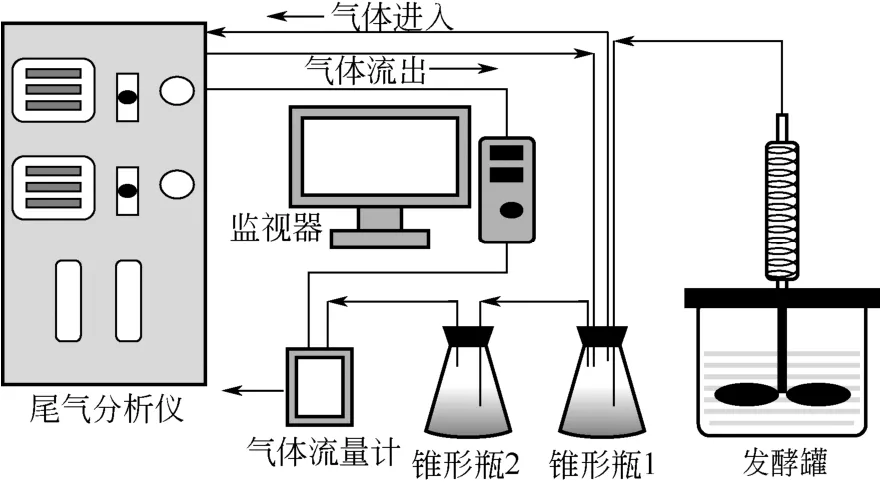
图3 厌氧发酵尾气在线监测装置图
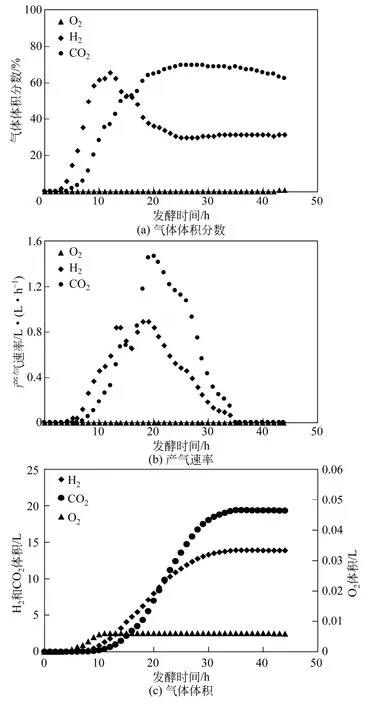
图4 厌氧发酵尾气在线体系监测丙酮丁醇梭菌游离发酵气体图
2.2 高细胞密度条件下的在线尾气分析
通过纤维床反应器固定化富集细胞,同时对发酵过程中产生的尾气进行在线监测。所得气体数据如图5所示。通过比较图5(a)和图4(a)可以看到,气体浓度趋势均为 H2先增加后降低、CO2后增加。从图5(b)得知,H2产气速率在第8h达到峰值1.42L/(L·h),CO2产气速率在第15h时最高,1.61L/(L·h),从图4(b)中可以看出,H2的产气速率最高为0.89L/(L·h),CO2的最高产气速率可以达到1.47L/(L·h),相比较于游离发酵的产气速率,高细胞密度条件下的H2和CO2的产气速率分别提高了60%和9%。图5(c)中可以看到CO2产气量23.3L,H2产气量 19.5L,相比较游离发酵 CO2产气量19.3L,H2产气量13.8L,分别提高了20.7%和41.3%。高细胞密度条件下的发酵,H2和CO2的产气速率和产气量均有提高。H2的产生和梭菌代谢过程中的NADH和铁氧还蛋白密切相关,通过尾气在线监测,量化气体生成,为高密度条件下细胞代谢分析提供准确的气体数据。高细胞密度条件下丙酮丁醇梭菌的厌氧发酵需要在细胞密度最大时富集细胞,由于菌体生长和CO2相偶联,可以在线通过CO2的浓度含量判断富集细胞的时间点。

图5 厌氧发酵尾气在线体系监测丙酮丁醇梭菌高密度细胞发酵气体图
2.3 游离细胞和高细胞密度条件下的丙酮丁醇梭菌的发酵性能比较
高密度条件下丙酮丁醇梭菌发酵是纤维床反应器和发酵罐之间循环发酵,在细胞密度最大第23h、第37h时,通过两次更换新鲜培养基使细胞保持较高活性,具体发酵过程如图6(b)。
对照组是游离批次发酵,由图6(a)得知,发酵周期44h,丁醇13.7g/L,丙酮5.6g/L,乙醇2.0g/L,计算得到丁醇得率0.18g/g,丁醇产率0.31g/(L·h)。高密度条件下的发酵结果由图6(b)可知,FBB发酵周期24h,丁醇15.4g/L,丙酮7.3g/L,乙醇2.4g/L,计算得到丁醇得率0.2g/g,丁醇产率0.64g/(L·h)。
高细胞密度条件下发酵与对照组相比,丁醇产量提高12.4%、得率提高11.1%,生产强度提高了一倍多,发酵周期从44h缩短到24h,主要原因是固定化可以提高细胞密度,同时延长细胞存活时间,提高细胞溶剂耐性[10-11]。
2.4 气体分析和菌体代谢
丙酮丁醇梭菌的代谢特点是两阶段代谢发酵,包括产酸期和产溶剂期。产酸期丙酮丁醇梭菌代谢产乙酸、丁酸,同时并伴随着大量的氢气和二氧化碳产生。产溶剂期,产酸期产生的乙酸和丁酸重吸收,生成乙醇和丁醇[12]。
二氧化碳的变化,反映了发酵过程中丙酮丁醇梭菌的代谢状态,因此CO2浓度可作为衡量发酵水平的重要指标[13]。从图6(a)中可以看出,OD值从0~20h逐渐增长,图4(b)的CO2的产气速率从0~20h逐渐递增,两者变化规律趋近,CO2产气速率越大,菌体生长力越旺盛,这和刘仲汇、姜长江等[14-15]的研究相符,可以通过检测CO2的生成跟踪丙酮丁醇梭菌的生长情况。
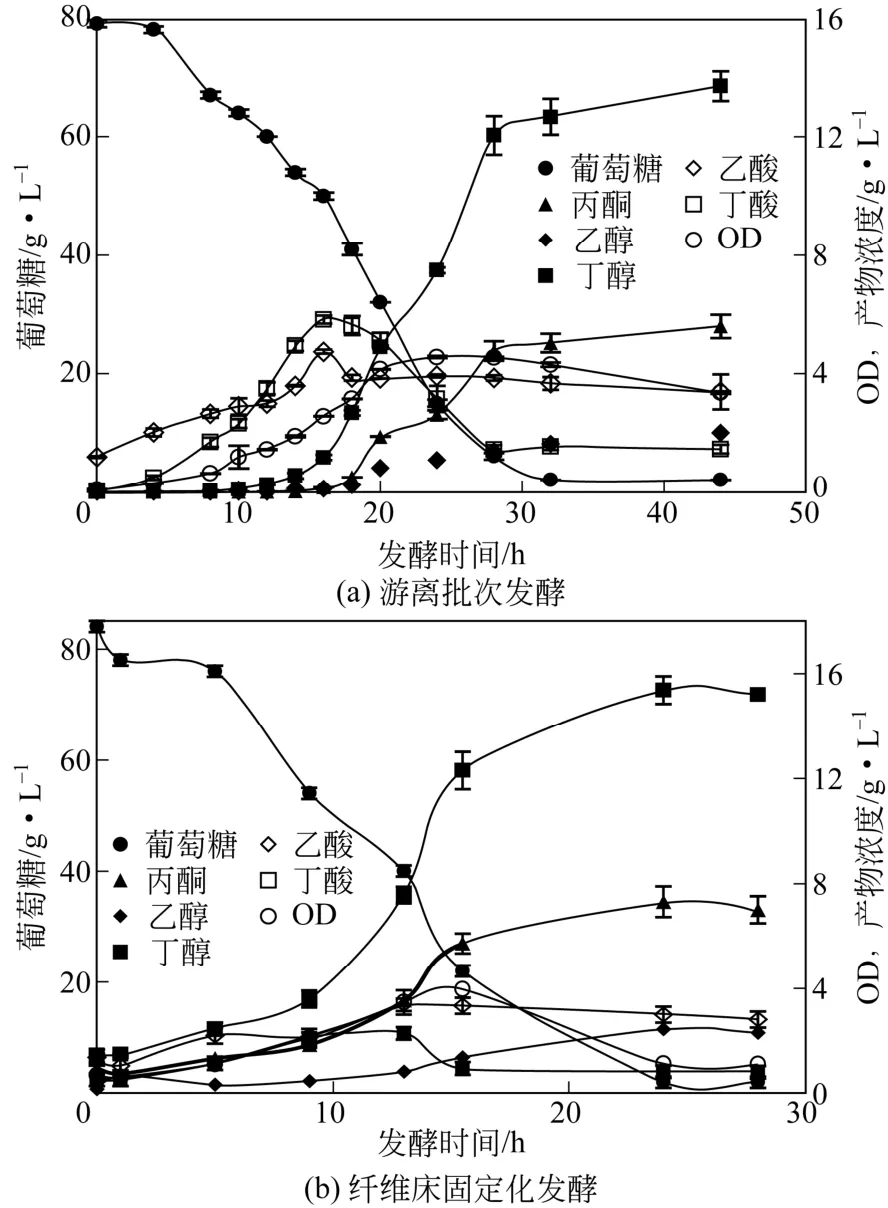
图6 丙酮丁醇梭菌发酵生长动力学
高密度条件下的发酵,生物量提高,菌体的整体代谢能力提高,因此,CO2和H2产气量分别提高了20.7%和41.3%。H2比率提高了3.8%,但是乙醇和丁醇的比例降低了2.8%,可能是因为H2生成和NADH的生成有关,菌体代谢过程中电子流过多的流向H2,会造成NADH的减少。生成醇需要醛脱氢酶和醇脱氢酶,也需要NADH,当NADH减少,乙醇和丁醇的比例就会减少[16-18]。
3 结 论
(1)设计了一种适用于厌氧菌丙酮丁醇梭菌发酵的尾气在线监测系统。
(2)高细胞密度条件下,丙酮丁醇梭菌的发酵性能有所提高,发酵周期明显缩短,丁醇最高产量为15.4g/L,生产强度0.64g/(L·h),分别较对照组提高了12.4%和106%,CO2和H2最高产气速率分别提高60%和9%,产气量分别提高20.7%和41.3%。
(3)通过尾气在线监测系统实时监测厌氧发酵过程,获得的气体数据为丙酮丁醇梭菌的代谢分析提供了准确的依据。
[1] NIGAM P S,SINGH A. Production of liquid biofuels from renewable resources[J]. Prog. Energ. Combust,2011,37(1):52-68.
[2] XUE C,ZHAO X Q,LIU C G,et al. Prospective and development of butanol as an advanced biofuel[J]. Biotechnol. Adv.,2013,31:1575-1584.
[3] DÜRRE P. Biobutanol:an attractive biofuel[J]. Biotechnol. J.,2007,2:1525-1534.
[4] XUE C,ZHAO J B,LIU F F,et al. Two-stage in situ gas stripping for enhanced butanol fermentation and energy-saving product recovery[J]. Bioresour. Technol.,2013,135:396-402.
[5] LEE S Y,PARK J H,JANG S H,et al. Fermentative butanol production by Clostridia[J]. Biotechnology and Bioengineering, 2008,101(2):209-228.
[6] 周灿灿,唐波,罗玮,等. 电子载体对丁醇发酵的影响[J]. 生物加工过程,2012,10(5):1-6.
[7] PETITDEMANGE H,CHERRIER C,RAVAL G,et al. Regulation of the NADH and NADPH-ferredoxin oxidoreductases in Clostridia of the butyric group[J]. Biochimica et Biophysica Acta (BBA):General Subjects,1976,421(2):334-347.
[8] RAO G,MUTHARASAN R. Altered electron flow in continuous cultures of Clostridium acetobutylicum induced by viologen dyes[J]. Applied and Environmental Microbiology,1987,53(6):1232-1235.
[9] XUE C,ZHAO XQ,BAI FW. Effect of the size of yeast flocs and zinc supplementation on continuous ethanol fermentation performance and metabolic flux distribution under very high concentration conditions[J]. Biotechol. Bioeng.,2010,105:935-944.
[10] LU C C,ZHAO J B,YANG S T,et al. Fed-batch fermentation for n-butanol production from cassava bagasse hydrolysate in a fibrous bed bioreactor with continuous gas stripping[J]. Bioresource Technology,2012,104:380-387.
[11] XUE C,ZHAO J B,LU C C,et al. High-titer n-butanol production by Clostridium acetobutylicum JB200 in Fed-batch fermentation with intermittent gas stripping[J]. Biotechnol. Bioeng.,2012,109(11):2746-2756.
[12] 何景昌,张正波,裘娟萍. 生物丁醇合成途径中关键酶及其基因的研究进展[J]. 食品与发酵工业,2009(2):116-120.
[13] 李强,曹竹安. 微生物发酵中二氧化碳释放速率变化规律[J]. 生物工程学报,1996,12:232-237.
[14] 刘仲汇,史建国,朱思荣,等. 尾气在线检测分析在发酵中的应用[J]. 发酵科技通讯,2012(4):36-39.
[15] 姜长江,薛天明. 在线分析仪表在发酵工程中的应用[J]. 仪表技术与传感器,2000(12):39-41.
[16] HÖNICKE D,JANSSEN H,GRIMMLER C,et al. Global transcriptional changes of Clostridium acetobutylicum cultures with increased butanol: acetone ratios[J]. New Biotechnology,2012,29(4):485-493.
[17] SAINT-AMAN S,GIRBAL L,ANDRADE J,et al. Regulation of carbon and electron flow in Clostridium butyricum VPI 3266 grown on glucose-glycerol mixtures[J]. Journal of Bacteriology,2001,183(5):1748-1754.
[18] MEYER C L,PAPOUTSAKIS E T. Increased levels of ATP and NADH are associated with increased solvent production in continuous cultures of Clostridium acetobutylicum[J]. Applied Microbiology and Biotechnology,1989,30(5):450-459.
The design of online off-gas analysis for anaerobic fermentation and its application in biobutanol production by Clostridium as advanced biofuels
ZHAO Qianqian,DU Guangqing,CHEN Lijie,XUE Chuang,BAI Fengwu
(School of Life Science and Biotechnology,Dalian University of Technology,Dalian 116023,Liaoning,China)
Currently,an online off-gas analysis for aerobic or micro-aerobic ethanol fermentation has been established,but the online off-gas analysis for Clostridium acetobutylicum and other strict anaerobic fermentation are rarely reported. Therefore,the study on anaerobic fermentation system is based on an online off-gas analysis for aerobic or micro-aerobic ethanol fermentation,and we take a strictly anaerobic fermentation system of C. acetobutylicum which produces butanol as our research target. Then we get a detection result for the C. acetobutylicum fermentation system by traditional aerobic or micro oxygen gas. Then a design of online off-gas analysis for anaerobic fermentation can be confirmed. Using the online off-gas analysis,the fermentation performance of C.acetobutylicum under the condition of high cell density was investigated. Compared with the batch fermentation,the fermentation time was shortened,and thus butanol productivity was markedly increased. C.acetobutylicum produced 15.40g/L butanol with a productivity of 0.64g/(L·h) when grown in high cell density. Meanwhile,the butanol production and the productivity were 12.4% and 106%,respectively,higher than those of the control. CO2and H2maximum gas rate increased by 60% and 9% respectively,while gas production increased by 20.7% and 41.3%,respectively,while gas data from online off-gas analysis provides an important basis for metabolic analysis of C.acetobutylicum.
online off-gas analysis;anaerobic fermentation;high cell density fermentation;butanol;biofuel;
TQ 923
A
1000-6613(2016)10-3295-06
10.16085/j.issn.1000-6613.2016.10.039
2016-03-15;修改稿日期:2016-06-01。
国家自然科学基金(21576045, 21306020)及辽宁省博士科研启动基金(20141197)项目。
赵倩倩(1990—),女,硕士研究生。E-mail 519241612@qq.com。联系人:薛闯,副教授,主要从事生物能源方面研究。E-mail xue.1@dlut.edu.cn。

