生物基化学品的微生物电合成研究进展
周瑾洁,王旭东,孙亚琴,修志龙
(大连理工大学生命科学与技术学院,辽宁 大连116024)
特约评述
生物基化学品的微生物电合成研究进展
周瑾洁,王旭东,孙亚琴,修志龙
(大连理工大学生命科学与技术学院,辽宁 大连116024)
微生物电合成是结合微生物学与电化学的新兴研究方向。电化学活性菌株以直接或间接的方式吸收人工提供的外源电子,打破胞内代谢原有的氧化还原平衡,定向催化底物合成还原性目的产物。近年来,基于生物基化学品的微生物电合成取得广泛关注。本文综述了生物基化学品微生物电合成的基本原理及最新研究进展,并讨论了电化学活性菌株的种类、电子传递机制以及典型的菌株培养方式,同时结合菌株代谢途径,讨论了微生物电合成促进乙酸、1,3-丙二醇、丁醇、琥珀酸等生物基化学品的作用机理及研究现状。最后指出了电子传递机制、电子传递效率及成本是限制该技术发展的关键问题及未来的发展趋势,旨在推动该技术应用于生物基化学品的发酵工业中。
微生物电合成;发酵;生物基化学品;电子传递机制;电化学活性菌株
微生物发酵工业主要利用纯种菌株转化底物为高附加值目标产物,如乙醇、1,3-丙二醇、丁醇等大宗化学品及氨基酸、抗生素等精细化学品。微生物胞内代谢是一个复杂的氧化还原反应网络,这些氧化还原反应由特异性酶高效催化,各个反应之间彼此联系、互相交错形成一个高效、节能的细胞工厂[1]。在氧化代谢支路中,微生物细胞通过利用碳源、氮源及其他成分组成细胞结构,并合成三磷酸腺苷(ATP)以提供能量,生成氧化产物,氧化反应失去的电子被特定的氧化型辅酶捕获,生成对应的还原型辅酶;在还原代谢支路中,微生物以氧气、底物或特定代谢中间产物为电子受体,生成各类还原产物,并伴随氧化型辅酶的再生。在复杂的微生物代谢过程中,目的产物的形成必然伴随着各类副产物的产生,导致目的产物产率降低、后期分离纯化成本高等系列问题。如何打破微生物细胞内原有的代谢平衡、提高目的产物的得率,是微生物发酵行业面临的一大挑战[2]。改造微生物胞内代谢的方式主要有菌种诱变、基因定向改造、发酵过程调控等,分别从内部基因与外部环境两方面入手优化代谢途径,已取得了长足的进展。
微生物电合成(microbial electrosynthesis,MES)也称微生物电解池(microbial electrolysis cells,MEC),是近年来新兴的微生物学与电化学相结合的交叉技术,由RABAEY教授于2010年在Nature杂志中进行了系统阐述[3],在一定程度上相当于微生物燃料电池(microbial fuel cells,MFC)的逆过程。微生物作为一种特殊的生物催化剂,以直接或间接的方式吸收外界提供的电子,打破胞内代谢原有的氧化还原平衡,定向催化底物合成还原性目的产物,抑制氧化副产物的生成。MES主要在生物电化学系统(bioelectrochemical systems,BES)中实现,如图1所示,该系统由阳极室、阴极室构成,两室各插入电极,由离子交换膜或盐桥相隔,通过恒电位仪向两电极间施加电势或电流,结合菌体自身代谢实现电子回路[4]。
MES研究发展大致分为3个时期:首先在二十世纪八十年代时期,HONGO等[5]学者首先将MES应用于L-谷氨酸发酵,通过施加1.5V电压将L-谷氨酸产量提高10%。各学者相继发现外源电子的引入可促进乳酸[6]、丙酸[7]及丁酸[8]产量的提高;其次在2000年后,该热潮起源于1999年将循环伏安法应用于电子传递机理的探究,证实了外源电子传递介质中性红可将电子由电极运送至细胞膜延胡索酸还原酶中,促进延胡索酸转化为琥珀酸[9]。自此人们开始利用电化学手段表征电子传递机制,探究外源电子影响细胞代谢的作用机理[10];第三次研究热潮出现在二十一世纪一零年代,MES被应用于固定CO2,微生物可将外源电子作为电子供体,驱动 CO2生成为乙酸、甲烷等化学品[11]。在此期间MFC应用于有机污染物处理的研究也异常活跃[12],而一些从事 MFC研究的学者反过来开始研究MES,进一步推动了这一领域的迅速发展。人们普遍认为利用 MES可改变胞内氧化还原辅酶[NAD(P)/NAD(P)H2]比例,为细胞提供还原力。PANDIT等[13]学者利用计算机模拟手段证明了利用微生物电合成手段产生的还原当量可以显著提高大肠杆菌胞内ATP产率及细胞生长速率。因此,MES可以理解为外源电子对微生物的刺激效应[14],通过这种特殊的刺激手段,微生物可表现出独特的生理与代谢应答,完成自然条件难以实现的“非平衡”代谢。由于此过程无需对菌体本身进行基因改造,这无疑成为代谢工程新的发展方向,也将促进生物基化学品的研究及应用开发。

图1 微生物电合成装置及电子传递机制示意图
1 电化学活性菌株及电子传递机制
电化学活性菌株(electroactive bacteria,EAB)是指具有与环境交换电子能力的菌株,这种交换能力可包含两种相反方向的电子传递:①电子由微生物胞内向胞外传递,以环境中固体电极为最终受体,主要应用于MFC中,将底物化学能转化为电能;②微生物细胞摄入外界环境(固体电极等)提供的外源电子,将其由胞外转移至胞内[15]。EAB大部分属于严格厌氧菌或兼性厌氧菌。在菌株长期进化过程中,由于缺乏充足的最终电子受体(O2、CO2,NO3-,SO42-等可溶性底物),某些菌株可利用环境存在的不溶性高价金属离子(Mn4+,Fe3+,Cu2+)作为最终电子受体,将胞内代谢产生的电子转移至外部环境中[16-17],而这种能力成为 MFC的基础。EAB的电子传递并不是简单的一步氧化还原反应,细胞在细胞质膜内存在相当复杂的系列氧化还原电子对,通过形成电子传递链完成电子交换,胞外电子传递(extracellular electron transfer,EET)也是近年来国内外学者研究的热点[18-19]。并不是所有的EAB兼有这两种相反方向的电子交换能力,看似可逆的电子交换在细胞中并不完全经历同一传递途径[20]。该研究领域至今尚未解析清楚,仍存在诸多争议。本文着重介绍电子由固体电极传递至胞内,即EAB应用于MES中的机制。现有研究表明EAB存在的EET主要包含两种方式:①直接传递(direct electron transfer,DET),即EAB直接吸附于固体电极上,依赖细胞质膜细胞色素c[21]、菌毛(纳米导线)[22]传递电子;②间接传递(mediated electron transfer,MET),即EAB与电极依赖于某些小分子介质传递电子。这些小分子介质可以是微生物的某些中间代谢产物(H2[23],HCOOH),也可以是自身合成(黄素[24]、吩嗪类[25]、醌类[26]等)或人工添加的外源电子载体(甲基紫精[27]、中性红[28]、蒽醌-2,6-二磺酸钠[29])。不同种属的EAB存在不同电子传递方式,同一EAB也可存在几种不同的电子传递机制。EAB种类及电子传递机制的深入研究将为MES应用提供理论基础。
当外源电子由不同 EET导入微生物细胞外膜后,电子最终去向与细胞种类有关,不同细胞可通过不同电子传递途径分配给不同电子受体。由于现有技术的限制,这些电子传递途径及电子受体仍存在诸多争议。ROSENBAUM等[30]学者认为细胞色素c与氢化酶在胞内电子传递中起到关键作用。这两种蛋白或单独作用,或相互合作将外源电子由细胞外膜运送至内膜,最终传递给细胞质内电子受体(SO42-、CO2等)。许多证据表明,外源电子的引入会提高胞内 NADH2浓度以及代谢途径中还原产物产量[9,31-32]。因此,这些电子的最终受体很可能与胞内氧化还原反应关系密切的辅酶NAD有关,外源电子的引入导致还原力 NADH2溢出进而还原产物浓度显著增加、氧化产物浓度随之减少是这一现象的最优解释。然而这一猜想也存在争议,不同微生物对外源电子的应答并不相同,某些微生物反而导致其氧化产物的增加[33]。同时新的电子受体(甲基萘醌)的发现,也引发学者对这一猜想的怀疑与探讨[34]。但毋庸置疑,外源电子的引入会干预细胞原有的代谢途径,提高或降低某些特定代谢产物的产量。更多胞内电子传递途径还有待进一步研究。
外源电子进入细胞质后会影响胞内带电状态。微生物为使其处于稳定电中性,质子也将跟随移动至胞内中和掉这部分电子,使得胞内质子浓度上升。而细胞能量直接来源ATP的生成需要消耗质子,每生成1mol ATP需消耗4mol质子。因此,MES理论上会促进ATP的生成,使ATP合酶由ATP消耗态转变为ATP生成态,为细胞生长代谢提供能量[13]。HE 等[31]学者发现,拜氏梭菌(Clostridium beijerinckii)在-0.7V vs Ag/AgCl电势作用下胞内ATP含量由6.98提高至12.93nmol/g,也印证了该推论的正确性。
综上,由BES提供的电子由外界环境进入细胞外膜,再由细胞外膜运送至细胞质,最终由胞内某些酶、辅酶、小分子物质等电子受体捕捉后为己所用,同时耦合的其他电子及质子移动,导致细胞内能量及代谢变化。这一过程经历了从宏观电子供给到微观细胞吸收再到宏观产物生成,各种氧化还原反应互相交错、繁琐复杂,研究难度大,需要国内外学者共同努力。
2 微生物电合成的菌株培养方式
由于天然 EAB分布的局限性及微生物电子传递机制的多样性,为实现细胞与外源电子进行电子传递,改变胞内代谢平衡所采取的菌株培养方式及菌群结构各有不同。典型的 MES所利用的菌株培养方式有纯种培养及混菌培养。
2.1 纯种培养
典型的EAB包括S. oneidensis及G. sulfurreducens。对于典型EAB菌株早期研究主要关注其利用Fe3+、Mn4+等高价金属离子作为直接电子受体的能力,这为其在BES的应用奠定了良好的理论基础。研究表明典型EAB依赖细胞膜蛋白(细胞色素c)、纳米导线及自身分泌黄素等多种电子传递机制,高效的电子传递速率及较为清晰的电子传递机制使其在MEC及MFC中均有广泛的应用。
随着研究的深入,更多类型的EAB被发现,尤其是工业上利用广泛的发酵菌株,极大推动了MES的发展。虽然其电子传递机制不同,但外源电子的引入无一例外会显著影响胞内代谢。然而由于外源电子进入细胞后对应电子受体不同,微生物对其应答并不是简单地提高还原支路的产物,而是与电子传递链密切相关。现今发现的具有工业应用前景的天然EAB主要为杆菌属及梭菌属,其中包含克雷伯氏杆菌(Klebsiella. pneumoniae)[26,35]、巴斯德梭菌(Clostridium pasteurianum)[36]、拜氏梭菌(Clostridium beijerinckii)[31]等发酵生产菌株。
由于EAB种类的限制,自然界现有EAB往往发酵能力有限。基于基因改造的 MES已逐渐成为微生物突破自身 EET及代谢通路限制的最佳手段[15]。目前研究主要分为两个方向:一方面是基于EAB自身的基因工程研究,探求外源电子由胞外进入胞内具体路线以及各菌株进行基因改造的可操作性。 S. oneidensis MR-1[37]与 G. sulfurreducens PCA[38]作为各自的模式菌株已被全基因组测序,从分子生物学角度完成对EET的认知,也为改造菌株代谢途径提供了坚实可靠的分子基础。同时另一EAB嗜酸性氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans)经基因测序也逐渐被人们熟知[39]。国内外学者也对这三类菌株进行各种基因操作(接合、电穿孔、基因敲除、质粒表达等),为后续MES的基因工程改造奠定了坚实基础[15]。除此之外,用于固定 CO2的 EAB 永达尔梭菌(Clostridium ljungdahlii)的基因敲除策略[40]以及新代谢路径的建立[41]也逐步拓宽了该技术在MES的应用范围。随着基因工程技术的发展,将会有更多遗传背景清晰、生产能力强大的EAB应用于MES中,高效完成其被赋予的使命。另一方面是结合以大肠杆菌(E coli)为代表的基因工程菌的MES。E. coli由于其明确的遗传背景与代谢途径,广泛应用于多种生物基化工产品的发酵生产[42-44]。一般认为大肠杆菌自身缺乏有效的电子传递机制,利用基因工程手段结合 E. coli的遗传背景及典型EAB的电子传递机制成为最近研究的一大热点[45]。二者结合方式主要集中于两方面:将EAB内部编码EET的关键基因导入E. coli中构建E.coli新型电子传递机制[46-47],或将E. coli中高效底物代谢途径的关键基因导入典型 EAB中[48]。以上基因改造均可提高电子由胞内向胞外转移速率,促进氧化途径产物的生成。由于微生物吸收外源电子机制尚不明确,利用基因工程手段提高细胞吸收外源电子速率,进而促进还原产物的生成还有待进一步研究。
2.2 混菌培养
由于EAB分布的局限性及EET的复杂性,纯种培养往往不能实现高效的电子传递,研究发现不同种属间也存在电子交换能力[49],因此无需外源电子介体介导的混菌培养在 MES中,尤其是环境生物学领域占有举足轻重的地位[50]。混菌培养分为已知菌种的人工混合菌群(coculture)及在自然界中通过筛选驯化的自然混合菌群(mixed culture)[51],二者在MES中均有成功的应用。
人工混合菌群由已知代谢条件的特定菌株构成,通过形成鲁棒性关系构建出单一菌株不存在或产物产率较低的代谢途径。不同菌株分别承担不同功能,共同完成发酵任务,具有方向性强、效率高等优势。由于 EAB种类有限,将发酵能力较弱的EAB与缺乏电化学活性但发酵能力强的菌株人工混合培养显示出巨大应用潜力。ALLISON等[52]学者将产电菌株 G. sulfurreducens与发酵菌株产纤维二糖梭菌(Clostridium cellobioparum)在BES阳极中混合培养,前者可利用后者发酵过程中生成有机酸及氢气作为电子供体,显著提高产物乙醇的转化率。与此同时,有研究表明发酵菌株产生的代谢产物 2,3-丁二醇可促进电化学活性菌株自身分泌电子传递介体,进而大幅提高产电能力[53]。利用产电菌株与发酵菌株人工混合也可定向降解纤维素同时高效产电,将纤维素化学能转化为电能,完成纯培养无法完成的任务[54]。但由于微生物吸收外源电子机制尚不明确,BES的阴极尚未报道利用人工混合菌株完成MES促进发酵产品的研究。
相比于人工混合菌群,自然混合菌群在微生物电化学领域应用更为广泛。从自然界通过一定手段富集驯化得到的自然混合菌群具有人工混菌欠缺的菌种稳定性、底物广谱性、环境抗逆性以及无需外加人工电子载体的高效电子传递效率等多种优势。但由于菌种构成多样,其内部代谢网络、电子传递机制复杂,研究难度较大。自然混合菌群大多来源于活性污泥、泥土、废水、沉积污染物等富含各种有机质、微生物种类数量繁多的样本[50]。在MFC中,利用自然混合菌群将环境污染物内部储存的化学能转化为电能,伴随高附加值产物的生成,已得到广泛研究与应用[55];在MES中利用自然混合菌群将废水中有机质转化为氢气也具有显著效果[56-57];而在驱动发酵产品生成方面,有研究表明利用自然混合菌群的 MES可显著提高 1,3-丙二醇产量[58-59]。
3 生物基化学品的微生物电合成
近年来,MES偶联生物基化学品的发酵受到国内外学者越来越多的关注,表 1归纳了近期 MES结合微生物发酵取得的初步成果。由于MES偶联发酵尚在起步阶段,国内外学者对 MES偶联微生物发酵的研究所利用底物及合成产物较为单一,底物分为无机碳源(CO2)及有机碳源(乙酸、葡萄糖、甘油、纤维素等),产物包括1,3-丙二醇、丁醇、琥珀酸、乙醇、乙酸及乳酸等。
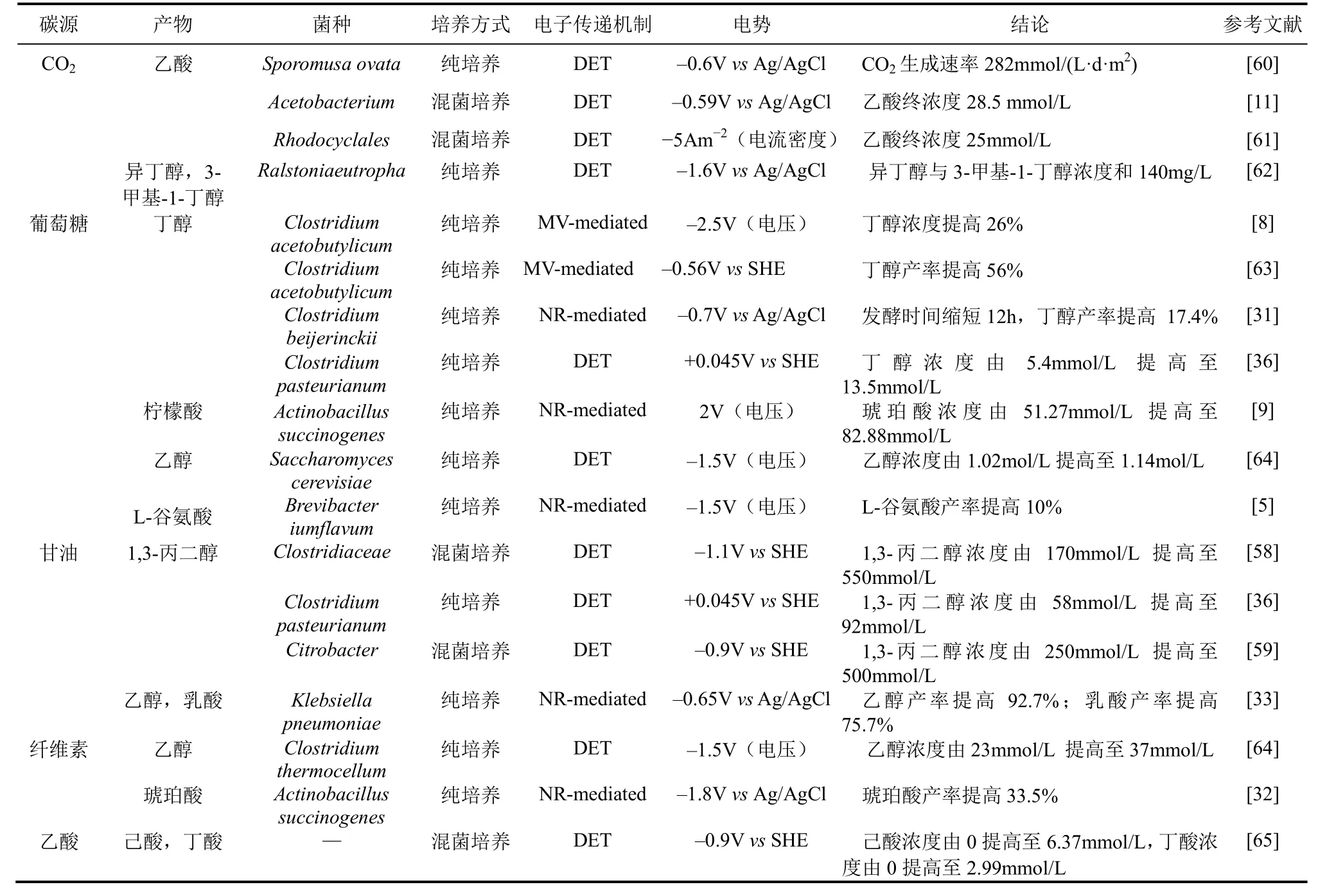
表1 微生物电合成促进生物基化学品发酵的典型应用
3.1 以CO2为底物的微生物电合成
随着全球工业的发展,CO2的过度排放引发了全球变暖等系列环境问题。CO2作为一种温室气体,可作为碳源被某些细菌及古生菌利用,合成乙酸等并生物基化学品维持自身代谢。而自然界微生物吸收CO2能力有限,利用MES将外源电子导入微生物,还原CO2为有机碳化合物是近年来国内外学者关注的重点[66]。该技术不仅可实现CO2的回收再利用,而且具有巨大的环境生态效益。
以CO2为底物的MES所用菌种主要有4类:产乙酸菌、Fe(Ⅱ)氧化菌、产甲烷菌及典型EAB,几乎所有菌株均可自主吸收外源电子,无需添加电子载体。不同菌株利用CO2的途径不尽相同。
(1)产乙酸菌 以梭菌属、鼠孢菌属等种属为主[67]。产乙酸菌通过 Wood-Ljungdahl途径将CO2转化为乙酸等有机碳并释放到环境中,由于CO2为产乙酸菌唯一电子受体,该途径是继光合作用最有效的 CO2固定方式。自然条件下此过程需H2或CO作为电子供体,无疑限制了CO2的固定效率,提高了固定成本[68]。研究表明某些产乙酸菌可直接吸收外源电子为电子供体,通过在阴极表面形成生物膜,将CO2还原为乙酸等产物[69]。与此同时,该过程的重要中间产物乙酰-CoA可作为合成其他多元醇、脂肪酸的基础元件,通过基因改造将 CO2转化为丁醇等生物基化学品已被证明其可行性[41]。以CO2为底物的MES不仅在环境学中有巨大研究价值,并可实现 CO2定向转化为生物燃料的合成生物学新途径[41]。虽然该方法乙酸合成速率最高仅为 282mmol/(L·d·m2)[61],但这种以菌株为媒介,以电能为唯一能量来源,将CO2还原为多碳化合物的理念为绿色工业发展提供了新的思路。
(2)嗜酸性氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans) A. ferrooxidans因其独特的代谢途径及细菌浸出作用逐渐引起国内外学者的关注[70]。自然条件下该菌以CO2为碳源,通过氧化Fe(Ⅱ)获得能量,并以O2、硫酸盐等为电子最终受体。但环境中Fe(Ⅱ)浓度较低且氧化产物Fe(Ⅲ)毒性较强导致菌体丰度偏低、CO2固定能力较弱。利用MES可显著增强其固定CO2能力。外源电子并不直接作用于微生物细胞,而首先将电解质中的 Fe(Ⅲ)还原为Fe(Ⅱ),微生物将Fe(Ⅱ)氧化为Fe(Ⅲ),完成Fe元素循环利用,显著提高A. ferrooxidans丰度,提高CO2利用率[71]。
(3)产甲烷菌 通过在阴极形成生物膜吸收外源电子将CO2转化为CH4。相比于前两种方式,产甲烷菌固定 CO2所需电势较低(<-0.7V vs Ag/AgCl),能耗较大,在阴极电势为-1V vs Ag/AgCl时CH4产率可至200mmol/(L·d·m2)[72]。
(4)典型 EAB LAURENCE等[73]学者发现G. sulfurreducens在-0.4V vs. Ag/AgCl作用下在消耗CO2同时可将琥珀酸转化为甘油。但现有研究未证明G. Sulfurreducens能够以CO2为唯一电子受体、BES所提供的外源电子为唯一电子供体下生长,因此CO2吸附能力较局限。与此同时,LI等[62]学者利用MES将CO2还原为甲酸,甲酸在基因工程菌罗尔斯通氏菌(Ralstoniaeutropha)LH74D胞内作为能源,经代谢生成CO2及NADH2后进入合成途径生成燃料,产物异丁醇及 3-甲基-1-丁醇总量达140mg/L,也间接验证了MES驱动CO2合成生物燃料的可行性。
毋庸置疑,以 CO2为底物的 MES存在菌种限制、产物浓度及生产强度较低等亟待解决的问题,但该方法可将大气中CO2固定为易储存的生物基化学品,在环境生物学、合成生物学等学科领域前景巨大,值得学者广泛重视及深入研究。
3.2 以有机碳源为底物的微生物电合成
虽然以CO2为底物的MES具有环境友好、资源回收等诸多优势,该技术电子转移效率低、产物浓度低及生产强度弱等局限,在生物基化学品工业生产中存在诸多问题。廉价有机碳源(葡萄糖、甘油、纤维质等)耦合 MES以其基于高浓度发酵并显著提高产品产量及转化率的优势,已取得广泛关注。本文以MES产物1,3-丙二醇、丁醇及琥珀酸为例,阐述 MES偶联利用廉价有机碳源发酵生产生物基化学品的实例及应用前景。
3.2.1 1,3-丙二醇
1,3-丙二醇(1,3-PD)是一种重要的化工原料,具有多种重要用途,广泛应用于医药、化工、食品及化妆品等行业。同时,1,3-PD是合成聚对苯二甲酸丙二酯(PTT)的重要单体。PTT是一种具有广泛应用前景的新型聚酯材料,因其在纺织业广泛应用得到人们关注。自然界1,3-PD的微生物发酵生产菌包含丁酸梭菌(Clostridium butyricum)、巴斯德梭菌(Clostridium pasteurianum)、克雷伯氏杆菌(Klesbiella pneumoniae)及弗氏柠檬酸杆菌(Citrobacter freundii)等。几乎所有自然界发酵生产1,3-PD的菌株均以甘油为底物。典型的甘油代谢生产1,3-PD过程如图2(以C. butyricum为例)[74],甘油代谢属于歧化反应:在氧化途径中生成丁酸、乙酸等副产物,伴随生物质、生物能ATP及还原当量NADH2的生成。在还原途径中合成1,3-PD,并消耗过量的 NADH2。胞内氧化还原水平是限制1,3-PD产量的关键因素[75],而MES可打破胞内氧化还原平衡,促进还原力 NADH2再生,进而提高1,3-PD产量,降低氧化支路中副产物的产生。因此,MES偶联1,3-PD发酵一直以来被认为是该领域最具潜力的应用实例[76]。
利用MES生产1,3-PD首先被应用于生物柴油废水的处理,国内外学者已成功利用自然混合菌群将生物柴油废水中低浓度甘油合成1,3-PD[59,77]。由于底物浓度限制,1,3-PD含量有限,但其可行性已得到初步验证。例如,以甘油为底物,电化学驱动C. pasteurianum 代谢流流向还原支路,提高NADH2/NAD比例,进而1,3-PD产量由60mmol/L提高至92mmol/L[36]。利用混合菌群结合MES条件下 1,3-PD浓度可增至 42g/L,已接近传统发酵产量[58]。但也有研究显示,外源电子的引入并未导致K. pneumoniae显著提高1,3-PD产量,推测当外源电子进入细胞后,最终电子受体并非NAD,外源电子引入对1,3-PD的产量影响不大,反而提高了氧化支路中乳酸及乙醇的产量[33]。因此对于外源电子引入后电子流向及具体机制还需要深入研究,但MES耦合1,3-PD发酵仍具有巨大研究价值。

图2 C. butyricum甘油代谢途径[74]
3.2.2 丁醇
丁醇是作为另一种大宗生物基化学品,广泛应用于各种塑料和橡胶制品中。同时,丁醇是继燃料乙醇后的一种极具发展前景的新一代液体燃料,与乙醇相比具有高热值、低挥发性、低吸湿性及低腐蚀性等优点,是理想的石油替代品[78]。微生物法生产丁醇所用菌株为产溶剂梭状芽胞杆菌(Clostridium acetobutylicum)。利用葡萄糖生产丁醇的微生物胞内代谢如图 3(以 C. acetobutylicum为例)[79]。C. acetobutylicum代谢的第一阶段为产酸期,底物转化为乙酸、丁酸等有机酸,伴随溶液pH下降。在该阶段中,NADH2不断积累为后续丁醇生产提供了充足的还原力。为抵抗不利的生存环境,细胞可重新利用有机酸同时消耗糖类等底物,进入产溶剂期。此时微生物细胞消耗 NADH2,生成丁醇、乙醇、丙酮等产物。相比于 1,3-PD发酵,微生物生产丁醇所经氧化还原代谢途径更为复杂,丁醇并不是简单的还原支路产物,而与其他副产物(丁酸、乙醇、丙酮等)拥有相同中间代谢途径,共享中间代谢产物(丙酮酸、乙酰-CoA等)。但从整体网络看,微生物生产1mol丁醇需消耗2mol还原当量NADH2。因此,对微生物代谢进行氧化还原平衡改造,再生胞内还原当量 NADH2是提高丁醇产量的有效手段[79]。
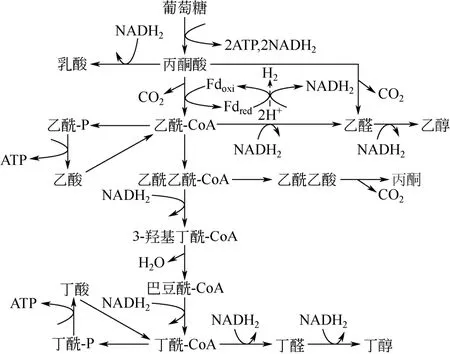
图3 C. acetobutylicum葡萄糖代谢途径[79]
国内外学者利用MES再生NADH2,进而提高丁醇产量已取得初步研究成果。1988年 KIM等[8]学者发现C. acetobutylicum可在甲基紫精为电子介体的-2.5V电压下将丁醇产量提高26%,同时丙酮产量降低25%。类似的效果在巴斯德梭菌中也得到实现,该菌株在不加外源介体条件下可自主吸收外源电子,驱动菌株向消耗NADH2支路代谢,使丁醇产量由5.4mmol/L提高至13.5mmol/L,但细胞密度显著降低[36]。HE等[31]学者发现C. beijerinckii可利用中性红为电子传递介体,在-0.7V vs Ag/AgCl电势下丁醇产量提高了17.4%,同时可将发酵时间缩短12h。GALLARDO等[80]学者利用计算机模拟手段也确定了C. acetobutylicum ATCC 824在外源电子介入后可提高丁醇比生成速率。几乎所有研究将 MES促进丁醇发酵的原因归结为外源电子的引入可促进还原当量 NADH2的再生,提高NADH2/NAD比例,进而提高丁醇产量。
3.2.3 琥珀酸
琥珀酸是一种重要的平台化合物,是许多重要化合物如1,4-丁二醇、己二胺、己二酸、丁二酸二乙酯等的前体物质。同时,微生物发酵生产琥珀酸利用CO2作为辅助碳源,对温室气体CO2的再利用提供了新途径[81]。典型的琥珀酸产生菌有琥珀酸放线杆菌(Actinobacillus succinogenes),产琥珀酸厌氧螺菌(Anaerobiospirillum succiniciproducens),同时E. coli经基因改造也可达到工业化生产水平。利用葡萄糖为底物生产琥珀酸代谢途径如图4(以A. succinogenes为例)[81]。在A. succinogenes厌氧发酵途径中,葡萄糖通过糖酵解途径合成磷酸烯醇式丙酮酸,后进入C4途径生成琥珀酸。C3途径为细胞生长提供能量,提供还原力NADH2,并生成乳酸、乙酸、乙醇等副产物。每生成 1mol琥珀酸可固定1mol CO2,同时消耗2mol NADH2[82]。

图4 A. succinogenes葡萄糖代谢途径[81]
1999年PARK等[9]学者首先发现,以葡萄糖作为底物,以中性红为电子介体,施加2V的电压可以使A. succinogenes的琥珀酸产量由51.27mmol/L提高至 82.88mmol/L,副产物甲酸与乙酸浓度明显降低。并猜想细胞吸收外源电子可能的机制:被外源电势还原的还原态中性红可代替富马酸还原酶复合体中的甲基萘醌的功能。当加入甲基萘醌抑制剂时,以H2为电子供体的对照组细胞富马酸还原酶酶活被完全抑制,而在电化学系统下细胞酶活并未发生改变。被还原的中性红可进入胞内,可将 NAD还原为NADH2,因此外源电子可促进胞内还原力再生。作者也发现基因突变菌株A. succinogenes FZ-6利用电还原的中性红可代替H2作为唯一电子供体,将延胡索酸转化为琥珀酸,证明了细胞可以利用电合成的还原力进行生长及代谢[83]。ZHAO等[63]学者运用不同碳源(葡萄糖、木糖、阿拉伯糖、混合糖及玉米芯水解液)均发现 MES可促进 A. succinogenes NJ113发酵生产琥珀酸,同时胞内还原力 NADH2含量较对照有显著提高。此研究也成功将微生物电合成底物应用范围扩展至廉价碳源,具有良好的应用潜力。
除此之外,MES在乙醇[64]、乳酸[6]等生物基产品的发酵中也有应用,MES促进生物基化学品发酵已取得广泛关注。其原理主要基于BES对胞内氧化还原平衡的影响,即外源电子引入可促进胞内还原力 NADH2再生,以弥补细胞自身还原力的不足,进而提高产量。事实也证明了该方法是一种无需进行基因改造、快速有效的调控手段。
4 结 语
MES是一种新型的调节微生物生理代谢的手段。通过外源电子的提供,驱动细胞吸收电子,可实现定向改变微生物代谢流向,促进代谢网络中特定还原产物的生成,降低其他氧化支路副产物的产量。与其他改变微生物代谢通路的方法相比,该方法无需对微生物进行遗传改造,可通过持续为细胞提供外源电子完成对其持续刺激作用。MES促进生物基化学品的发酵主要面临以下三方面挑战:首先,微生物吸收外源电子的电子传递机制尚不明确,电子进入微生物细胞后的最终电子受体有待深入研究,电子对不同微生物代谢影响的机制也需进一步探究;其次,微生物吸收外源电子的效率是影响该技术在发酵产业应用的关键限制因素,如何提高微生物对外源电子的响应值、促进微生物高效吸收外源电子进而改变代谢流是今后工业化应用的重点研究方向;最后,生物基化学品的 MES尚处于实验室研究阶段,其产业化还需考虑成本因素,该技术产业应用所带来的经济效益应高于设备改造及电势能耗所投入的成本。同时探求将风能、太阳能等可再生能源转化为电能,再由BES将电能转化为生物基化学品的化学能,实现绿色环保、循环经济的可持续发展理念。从长远看,随着机理研究不断深入,应用领域不断扩大,MES促进生物基化学品发酵将向更加理性、高效、绿色的方向发展。
[1] PEL H J,DE WINDE J H,ARCHER D B,et al. Genome sequencing and analysis of the versatile cell factory Aspergillus niger CBS 513.88[J].Nat. Biotechnol.,2007,25(2):221-231.
[2] 秦义,董志姚,刘立明,等. 工业微生物中 NADH的代谢调控[J].生物工程学报,2009,25(2):161-169.
[3] RABAEY K,ROZENDAL R A. Microbial electrosynthesis——revisiting the electrical route for microbial production[J].Nat. Rev. Microbiol.,2010,8(10):706-716.
[4] PANT D, SINGH A, VAN BOGAERT G, et al. Bioelectrochemical systems(BES)for sustainable energy production and product recovery from organic wastes and industrial wastewaters[J].RSC Adv.,2012,2(4):1248-1263.
[5] HONGO M,IWAHARA M. Application of electro-energizing method to L-glutamic acid fermentation[J].Agricultural and Biological Chemistry,1979,43(10):2075-2081.
[6] HONGO M,NOMURA Y,IWAHARA M. Novel method of lactic acid production by electrodialysis fermentation[J].Applied and Environmental Microbiology,1986,52(2):314-319.
[7] SCHUPPERT B,SCHINK B,TRÖSCH W. Batch and continuous production of propionic acid from whey permeate by propionibacterium acidi-propionici in a three-electrode amperometric culture system[J]. Applied Microbiology and Biotechnology,1992,37(5):549- 553.
[8] KIM T S,KIM B H. Electron flow shift in Clostridium acetobutylicum fermentation by electrochemically introduced reducing equivalent[J]. Biotechnology Letters,1988,10(2):123-128.
[9] PARK D H,ZEIKUS J G. Utilization of electrically reduced neutral red by Actinobacillus succinogenes:physiological function of neutral red in membrane-driven fumarate reduction and energy conservation[J]. Journal of Bacteriology,1999,181(8):2403-2410.
[10] MARSILI E,ROLLEFSON J B,BARON D B,et al. Microbial biofilm voltammetry:direct electrochemical characterization of catalytic electrode-attached biofilms[J]. Appl. Environ. Microbiol.,2008,74(23):7329-7337.
[11] MARSHALL C W,ROSS D E,FICHOT E B,et al. Electrosynthesis of commodity chemicals by an autotrophic microbial community[J].Appl. Environ. Microbiol.,2012,78(23):8412-8420.
[12] HERNÁNDEZ FERNÁNDEZ F J,DE LOS RÍOS A P,SALAR-GARCÍA M J,et al. Recent progress and perspectives in microbial fuel cells for bioenergy generation and wastewater treatment[J]. Fuel Processing Technology,2015,138:284-297.
[13] PANDIT A V,MAHADEVAN R. In silico characterization of microbial electrosynthesis for metabolic engineering of biochemicals[J].Microb. Cell Fact.,2011,10(1):76.
[14] THRASH J C,COATES J D. Review:direct and indirect electrical stimulation of microbial metabolism[J].Environmental Science & Technology,2008,42(11):3921-3931.
[15] SYDOW A,KRIEG T,MAYER F,et al. Electroactive bacteria——molecular mechanisms and genetic tools[J].Appl. Microbiol. Biotechnol.,2014,98(20):8481-8495.
[16] MYERS C R,NEALSON K H. Bacterial manganese reduction and growth with manganese oxide as the sole electron acceptor[J].Science,1988,240(4857):1319-1321.
[17] LOVLEY D R,PHILLIPS E J P. Novel mode of microbial energy metabolism:organic carbon oxidation coupled to dissimilatory reduction of iron or manganese[J].Applied and Environmental Microbiology,1988,54(6):1472-1480.
[18] PATIL S A,HÁGERHÁLL C,GORTON L. Electron transfer mechanisms between microorganisms and electrodes in bioelectrochemical systems[J]. Bioanalytical Reviews,2012,4(2-4):159-192.
[19] KATO S. Biotechnological aspects of microbial extracellular electron transfer[J]. Microbes Environ.,2015,30(2):133-139.
[20] STRYCHARZ S M,GLAVEN R H,COPPI M V,et al. Gene expression and deletion analysis of mechanisms for electron transfer from electrodes to Geobacter sulfurreducens[J]. Bioelectrochemistry,2011,80(2):142-150.
[21] BUSALMEN J P,Esteve-NÚÑEZ A,BEMÁ A,et al. C-type cytochromes wire electricity-producing bacteria to electrodes[J].Angew. Chem. Int. Ed. Engl.,2008,47(26):4874-4877.
[22] MALVANKAR N S,VARGAS M,NEVIN K,et al. Structural basis for metallic-like conductivity in microbial nanowires[J]. Mbio.,2015,6(2):e00084-15.
[23] BAJRACHARYA S,TER HEIJNE A,BENETTON X D,et al. Carbon dioxide reduction by mixed and pure cultures in microbial electrosynthesis using an assembly of graphite felt and stainless steel as a cathode[J]. Bioresour Technol.,2015,195:14-24.
[24] MARSILI E,BARON D B,SHIKHARE I D,et al. Shewanella secretes flavins that mediate extracellular electron transfer[J].Proceedings of the National Academy of Sciences,2008,105(10):3968-3973.
[25] BOON N,AELTERMAN P,CLAUWAERT P,et al. Metabolites produced by Pseudomonas sp. enable a Gram-positive bacterium to achieve extracellular electron transfer[J].Applied Microbiology and Biotechnology,2007,77(5):1119-1129.
[26] DENG L F,LI F B,ZHOU S G,et al. A study of electron-shuttle mechanism in Klebsiella pneumoniae based-microbial fuel cells[J]. Chinese Science Bulletin,2010,55(1):99-104.
[27] CHOI O,UM Y,SANG B I. Butyrate production enhancement by Clostridium tyrobutyricum using electron mediators and a cathodic electron donor[J]. Biotechnology and Bioengineering,2012,109(10):2494-2502.
[28] PARK D H,LAIVENIEKS M,GUETTLER M V,et al. Microbial utilization of electrically reduced neutral red as the sole electron donor for growth and metabolite production[J].Applied and Environmental Microbiology,1999,65(7):2912-2917.
[29] MILLIKEN C E,MAY H D. Sustained generation of electricity by the spore-forming,Gram-positive,Desulfitobacterium hafniense strain DCB2[J].Applied Microbiology and Biotechnology,2007, 73(5):1180-1189.
[30] ROSENBAUM M,AULENTA F,VILLANO M,et al. Cathodes as electron donors for microbial metabolism:which extracellular electron transfer mechanisms are involved?[J].Bioresour Technol.,2011,102(1):324-333.
[31] HE A Y,YIN C Y,XU H,et al. Enhanced butanol production in a microbial electrolysis cell by Clostridium beijerinckii IB4[J].Bioprocess. Biosyst Eng.,2016,39(2):245-254.
[32] ZHAO Y,CAO W,WANG Z,et al. Enhanced succinic acid production from corncob hydrolysate by microbial electrolysis cells[J].Bioresource Technology,2016,202:152-157.
[33] HARRINGTON T D,MOHAMED A,TRAN V N.Neutral red-mediated microbial electrosynthesis by Escherichia coli,Klebsiella pneumoniae, and Zymomonas mobilis[J].Bioresour Technol.,2015,195:57-65.
[34] HARRINGTON T D,TRAN V N,MOHAMED A,et al. The mechanism of neutral red-mediated microbial electrosynthesis in Escherichia coli:menaquinone reduction[J].Bioresour. Technol.,2015,192:689-695.
[35] ZHANG L,ZHOU S,ZHUANG L,et al. Microbial fuel cell based on Klebsiella pneumoniae biofilm[J].Electrochemistry Communications,2008,10:1641-1643.
[36] CHOI O,KIM T,WOO H M.Electricity-driven metabolic shift through direct electron uptake by electroactive heterotroph Clostridium pasteurianum[J].Sci. Rep.,2014,4:6961.
[37] HEIDELBERG J F,PAULSEN I T,NELSON K E,et al. Genome sequence of the dissimilatory metal ion-reducing bacterium Shewanella oneidensis[J].Nat. Biotechnol.,2002,20(11):1118-1123.
[38] METHE B A,NELSON K E,EISEN J A,et al. Genome of Geobacter sulfurreducens: metal reduction in subsurface environments[J].Science,2003,302(5652):1967-1969.
[39] VALDÈS J,PEDROSO I,QUATRINI R,et al. Comparative genome analysis of Acidithiobacillus ferrooxidans,A.thiooxidans and A.caldus:insights into their metabolism and ecophysiology[J].Hydrometallurgy,2008,94(1-4):180-184.
[40] LEANG C,UEKI T,NEVIN K P,et al.A genetic system for Clostridium ljungdahlii:a chassis for autotrophic production of biocommodities and a model homoacetogen[J].Applied and Environmental Microbiology,2013,79(4):1102-1109.
[41] KÖPKE M,HELD C,HUJER S,et al. Clostridium ljungdahlii represents a microbial production platform based on syngas[J]. Proceedings of the National Academy of Sciences,2010,107(29):13087-13092.
[42] INGRAM L O,CONWAY T,CLARK D P,et al. Genetic engineering of ethanol production in Escherichia coli[J].Applied and Environmental Microbiology,1987,53(10):2420-2425.
[43] TANG X,TAN Y,ZHU H,et al. Microbial conversion of glycerol to 1,3-propanediol by an engineered strain of Escherichia coli[J].Applied and Environmental Microbiology,2009,75(6):1628-1634.
[44] NIELSEN D R,YOON S H,YUAN C J,et al. Metabolic engineering of acetoin and meso-2,3-butanediol biosynthesis in E.coli[J].Biotechnol. Journey,2010,5(3):274-284.
[45] ERAVEST M A, AJO-FRANKLIN C M.Transforming exoelectrogens for biotechnology using syntheticbiology[J].Biotechnology and Bioengineering,2016,113(4):687-697.
[46] STURM-RICHTER K,GOLITSCH F,STURM G,et al. Unbalanced ermentation of glycerol in Escherichia coli via heterologous production of an electron transport chain and electrode interaction in microbial electrochemical cells[J].Bioresource Technology,2015,186:89-96.
[47] TERAVEST M A,ZAJDEL T J,AJO-FRANKLIN C M,et al.The Mtr pathway of Shewanella oneidensis MR-1 couples substrate utilization to current production in Escherichia coli[J].Chem. Electro. Chem.,2014,1(11):1874-1879.
[48] FLYNN J M,ROSS D E,HUNT K A,et al. Enabling unbalanced fermentations by using engineered electrode-interfaced bacteria[J]. MBio,2010,1(5):e00190-10.
[49] ZHAO Z,ZHANG Y,QUAN X,et al. Evaluation on direct interspecies electron transfer in anaerobic sludge digestion of microbial electrolysis cell[J].Bioresource Technology,2015,200:235-244.
[50] AGHABABAIE M,FARHADIAN M,JEIHANIPOUR A,et al. Effective factors on the performance of microbial fuel cells in wastewater treatment:a review[J].Environmental Technology Reviews,2015,4(1):71-89.
[51] BADER J,MAST-GERLASH E,POPOVIĆ M K,et al. Relevance of microbial coculture fermentations in biotechnology[J].Journal of Applied Microbiology,2010,109(2):371-387.
[52] SPEERS A M,YOUNG J M,REGUERA G. Fermentation of glycerol into ethanol in a microbial electrolysis cell driven by a customized consortium[J].Environmental Science & Technology,2014,48(11):6350- 6358.
[53] VENKATARAMAN A,ROSENBAUM M A,PERKINS S D,et al. Metabolite-based mutualism between Pseudomonas aeruginosa PA14 and Enterobacter aerogenes enhances current generation in bioelectrochemical systems[J].Energy & Environmental Science,2011,4(11):4550.
[54] REN Z,WARD T E,REGAN J M. Electricity production from cellulose in a microbial fuel cell using a defined binary culture[J].Environmental Science & Technology,2007,41(13):4781-4786.
[55] KIM G T,WEBSTER G,WIMPENNY J W T,et al. Bacterial community structure,compartmentalization and activity in a microbial fuel cell[J].Journal of Applied Microbiology,2006,101(3):698-710.
[56] DITZIG J,LIU H,LOGAN B E. Production of hydrogen from domestic wastewater using a bioelectrochemically assisted microbial reactor (BEAMR)[J].International Journal of Hydrogen Energy,2007,32(13):2296-2304.
[57] HEIDRICH E S,DOLFING J,SCOTT K,et al.Production of hydrogen from domestic wastewater in a pilot-scale microbial electrolysis cell[J]. Applied Microbiology and Biotechnology,2013,97(15):6979-6989.
[58] XAFENIAS N,ANUNOBI M S O,MAPELLI V. Electrochemical startup increases 1,3-propanediol titers in mixed-culture glycerol fermentations[J].Process Biochemistry,2015,50(10):1499-1508.
[59] ZHOU M,CHEN C,FREGUIA S,et al. Carbon and electron fluxes during the electricity driven 1,3-propanediol biosynthesis from glycerol[J]. Environ. Sci. Technol.,2013,47(19):11199-11205.
[60] NIE H,ZHANG T,CUI M,et al. Improved cathode for high efficient microbial-catalyzed reduction in microbial electrosynthesis cells[J].Phys. Chem. Chem. Phys.,2013,15(34):14290-14294.
[61] PATIL S A,ARENDS J B A,VANWONTERGHEM I,et al. Selective enrichment establishes a stable performing community for microbial electrosynthesis of acetate from CO2[J].Environ. Sci. Technol.,2015,49(14):8833-8843.
[62] LI H,OPGENORTH P H,WERNICK D G,et al. Integrated electromicrobial conversion of CO2to higher alcohols[J].Science,2012,335(6076):1596-1596.
[63] PEGUIN S,DELORME P,GOMA G,et al. Enhanced alcohol yields in batch cultures of Clostridium acetobutylicum using a three-electrode potentiometric system with methyl viologen as electron carrier[J]. Biotechnology Letters,1994,16(3):269-274.
[64] SHIN H,ZEIKUS J,JAIN M.Electrically enhanced ethanol fermentation by Clostridium thermocellum and Saccharomyces cerevisiae[J].Applied Microbiology and Biotechnology,2002,58(4):476-481.
[65] VAN EERTEN-JANSEN M C A A,TER HEIJNE A,GROOTSCHOLTEN T I M,et al. Bioelectrochemical production of caproate and caprylate from acetate by mixed cultures[J].ACS Sustainable Chemistry & Engineering,2013,1(5):513-518.
[66] TREMBLAY P L,ZHANG T. Electrifying microbes for the production of chemicals[J].Front Microbiol.,2015,6:201.
[67] NEVIN K P,HENSLEY S A,FRANKS A E,et al. Electrosynthesis of organic compounds from carbon dioxide is catalyzed by a diversity of acetogenic microorganisms[J]. Appl. Environ. Microbiol.,2011,77(9):2882-2886.
[68] BALCH W E,SCHOBERTH S,TANNER R S,et al. Acetobacterium,a new genus of hydrogen-oxidizing,carbon dioxide-reducing,anaerobic bacteria[J].International Journal of Systematic and Evolutionary Microbiology,1977,27(4):355-361.
[69] NEVIN K P,WOODARD T L,FRANKS A E,et al. Microbial electrosynthesis:feeding microbes electricity to convert carbon dioxide and water to multicarbon extracellular organic compounds[J].MBio,2010,1(2):e00103-10.
[70] LUNDGREN D G,SILVER M. Ore leaching by bacteria[J].Annual Reviews in Microbiology,1980,34(1):263-283.
[71] MATSUMOTO N,NAKASONO S,OHMURA N,et al. Extension of logarithmic growth of Thiobacillus ferrooxidans by potential controlled electrochemical reduction of Fe(Ⅲ )[J]. Biotechnology and Bioengineering,1999,64(6):716-721.
[72] CHENG S,XING D,CALL D F,et al. Direct biological conversion of electrical current into methane by electromethanogenesis[J]. Environmental Science & Technology,2009,43(10):3953-3958.
[73] SOUSSAN L,RIESS J,ERABLE B,et al. Electrochemical reduction of CO2catalysed by Geobacter sulfurreducens grown on polarized stainless steel cathodes[J].Electrochemistry Communications,2013,28:27-30.
[74] ZENG A P. Pathway and kinetic analysis of 1,3-propanediol production from glycerol fermentation by Clostridium butyricum[J].Bioprocess Engineering,1996,14(4):169-175.
[75] DU C Y,YAN H,ZHANG Y P,et al. Use of oxidoreduction potential as an indicator to regulate 1,3-propanediol fermentation by Klebsiella pneumoniae[J].Applied Microbiology and Biotechnology,2006,69(5):554-563.
[76] RABAEY K,Bioelectrochemical systems:from extracellular electron transfer to biotechnological application[M].London:IWA Publishing,2010.
[77] DENNIS P G,HARNISCH F,YEOH Y K,et al. Dynamics of cathode-associated microbial communities and metabolite profiles in a glycerol-fed bioelectrochemical system[J].Applied and Environmental Microbiology,2013,79(13):4008-4014.
[78] LEE S Y,PARK J H,JANG S H,et al. Fermentative butanol production by Clostridia[J].Biotechnology and Bioengineering,2008,101(2):209-228.
[79] LÜTKE-EVERSLOH T,BAHL H. Metabolic engineering of Clostridium acetobutylicum:recent advances to improve butanol production[J].Current Opinion in Biotechnology,2011,22(5):634- 647.
[80] GALLARDO R,ACEVEDO A,QUINTER J,et al. In silico analysis of Clostridium acetobutylicum ATCC 824 metabolic response to an external electron supply[J].Bioprocess and Biosystems Engineering,2016,39(2):295-305.
[81] MCKINLAY J B,VIEILLE C,ZEIKUS J G. Prospects for a bio-based succinate industry[J].Applied Microbiology and Biotechnology,2007,76(4):727-740.
[82] 奚永兰,陈可泉,李建,等. 琥珀酸发酵过程中固定 CO2的研究进展[J].化工进展,2010,29(7):1314-1319.
[83] PARK D H,LAIVENIEKS M,GUETTLER M V,et al. Microbial utilization of electrically reduced neutral red as the sole electron donor for growth and metabolite production[J].Applied and Environmental Microbiology,1999,65(7):2912-2917.
Progress on microbial electrosynthesis of bio-based chemicals
ZHOU Jinjie,WANG Xudong,SUN Yaqin,XIU Zhilong
(School of Life Science and Biotechnology,Dalian University of Technology,Dalian 116024,Liaoning,China)
Microbial electrosynthesisis is a new technology that combines microbiology and electrochemistry. The external electrons from an artificial power source are accepted by electroactive bacteria directly or indirectly,changing the intracellular redox balance,and promoting the formation of reductive products. Recently,microbial electrosynthesis based on bio-based chemicals has been attracting more and more attention. This review summarizes the basic principles and latest research progress in microbial electrosynthesis of bio-based chemicals. The electroactive bacterial selection,electron transfer mechanism,and typical cultivation methods are disclosed. Combined with microbial metabolism,the principle and research progress of microbial electrosynthesis on production of acetate,1,3-propanediol,butanol,and succinate are also discussed. The electron transfer mechanism,efficiency,and costs are thought to be the key factors restraining the development of microbial electrosynthesis. Finally,future trends on application which would contribute to the development of microbial electrosynthesis and application in fermentation of bio-based chemicals are prospected in this paper.
microbial electrosynthesis;fermentation;bio-based chemicals;electron transfer mechanism;electroactive bacteria
TQ 920
A
1000-6613(2016)11-3005-11
10.16085/j.issn.1000-6613.2016.11.001
2016-01-29;修改稿日期:2016-03-09。
国家自然科学基金项目(21476042,21306021)。
周瑾洁(1991—),女,博士研究生。联系人:修志龙,教授,主要从事生物基化学品发酵及分离研究。E-mail zhlxiu@dlut.edu.cn。

