Oct4和 PI3K在胃癌组织中的表达变化及意义
程玉,薛晶,次云哲,纪海茹,郑纪宁
(承德医学院,河北承德067000)
·临床研究·
Oct4和 PI3K在胃癌组织中的表达变化及意义
程玉,薛晶,次云哲,纪海茹,郑纪宁
(承德医学院,河北承德067000)
目的观察八聚体结合转录因子(Oct4)与磷脂酰肌醇3-激酶(PI3K)在胃癌组织中的表达变化,并探讨其临床意义。方法 收集60例胃癌组织和25例正常胃组织,分别应用Western blot和RT-PCR法检测Oct4与PI3K蛋白和mRNA;分析Oct4、PI3K表达与胃癌临床病理特征的关系,以及胃癌组织中Oct4与PI3K表达的关系。结果 Oct4、PI3K蛋白和mRNA在胃癌组织中的相对表达量均高于在正常胃组织(P均<0.01)。胃癌组织分化程度越低、浸润深度越深、有淋巴结转移的胃癌组织中,Oct4、PI3K蛋白及mRNA相对表达量越高(P均<0.05)。相关性分析显示,胃癌组织中Oct4、PI3K蛋白、mRNA表达呈正相关关系(r=0.634、0.587,P均<0.05)。结论 Oct4、PI3K从基因和蛋白水平在胃癌组织中呈高表达,二者共同参与了胃癌的发生、发展。
胃癌;八聚体结合转录因子;磷脂酰肌醇3-激酶
近年来,胃癌在我国的发病率和病死率均呈上升趋势,因此胃癌的发生发展机制成为了研究的热点。八聚体结合转录因子4蛋白(Oct4)是肿瘤干细胞的重要标志物之一[1],对细胞的正常分化起着决定性作用[2]。磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)信号通路的活化可促进细胞增殖,并促进肿瘤细胞的转移和侵袭[3]。PI3K是存在于细胞质的复合体,是磷脂激酶家族中的重要成员,在PI3K/Akt信号传导通路中是始动因子[4]。目前,对于在胃癌的发生、发展中Oct4和PI3K信号转导通路作用的研究报道较少。本研究检测了正常胃组织与胃癌组织中Oct4、PI3K的表达,分析二者与胃癌患者临床病理特征的关系,从而探索胃癌的发生、发展机制,也为临床治疗胃癌提供潜在作用靶点。
1 材料与方法
1.1材料
1.1.1标本来源收集承德医学院附属医院2013年7月~2014年2月手术切除的胃癌组织60例及癌旁正常胃组织25例,患者术前均未行化疗、放疗,术后均经病理学检查证实为胃腺癌,相应癌旁组织均未见累及。患者中男45例、女15例,年龄(56±10.47)岁;病理组织高、中分化24例,低分化36例;癌组织侵及浆膜层48例,未侵及浆膜层12例;无淋巴结转移25例,有淋巴结转移35例;TNM分期:Ⅰ~Ⅱ期28例,Ⅲ~Ⅳ期32例。所有标本离体后30 min内储存在-80 ℃冰箱里,另一部分离体后立即于4%甲醛溶液中固定,常规石蜡包埋。
1.1.2主要试剂兔抗人一抗Oct4及PI3K抗体均购自英国ABCOM公司,RIPA组织裂解液(BB120031)购自上海贝博公司,BCA蛋白浓度测定试剂盒、羊抗兔HRP标记二抗及ECL超敏发光液均购自北京索莱宝科技有限公司。cDNA合成试剂盒购自大连宝生物工程有限公司,DNA Ladder试剂购自天根生化科技(北京)有限公司。TRIzol 购自Invitrogen公司,引物由北京赛百盛基因技术有限公司合成。Oct4上游引物为5′- GTGCCGTGAAGCTGGAGAA-3′,下游引物5′-TGGTCGTTTGGCTGAATACCTT-3′;PI3K上游引物5′- TGCTATGCCTGCTCTGTAGTGGT-3′,下游引物5′-GTGTGACATTGAGG-GAGTCGTTG-3′;β-actin上游引物5′-AGCGGGAAA-TCGTGCGTGAC-3′,下游引物5′-ACATCTGCTGGAA-GGTGGAC-3′。
1.2检测方法
1.2.1Oct4、PI3K蛋白检测采用Western blot法。称取适量胃癌组织及远端正常胃组织标本(50~100 mg),剪碎,加入约600 μL RIPA蛋白裂解液和5 μL PMSF蛋白保护液;4 ℃下12 000 r/min离心20 min后取上清,测定其中蛋白浓度。灌制5%的浓缩胶和12%的分离胶,每泳道加总蛋白量80 μg进行电泳分离;在稳流状态下低温转膜,将蛋白转至PVDF膜,在含5%脱脂奶粉的TBST溶液中常温封闭3 h。分别加入兔抗人Oct4及PI3K单克隆抗体(1∶10 000)和小鼠抗人β-actin单克隆抗体(1∶1 000),4 ℃孵育过夜。10 min×3次TBST洗膜后加入HRP标记的山羊抗兔二抗(1∶10 000)和HRP标记的山羊抗鼠二抗(1∶3 000),室温孵育1 h。10 min×3次TBST洗膜后,显影,定影。采用IPP图像分析软件,分别用Oct4、PI3K与β-actin灰度比值表示Oct4及PI3K蛋白相对表达量。
1.2.2Oct4、PI3K基因检测采用RT-PCR法。按TRIzol说明书分别提取胃癌及正常胃组织总RNA,分别分析其完整性、浓度和纯度。采用逆转录试剂盒进行RT-PCR检测,PCR扩增产物经电泳进行定量检测。采用IPP图像分析软件分析,分别用目的基因与内参β-actin灰度比值表示目的基因相对表达量。

2 结果
2.1胃癌与正常胃组织Oct4、PI3K蛋白表达比较见表1。

表1 胃癌与正常胃组织Oct4、PI3K蛋白相对表达量比较±s)
注:与正常胃组织比较,*P<0.01。
2.2Oct4、PI3K蛋白表达与胃癌临床病理特征的关系Oct4、PI3K蛋白表达与胃癌的分化程度、TNM分期、浸润深度、淋巴结转移情况均有关(P均<0.05)。见表2。
2.3胃癌与正常胃组织Oct4、PI3K mRNA表达比较见表3。
2.4Oct4、PI3K mRNA表达与胃癌临床病理特征的关系Oct4、PI3K mRNA的表达与胃癌的分化程度、TNM分期、浸润深度、淋巴结转移情况均有关(P均<0.05)。见表4。
2.5胃癌组织中Oct4、PI3K表达的关系 相关性分析显示,胃癌组织中Oct4与PI3K蛋白表达呈正相关关系(r=0.634,P<0.05),Oct4与PI3K mRNA表达呈正相关关系(r=0.587,P<0.05)。

表2 Oct4、PI3K蛋白表达与胃癌临床病理特征的关系

表3 胃癌与正常胃组织Oct4、PI3K mRNA相对表达量比较
注:与正常胃组织比较,*P<0.01。
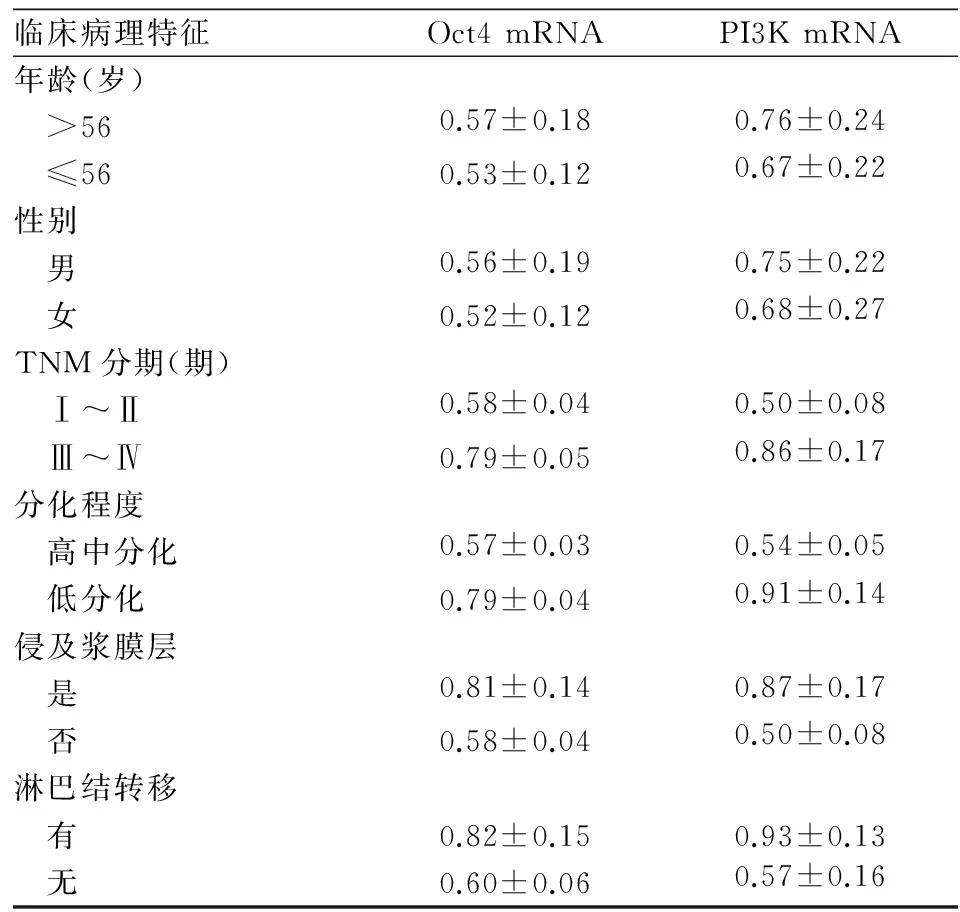
表4 Oct4、PI3K mRNA表达与胃癌临床病理特征的关系
3 讨论
Oct4 基因是八聚体核苷酸结合蛋白转录因子家族中的一员,早期发现于胚胎干细胞中[5,6]。人的Oct4蛋白属于八聚体核苷酸结合蛋白家族第5类转录因子,它在调节胚胎发育、维持胚胎干细胞自我更新能力及定向分化能力方面具有重要作用[7]。除在胚胎和生殖细胞癌中表达外[8],有研究者在乳腺癌MCF7细胞、肝癌Mahlava细胞和宫颈癌Hela细胞等非生殖细胞及组织肿瘤中也发现了Oct4的表达[9~12]。本研究发现,胃癌组织分化程度越低,Oct4的蛋白及mRNA相对表达量越高,且在浸润深度侵及浆膜的胃癌组织中的表达高于于未侵及浆膜的胃癌组织,在有淋巴结转移的胃癌组织中的相对表达量高于无淋巴结转移的组织。这些实验结果表明,随着胃癌恶性程度的增加,Oct4表达也是增高的。Oct4的高表达可能是胃癌干细胞扩散的必须条件[13]。
PI3K是PI3K/Akt信号转导通路的始动因子,此信号通路是一条酪氨酸激酶级联信号通路。Src、Ras、Rac、Ab1、v-Crk等具有酪氨酸激酶活性的癌性蛋白可与PI3K的调节亚基p85结合而发生作用,这些癌性蛋白的异常活化可被PI3K持续活化,引起细胞形态改变、凋亡受阻,导致细胞转化及过度增殖[14]。PI3K还可以将具有PH结构域的信号分子Akt招募到质膜上进行活化,活化的Akt进一步激活下游信号分子,对细胞功能进行调控[15]。本研究结果显示,PI3K在胃癌组织中的表达明显高于远端正常组织,且随着胃癌分化程度高、中、低变化,浸润深度由浅到深的改变,PI3K表达增高,有淋巴结转移者PI3K表达也明显高于无淋巴结转移者,提示PI3K激活与胃癌的发生发展及浸润转移有关。其机制可能是PI3K/Akt信号转导通路在抵抗Fas调节的凋亡中起重要作用[16]。活化的PI3K/Akt信号转导通路可以上调基质金属蛋白酶2(MMP-2)、MMP-9 mRNA和蛋白的表达,降解细胞外基质,突破基底膜,促进侵袭浸润[17]。
综上所述,本研究从基因和蛋白水平证实了Oct4、PI3K在胃癌组织中高表达,并且二者的表达在胃癌组织中呈正相关,二者可能共同参与了胃癌的发生发展,但目前对于肿瘤中OCT4与PI3K相互作用的具体机制,还有待于进一步研究。
[1] Li N, Deng W, Ma J, et al. Prognostic evaluation of Nanog, Oct4, Sox2, PCNA, Ki67 and E-cadherin expression in gastric cancer[J]. Med Oncol, 2015,32(1):433.
[2] Pan C, Jia W, Lu B, et al. Expression of TAT recombinant Oct4, Sox2, Lin28, and Nanog proteins from baculovirus-i nfected Sf9 insect cells[J]. Gene, 2015,556(2):245-248.
[3] Shaw RJ, Cantley LC. Ras PI (3) K and mTOR signaling controls tumor cell growth[J]. Nature, 2006,441(7092):424-430.
[4] Nishio K, Sakai K, Togashi Y. PI3K and mTOR pathway and molecular targeted agents[J]. Nihon Rinsho, 2015,73(8):1315-1322.
[5] Boo K, Bhin J, Jeon Y, et al. Pontin functions as an essential coactivator for Oct4-dependent lincRNA expression in mouse embryonic stem cells[J]. Nat Commun, 2015,10(6):6810.
[6] Guseva D, Rizvanov AA, Salafutdinov II, et al. Over-expression of Oct4 and Sox2 transcription factors enhances differentiation of human umbilical cord blood cells in vivo[J]. Biochem Biophys Res Commun, 2014,451(4):503-509.
[7] Asadi MH, Mowla SJ, Fathi F, et al. OCT4B1, a novel spliced variant of OCT4, is highly expressed in gastric cancer and acts as an antiapoptotic factor[J]. Int J Cancer, 2011,128(11):2645-2652.
[8] Santagata S, Ligon KL, Hornick JL. Embryonic stem transcription factor signatures in the diagnosis of primary and metastatic germ cell tumors[J]. Am J Surg Pathol, 2007,31(6):836-845.
[9] Hu J, Qin K, Zhang Y, et al. Down regulation of transcription factor Oct4 induces an epithelial-to-mesenchymal transition via enhancement of Ca2+influx in breast cancer cells[J]. Biochem Biophys Res Commun, 2011,411(4):786-791.
[10] Schwede M, Spentzos D, Bentink S, et al. Stem cell-like gene expression in ovarian cancer predicts type Ⅱ subtype and prognosis[J]. PLoS One, 2013,8(3):e57799.
[11] Elsir T, Edqvist PH, Carlson J, et al. A study of embryonic stem cell-related proteins in human astrocytomas: identification of Nanog as a predictor of survival[J]. Int J Cancer, 2014,134(5):1123-1131.
[12] Darini CY, Pisani DF, Hofman P, et al. Self-renewal gene tracking to identify tumour-initiating cells associated with metastatic potential[J]. Oncogene, 2012,31(19):2438-2449.
[13] Matsuoka J, Yashiro M, Sakurai K, et al. Role of the stem ness factors sox2, oct 3/4, and nanog in gastric carcinoma[J]. J Surg Res, 2012,174(1):130-135.
[14] Zenonos K. RAS signaling pathways,mutation and their role in colorectal cancer[J]. World J Gastrointest Oncol, 2013,5(5):97-101.
[15]Dunn EF, Connor JH. HijAkt: the PI3K/Akt pathway in virus replication and pathogenesis[J]. Prog Mol Biol Transl Sci, 2012,106:223-250.
[16] Osaki M, Kase S, Adachi K, et al. Inhibition of the PI3K-Akt signaling pathway enhances the sensitivity of Fas-mediated apoptosis in human gastric carcinoma cell line, MKN-45[J]. Cancer Res Clin Oncol, 2004,130(1):8-14.
[17] Ferretti C, Bruni L, Dangles-Marie V, et al. Molecular circuits shared by placental and cancer cells, and their implications in the proliferative, invasive and migratory capacities of trophoblasts[J]. Hum Reprod Update,2007,13(2):121-141.
河北省高校重点学科建设项目(冀教高2013-4号 )。
10.3969/j.issn.1002-266X.2016.34.010
R735.2
B
1002-266X(2016)34-0027-03
2016-02-16)

