负载氢氧化铁的膨胀石墨吸附剂的除磷
张 玲, 苏 阳, 陆群赞, 王 永
(上海大学 环境与化学工程学院,上海 200444)
负载氢氧化铁的膨胀石墨吸附剂的除磷
张玲, 苏阳, 陆群赞, 王永
(上海大学 环境与化学工程学院,上海 200444)
成功制备了负载氢氧化铁的膨胀石墨吸附剂(EG-FeOH),其最优制备条件为铁浓度0.26 mol·L-1、浸渍时间100min.通过对EG-FeOH等温吸附线和动力学研究,发现EG-FeOH更加符合Langmuir等温吸附模型和准二级动力学方程,说明EG-FeOH的除磷过程以单分子层的化学吸附为主.通过热力学参数ΔHΘ(>0)和ΔGΘ(<0)说明EG-FeOH吸附磷过程是自发吸热的,升温在一定程度上会提升EG-FeOH的除磷吸附容量.EG-FeOH对低浓度含磷水体(5 mg·L-1)有较好的除磷效果.通过吸附过程中溶液pH值变化和傅里叶红外变换光谱(FT-IR)等分析手段,联合说明了EG-FeOH主要通过离子交换作用和Lewis酸碱相互作用进行吸附除磷.以NaOH为脱附液,实现了对EG-FeOH的脱附再生.
膨胀石墨; 氢氧化铁; 除磷; 吸附; 机理
磷是人类社会发展的必需元素,对农业、工业发展具有重要意义.但若水环境中磷过量会导致富营养化,造成水生生物死亡、水体生态系统崩溃、滋生毒素进而威胁人类健康等严重后果[1].所以,去除水体中的过量磷是防治富营养化的有效手段.目前主要的除磷手段有化学沉淀法、生物法和吸附法.相较于前两者,吸附法具有占地面积小、除磷稳定、无二次污染、可回收等显著优势[2],是一种极具发展潜力的除磷方式.吸附法的核心是找寻合适的吸附剂.
膨胀石墨(EG)发现于19世纪60年代,是由天然鳞片石墨制得的一种疏松多孔的蠕虫状物质,又称蠕虫石墨.具有活性位点多、比表面积大、化学性质稳定、分散性好、密度低、无生态毒性和低成本等显著优势,被广泛应用于环境保护领域,如对重油、苯类、胺类有机物的去除等[3].但是在去除磷方面EG的吸附容量并不显著.而活性铁对水体中的磷有较好的吸附容量,同时来源广、经济成本低,除磷后不会明显降低水体pH值,尤其是在处理低浓度含磷废水中有着出色的应用.但是,活性铁除磷结束后,会沉入水体底部,难于回收,这就造成了吸附剂的浪费和二次污染[4-6].
鉴于活性铁具有优良的除磷性能及EG具有疏松多孔、性质稳定、高分散性等特点,本文首次制备了负载氢氧化铁的膨胀石墨吸附剂EG-FeOH并用于水体除磷,对其除磷性能尤其是对低浓度含磷废水的去除及机理进行研究.
1 材料与方法
1.1实验材料与表征仪器
实验的主要试剂有磷酸二氢钾、硝酸铁、氨水等,购自国药集团,为分析纯.可膨胀石墨(80目,纯度 99%)购自青岛金日来公司.以可膨胀石墨为原料,经由微波法制备得到膨胀石墨[7-8](expanded graphite,EG).
傅里叶变换红外光谱(FT-IR)测定在Nicolet FT-IR 380(美国尼高力仪器公司)上进行,空白基底为干燥的溴化钾,纯度为分析纯.使用 JSM-6700 F(日本JEOL电子株式会社)仪器测定物质的扫描电子显微镜图谱(SEM).水体中磷浓度的测定通过紫外仪器(Agilent 8453 紫外-可见分光光度计)完成.使用电感耦合等离子体发射光谱(ICP-OES)测定EG-FeOH中的铁含量,仪器来自美国雷曼公司.
1.2EG-FeOH制备
配置一定浓度的硝酸铁溶液10 mL,加入0.2 g EG,后向其中搅拌滴加氨水,滴加完毕后补加去离子水至溶液体积为40 mL,浸渍一定时间后,离心,固体用去离子水洗涤,并于105 ℃下干燥12 h,密封保存待用.
1.3EG-FeOH静态吸附实验
配置一定浓度的磷酸二氢钾溶液,按照1.0 g·L-1的投加量加入EG-FeOH,于设定温度下振荡12h,测定溶液中剩余磷浓度.溶液的剩余磷浓度使用抗坏血酸-钼酸盐法(GB11906—89)在700 nm波长的光下检测获得[9-11].除磷率(E, %)和吸附容量(qe, mg·g-1)可通过式(1)—(2)计算得到:
(1)
(2)
式(1)—(2)中:C0和Ce分别为初始磷浓度和最终磷浓度,mg·L-1;V代表溶液体积,L;m为吸附剂质量.
在磷溶液的浓度依次为10,20,30,40,50 mg·L-1时,温度为25 ℃、45 ℃和65 ℃下,考察初始磷溶液浓度及温度对EG-FeOH除磷性能的影响.
于25 ℃、45 ℃和65 ℃下,在固定的时间点测定溶液内的剩余磷浓度和溶液pH值,考察吸附过程中时间对EG-FeOH除磷性能的影响;于25 ℃下,将EG-FeOH投加至5 mg·L-1的磷溶液中,考察在低浓度磷溶液中吸附时间对EG-FeOH除磷性能的影响.
1.4数据处理
等温吸附线的数据,主要通过Langmuir和Freundlich等温吸附模型进行分析,公式如下:
(3)
(4)
式(3)—(4)中:Ce代表溶液中的平衡磷浓度;Kf是Freundlich常数,与去除能力相关;1/n也是Freundlich常数,与吸附强度相关;qmax是最大吸附能力;KL是Langmuir常数,与键合强度有关.
热力学参数ΔHΘ, ΔSΘ和ΔGΘ的计算方程如下:
(5)
(6)
(7a)
(7b)
式(5)—(7)中:ΔSΘ是熵变值;ΔHΘ是吸附反应中的焓变值;ΔGΘ是吉布斯自由能变值;R是一个常数(8.314 J·mol-1·K-1;T是热力学温度,K;Ke代表了平衡常数;a为吸附剂的投加量.对ln(Ke)和1/T进行线性拟合,得到斜率与截距,通过公式(7)可以计算得到ΔSΘ和ΔHΘ值.
使用准一级动力学方程公式(8)、准二级动力学方程公式(9)的计算如下:
(8)
(9)
式(8)—(9)中:qe为平衡时的磷吸附量,mg·g-1;qt为在某个时间点吸附剂的磷吸附容量,mg·g-1;k1为准一级动力学方程的速率常数;k2为准二级动力学方程的速率常数;t为吸附时间.
1.5再生实验
将饱和吸附磷的EG-FeOH(EG-FeOH-P)置于固液比为80mL·g-1的1.0mol·L-1NaOH溶液中脱附8h,固体取出后用去离子水洗涤并于105 ℃下烘干,得到一次再生后的吸附剂.
2 结果与讨论
2.1EG-FeOH制备
2.1.1氢氧化铁浓度
氢氧化铁浓度对EG-FeOH除磷率的影响见图1.随着氢氧化铁浓度的升高,吸附剂的除磷率逐步上升,当铁浓度到达0.26mol·L-1时,除磷率增势缓慢,最终保持不变.形成这种趋势的原因可能是随着硝酸铁浓度的增加,有更多的氢氧化铁生成并负载到EG上,而当EG上的活性位点被氢氧化铁全部占据,即活性位点饱和时,EG-FeOH的除磷率达到最大值并保持不变.

图1 氢氧化铁浓度对EG-FeOH除磷率的影响
2.1.2浸渍时间
浸渍时间对EG-FeOH除磷率的影响见图2.当浸渍时间在100min之前时,随着时间的延长EG-FeOH的除磷率不断增大,而超过100min后,EG-FeOH的除磷率受浸渍时间的影响并不明显.这主要是因为活性氢氧化铁负载到EG上需要一定的时间,若时间过短,生成的Fe(OH)3还未完全负载到EG上,即EG内部的孔洞中仍存在活性点负载Fe(OH)3.当给予足够的时间后,Fe(OH)3完全进入到EG内部并均匀分布于孔道内部,EG上的位点被Fe(OH)3完全占据,这样延长时间也不会增加EG-FeOH的除磷率.
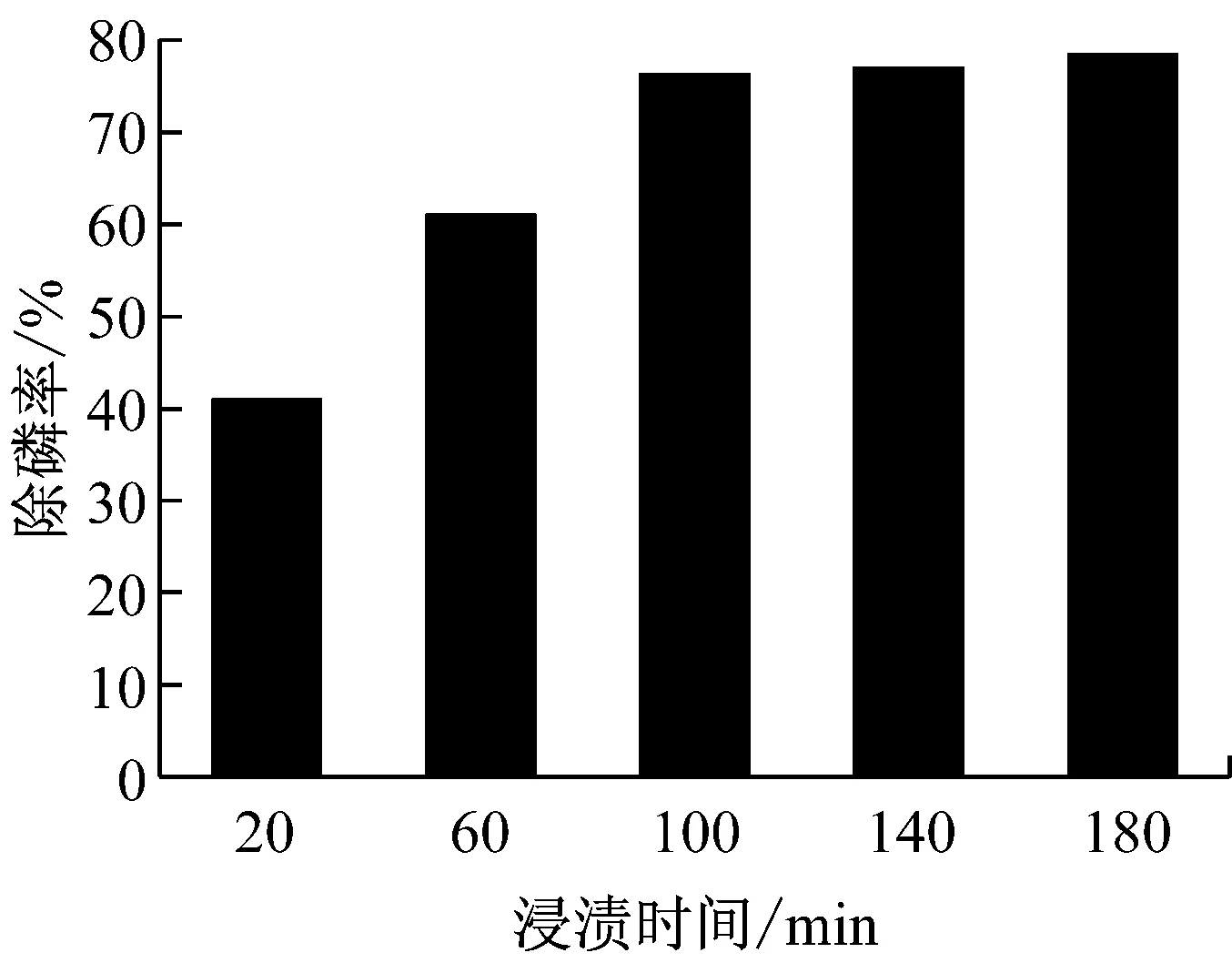
图2 浸渍时间对EG-FeOH除磷率的影响
2.1.3SEM分析
EG与所制备的吸附剂EG-FeOH的SEM如图3所示.图3a可以明显看到EG内部的层间结构,而对比图3a和3b之后发现,图3b中可以清晰看到有颗粒存在于EG内部孔洞中,这主要是由于活性Fe(OH)3负载于EG上所致.

a EG

b EG-FeOH
2.2EG-FeOH除磷性能
2.2.1EG-FeOH除磷性能
表1为9种吸附剂的除磷性能对比.表中,PBGC表示多孔生物形态复合物,EDTA表示乙二胺四乙酸,ACF表示活性炭纤维.在表1中,对比EG与EG-FeOH的除磷性能,发现未负载活性铁前,EG的吸附容量只有1.24mg·g-1,经过活性铁负载后,吸附剂的除磷性能提升至7.89mg·g-1,除磷性能上有了大幅度的提高,说明EG-FeOH的除磷吸附容量主要由活性铁提供.
EG-FeOH与其他7种含铁吸附剂的除磷性能对比,发现EG-FeOH的单位铁吸附容量显著高于其他类吸附剂,认为EG-FeOH中铁的活性较其他吸附剂更强,单位铁的利用率更高,说明EG-FeOH的经济成本较低.
2.2.2等温吸附线
使用Langmuir和Freundlich等温吸附模型处理后的模型参数见表2.从表2可以看出,在25 ℃、45 ℃、65 ℃下,EG-FeOH的最大吸附容量qmax分别为7.34,8.03和8.30mg·g-1,说明温度升高对吸附除磷是有利的.在三个温度下,EG-FeOH吸附过程的Langmuir模型的拟合度R2都明显高于

表1 九种吸附剂的除磷性能
Freundlich模型,证明EG-FeOH的除磷过程主要以单分子层吸附为主.而随着温度的升高,KL也在提升,说明吸附剂与磷酸根的键合强度在加强.这可能是由于温度上升后会给予吸附剂更大的活性、降低了液膜层的厚度等,导致EG-FeOH的除磷吸附容量提升.
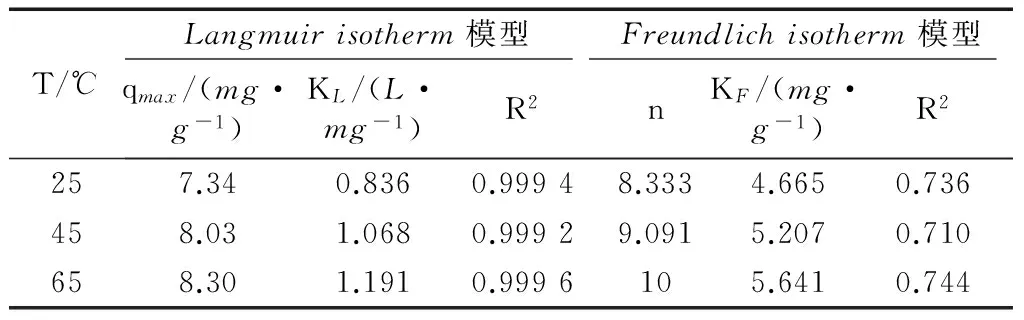
表2 Langmuir和Freundlich等温吸附模型的参数
2.2.3熵变、焓变及吉布斯自由能变
在25 ℃、45 ℃和65 ℃下,EG-FeOH除磷过程的ΔGΘ分别为-5.71,-6.91和-8.41kJ·mol-1,均小于零,ΔSΘ为60.72J·mol-1·K-1,ΔHΘ为12.37kJ·mol-1,说明EG-FeOH的吸附除磷为自发放热的过程.随着温度的升高,EG-FeOH的ΔGΘ值越来越小,说明其吸附除磷过程的自发性在逐渐增强,即升高温度有利于EG-FeOH吸附除磷,这与表2中得到结果一致.
2.2.4动力学
25 ℃、45 ℃和65 ℃下EG-FeOH的动力学曲线见图4,使用准一级动力学模型和准二级动力学模型处理后的拟合直线参数见表3.从图4中可以明显看到,于25 ℃、45 ℃和65 ℃下EG-FeOH的吸附除磷趋势类似——初始阶段吸附剂的除磷吸附容量快速上升,之后上升速率逐渐放缓直至达到平衡,主要的原因可能是随着吸附时间的增长,EG-FeOH上的活性位点经历了不饱和到逐渐饱和的过程.在三个温度下,EG-FeOH吸附过程的准二级动力学模型的拟合度R2都明显高于准一级模型,且模型中qmax与实验值非常接近,说明EG-FeOH的除磷过程主要以化学吸附为主.

表3 准一级与准二级动力学模型参数
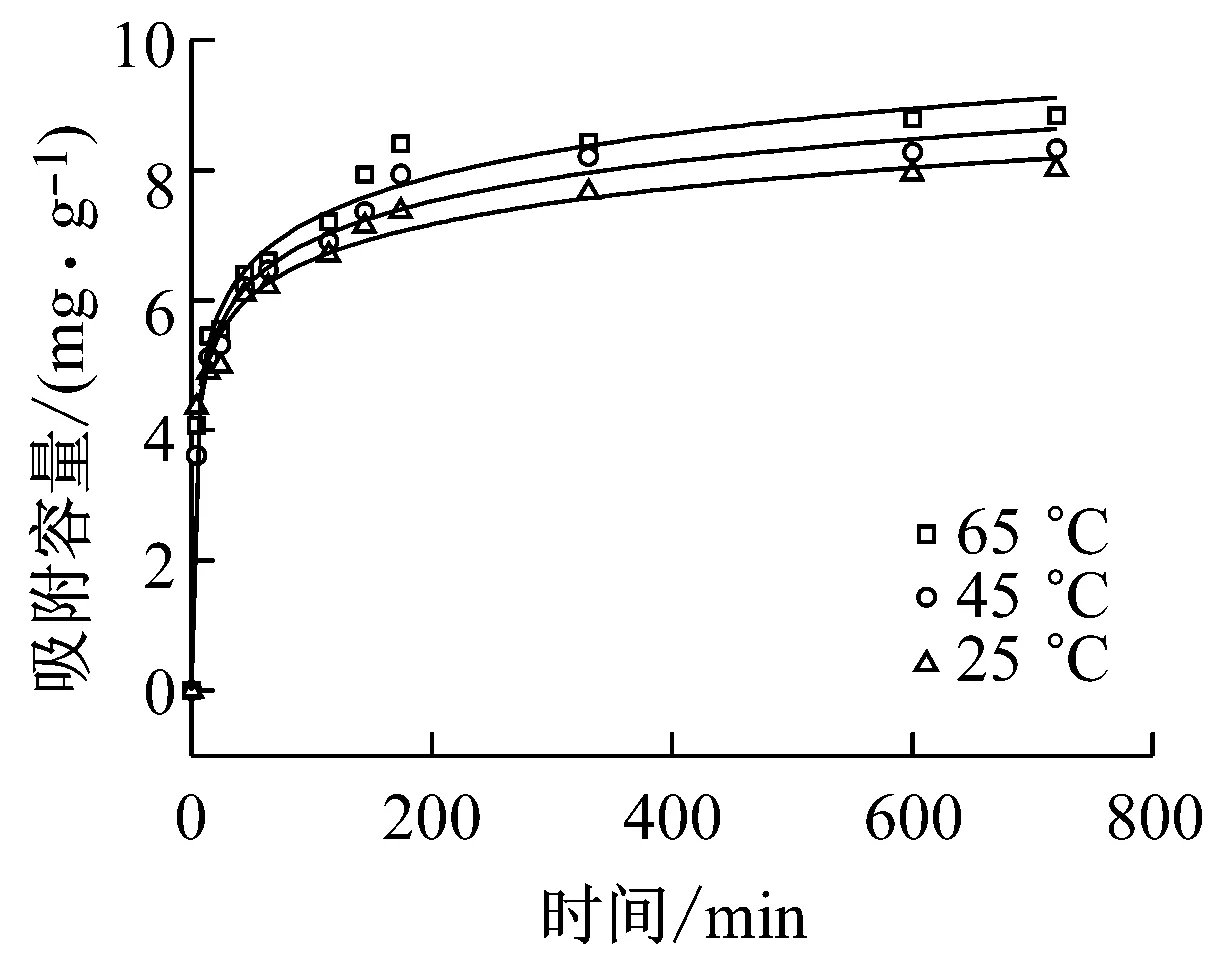
图4 25 ℃、45 ℃和65 ℃下EG-FeOH的动力学曲线
考虑到低浓度含磷废水的难去除性,使用EG-FeOH对5mg·L-1的溶液进行了吸附实验,结果如图5所示.EG-FeOH在低浓度含磷溶液中经历了一个快速磷吸附过程,在吸附的前2h,水体中的磷被快速去除,剩余磷浓度已经低于0.5mg·L-1,达到了国标中污水的排放标准(GB18918—2002、GB3838—2002). 3h后水体剩余磷浓度已经降至0.07mg·L-1,明显低于国标要求,仅次于源头水(Ⅰ类,总磷含量小于0.02mg·L-1.因此,认为EG-FeOH具有一定的工业应用价值,是一种拥有广阔应用前景的吸附除磷剂.
2.3EG-FeOH除磷机理
2.3.1EG-FeOH除磷过程中溶液pH变化
吸附过程中溶液的pH的变化趋势见图6,随着吸附时间的增长,pH值经历了先上升后相对保持不变的趋势.吸附过程中溶液pH值的上升主要是由于EG-FeOH上的羟基与溶液中的磷酸根进行了离子交换,氢氧根进入水体后使溶液pH上升.同时发现吸附过程中在溶液pH骤升的时间段内恰好是EG-FeOH快速除磷的阶段,也可以说明EG-FeOH的吸附除磷过程离子交换起到了主要作用.
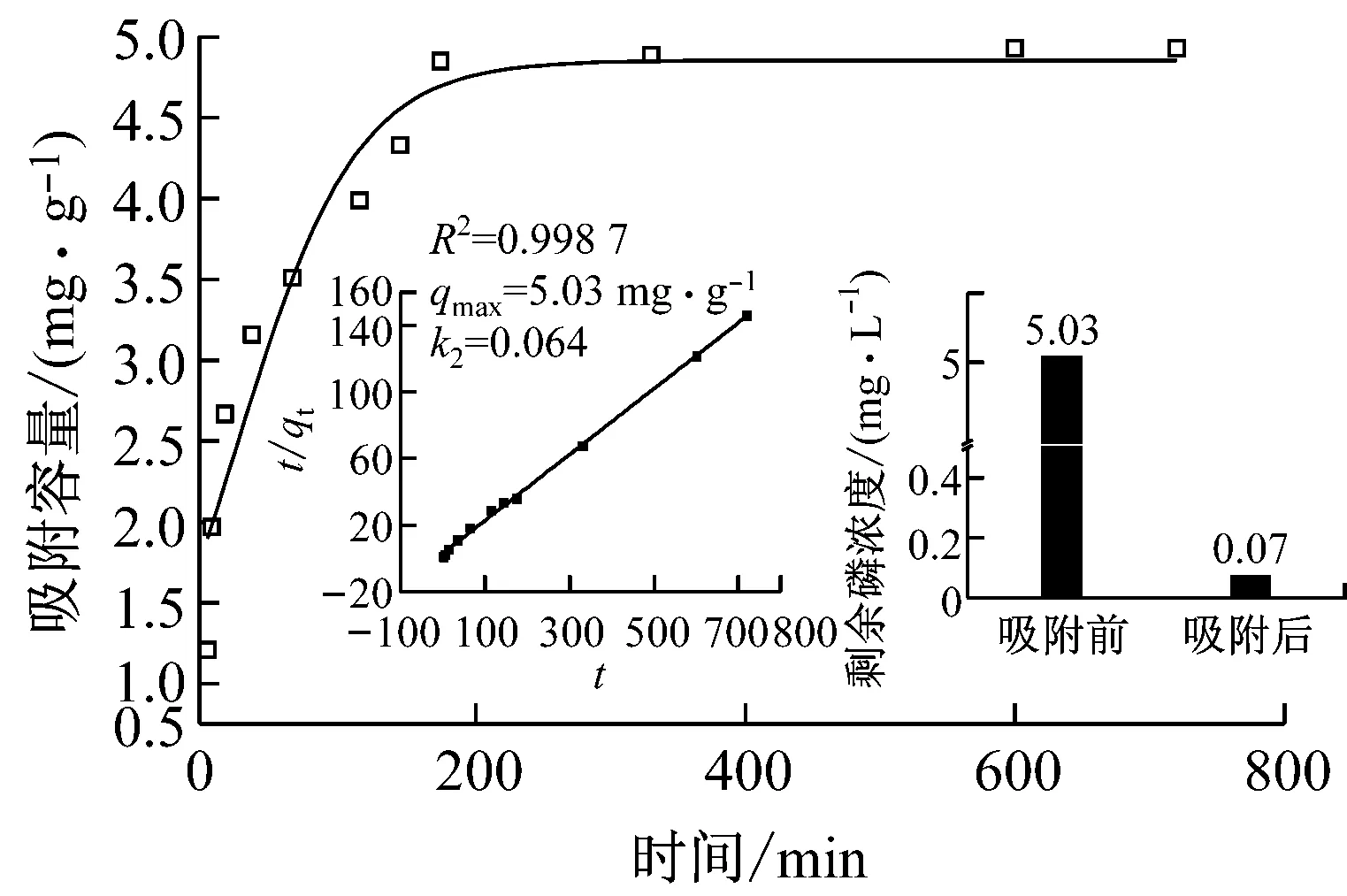
图5 25 ℃下EG-FeOH在5 mg·L-1含磷溶液中的吸附动力学曲线
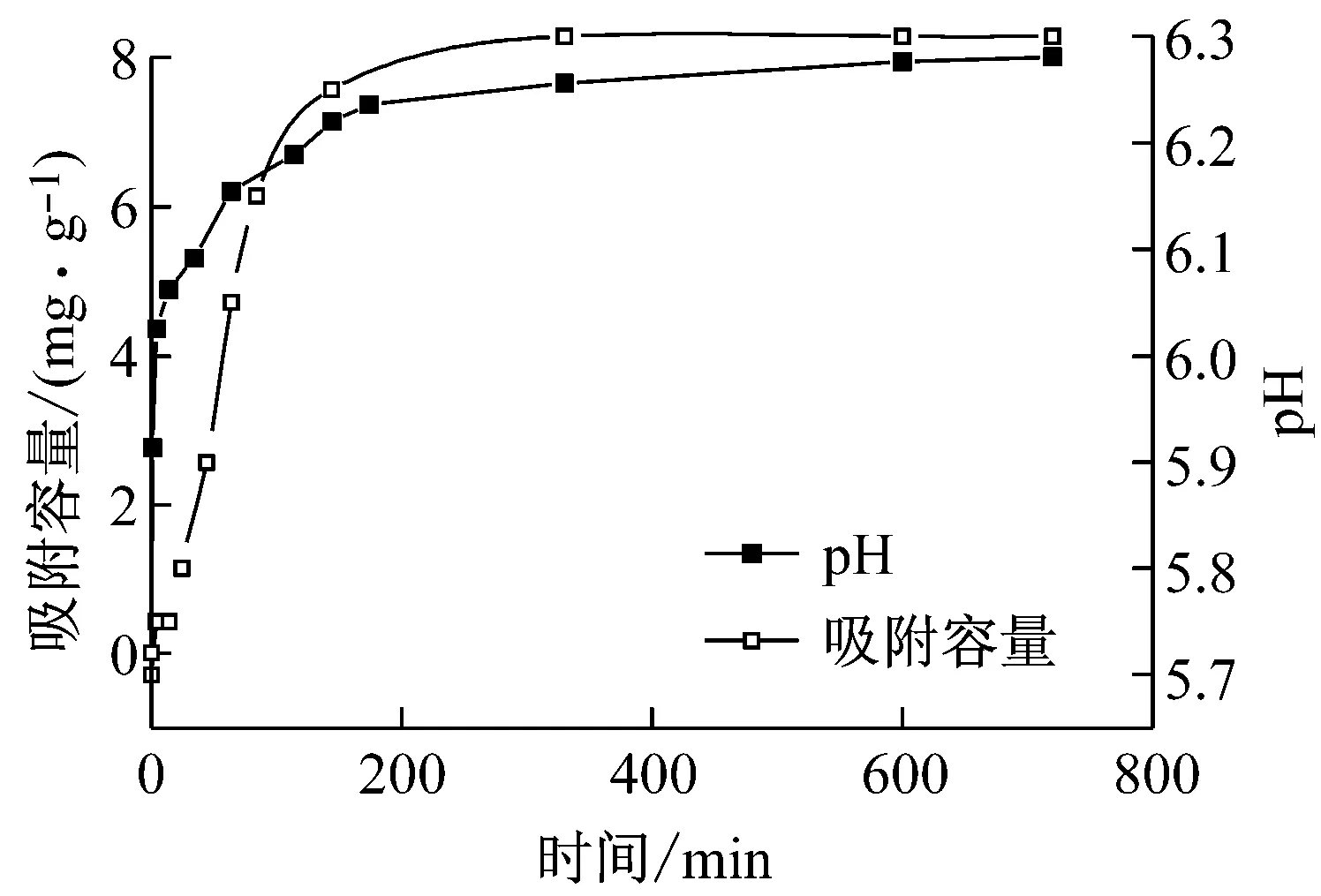
图6 吸附过程中的pH变化
2.3.2FT-IR分析
EG、EG-FeOH、饱和吸附磷后的EG-FeOH(EG-FeOH-P)的FT-IR谱图见图7.对比EG与EG-FeOH的FT-IR图谱,发现EG-FeOH中558cm-1处出现了新峰,归属于-OH的伸缩振动峰[19].在682和737cm-1上也出现了新峰,归属于典型的Fe-O配位伸缩振动峰[19],说明Fe(OH)3已经成功负载于EG上;对比EG-FeOH-P和EG-FeOH的FT-IR图谱,可以看到EG-FeOH-P中1 110cm-1处出现了新峰,其归属于P-O伸缩振动[20],说明磷被成功吸附于材料上.而EG-FeOH中位于682cm-1的Fe-OH振动峰移动至了668cm-1,这主要是由于磷酸根吸附后Fe-OH发生旋转和位移所致[21].而新出现于442cm-1的峰则归属为Fe-O-P键,说明活性铁与磷酸根中的氧之间发生了配位络合,进而说明EG-FeOH对磷酸根的吸附存在Lewis酸碱相互作用[17,21].
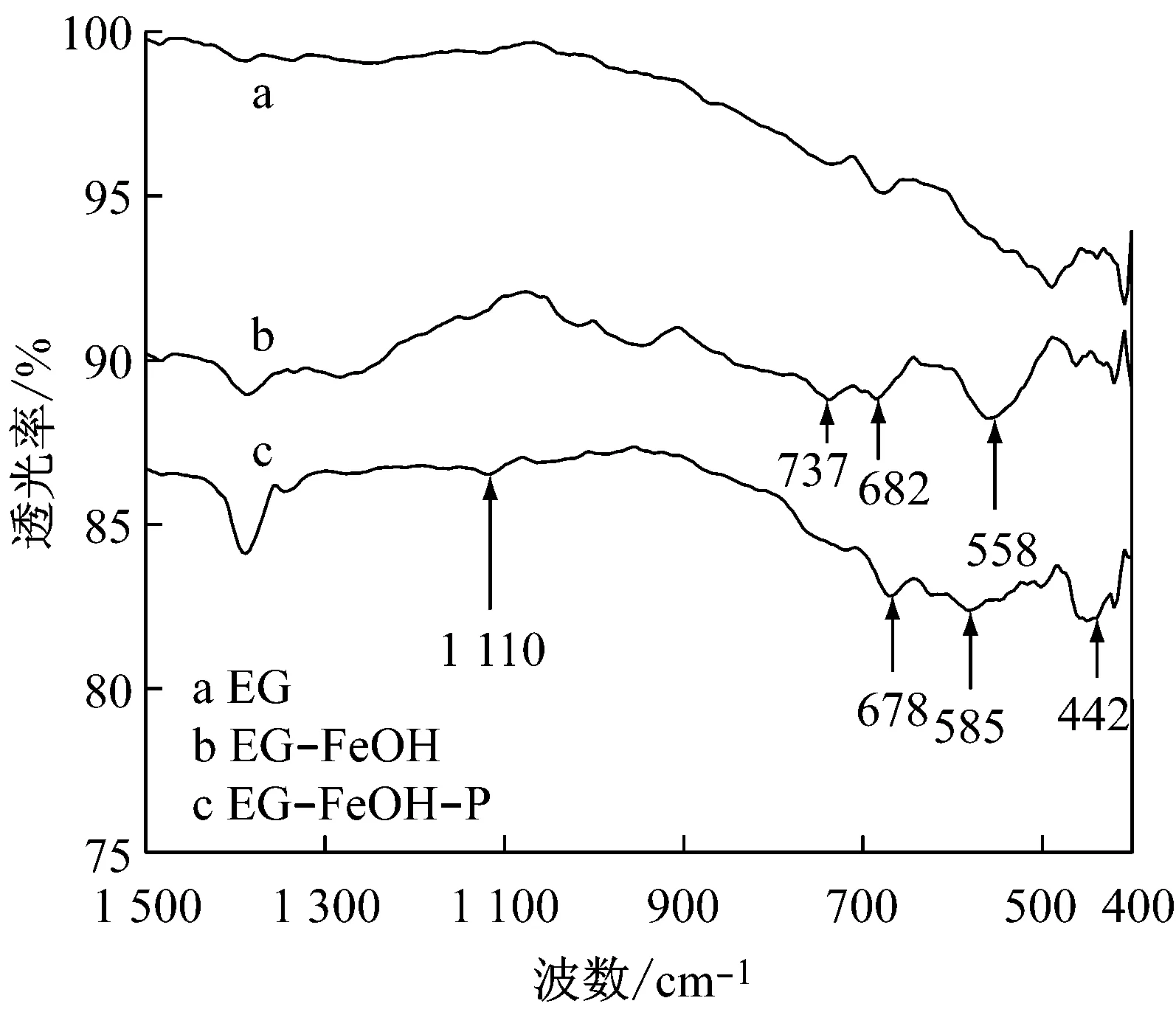
图7 EG、EG-FeOH和EG-FeOH-P的FT-IR图谱
3 再生
对饱和吸附磷的吸附剂进行再生和重新利用,可以极大降低除磷成本,还能避免吸附剂带来的二次污染.本文中使用NaOH为脱附液对EG-FeOH-P进行再生,结果见图8.可以看到NaOH作为脱附液对EG-FeOH-P的再生是有效的,再生三次后的再生率分别达到了74.40%、63.36%和51.41%.这主要是由于脱附液中的氢氧根对吸附剂上以离子交换作用结合的磷进行了有效交换而达到了再生目的.而随着再生次数的增加,再生后EG-FeOH的吸附容量有所下降,这主要是因为吸附饱和的EG-FeOH中以Lewis酸碱作用结合的那部分磷难以被脱附下来从而失活所致.
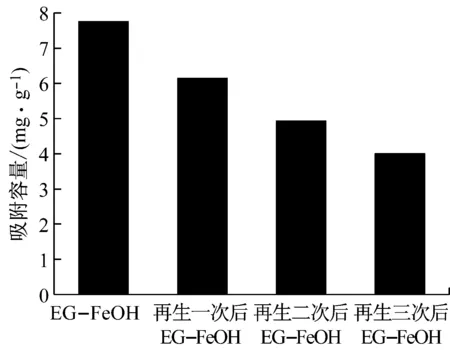
图8 NaOH对EG-FeOH再生性能的影响
4 结论
本文成功制备了EG-FeOH吸附剂用于水体除磷,其单位铁的除磷吸附容量达161mg·g-1Fe,在低浓度含磷废水中,EG-FeOH也表现了较好的除磷效果,显示了EG-FeOH具有良好的吸附除磷性能;其吸附除磷主要以单分子层的化学吸附为主,是自发吸热的过程.EG-FeOH主要通过离子交换作用和Lewis酸碱相互作用实现对磷的吸附.
[1]HUANGW,ZHUY,TANGJ, et al.Lanthanum-dopedorderedmesoporoushollowsilicaspheresasnoveladsorbentsforefficientphosphateremoval[J].JournalofMaterialsChemistryA, 2014, 2(2): 8839.
[2]PitakteeratharmN,HafukA,SatohH, et al.Highefficiencyremovalofphosphatefromwaterbyzirconiumsulfate-surfactantmicellemesostructureimmobilizedonpolymermatrix[J].England,WaterResearch, 2013, 47: 3583.
[3]陈志刚, 张勇, 杨娟,等. 膨胀石墨的制备、结构和应用[J]. 江苏大学学报:自然科学版, 2005, 26(3): 248.
CHENZhigang,ZHANGYong,YANGJuan, et al.Preparations,structuresandapplicationsofexfoliatedgraphite[J].China,JournalofJiangsuUniversity:NaturalScienceEdition, 2005, 26(3): 248.
[4]ZHANGM,ZHENGK,JINJ, et al.EffectsofFe(II)/PratioandpHonphosphorusremovalbyferroussaltandapproachtomechanisms[J].Netherlands,SeparationandPurificationTechnology, 2013, 118: 801.
[5]ZHANGG,LIUH,LIUR, et al.AdsorptionbehaviorandmechanismofarsenateatFe-Mnbinaryoxide/waterinterface[J].Netherlands,JournalofHazardousMaterials, 2009, 168(2-3): 820.
[6]WANGX,LIUF,LUL, et al.IndividualandcompetitiveadsorptionofCr(Ⅵ)andphosphateontosyntheticFe-Alhydroxides[J].Netherlands,ColloidsandSurfacesA:PhysicochemicalandEngineeringAspects, 2013, 423: 42.
[7]GorshenevV.N.Microwave-assistedandthermalstepwiseexpansionofoxidizedgraphites[J].Russia,RussianJournalofPhysicalChemistryB, 2011, 5(5): 780.
[8]HUAH,WANGY,WANGY, et al.Preparationofexpandedgraphiteusingrecyclinggraphiterodsbymicrowaveirradiation[J].Switzerland,AdvancedMaterialsResearch, 2013, 610-613(104): 2356.
[9]ZHANGL,WANL,CHANGN, et al.Removalofphosphatefromwaterbyactivatedcarbonfiberloadedwithlanthanumoxide[J].Netherlands,JournalofHazardousMaterials, 2011, 190(1-3): 848.
[10]ZHANGL,ZHOUQ,LIUJ, et al.Phosphateadsorptiononlanthanumhydroxide-dopedactivatedcarbonfiber[J].Switzerland,ChemicalEngineeringJournal, 2012, 185-186: 160.
[11]LIUJ,ZHOUQ,CHENJ, et al.Phosphateadsorptiononhydroxyl-iron-lanthanumdopedactivatedcarbonfiber[J].Switzerland,ChemicalEngineeringJournal, 2013, 215-216: 859.
[12]YOONS,LEEC,PARKJ, et al.Kinetic,equilibriumandthermodynamicstudiesforphosphateadsorptiontomagneticironoxidenanoparticles[J].Switzerland,ChemicalEngineeringJournal, 2014, 236: 341.
[13]ZHUZ,ZENGH,ZHUY, et al.Kineticsandthermodynamicstudyofphosphateadsorptionontheporousbiomorph-geneticcompositeofα-Fe2O3/Fe3O4/Cwitheucalyputswoodmicrostructure[J].Netherlands,SeparationandPurificationTechnology, 2013, 117: 124.
[14]YANGJ,ZENGQ,PENGL, et al.La-EDTAcoatedFe3O4nanomaterial:Preparationandapplicationinremovalofphosphatefromwater[J].China,JournalofEnvironmentalSciences, 2013, 25(2): 413.
[15]BiaG,PauliC,BorgninoL, et al.TheroleofFe(III)modifiedmontmorilloniteonfluoridemobility:Adsorptionexperimentsandcompetitionwithphosphate[J].England,JournalofEnvironmentalManagement, 2012, 100: 1.
[16]BorgninoL,AvenaMJ,DePauliC.P.SynthesisandcharacterizationofFe(III)-montmorillonitesforphosphateadsorption[J].Netherlands,ColloidsandSurfacesA:PhysicochemicalandEngineeringAspects, 2009, 341(1-3): 46.
[17]ZHOUQ,WANGX,LIUJ, et al.Phosphorusremovalfromwastewaterusingnano-particlesofhydratedferricoxidedopedactivatedcarbonfiberpreparedbysol-gelmethod[J].Switzerland,ChemicalEngineeringJournal, 2012, 200-202: 619.
[18]ZHANGL,GAOY,XUY, et al.Differentperformancesandmechanismsofphosphateadsorptionontometaloxidesandmetalhydroxides:acomparativestudy[J].England,JournalofChemicalTechnologyandBiotechnology, 2016,91:1232.
[19]SarkarA,PramanikP.DesignofanewnanostructurecomprisingmesoporousZrO2shellandmagnetitecore(Fe3O4@mZrO2)andstudyofitsphosphateionseparationefficiency[J].England,SupplementaryMaterialforJournalofMaterialsChemistry, 2010, 20: 4417.
[20]XIEJ,WANGZ,LUS, et al.Removalandrecoveryofphosphatefromwaterbylanthanumhydroxidematerials[J].Switzerland,ChemicalEngineeringJournal, 2014, 254: 163.
[21]XUP,ZENGG,HUANGD, et al.Useofironoxidenanomaterialsinwastewatertreatment:areview[J].Netherlands,ScienceoftheTotalEnvironment, 2012, 424: 1.
Phosphate Removal of Expanded Graphite Loaded with Ferric Hydroxide
ZHANG Ling, SU Yang, LU Qunzan, WANG Yong
(School of Environmental and Chemical Engineering, Shanghai University, Shanghai 200444, China)
The expanded graphite loaded with ferric hydroxide (EG-FeOH) is prepared successfully. Its most suitable synthesis conditions are 0.26mol/L of ironic concentration and 100min of immersion time, respectively. The Langmuir model and the pseudo second-order model are more suitable for well elucidation of the experimental data, indicating that the adsorption of phosphate is a monolayer chemisorption process. The positive ΔHΘand negative ΔGΘindicate that the process of phosphorus adsorption onto EG-FeOH is spontaneous and endothermic. It is favorable for the phosphorus adsorption with the rising of temperature to some extent. EG-FeOH performs excellently for phosphate adsorption in low concentration (5 mg·L-1). The ion exchange and lewis acid-base interactions are manifested to be two main mechanisms for phosphate adsorption of EG-FeOH revealed by Fourier transform infrared (FT-IR) spectroscopy and change of pH values associated with the adsorption process. The EG-FeOH after adsorption is also recovered using sodium hydroxide (NaOH).
expanded graphite; iron hydroxide; phosphorus removal; adsorption; mechanism
2016-01-06
国家自然科学基金(21207085),上海市教委科研创新项目(14YZ014)
张玲(1974—),女,工学博士,副教授,主要研究方向为水污染控制化学,E-mail:zhanglinglzu@stuff.shu.edu.cn
X524
A

