基于粒子群-支持向量机的时间序列分类诊断模型
张 涛, 张明辉, 李清伟, 张玥杰
(1.上海财经大学 信息管理与工程学院,上海 200433;2.同济大学附属同济医院,上海 200065;3.上海市金融信息技术研究重点实验室(上海财经大学),上海 200433;4.复旦大学 计算机科学技术学院,上海市智能信息处理重点实验室,上海 200433)
基于粒子群-支持向量机的时间序列分类诊断模型
张涛1,3, 张明辉1, 李清伟2, 张玥杰4
(1.上海财经大学 信息管理与工程学院,上海 200433;2.同济大学附属同济医院,上海 200065;3.上海市金融信息技术研究重点实验室(上海财经大学),上海 200433;4.复旦大学 计算机科学技术学院,上海市智能信息处理重点实验室,上海 200433)
构建一种基于粒子群算法-支持向量机(PSO-SVM)的磁共振功能成像(fMRI)时间序列分类诊断模型,通过针对脑区多维时间序列数据的深层次分析实现病症患者和健康者的准确判断与区分,为面向fMRI时间序列数据的病症诊断和预测提供有效科学依据.该方法在以下4个方面不同于其他已有相关研究工作:(1) 构建基于自回归模型的脑区多维时间序列数据特征表示;(2) 构建基于支持向量机模型的脑区多维时间序列数据分类机制;(3) 构建基于粒子群算法的分类学习参数寻优策略;(4) 建立融合上述特征表示、优化分类与参数优选模式的fMRI时间序列数据分类诊断模型.通过以精神抑郁症作为实证分析的具体案例,所提出分类诊断模型已取得良好实验效果,展示出其有效性与合理性.
fMRI多维时间序列; 分类诊断; 自回归模型; 支持向量机(SVM); 粒子群算法(PSO)
大量的诊断记录、医学影像、化验与测量结果、生物基因序列等信息组成十分庞大的医疗诊断时间序列数据库[1],有关医学诊断时间序列数据分析与挖掘的应用越来越广泛.特别是,近年来涉及认知神经科学的医疗诊断通常采用各种脑成像技术所生成的典型时间序列数据来进行和大脑神经活动相关的诊断决策研究,如脑电、脑磁、正电子断层扫描、磁共振成像及磁共振功能成像(functionalmagneticresonanceimaging,fMRI)[2].有关fMRI时间序列数据的分析与挖掘大都依赖于时间序列数据的相似性或不相似性的度量,但简单的等式或不等式策略在时间序列数据上作用微乎其微且时间序列往往很长,这就使得针对时间序列数据的处理问题更容易陷入“维度灾难(dimensionalcurse)”[3].实现面向fMRI时间序列数据信息的深层次分析与挖掘进行有效的分类诊断,已成为医疗数据研究与发展的新兴热点.
fMRI时间序列数据能充分展示大脑不同活动的变化,不仅包含大脑活动的时间信息,同时也包含大脑内部的空间特征,亟需高效成熟的分析与挖掘方法去捕获其在时间和空间上的特点.然而,目前基于fMRI时间序列数据挖掘的分类研究大部分只关注其中单一种类的时间信息或者空间特征,鲜有针对庞大fMRI时间序列数据集中特有时空模式特点的科学定量研究[4].为更加有效地实现fMRI时间序列数据有效分类诊断,亟需解决三个关键问题:①fMRI时间序列数据的合理特征表示,以特征化所蕴含的丰富时空属性信息;② 融合fMRI时间序列数据特征的优化分类诊断机制,以标识时间序列数据与具体疾病类别之间的关联;③ 针对fMRI时间序列数据分类诊断的参数调优策略,以保证分类机制的准确性与时间效率.为解决第一个问题,非常重要于利用大规模fMRI时间序列数据进行深度分析与挖掘,以全面获取有益特征信息.为解决第二个问题,非常关键于探索一种合适fMRI时间序列数据的分类诊断模型,以充分利用合理特征表述充分挖掘fMRI时间序列数据属性与疾病类别之间的内在相关性.为解决第三个问题,非常有必要构建新型的参数选择模式,以实现有效支撑分类诊断性能和效率的最优参数设置.
本文提出一种基于粒子群算法-支持向量机(particleswarmoptimization-supportvectormachine,PSO-SVM)的fMRI时间序列分类诊断模型,通过针对脑区多维时间序列数据的深层次分析实现病症患者和健康者的准确判断与区分,该方法在以下方面显著不同于其他已有相关研究工作:① 构建基于自回归(auto-regressive,AR)模型的脑区多维时间序列数据特征表示,合理表征这一特殊时间序列数据的内在属性信息;② 构建基于支持向量机(supportvectormachine,SVM)模型的脑区多维时间序列数据分类机制,实现fMRI时间序列数据有效模式与关系的深度分析与挖掘;③ 构建基于粒子群算法(particleswarmoptimization,PSO)的分类学习参数寻优策略,获取最佳参数组合以优化分类模型;④ 建立融合上述模式的fMRI时间序列数据分类诊断模型,为病症的科学诊断和预测形成定量指导和参考指标.通过以精神抑郁症作为实证分析的具体案例,所提出分类诊断模型已取得良好的实验效果,展示出其有效性与合理性.
1 相关工作
多维时间序列不同于通常的一维时间序列或者单变量时间序列,在具体应用场景中一个时刻对应多个实数变量或者描述属性而非简单的一维实值变量,同时其相互之间的关系不再局限于变量与时间之间的相关性,变量与变量之间也会具有一定的联系[5-6].近些年来,面向医学领域的脑电信号序列、磁共振成像fMRI时间序列等特有的脑区多维时间序列数据,越发体现出其在病症医学诊断和预测中非常重要的参考价值和借鉴意义.然而,脑区多维时间序列除具有数据规模较大、随时间不断变化、较高维度、结构较为复杂等特点外,还具有医学信息所独有的特殊性与复杂性,因此,面对大量脑区多维时间数据信息,探究合理有效的分类诊断和预测模型作为医学诊疗的辅助工具十分必要.
目前,融合基于假设驱动和基于数据驱动分类方法优势的分类模式,已成为针对fMRI多维序列数据分类诊断研究的热点.基于假设驱动的分类方法,以具体感兴趣区域为基础设定相关脑区,通过分析特定脑区的时间序列信息来构架分类模型.基于数据驱动的分类方法,以经过数据采集获取的数据样本为基础提取相关特征属性信息,通过基于特征属性描述的分析与挖掘来构架分类模型.两者相辅相成,优势互补,以感兴趣区域为基础针对病症关联的多脑区多维时间序列信息进行特征提取,筛选出与病症相关的关键属性关系,相对较为全面地反映fMRI多脑区多维时间序列信息的内在有价值数据特征,降低个体差异带来的误差影响.Norman等利用SVM训练分类器,可通过fMRI数据判断被测试者正在观看的是鞋子还是瓶子,也可判断被测试者观察的图片是人脸还是物体[7].Costafreda等和Fu等分别将SVM分类器应用到结构像和功能像fMRI数据中,正常对照组和抑郁症组的分类准确率分别为67%和86%[8].Chupin等提出一种基于概率和解剖经验的全自动海马分割方法,针对老年痴呆(Alzheimer’sdisease,AD)患者、轻度认知障碍(mildcognitiveimpairment,MCI)患者和正常对照组的fMRI图像进行海马分割而得到海马容积,然后利用SVM算法进行两组间分类研究[9].Gong等以灰质及白质组间差异为特征,使用SVM算法来区分难治性(refractorydepressivedisorder)和易治性(non-refractorydepressivedisorder)抑郁症,其准确率分别达到65.22%和76.09%[10].相洁等使用全脑体素实现分类,以预测人脑所在执行的高级思维状态[11].Mitchell等对比研究不同的分类算法,包括支持向量机(SVM)、动态贝叶斯网络(dynamicbayesiannetworks,DBNs)、高斯朴素贝叶斯(GaussianNaiveBayes,GNB)和k2最近邻分类算法(k2nearestneighbor,kNN)等,体现出SVM在解决小样本、非线性及高维模式识别方面具有一定优势[12-14].一些相关研究针对脑疾病的多种MRI数据进行多元模式分类开展,包括结构像(如Ti加权像)、功能磁共振成像fMRI、静息态功能磁共振成像、及扩散张量成像等[15-16].另外,还有一些相关研究在脑疾病分类研究中结合MRI中多种模态的图像数据,对多种精神疾病进行多元模式分类分析,如阿尔茨海默病、精神分裂症、抑郁症及抑郁狂躁型忧郁症(bipolardisorder)等[17-18].
由以上分析,针对fMRI脑区多维时间序列数据分类诊断研究,应更充分考虑以下方面:① 针对fMRI时间序列数据的深层次分析以挖掘有效特征表示——应通过深度分析与挖掘fMRI时间序列数据,探索蕴含有价值属性信息的特征空间构建,为分类诊断构架有益特征描述基础;② 针对fMRI时间序列数据与病症间相互关联性的合理度量——从fMRI时间序列数据特定属性信息的探究、利用和融合的角度,十分有必要组合其特有特征表述与适宜的分类决策模型以构建适用于脑区多维时间序列数据和病症关联度评测的分类诊断联合模型;③ 针对fMRI时间序列数据分类诊断的参数设置优化——构架分类诊断的参数优化设置模式,能够在很大程度上控制整个分类决策过程的时空代价在一个合理范围之内,有效促进分类诊断性能和效率的进一步改进与提升.
2 基于AR模型的fMRI时间序列数据特征表示
fMRI脑区多维时间序列数据中通常存在部分不相关或冗余的维度,针对多维时间序列分析必须考虑各维度间的联系,特别是不仅将时间序列看作是空间向量而关注维度之间的数量关系,同时也要充分利用隐藏在多维时间序列中的时间信息.若直接对原始时间序列进行特征提取则会大大降低分类诊断性能,有必要寻求一种有效特征表示模式来剔除不相关维度.
大量研究表明,AR模型的自回归系数对状态变化规律敏感,采用AR模型的自回归系数作为特征向量来分析时间序列邻域相关的变化十分有效.但由于AR模型只能针对平稳时间序列建模,因此在建模之前必须对时间序列进行平稳性检验,对于模型阶数的确定则只能满足一定置信范围.为此,特别考虑使用AR模型来拟合每个脑区的时间序列,其中使用平滑先验方法(smoothnesspriorapproach,SPA)和经验模式分解(empiricalmodedecomposition,EMD)方法对非平稳的原始时间序列去除趋势项,对残差项进行独立同分布(independentidenticaldistribution,IID)平稳性检验,检验通过后根据其自相关系数和偏自相关系数进行定阶,并利用Burg算法进行AR模型参数的估计而最终得到自回归方程.
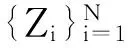
(1)
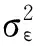
(2)
则q阶回归模型AR(q)产生拟合时间序列xt的似然概率为
(3)
需要注意的是,fMRI各脑区时间序列数据的AR阶数并不相等,而后续分类诊断模型要求每个时间序列样本均提供相同数目的特征属性值.为避免丢失过多的邻域信息且有效表征原始脑区时间序列的特征属性,不能直接利用自回归参数作为时间序列样本特征信息,而上述所构建的AR模型拟合概率模式成为实现各脑区时间序列相同阶数特征属性表示的适宜度量.
3 基于SVM模型的fMRI时间序列数据分类机制
fMRI脑区多维时间序列分类问题可描述为:给定一个fMRI多维时间序列数据集{Ti|i=1,…,M+N},其中每个时间序列样本Ti属于Rm*n,训练样本集{Ti|i=1,…,M},分类目标为测试集{Ti|i=M+1,…,M+N},通过已知分类的训练样本集基础上的有监督学习,建立基于SVM模型的分类机制对未知分类的测试集进行分类预测.基于SVM的fMRI时间序列数据分类模型在解决小样本问题上,能够最大化利用原始脑区多维时间序列数据的特征属性信息,挖掘其有效模式与关系,达到分类、预测、识别的最佳效果.
针对包含M个样本的训练集,每个样本可表示为一个二元组(xi,yi),其中xi=(xi1,xi2,…,xid)T对应第i个样本的d个属性集,yi{-1,1}为类标号.根据非线性SVM分类原理,将样本中特征属性集xi通过非线性变换Φ(xi)映射到高维空间中,在变换空间求解最优分类面w·Φ(xi)+b=0,其中w表示权值矢量,b为阈值,w和b确定分类面位置.对于过于接近超平面或者是被错误分类的向量xi,引进松弛变量ξi和惩罚系数c.由此,基于训练样本集的分类问题可转化为以下优化问题:
(4)
相应转化的对偶问题为
(5)
基于拉格朗日乘子αi的求解,可按式(6)—(7)计算参数w和b:
(6)
(7)
引入满足Mercer条件的非线性核函数K(xi,xj)表示变换空间中两向量的点积,即K(xi,xj)=Φ(xi)TΦ(xj),由此确定针对分类测试集z的决策函数为
(8)
其中,构造支持向量xi与输入空间抽取的向量xj之间的内积核是构造支持向量机的关键,为获得更为理想的fMRI时间序列分类性能,选用以下高斯径向基核函数(Gaussianradialbasisfunction,GRBF):
(9)
4 基于PSO算法的分类模型参数优化
在面向fMRI时间序列数据的SVM分类模型中,支持向量机通过核函数将输入空间中线性不可分的数据映射到高维特征空间,从而使问题变得线性可分,因此SVM分类模型的参数优化选择对整体分类性能有着非常关键的作用.决策惩罚参数c用来调节学习机置信范围和经验风险的比例,协调控制错分率和算法复杂度,使学习机具有最佳能力;而RBF核参数g表示RBF核的宽度,核参数的改变意味着非线性空间映射函数的改变,从而影响样本特征子空间分布的复杂程度.为寻找最优的决策惩罚参数和核参数,构建基于PSO算法的参数优化模式,对于在大规模样本中寻找最佳参数,具有更广泛的适用性.
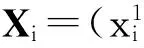

vdit+1()=ωvdit()+c1η1pdit()-xdit()+c2η2pdgt()-xdtt()(10)
(11)

(1)初始化,设定PSO参数初始值,即加速因子c1(局部搜索能力初始值)和c2(全局搜索能力初始值)、种群最大数量R(最大进化数量)、速率、速率和参数关系、速率更新速度弹性系数ω、种群更新速度弹性系数β、决策惩罚参数c和核参数g的最大值与最小值.
(2)初始解生成,即产生初始粒子和速度,在c和g设定的初始范围内随机产生种群和速度的初始值,并将c和g的值输入SVM分类器,计算其交叉验证准确率作为适应度值,确定全局极值及其对应的全局极值点(即最优粒子),并计算每一代种群的平均适应度.
(3)迭代寻优直到最大迭代次数或满足迭代终止条件——根据粒子群速度更新式(10)计算每个粒子的速度,根据种群位置更新式(11)调整每个粒子的位置,经过自适应粒子变异后基于SVM分类模型计算其交叉验证准确率作为适应度值.然后,进行判定,如果新位置的适应度优于局部最优粒子则用新粒子代替局部最优粒子,如果种群中的最优粒子优于全局最优粒子则将种群中的最优粒子替换全局最优粒子,并计算全局适应度和平均适应度.
(4)返回最优粒子和适应度值,得到最佳的(c,g)和交叉验证准确率,利用得到的最佳参数组合建立SVM分类模型进行训练并对分类测试集进行类别预测.
5 仿真实验与实证分析
5.1数据来源
本文以精神抑郁症为对象进行实验仿真,实验数据由某知名大学附属医院精神医学实验室提供.所采集的磁共振成像数据经过初期处理与分析,获得fMRI时间序列数据集.所有被试者均符合相应医学标准,且抑郁症组和健康对照组在年龄、性别分布及受教育年限分布的差异无统计学意义.一共获取33个抑郁症样本和33个健康样本,每个样本包括7个脑区在7分32秒内的152个观测值,采样间隔为3s,即对于每个样本均可由一个7×152的原始矩阵表示,66个样本形成多维时间序列数据集.实验中将每类样本的前20个样本作为训练集,另外13个样本作为测试集.
5.2针对fMRI时间序列特征表示的相关实验
为了对原始fMRI时间序列数据具有直观的认识,图1给出原始数据集中一个健康样本和一个病人样本的信号水平对比图,每个样本均包含7个脑区的152个观测值.从图1可看出,抑郁症样本和正常样本各脑区(P1~P7)时间序列可相对视为平稳序列或者去除趋势项后的平稳序列,围绕均值上下波动,在时间维度上存在着很明显的相似性,但两种类型的样本在P6和P7两个脑区的均值存在明显差异.
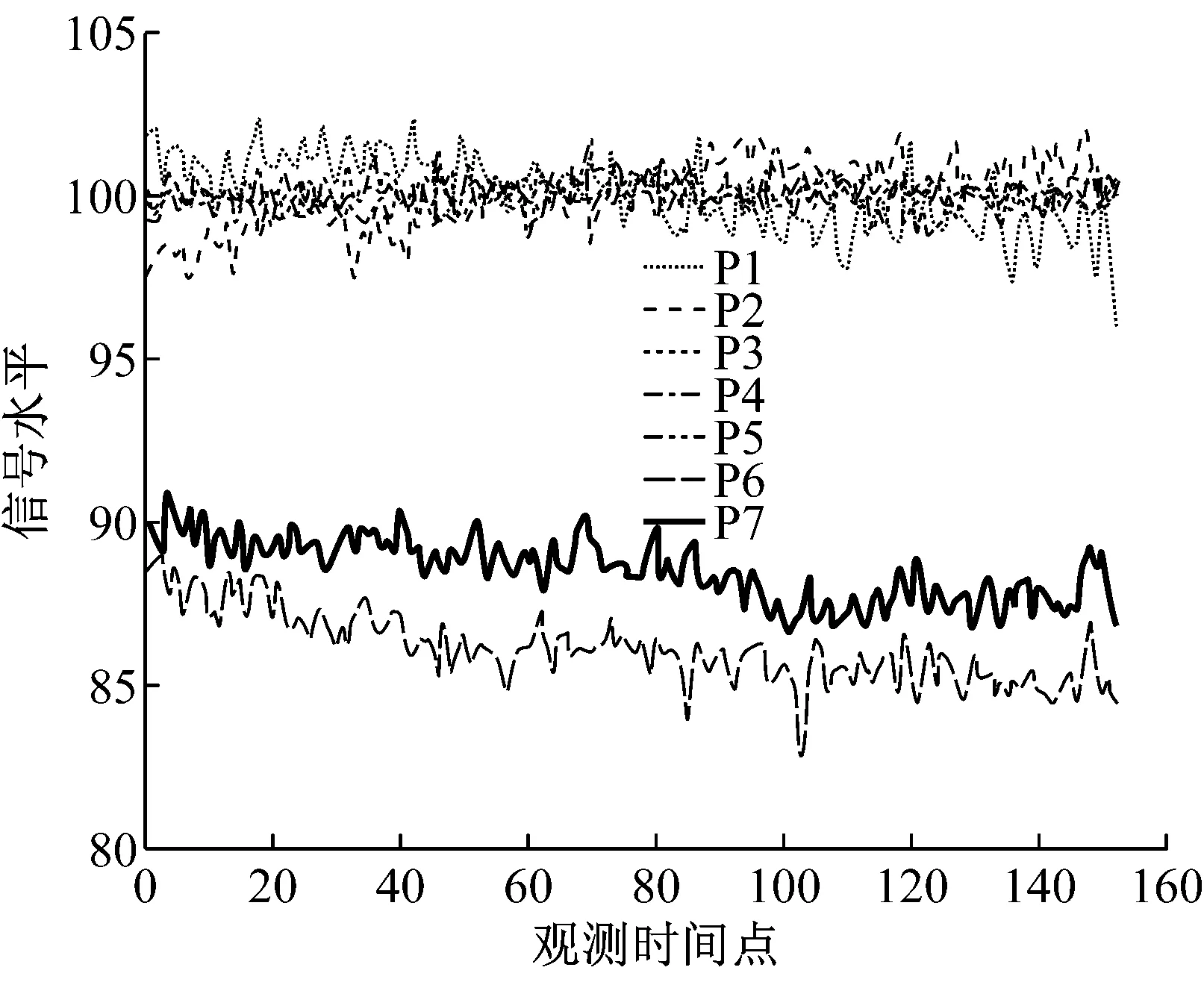
a 某抑郁症样本各脑区信号水平

b 某正常样本各脑区信号水平
Fig.1Originalsignallevelcontrastbetweenrandomsamplesofdepressionandnormalsamples
基于所构建fMRI脑区时间序列数据,利用自回归AR模型构建其相应的特征属性表示.同时,为展现基于AR模型的特征提取模式有效性,在相同时间序列数据集上实现另一种比较广泛采用的时间序列数据特征提取方法,即基于主成分分析(principalcomponentanalysis,PCA)的表示.有关fMRI时间序列数据特征提取的相关实验统计结果,见表1.表中,括号内的数字表示计算结果的由来,“/”表示相除.其中,考虑到如果对特征样本数据进行归一化处理,将原始数据映射到同一范围内以在一定程度上简化计算提高训练速度,但归一化并非必须采用的预处理方法,如处理不当会影响分类效果,因此实验中包括对特征样本数据不作任何归一化处理、以及进行[0,1]和[-1,1]范围内的归一化处理两种不同方式.
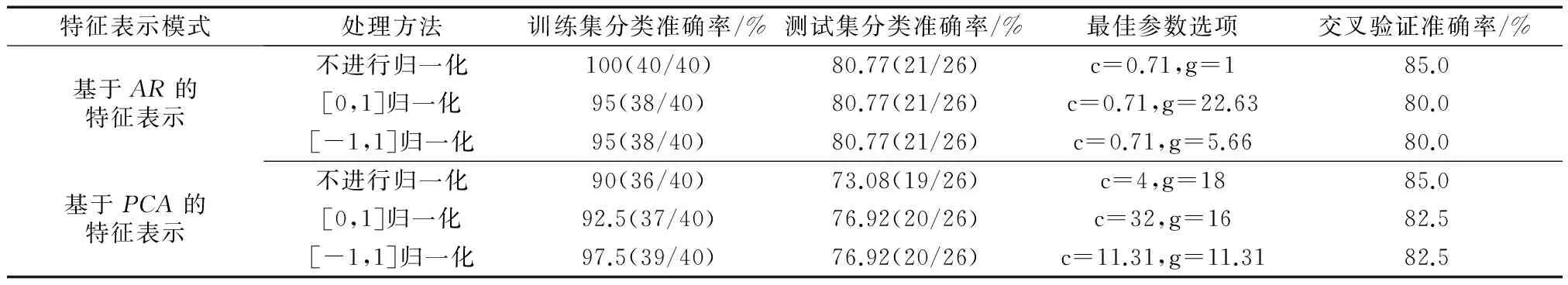
表1 fMRI时间序列数据特征提取的实验结果
从表1中可看出,在使用相同参数设置和归一化预处理的情况下,基于AR模型和基于PCA方法的特征属性表示都能够获得较高的分类预测准确率,而基于AR模型的特征属性表示在不经归一化处理的情况下,其分类预测准确率和交叉验证准确率均为最高,且训练集能够被100%正确分类,故不经归一化的基于AR模型的特征样本数据更有利于分类模型的训练,能够更有效地表达样本的特征属性.同时,也表明是否需要进行归一化预处理往往因样本数据而异,选择哪种归一化方式并非必须.因此,本文实验均以不经归一化的基于AR模型的特征数据作为样本集,对于每个样本最终都能够提取出7个属性值代替最初的7个多维时间序列.有关基于AR模型的特征样本数据的box可视化图,如图2所示.
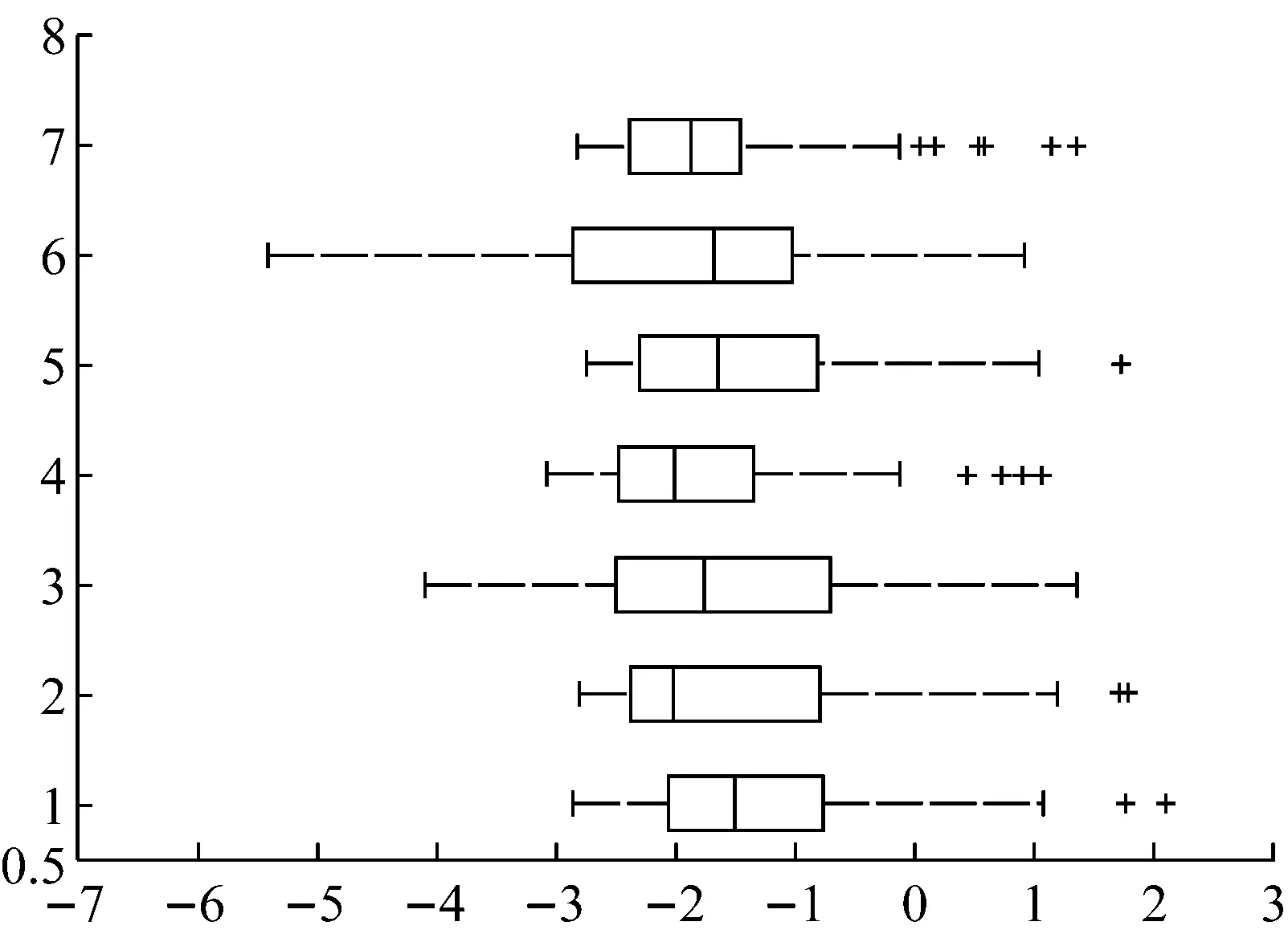
图2 基于AR模型特征样本数据的box可视化图
Fig.2TheboxvisualfigurebasingonthecharacteristicssampledataoftheARmodel
5.3针对fMRI时间序列优化分类模型的相关实验
针对所构建的基于PSO-SVM的fMRI时间序列优化分类模型,在PSO算法优化参数选择方面,考虑到编码方式和适应度评价函数两个关键问题,编码方式选择采用实数编码,适应度函数值则取针对训练集进行交叉验证意义下的准确率.其中,设定PSO参数局部搜索能力初始值c1为1.5,全局搜索能力初始值c2为1.7,最大进化数量初始值为200,种群最大数量为20,速率和参数关系为0.6,速率更新速度弹性系数为1,种群更新速度弹性系数为1.有关基于SVM模型的分类机制,其决策惩罚参数c的最大值设置为25,最小值为2-5;核参数g的最大值设置为25,最小值为2-5.有关fMRI时间序列数据优化分类的相关实验统计结果,见表2.从表2中可看出,十次随机实验中平均预测准确率达到82.69%,十次中仅一次相对稍低为76.92%,且十次交叉验证准确率为87.50%.由此可观测到,基于SVM的分类模型在解决面向小样本fMRI时间序列数据的分类诊断问题上具有良好分类性能,且其惩罚参数和相关核函数参数的优选对于分类性能至关重要.在同一样本数据及参数范围内,基于PSO算法参数寻优来搜索最佳参数的SVM分类性能表现良好.基于PSO-SVM的fMRI时间序列数据分类诊断机制能够正确识别患病组和正常组,尽管训练样本并非大规模,测试集有噪声等不确定因素影响,依然取得82.69%的平均分类准确率,再次表明该分类诊断模型在具体病症预测与识别中的实用性和有效性.
表2fMRI时间序列优化分类模型的实验结果
Tab.2TheexperimentalresultsoftheoptimizationclassificationmodelofthefMRItimeseries
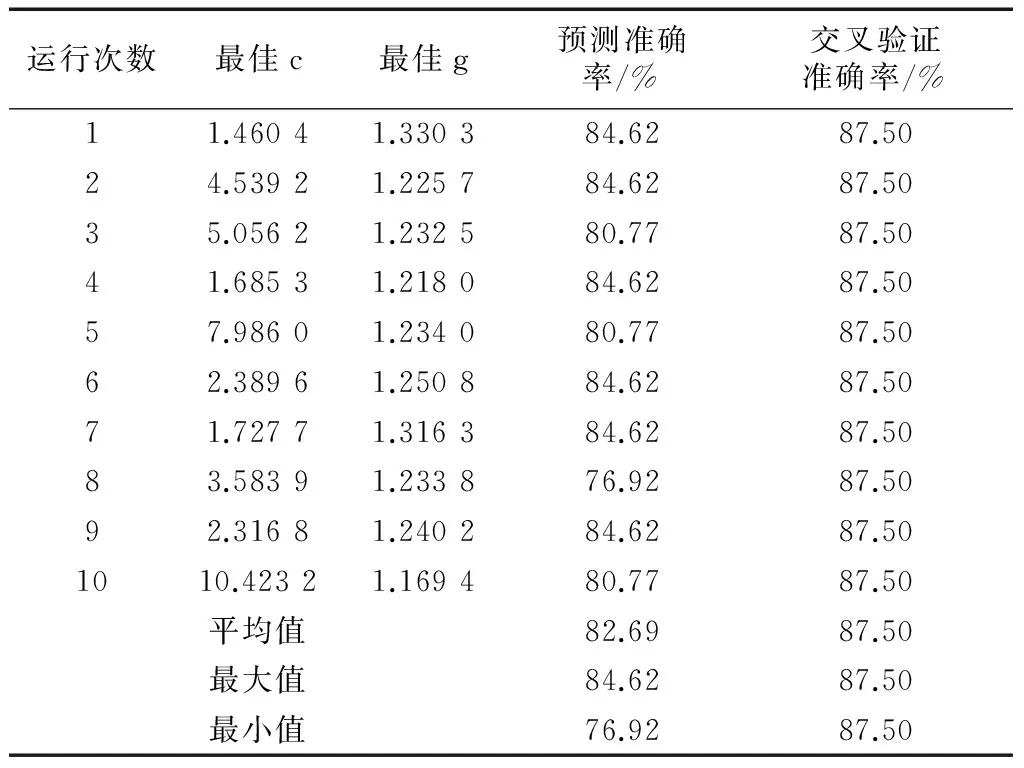
运行次数最佳c最佳g预测准确率/%交叉验证准确率/%11.46041.330384.6287.5024.53921.225784.6287.5035.05621.232580.7787.5041.68531.218084.6287.5057.98601.234080.7787.5062.38961.250884.6287.5071.72771.316384.6287.5083.58391.233876.9287.5092.31681.240284.6287.501010.42321.169480.7787.50平均值82.6987.50最大值84.6287.50最小值76.9287.50
另外,为进一步说明基于PSO算法的分类参数优化策略的优势,有关第7次运行中寻找最佳参数设置的适应度曲线如图3所示.从图3中可明显观察到,种群的平均适应度大都在81%以上,最佳适应度稳定在87.5%.在相同的参数范围内,基于PSO算法进行参数寻优的分类性能较为理想,能够找到更好的惩罚参数c和核参数g使分类准确率提高至84.62%,其相应平均最佳适应度提高2.94%,测试集分类准确率提高2.38%.因此,利用基于PSO算法的分类参数优化,最终可得到多组分类参数c和g的最优组合.但需要注意的是,由于惩罚因子c用于控制模型复杂度和逼近误差,其值越大则对数据的拟合程度越高,这将导致泛化能力降低,因此往往取
c值最小且预测准确率最高的分类参数组合(参数c1=1.5,c2=1.7,终止代数为200,种群数量POD=30).

图3 PSO算法寻找最优参数的适应度曲线
5.4针对不同优化分类机制的对比实验
为进一步展现所提出基于PSO-SVM的fMRI时间序列数据分类诊断模型的优势,也开展有关针对不同优化分类机制的对比实验.融合网格搜索(gridsearch)与SVM的优化分类模型是一种应用比较广泛的分类机制,其参数优化方法建立在交叉验证的基础上,利用设定的参数最大值和最小值确定一个网格作为搜索范围,在该范围内按照初始设定的步长寻找使得交叉验证准确率最高的参数组合,确定最佳参数设置后即可对SVM分类模型进行训练和分类[11].从整体架构上来讲,该模型与本文所提出基于PSO-SVM的优化分类模型比较类似,有关两者分类性能的相关对比实验统计结果,见表3.

表3 两种不同优化分类模型的实验结果对比
从表3中可看出,基于PSO-SVM优化分类模型分类性能显著高于融合网格搜索与SVM的优化分类模型分类性能,交叉验证准确率从后者的85%提高至前者的87.50%.在融合网格搜索与SVM的优化分类模型中,利用参数寻优策略所获得最佳参数设置c=0.71,g=1,基于整体测试集针对患者组和健康组的分类准确率为80.77%.在基于PSO-SVM的优化分类模型中,利用参数寻优策略所获得最佳参数设置c=1.46,g=1.33,基于整体测试集针对患者组和健康组的分类准确率提高至84.62%,同融合网格搜索与SVM的优化分类模型相比较分类准确率提高2.38%,而通常现实生活中对于抑郁症的正确识别率只有70%左右.实验结果表明所提出的基于PSO-SVM优化分类模型比融合网格搜索与SVM的优化分类模型更胜一筹,同时也反映使用PSO算法进行SVM参数选优的可行性与合理性.基于PSO-SVM优化分类机制是针对fMRI时间序列数据与具体病症之间关联决策的较好途径,可有效支持这类特殊时间序列数据信息的准确分类判别.
6 结论
本文主要介绍在基于PSO-SVM的fMRI时间序列分类诊断方面所做的一些研究工作,其中提出以基于SVM的分类模型为基本框架,同时结合基于AR模型的特征表示与基于PSO算法的参数优化处理来实现fMRI时间序列数据的自动预测与分类.从目前的实验结果来看,已达到比较令人满意的效果.该模型除表明统计学习的独特优势之外,同时也表明在统计学习方法基础上,适当应用时间序列数据相关的特有属性信息与启发式寻优策略,是提高fMRI时间序列分类诊断性能的有效方式.目前,脑区多维时间序列样本集还有待于扩充,同时为更为丰富优化分类过程中所利用的特征属性信息,也要进一步深入考虑新建形式的特征模板来反映和揭示多脑区时间序列所包含的时空信息,在更大程度上提高模型化与关联度.上述这些方面都将成为在未来研究工作中所要关注的问题.
[1]GuoH,CaoXH,LiuZF, et al.Machinelearningclassifierusingabnormalbrainnetworktopologicalmetricsinmajordepressivedisorder[J].Neuroreport, 2012, 23(17): 1006.
[2]KlöppelS,StonningtonCM,ChuC, et al.AutomaticclassificationofMRscansinAlzheimer'sdisease[J].Brain, 2008, 131(3): 681.
[3]LiY,WangY,WuG,et al.DiscriminantanalysisoflongitudinalcorticalthicknesschangesinAhheimer’sdiseaseusingdynamicandnetworkfeatures[J].NeurobiologyofAging, 2012, 33(2): 427.e15.
[4]KamitaniY,TongF.Decodingthevisualandsubjectivecontentsofthehumanbrain[J].NatureNeuroscience, 2005, 8(5): 679.
[5]WeeCY,YapPT,ZhangDQ, et al.IdentificationofMCIindividualsusingstructuralandfunctionalconnectivitynetworks[J].NeuroImage, 2012, 59(3): 2045.
[6]XieSY,GuoR,LiNF, et al.BrainfMRIprocessingandclassificationbasedoncombinationofPCAandSVM[C]∥Proceedingofthe2009InternationalJointConferenceonNeuralNetworks(IJCNN’09).Atlanta:IEEE, 2009: 3384-3389.
[7]NormanKA,PolynSM,DetreGJ, et al.Beyondmind-reading:multi-voxelpatternanalysisoffMRIdata[J].TrendsinCognitiveSciences. 2006, 10(9): 424.
[8]FuCH,Mourao-MirandaJ,CostafredaSG, et al.Patternclassificationofsadfacialprocessing:towardthedevelopmentofneurobiologicalmarkersindepression[J].Biologicalpsychiatry, 2008, 63(7): 656.
[9]ChupinM,GerardinE,CuingnetR, et al.FullyautomatichippocampussegmentationandclassificationinAlzheimer’sdiseaseandmildcognitiveimpairmentappliedondatafromADNI[J].Hippocampus, 2009, 19(6): 579.
[10]GongQ,WuQ,ScarpazzaC, et al.Prognosticpredictionoftherapeuticresponseindepressionusinghigh-fieldMRimaging[J].Neuroimage, 2011, 55(4): 1497.
[11]相洁, 陈俊杰. 基于SVM的fMRI数据分类: 一种解码思维的方法 [J]. 计算机研究与发展, 2010, 47(2): 286.
XIANGJie,CHENJunjie.SVMbasedfMRIdataclassification:anapproachtodecodementalstate[J].JournalofComputerResearchandDevelopment, 2010, 47(2): 286.
[12]BanerjeeTP,DasS.Multi-sensordatafusionusingsupportvectormachineformotorfaultdetection[J].InformationSciences, 2012, 217: 96.
[13]deMoraesRM,dosSantosMachadoL.OnlineassessmentinmedicalsimulatorsbasedonvirtualrealityusingfuzzyGaussiannaivebayes[J].Multiple-ValuedLogicandSoftComputing, 2012,18(5-6): 479.
[14]PereiraF,MitchellT,BotvinickM.MachinelearningclassifiersandfMPJ:atutorialoverview[J].Neuroimage, 2009, 45(1): 199.
[15]FeisDL,BrodersenKayH,vonCramonDY, et al.DecodinggenderdimorphismofthehumanbrainusingmultimodalanatomicalanddiffusionMRIdata[J].Neuroimage, 2013, 70: 250.
[16]MuellerSG,YoungK,HartigM, et al.Atwo-levelmultimodalityimagingBayesiannetworkapproachforclassificationofpartialepilepsy:preliminarydata[J].Neuroimage, 2013, 71: 224.
[17]CalhounVD,MaciejewskiPK,PearlsonGD, et al.Temporallobeand“default”hemodynamicbrainmodesdiscriminatebetweenschizophreniaandbipolardisorder[J].HumBrainMapp, 2008, 29(11): 1265.
[18]DavatzikosC,ShenD,GurRC, et al.Whole-brainmorphometricstudyofschizophreniarevealingaspatiallycomplexsetoffocalabnormalities[J].ArchGenPsychiatry, 2005, 62(11): 1218.
TimeSeriesClassificationDiagnosisModelbasedonParticalSwarmOptimizationandSupportVectorMachine
ZHANGTao1,3,ZHANGMinghui1,LIQingwei2,ZHANGYuejie4
(1.SchoolofInformationManagementandEngineering,ShanghaiUniversityofFinanceandEconomics,Shanghai200433,China; 2.DepartmentofPsychiatry,TongjiHospitalofTongjiUniversity,Shanghai200065,China; 3.ShanghaiKeyLaboratoryofFinancialInformationTechnology(ShanghaiUniversityofFinanceandEconomics),Shanghai200433,China; 4.SchoolofComputerScience,ShanghaiKeyLaboratoryofIntelligentInformationProcessing,FudanUniversity,Shanghai200433,China)
ThispaperpresentsafMRItime-seriesclassificationdiagnosismodelbasedonparticleswarmoptimization-supportvectormachine(PSO-SVM),whichachievesmoreaccuratejudgmentsanddistinctionsbetweenpatientsandhealthyindividualsbydeeplyanalyzingmulti-dimensionaltime-seriesdataofbrainregions.Thisapproachissignificantlydifferentfromtheotherexistingrelatedresearchworkinfouraspectsasfollows:Constructingthefeaturerepresentationformulti-dimensionaltime-seriesdataofbrainregionsbasedontheauto-regressive(AR)model;Constructingtheclassificationschemeformulti-dimensionaltime-seriesofbrainregionsbasedonthesupportvectormachine(SVM)model;Constructingtheparameteroptimizationstrategyfortheclassificationlearningbasedontheparticleswarmoptimization(PSO)algorithm;ConstructingtheclassificationdiagnosisframeworkforfMRItime-seriesdatabyintegratingtheabovefeaturerepresentation,optimizedclassificationandparameteroptimizationpatterns.Withthementaldepressiondisorder(MDD)asaspecificcaseofempiricalanalysis,ourclassificationdiagnosismodelhasobtainedverypositivenumericalcomputationresults.
fMRImulti-dimensionaltimeseries;classificationdiagnosis;auto-regressive(AR)model;supportvectormachine(SVM);particleswarmoptimization(PSO)
2015-07-12
国家自然科学基金(71171126, 61572140); 教育部高等学校博士学科点专项科研基金(20130078110001); 上海市科学技术委员会科技创新行动计划资助项目(16511104704); 同济大学青年优秀人才培养计划(1508-219-040).
张涛(1970—), 男, 工学博士,教授, 博士生导师, 主要研究方向为数据挖掘、物流建模与优化、智能优化算法.
E-mail:taozhang@mail.shufe.edu.cn
李清伟(1977—), 男, 医学博士, 副主任医师, 主要研究方向为神经影像学、智能诊断.E-mail:lianocd@tongji.edu.cn
TP391
A

