白介素17基因启动子区CpG岛甲基化与宫颈癌的相关性研究
袁 陆,张丽杰,李 鸥,杨艳艳,张 琪,王新月,耿美丽,姜春阳,王 洋,马 冬
·论著·
·专题研究·
白介素17基因启动子区CpG岛甲基化与宫颈癌的相关性研究
袁 陆,张丽杰,李 鸥,杨艳艳,张 琪,王新月,耿美丽,姜春阳,王 洋,马 冬
目的探讨白介素17(IL-17)基因启动子区CpG岛甲基化与宫颈癌的相关性,为临床诊断和免疫治疗宫颈癌提供新思路。方法选取2011年3月—2012年5月在唐山工人医院住院部就诊的宫颈癌患者43例(宫颈癌组)、癌前病变患者62例〔其中宫颈上皮内瘤变(CIN)Ⅰ级23例(CINⅠ组)、CINⅡ~Ⅲ级39例(CINⅡ~Ⅲ组)〕,另选取本院同期因子宫肌瘤行全子宫切除术的患者43例作为对照组。4组患者宫颈组织标本均经手术获得。提取4组宫颈组织DNA并进行高危型人乳头瘤病毒(HPV)16 DNA检测,采用CpG岛甲基化特异性PCR(MSP)法检测IL-17基因启动子区CpG岛甲基化状态,采用半定量反转录PCR(RT-PCR)法检测IL-17 mRNA表达水平,分析IL-17基因启动子区CpG岛甲基化率与IL-17 mRNA表达水平的相关性及其与HPV16 DNA阳性率的关联性,并分析不同年龄、临床特征宫颈癌患者IL-17基因启动子区CpG岛甲基化率。结果4组HPV16 DNA阳性率比较,差异有统计学意义(P<0.001)。CINⅡ~Ⅲ组、宫颈癌组IL-17基因启动子区CpG岛甲基化率低于对照组(P<0.01);CINⅠ组与对照组、CINⅡ~Ⅲ组、宫颈癌组IL-17基因启动子区CpG岛甲基化率比较,差异无统计学意义(P>0.05);CINⅡ~Ⅲ组与宫颈癌组IL-17基因启动子区CpG岛甲基化率比较,差异无统计学意义(P>0.05)。CINⅠ组、CINⅡ~Ⅲ组和宫颈癌组IL-17 mRNA表达水平均高于对照组(P<0.05);CINⅠ组与CINⅡ~Ⅲ组、宫颈癌组IL-17 mRNA表达水平比较,差异无统计学意义(P>0.05);CINⅡ~Ⅲ组与宫颈癌组IL-17 mRNA表达水平比较,差异无统计学意义(P>0.05)。根据IL-17基因启动子区CpG岛甲基化检测结果将所有患者分为IL-17基因启动子区CpG岛甲基化患者(93例)和非甲基化患者(55例),IL-17基因启动子区CpG岛非甲基化患者IL-17 mRNA表达水平高于甲基化患者(P<0.05)。所有患者宫颈组织中IL-17基因启动子区CpG岛甲基化率与IL-17 mRNA表达水平呈负相关(rs=-0.627,P<0.05)。所有患者宫颈组织中IL-17基因启动子区CpG岛甲基化率和HPV16 DNA感染阳性率存在关联性(χ2=33.209,P<0.05,r=-0.474)。临床分期为Ⅱ期、Ⅲ期的宫颈癌患者IL-17基因启动子区CpG岛甲基化率低于临床分期为Ⅰ期的宫颈癌患者(P<0.05);不同年龄、病理分级、肿瘤直径及有无淋巴结转移的宫颈癌患者IL-17基因启动子区CpG岛甲基化率比较,差异无统计学意义(P>0.05)。结论IL-17基因启动子区CpG岛甲基化与高危型HPV16感染具有关联性,IL-17基因启动子区CpG岛低甲基化可能与宫颈癌发生、发展存在相关性。
宫颈肿瘤;白细胞介素17;DNA甲基化;CpG岛;人乳头瘤病毒16
袁陆,张丽杰,李鸥,等.白介素17基因启动子区CpG岛甲基化与宫颈癌的相关性研究[J].中国全科医学,2016,19(27):3300-3305.[www.chinagp.net]
YUAN L,ZHANG L J,LI O,et al.Correlation between CpG island methylation in IL-17 gene promoter and cervical cancer[J].Chinese General Practice,2016,19(27):3300-3305.
高危型人乳头瘤病毒(HPV)持续感染在宫颈癌的发生、发展过程中起重要作用[1-2],同时宿主遗传、自身免疫反应[3-4]等因素对宫颈癌的发生、发展亦十分重要。白介素(IL)-17是一类促炎性细胞因子,主要由活化的CD4+T淋巴细胞产生,在调节辅助性T细胞(Th)1/Th2免疫平衡和清除细胞外病原体方面发挥重要作用,与自身免疫和肿瘤发生、发展密切相关[5]。相关临床研究显示,IL-17可能参与宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)的发生、发展过程[6]。CpG岛是指在基因组中长度为300~3 000 bp富含CpG二核苷酸的区域,启动子区CpG岛的甲基化状态是基因转录所必需的,而CpG序列中C的甲基化是导致基因转录被抑制的可能机制之一[7],但其在宫颈癌进展中的变化及临床意义尚未见报。本研究采用甲基化特异性PCR(MSP)法研究IL-17基因启动子区CpG岛甲基化状态,结合宫颈癌的临床病例特征与HPV检测结果,探讨IL-17基因启动子区CpG岛甲基化与宫颈癌的关系。
1 资料与方法
1.1纳入与排除标准纳入标准:(1)年龄28~69岁,临床资料及病理资料完整;(2)无子宫切除史;(3)纳入研究时未妊娠;(4)手术标本均经病理证实,且患者术前未行化疗、放疗或免疫治疗。排除标准:(1)术前3个月行阴道药物治疗及任何宫颈手术者;(2)卵巢癌、子宫内膜异位症、子宫内膜癌等患者;(4)存在供血不足的慢性疾病史:(5)肝硬化、肾衰竭、心血管疾病、有药物依赖者;(6)精神疾病患者。
1.2临床资料选取2011年3月—2012年5月在唐山工人医院住院部就诊的宫颈癌患者43例(宫颈癌组)、癌前病变患者62例〔其中CINⅠ级23例(CINⅠ组)、CINⅡ~Ⅲ级39例(CINⅡ~Ⅲ组)〕,另选取本院同期因子宫肌瘤行全子宫切除术的患者43例作为对照组。4组患者宫颈组织标本均经手术获得,于-80 ℃冰箱保存。宫颈癌患者的临床分期参照国际妇产科联盟子宫颈癌的临床分期标准[8],病理类型参照WHO制定的相关标准[9]。本研究经唐山工人医院伦理委员会批准,临床资料的收集和组织标本的采集均经研究对象知情同意。
1.3方法
1.3.1宫颈组织DNA的提取及HPV16 DNA检测[10]采用饱和酚三氯甲烷抽提法提取宫颈组织细胞DNA,PCR扩增HPV16 DNA基因片段,2%琼脂糖凝胶电泳检测PCR结果。
1.3.2MSP法检测IL-17基因启动子区CpG岛甲基化状态[7]按照EZ DNA Methylation-GoldTMKit试剂盒说明书对DNA进行甲基化修饰及纯化。检索NCBI(AY630567)IL-17基因序列,确定启动子区,采用Methyl Primer Express v1.0软件分析IL-17基因启动子区CpG岛并设计甲基化与非甲基化两对引物(由北京赛百盛基因技术有限公司合成)。IL-17启动子甲基化上游引物5′-TTTTTATGATTTTATTGGGGGC-3′,下游引物5′-ATAAACAAAATATAACGCTATCGTC-3′,产物长度138 bp。非甲基化上游引物5′-TTTATGATTTTATTGGGGGTGG-3′,下游引物5′-AATAAACAAAATATAACACTATCATC-3′,产物长度137 bp。PCR反应体系为2×Taq PCR Master Mix 12.5 μl,上下游引物(10 μmol/L)各3 μl,DNA模板2 μl,超纯水25 μl。PCR反应条件:95 ℃预热3 min,94 ℃变性45 s,55 ℃退火60 s,72 ℃延伸45 s,共35个循环;72 ℃延伸5 min,4 ℃保存。2%琼脂糖凝胶电泳。结果判定标准:电泳结果只出现非甲基化条带视为非甲基化结果;电泳结果同时出现甲基化和非甲基化条带或只出现甲基化条带视为甲基化结果。PCR产物送北京赛百盛基因技术有限公司进行测序,验证甲基化或非甲基化检测结果。
1.3.3半定量反转录PCR(RT-PCR)法检测IL-17mRNA表达水平Trizol法提取宫颈组织细胞总RNA,人IL-17mRNA序列(NM 002190)下载自NCBI网站,采用Primer 5软件设计引物,由北京赛百盛基因技术有限公司合成,采用β-actin(其序列下载自NCBI网站)作为内参基因。IL-17mRNA上游引物5′-GAAGGCAGGAATCACAAT-3′,下游引物5′-AGCCCACGGACACCAGTA-3′,产物长度138 bp。β-actin上游引物5′-TGCCGACAGGATGCAGAAG-3′,下游引物5′-CTCAGGAGGAGCAATGATCTTGA-3′,产物长度76 bp。RT-PCR反应体系为2×Reaction Mix 25 μl,总RNA 1 μl,上下游引物(10 μmol/L)各1 μl,RT/Platinum®Taq Mix 1 μl,超纯水50 μl。RT-PCR反应条件:45 ℃反转录30 min,94 ℃预热2 min,进行1个循环;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min。共进行40个循环。1.5%琼脂糖凝胶电泳,行半定量分析,IL-17 mRNA与β-actin 的综合光密度(OD)比值代表相对表达水平。
2 结果
2.14组患者一般资料比较对照组、CINⅠ组、CINⅡ~Ⅲ组及宫颈癌组年龄、婚史、初潮年龄、经期时长、月经周期、流产次数、吸烟率、饮酒率比较,差异均无统计学意义(P>0.05,见表1)。
2.2HPV16 DNA检测结果对照组、CINⅠ组、CINⅡ~Ⅲ组、宫颈癌组HPV16 DNA阳性率分别为16.3%(7/43)、47.8%(11/23)、69.2%(27/39)、90.7%(39/43)。4组HPV16 DNA阳性率比较,差异有统计学意义(χ2=52.108,P<0.001)。
2.3IL-17基因启动子区CpG岛甲基化检测结果MSP检测结果见图1~2(本文图1~2彩图见本刊官网www.chinagp.net电子期刊相应文章附件)。对照组、CINⅠ组、CINⅡ~Ⅲ组、宫颈癌组IL-17基因启动子区CpG岛甲基化率分别为81.4%(35/43)、73.9%(17/23)、51.3%(20/39)和48.8%(21/43)。4组IL-17基因启动子区CpG岛甲基化率比较,差异有统计学意义(χ2=13.389,P=0.004)。其中CINⅡ~Ⅲ组、宫颈癌组IL-17基因启动子区CpG岛甲基化率低于对照组(χ2值分别为4.850、6.835,P<0.01);CINⅠ组与对照组、CINⅡ~Ⅲ组、宫颈癌组IL-17基因启动子区CpG岛甲基化率比较,差异无统计学意义(χ2值分别为1.319、0.606、1.235,P>0.05);CINⅡ~Ⅲ组与宫颈癌组IL-17基因启动子区CpG岛甲基化率比较,差异无统计学意义(χ2=0.150,P>0.05)。
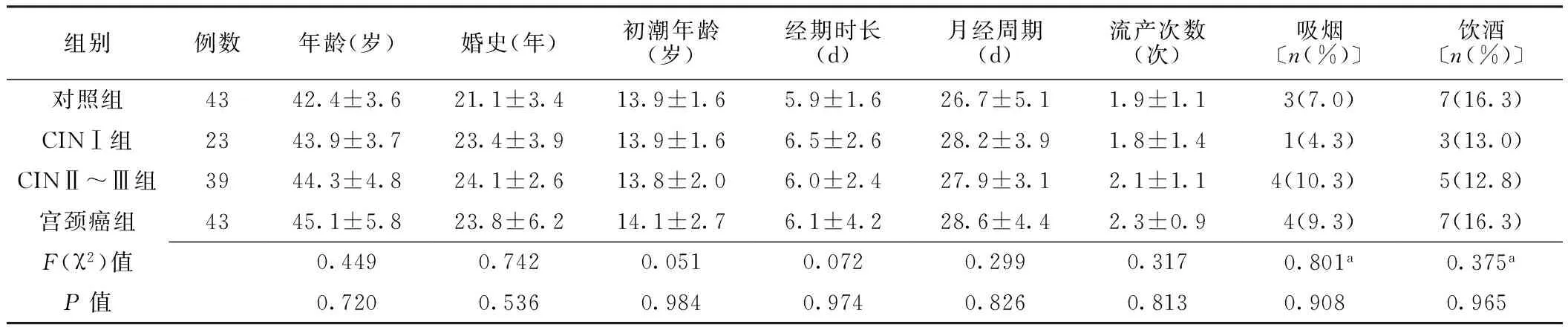
表1 4组患者一般资料比较
注:a为χ2值;CIN=宫颈上皮内瘤变;吸烟定义为每天吸烟至少1支,连续吸烟6个月以上;饮酒定义为每周饮酒至少1次(≥250 ml/次),连续6个月以上
2.4IL-17 mRNA表达水平比较对照组、CINⅠ组、CINⅡ~Ⅲ组及宫颈癌组IL-17 mRNA表达水平分别为(0.50±0.18)、(0.62±0.26)、(0.70±0.19)和(0.76±0.29)。4组IL-17 mRNA表达水平比较,差异有统计学意义(F=10.026,P<0.05)。其中CINⅠ组、CINⅡ~Ⅲ组和宫颈癌组IL-17 mRNA表达水平均高于对照组,差异有统计学意义(t值分别为-3.331、-2.584、-2.550,P<0.05);CINⅠ组与CINⅡ~Ⅲ组、宫颈癌组IL-17 mRNA表达水平比较,差异无统计学意义(t值分别为0.609、1.843,P>0.05);CINⅡ~Ⅲ组与宫颈癌组IL-17 mRNA表达水平比较,差异无统计学意义(t=1.117,P>0.05)。根据IL-17基因启动子区CpG岛甲基化检测结果将所有患者分为IL-17基因启动子区CpG岛甲基化患者(93例)和非甲基化患者(55例),其IL-17 mRNA表达水平分别为(0.50±0.16)、(0.90±0.17)。IL-17基因启动子区CpG岛非甲基化患者IL-17 mRNA表达水平高于甲基化患者,差异有统计学意义(t=13.928,P<0.05)。
2.5IL-17基因启动子区CpG岛甲基化率与IL-17 mRNA表达水平的相关性所有患者宫颈组织中IL-17基因启动子区CpG岛甲基化率为62.8%(93/148),IL-17 mRNA表达水平为(0.65±0.29)。所有患者宫颈组织中IL-17基因启动子区CpG岛甲基化率与IL-17 mRNA表达水平呈负相关(rs=-0.627,P<0.05)。
2.6IL-17基因启动子区CpG岛甲基化率与HPV16 DNA阳性率的关联性分析所有患者宫颈组织中IL-17基因启动子区CpG岛甲基化率和HPV16 DNA感染阳性率存在关联性(χ2=33.209,P<0.05,r=-0.474,见表2)。
2.7不同年龄和临床特征宫颈癌患者IL-17基因启动子区CpG岛甲基化率比较不同临床分期的宫颈癌患者IL-17基因启动子区CpG岛甲基化率比较,差异有统计学意义(P<0.05);其中临床分期为Ⅱ期、Ⅲ期的宫颈癌患者IL-17基因启动子区CpG岛甲基化率低于临床分期为Ⅰ期的宫颈癌患者,差异有统计学意义(P<0.05);不同年龄、病理分级、肿瘤直径及有无淋巴结转移的宫颈癌患者IL-17基因启动子区CpG岛甲基化率比较,差异均无统计学意义(P>0.05,见表3)。
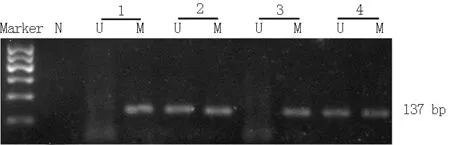
注:N为空白对照,1为对照组,2为宫颈癌组,3为CINⅠ组,4为CINⅡ~Ⅲ组,U表示非甲基化,M表示甲基化;CIN=宫颈上皮内瘤变
图1MSP法检测IL-17基因启动子区CpG岛甲基化状态的2%琼脂糖凝胶电泳结果
Figure 12% agarose gel electrophoresis results of CpG island methylation status in IL-17 gene promoter was detected by MSP
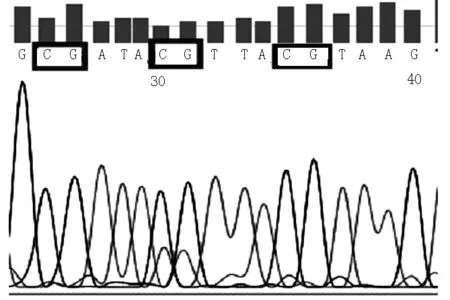
注:MSP=甲基化特异性PCR
图2MSP测序验证
Figure 2Sequencing verification of MSP
表2宫颈组织中IL-17基因启动子区CpG岛甲基化状态与HPV16 DNA感染的结果
Table 2Correlation between CpG island methylation status of IL-17 gene promoter and HPV16 DNA infection in cervical tissues
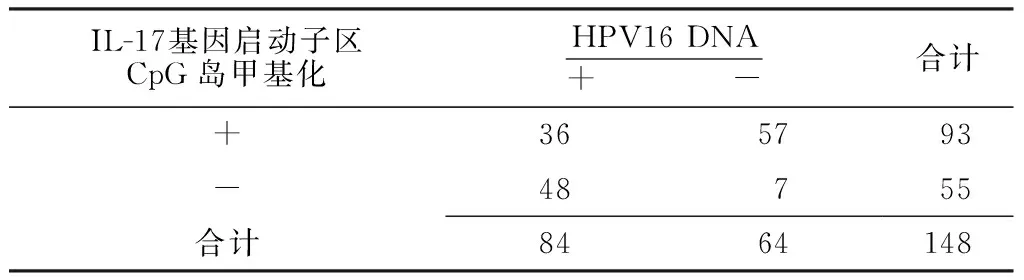
IL-17基因启动子区CpG岛甲基化HPV16DNA+ -合计+3657 93 -48 7 55 合计8464148
注:IL-17=白介素17;HPV=人乳头瘤病毒
表3不同年龄和临床特征宫颈癌患者IL-17基因启动子区CpG岛甲基化率比较〔n(%)〕
Table 3Comparsion of CpG island methylation rate of IL-17 gene promoter of cervical cancer patients in different ages and clinical features
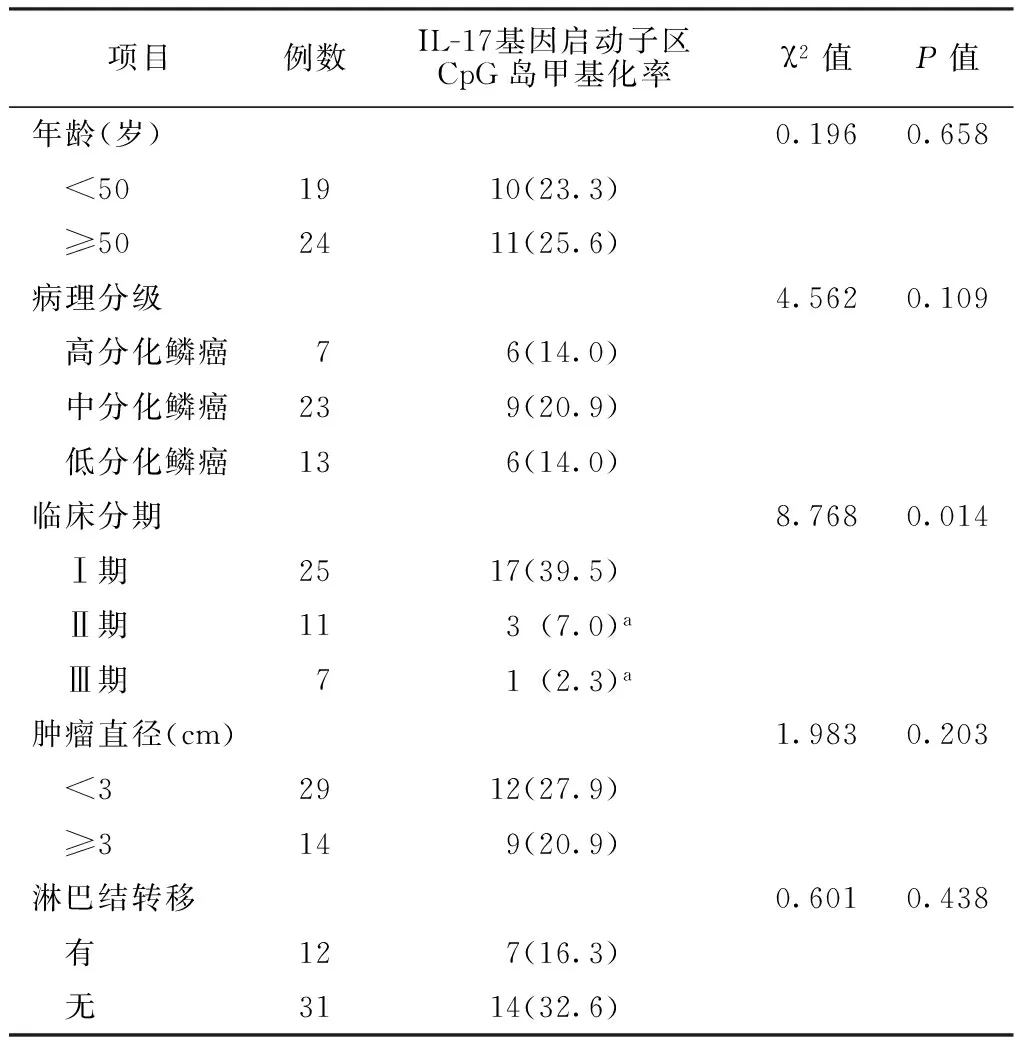
项目例数IL-17基因启动子区CpG岛甲基化率χ2值P值年龄(岁)0.1960.658 <501910(23.3) ≥502411(25.6)病理分级4.5620.109 高分化鳞癌76(14.0) 中分化鳞癌239(20.9) 低分化鳞癌136(14.0)临床分期8.7680.014 Ⅰ期2517(39.5) Ⅱ期113(7.0)a Ⅲ期71(2.3)a肿瘤直径(cm)1.9830.203 <32912(27.9) ≥3149(20.9)淋巴结转移0.6010.438 有127(16.3) 无3114(32.6)
注:病理分级及临床分期的两两比较采用Fisher′s确切概率法,其余采用χ2检验;与临床分期为Ⅰ期的患者比较,aP<0.05
3 讨论
宫颈癌是由慢性宫颈炎症经历各种癌前病变演变而成。高危型HPV持续感染是宫颈癌发病的主要影响因素,而单独HPV感染不足以引起宫颈癌。IL-17是主要由Th亚群分泌的促炎性细胞因子,具有强大的招募、激活中性粒细胞的功能,在促进细胞增殖及新生血管生成过程中发挥重要作用。目前,IL-17在宫颈癌变过程中发挥肿瘤促进作用还是抑制作用尚存在争议[11]。细胞因子DNA甲基化能改变肿瘤细胞的恶性程度[12]。HASHIMOTO等[13]研究证实,IL-8基因甲基化水平降低能促使IL-8水平升高,促进肿瘤的发生、发展。CAMPOS等[14]研究显示,干扰素γ(IFN-γ)基因甲基化水平升高能使具有病毒、抗肿瘤和免疫调节功能的IFN-γ水平下降,促使牙根尖肿物的形成。因此本研究从IL-17基因启动子区CpG岛甲基化角度探讨其在宫颈癌病变过程中的表达情况及其与高危型HPV感染的关系,为宫颈癌的发生、发展提供科学理论依据。
本研究结果显示,CINⅡ~Ⅲ组、宫颈癌组IL-17基因启动子区CpG岛甲基化率低于对照组;CINⅠ组、CINⅡ~Ⅲ组、宫颈癌组IL-17 mRNA表达水平均高于对照组,且IL-17基因启动子区CpG岛甲基化率与IL-17mRNA表达水平呈负相关,IL-17基因启动子区CpG岛甲基化率和HPV 16 DNA感染阳性率存在关联性。因此推测IL-17在宫颈癌变过程中发挥肿瘤促进作用,分析原因为:IL-17一方面可以促进宫颈癌细胞分泌IL-6和IL-8,协同促进肿瘤细胞的生长,加速肿瘤周围血管的形成;另一方面与存在于细胞膜上的跨膜蛋白白介素17受体C(IL-17RC)特异性结合,激活多条信号转导通路,促进肿瘤细胞的生长与增殖。青文婕等[15]研究表明,在裸鼠体内植入人宫颈癌细胞,发现IL-17可促进人宫颈癌细胞增生,在肿瘤部位促进IL-6分泌,激活巨噬细胞浸润及抑制抗肿瘤功能。IL-17可促进人宫颈癌细胞增长,使肿瘤体积明显增大。邓康丽[16]的研究亦表明,IL-17能促进人宫颈癌HeLa细胞株的体外增殖、抑制人宫颈癌HeLa细胞的凋亡。IL-17RC启动子区CpG岛的低甲基化在眼局部炎症、渗出、新生血管形成的过程中发挥了一定作用[17]。同时BENARD等[18]、张哲雄等[19]和薛纪森等[20]研究均表明,HPV感染阳性患者、宫颈癌患者的IL-17水平均较HPV阴性患者明显增高,提示IL-17与宫颈癌的发生、发展存在一定关系,本研究亦证实该观点。因此本研究认为,IL-17基因启动子区CpG岛的低甲基化状态可能与HPV感染协同促进了宫颈癌的发生、发展。但由于本研究样本量较少,且本研究仅针对唐山地区妇女,因此可能存在一定偏倚,仍需以后继续扩大样本量及地域范围深入研究。
分析宫颈癌患者IL-17基因启动子区CpG岛甲基化率与年龄、临床特征的关系,结果显示,IL-17基因启动子区CpG岛的甲基化率与年龄、病理分级、肿瘤直径、淋巴结状态无关,但与临床分期存在一定联系,提示IL-17基因启动子区CpG岛甲基化与宫颈癌的恶性进展可能有关。宋利[21]研究亦证实IL-17表达水平和宫颈癌的临床分期有关,宫颈癌晚期患者的IL-17表达水平高于宫颈癌早期患者,而IL-17基因启动子区CpG岛甲基化水平的降低是其表达水平升高的重要因素。IL-17基因启动子区CpG岛的低甲基化可能是促使宫颈癌病情进展的一个重要因素,IL-17基因启动子区CpG岛甲基化率可作为预测宫颈癌预后的早期指标。
综上所述,宫颈癌组织IL-17基因启动子区CpG岛甲基化率与IL-17 mRNA表达水平呈负相关,与HPV16 DNA阳性率存在关联性,推测IL-17基因启动子区CpG岛低甲基化状态可抑制宫颈癌患者免疫功能,为临床诊断和免疫治疗宫颈癌提供参考。
作者贡献:袁陆进行试验设计与实施、撰写论文、成文并对文章负责;张丽杰、李鸥、杨艳艳、张琪、王新月、耿美丽、王洋进行试验实施、资料收集,姜春阳进行文章评估,马冬进行质量控制及审校。
本文无利益冲突。
[1]DIMAIO D,LIAO J B.Human papillomaviruses and cervical cancer[J].Adv Virus Res,2006,66:125-159.
[2]薛旻,俞文菊,朱凯.宫颈癌及癌前病变中IL-17表达和HPV感染的相关性研究[J].中华肿瘤防治杂志,2011,18(9):701-703.
XUE M,YU W J,ZHU K.Expression of IL-10 in cervical cancer and precancerous lesion and its correlation with HPV infection[J].Chinese Journal of Cancer Prevention and Treatment,2011,18(9):701-703.
[3]WOODMAN C B,COLLINS S I,YOUNG L S.The natural history of cervical HPV infection:unresolved issues[J].Nat Rev Cancer,2007,7(1):11-22.
[4]SHEU B C,CHANG W C,LIN H H,et al.Immune concept of human papillomaviruses and related antigens in local cancer milieu of human cervical neoplasia[J].J Obstet Gynaecol Res,2007,33(2):103-113.
[5]杨丽娟.Th17 细胞抗肿瘤作用及其机制研究[D].石家庄:河北医科大学,2010.
[6]童丹,宋文静.IL-17、IL-6和TGF-β1在宫颈上皮内瘤变和宫颈癌中的表达及临床意义[J].中国妇幼保健,2014,29(24):3984-3986.
TONG D,SONG W J.Expressions and clinical significances of IL-17,IL-6 and TGF-β1 in cervical intraepithelial neoplasia and cervical cancer[J].Maternal & Child Health Care of China,2014,29(24):3984-3986.
[7]DAS P M,SINGAL R.DNA methylation and cancer[J].J Clin Oncol,2004,22(22):4632-4642.
[8]谢幸,苟文丽.妇产科学[M].北京:人民卫生出版社,2013:306-307.
[9]朱雄增.学习和掌握肿瘤的WHO分类,提高病理诊断和研究的水平[J].中华病理学杂志,2006,35(11):646-650.
ZHU X Z.Understanding WHO classification of tumors[J].Chinese Journal of Pathology,2006,35(11):646-650.
[10]马冬,于晓牧,吴尚青,等.IL-10-592多态性与唐山地区汉族女性HPV相关性宫颈癌[J].中国妇幼保健,2011,26(2):172-175.
MA D,YU X M,WU S Q,et al.Study on IL-10-592A/C polymorphism in high risk-HPV16/18-associated cervical carcinoma in Tangshan[J].Maternal & Child Health Care of China,2011,26(2):172-175.
[11]WILKE C M,KRYCZEK I,WEI S,et al.Th17 cells in cancer:help or hindrance?[J].Carcinogenesis,2011,32(5):643-649.
[12]CHERNOV A V,STRONGIN A Y.Epigenetic regulation of matrix metalloproteinases and their collagen substrates in cancer[J].Biomol Concepts,2011,2(3):135-147.
[13]HASHIMOTO K,OTERO M,IMAGAWA K,et al.Regulated transcription of human matrix metalloproteinase 13 (MMP 13) and interleukin-1β(IL1B) genes in chondrocytes depends on methylation of specific proximal promoter CpG sites[J].J Biol Chem,2013,288(19):10061-10072.
[14]CAMPOS K,GOMES C C,DE FTIMA CORREIA-SILVA J,et al.Methylation pattern of IFNG in periapical granulomas and radicular cysts[J].J Endod,2013,39(4):493-496.
[15]青文婕,吕莎,侯倩男,等.白细胞介素-17 在妇科肿瘤中的研究进展[J].中华妇幼临床医学杂志(电子版),2010,6(5):363-366.
QING W J,LYU S,HOU Q N,et al.Updated progress of interleukin-17 in gynecological tumors[J].Chinese Journal of Obstetrics & Gynecology and Pediatrics(Electronic Edition),2010,6(5):363-366.
[16]邓康丽.IL-17对人宫颈癌细胞株HeLa体外增殖的影响及作用机制的研究[D].长春:吉林大学,2013.
[17]吴文婷.IL-17RC低甲基化影响葡萄膜炎的机制研究及中药治疗葡萄膜炎的临床体会[D].北京:北京中医药大学,2014.
[18]BENARD V B,WATSON M,CASTLE P E,et al.Cervical carcinoma rates among young females in the United States[J].Obstet Gynecol,2012,120(5):1117-1123.
[19]张哲雄,徐承来,曹永涛.高危型人乳头状病毒和IL-17在宫颈病变患者宫颈脱落细胞中表达的相关性和临床意义[J].中国实验诊断学,2012,16(2):252-254.
ZHANG Z X,XU C L,CAO Y T.Correlations between human papillomavirus testing and Interleukin-17 in cervical exfoliated cells with cervical cancer and its clinical significonce[J].Chinese Journal of Laboratory Diagnosis,2012,16(2):252-254.
[20]薛纪森,陈骋,朱华,等.IL-17 在高危型HPV阳性宫颈癌中的表达[J].温州医科大学学报,2016,46(1):24-27.
XUE J S,CHEN C,ZHU H,et al.The expression of IL-17 in the cervical cancer with high-risk human papillomavirus infection[J].Journal of Wenzhou Medical University,2016,46(1):24-27.
[21]宋利.宫颈癌患者血清中IL-17水平的检测及临床意义[J].现代预防医学,2012,39(19):4966-4967.
SONG L.Detection and clinical significance of cervical cancer patients′ serum IL-17 level[J].Modern Preventive Medicine,2012,39(19):4966-4967.
(本文编辑:毛亚敏)
Correlation between CpG Island Methylation in IL-17 Gene Promoter and Cervical Cancer
YUANLu,ZHANGLi-jie,LIOu,YANGYan-yan,ZHANGQi,WANGXin-yue,GENGMei-li,JIANGChun-yang,WANGYang,MADong.
NorthChinaUniversityofScienceandTechnology,KeyLaboratoryofHebeiCoalOccupationalHealthandSafety,Tangshan063000,ChinaCorrespondingauthor:MADong,NorthChinaUniversityofScienceandTechnology,KeyLaboratoryofHebeiCoalOccupationalHealthandSafety,Tangshan063000,China;E-mail:mamamadong@163.com
ObjectiveTo investigate the correlation between CpG island methylation of IL-17 gene promoter and cervical cancer,and to provide new ideas for clinical diagnosis and immunotherapy of cervical cancer.Methods43 cervical cancer patients (cervical cancer group) and 62 patients with precancerous lesions〔23 cases with CINⅠ(CINⅠ group),39 cases with CINⅡ~Ⅲ(CINⅡ~Ⅲ group)〕 who received treatment in Inpatient Department of Tangshan Gongren Hospital from March 2011 to May 2012 were selected,and another 43 patients who had undergone total abdominal hysterectomy in this hospital at the same period due to uterine fibroids were enrolled as control group.Cervical tissue specimens of patients in four groups were obtained by surgery.DNA in cervical tissue of patients in four group was extracted to make a detection of HPV16 DNA,CpG island methylation status in IL-17 gene promoter was detected by using CpG island methylation specific PCR (MSP),IL-17 mRNA expression levels were detected by semi-quantitative reverse transcription PCR (RT-PCR),correlation between CpG island methylation rate of IL-17 gene promoter and IL-17 mRNA expression levels,and the relevance of this rate to the positive rate of HPV16 DNA were analyzed,and CpG island methylation status of IL-17 gene promoter in cervical cancer patients of different ages and clinical features were also analyzed.ResultsHPV16 DNA positive rates in four groups were significantly different (P<0.001).CpG island methylation rate of IL-17 gene promoter in CINⅡ~Ⅲ group and cervical cancer group was significantly lower than that in control group(P<0.01);CpG island methylation rates of IL-17 gene promoter in CINⅠ group and control group,CINⅠ group,CINⅡ~Ⅲ group,cervical cancer group were not significantly different (P> 0.05);CpG island methylation rates of IL-17 gene promoter between CINⅠgroup and CINⅡ~Ⅲ group were not significantly different (P>0.05).The expression levels of IL-17 mRNA in CINⅠ group,CINⅡ~Ⅲ group and cervical cancer group were higher than those in control group (P<0.05);the expression levels of IL-17 mRNA in CINⅠgroup,CINⅡ~Ⅲ group and cervical cancer group was not significantly different (P>0.05);the expression level of IL-17 mRNA between CINⅡ~Ⅲ group and cervical cancer group was not significantly different (P>0.05).According to the detected results of CpG island methylation in IL-17 gene promoter,all patients were divided into patients with CpG island methylation of IL-17 gene promoter (93 cases) and non-methylation patients (55 cases),IL-17 mRNA expression level of patients with CpG island non-methylation in IL-17 gene promoter was higher than that in methylation patients (P<0.05).In all patients′ cervical tissues,CpG island methylation rate of IL-17 gene promoter was negatively correlated with its mRNA expression level(rs=-0.627,P<0.05).There was correlation between CpG island methylation rate of IL-17 gene promoter in all patients′ cervical tissue and infection positive rates of HPV16 DNA (χ2=33.209,P<0.05,r=-0.474).CpG island methylation rate of IL-17 gene promoter in cervical cancer patients at Ⅱ and Ⅲ clinical stages were lower than that of patients at Ⅰ clinical stage (P<0.05);CpG island methylation rates of IL-17 gene promoter among cervical cancer patients of different ages,pathological grading,tumor diameter,and with or without lymph node metastasis were not significantly different (P>0.05).ConclusionCpG island methylation of IL-17 gene promoter is related with high-risk HPV16 infection,CpG island methylation of IL-17 gene promoter may be associated with the occurrence and development of cervical cancer.
Uterine cervical neoplasms;Interleukin-17;DNA methylation;CpG islands;Human papillomavirus 16
国家自然科学基金资助项目(81541149);河北省青年科学自然基金(H 2016209046)
063000河北省唐山市,华北理工大学,河北省煤炭职业卫生与安全重点实验室(袁陆,张琪,王新月,王洋,马冬);唐山工人医院妇科(张丽杰,李鸥,杨艳艳,耿美丽);天津市人民医院胸外科(姜春阳)
马冬,063000河北省唐山市,华北理工大学,河北省煤炭职业卫生与安全重点实验室;E-mail:mamamadong@163.com
R 737.33
A
10.3969/j.issn.1007-9572.2016.27.009
2016-03-06;
2016-08-12)

