氧化苯砷体外对大鼠原代肝星状细胞活化的阻抑作用研究*
仝艳艳,李光明,邓怡林,石翠翠,黄福德,范建高
氧化苯砷体外对大鼠原代肝星状细胞活化的阻抑作用研究*
仝艳艳,李光明,邓怡林,石翠翠,黄福德,范建高
目的探讨氧化苯砷(PAO)对肝星状细胞(HSC)活化的影响。方法采用密度梯度离心法提取SD大鼠原代HSC,在倒置显微镜下观察HSC形态的改变;以25、50、100、150和200 nmol/L浓度PAO处理活化的HSC-T6细胞,以四甲基偶氮唑盐(MTT)法评估PAO的细胞毒性;分别以25、50、100 nmol/L浓度的PAO处理离体培养4 d的HSC 72 h,并设对照组,采用Western blot和Real-time PCR法检测各组细胞α-SMA和I型胶原mRNA和蛋白表达。结果原代HSC离体培养过程中α-SMA表达量逐渐升高,与培养1 d时(0.762±0.062)比,培养4 d时其α-SMA蛋白表达【(1.51±0.045),P<0.05】显著升高;PAO在25~100 nmo/L浓度范围内对活化的HSC无明显的细胞毒性,但能浓度依赖性抑制活化的HSC α-SMA和I型胶原mRNA水平和蛋白表达。结论离体培养4 d时,HSC呈初始活化状态。PAO在25~100 nmol/L范围可浓度依赖性地阻抑离体培养的HSC的自发激活,提示PAO有潜力成为一类新型的抗肝纤维化药物。
肝纤维化;肝星状细胞;氧化苯砷;体外
1 材料与方法
1.1动物、试剂和设备SPF级雄性SD大鼠,体质量400 g左右,由上海中医药大学实验动物中心提供,普通饲料喂养,自由饮水。PAO由中国科学研究院黄福德教授惠赠,用DMSO配制成10 mmol/L的原液,再用DPBS稀释成10 μmol/L的母液,用0.22 μm的无菌滤器过滤除菌,4℃保存备用。链酶蛋白酶、Ⅳ型胶原酶均购自美国Sigma公司;I型DNA酶购自Roche公司;Nycodenz购自挪威Axis-Shield公司;DMEM培养基和胎牛血清均购自美国Hydcm公司;D-Hank's缓冲液、Hank's缓冲液均购自上海碧云天生物科技公司;Chemi Doc XRS凝胶成像系统购自Bio-Rad公司;BCA试剂盒购自海门碧云天生物技术研究所;兔抗大鼠Tubulin单克隆抗体和小鼠抗大鼠PI4K单克隆抗体购自美国Sigma公司;抗α-SMA单克隆抗体、Goat-anti-Rabbit IgGHRP购自美国Santa Cruz公司;二抗检测试剂盒购自碧云天生物技术研究所;PCR引物由上海生工生物工程公司合成;6孔培养板、24孔培养板、96孔培养板购自美国Corning Costar公司。
1.2大鼠原代HSC分离及培养取SD大鼠,无菌条件下经戊巴比妥钠麻醉,门脉插管,以D-Hank's灌注冲洗,同时将肝脏游离;取出肝脏,置于无菌培养皿中切碎,去除筋膜,转入含0.5g/LⅣ型胶原酶和0.1g/L蛋白酶E的D-Hank's液中,37℃水浴,振荡消化。细胞悬液经过200目滤网细胞筛选,离心,DMEM冲洗3遍,在180 g/L Nycodenz行梯度离心,取中间云雾状细胞层[6],细胞计数,以含20%胎牛血清的DMEM培养液调整细胞数为1×105个/孔,接种于无包被的6孔塑料培养板上,置于37℃、体积分数5%CO2、95%潮湿空气的CO2培养箱中培养。24 h后更换培养液为含10%胎牛血清的DMEM培养液。根据细胞生长情况,每2~3 d换液。用倒置显微镜观察肝星状细胞的形态变化,抽提RNA和蛋白质。
1.3PAO有效浓度的筛选由于PAO具有较强的细胞毒性,因此需要预实验确定合适的药物浓度,以活化HSC。采用MTT法评估PAO对活化的HSC的毒性浓度阈值。分别以25、50、100、150和200 nmol/L 5种不同浓度的PAO处理贴壁培养的HSC-T6细胞(本室保持),同时设空白对照组,每个浓度设置6个复孔,孵育24 h,每孔加入5 mg/ ml的MTT 20 μl,37℃继续孵育4 h,弃MTT,加入DMSO150 μl,37℃孵育10 min,于波长562 nm 测OD值。综合评估PAO对HSC-T6细胞存活率的影响,细胞存活率=实验组OD/对照组OD× 100%。
1.4原代HSC α-SMA和I型胶原mRNA检测采用Real-time PCR法,提取原代HSC,以5×104个/孔接种于12孔板,每孔1 ml,每组设3个复孔;分别以25、50、100 nmol/L PAO处理培养第4 d的原代HSC,并设置空白对照组,作用72 h后收集细胞,提取细胞总RNA,经紫外分光光度计检测其纯度和定量。采用10 μl逆转录体系,包含5× PrimeScript RT Master Mix(for Real Time)Total RNA 2 μl,用RNase Free dH2O补至10 μl,将逆转录反应液置于ABI Veriti梯度PCR仪进行逆转录,逆转录条件设置如下:37℃15 min(反转录反应阶段),85℃5 s(反转录酶的失活反应阶段),单次循环,随后4℃维持。逆转反应结束后将cDNA产物置于-20℃中保存。根据GeneBank资料设计引物,用制备的标准品作模板,确定最佳反应体系和反应条件,采用SYBR Green-1荧光定量PCR扩增,以磷酸甘油醛脱氢酶(GAPDH)作为内参,PCR反应体系为20 μl,包含cDNA 2 μl,上下游引物(10 μmol/L)各1 μl,SYBR Premix Ex Taq(2×)10 μl,用DEPC水补至20 μl。在ABI 7500 Real-time PCR仪设置反应程序为:预变性95℃30 s,1个循环,PCR扩增反应95℃5 s,40个循环,60℃34 s,40个循环,95℃15 s,1个循环。各样品目的基因和内参基因分别进行扩增反应。各样品目的基因和内参基因的扩增曲线在扩增反应结束后有机器直接生成。GAPDH引物:上游:5'-GAG GAC CAG GTT GTC TCC TG-3',下游:5'-GGA TGG ATT GTG AGG GAG A-3';α-SMA引物:上游: 5'-GGT GAA ACT CTG GAG ATC CT-3',下游:5'-AAT GGC ATC TGT GTC AAC C-3';I型胶原引物:上游:5'-CAG GCT GGT GTG ATG GGA TT-3',下游:5'-CCA AGG TCT CCA GGA ACAC C-3'。
1.5原代HSC α-SMA蛋白表达检测采用Western-blot法,取原代HSC,以5×104个/孔接种于12孔板,每孔1 ml,每组设3个复孔;分别以25、50、100 nmol/L PAO处理培养第4 d的原代HSC,并设置空白对照组,作用72 h后收集细胞,以RIPA裂解液裂解细胞,加入蛋白酶抑制剂PMSF 10 μl/ml,冰上静置15 min,4℃15000 r/m离心15 min,取上清,转入新的EP管中,用蛋白质定量试剂对每个样品的总蛋白进行定量。加入5×SDS凝胶电泳上样缓冲液,沸水浴5 min,在蛋白样品变性后置于-80℃保存。取各组总蛋白60 μg,用SDS-PAGE分离,灌制12%SDS-PAGE分离胶、4%浓缩胶,加样,80 v电泳至分界处,换成120 v直至溴酚蓝跑至胶底部;300 mA、40 min转移至聚偏二氟乙烯(PVDF)膜。用含5%脱脂奶粉、0.1%Tween20的TBST封闭液室温下封闭2 h;将PVDF膜在含有各一抗的稀释液(1:1000)中4℃孵育过夜。同时使用小鼠抗大鼠Tubulin单克隆抗体(1:1000)孵育作为对照;置于洗膜液(含0.1%Tween20的TBS)中洗膜3次,每次10 min;将膜置于HRP标记的山羊抗兔IgG(H+L)或山羊抗小鼠IgG(H+L)的二抗稀释液(1:1000)中,在摇床上震荡孵育2 h;洗膜液洗膜3次,每次15 min。暗室中将膜加上ECL发光剂,铺上保鲜膜,在化学发光成像系统中检测。
1.6统计学处理应用SPSS 11.0软件包进行统计学分析,所有数据进行正态性及方差齐性检验,计量资料以(±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析(One-way ANOVA),组间两两比较采用Turkey's检验,P<0.05表示差异具有统计学意义。
2 结果
2.1HSC活化的形态学鉴定在倒置相差显微镜下观察发现,新分离未贴壁的HSC呈圆形,胞浆折光性很强,体积明显小于肝细胞。培养1 d后,多数细胞已贴壁,呈扁圆形或椭圆形。培养3 d后,部分细胞出现多角伪足。培养4 d时,细胞开始呈现典型的星状外形,胞浆内颗粒减少,细胞逐渐融合,体积增大。培养7 d时,细胞由局灶性生长变为单层成片生长,胞质中脂滴不明显,或消失,细胞明显增大,呈现典型的成纤维细胞样形态(图1)。研究结果表明离体培养4 d的原代HSC呈初始活化状态;培养7 d时呈完全活化状态,说明形态学观察可作为评估HSC活化状态的一个有效方法。
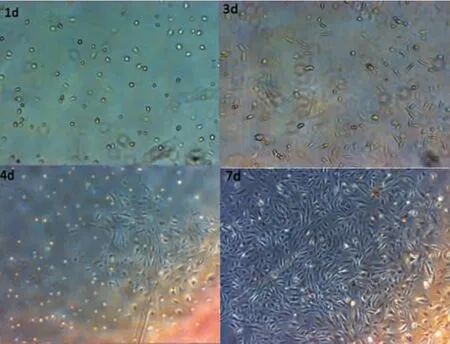
图1 体外培养的原代HSC形态变化
2.2PAO有效工作浓度的确定在25~200 nmol/L范围内,随着PAO浓度的增高,HSC存活率逐渐下降;当PAO浓度增高至150 nmol/L时,HSC细胞存活率为对照组的82%(P<0.05);当PAO浓度增加至200 nmol/L时,细胞存活率降低为对照组的72%以下(P<0.01,图2),表明在25~100 nmol/L浓度范围内,PAO对HSC的毒性小,细胞存活率在90%以上,即确定为有效工作浓度。
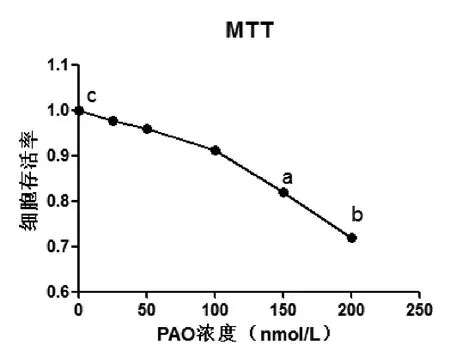
图2 PAO对HSC-T6增殖的影响与对照组细胞(C,0 nmol/L)相比,在PAO为150 nmol/L和200 nmol/L时,细胞存活率显著降低aP<0.05;bP<0.01
2.3PAO对HSC α-SMA表达的影响经Realtime PCR检测,发现与对照比,PAO作用72 h后,各处理组HSC α-SMA mRNA水平呈浓度依赖性显著下降(P<0.01,图3),提示PAO对初始活化的HSC可能具有逆转作用。经Western blot检测,随着培养时间的延长,HSC表达α-SMA逐渐增强,离体培养4 d时其相对表达量为(1.51±0.045),较对照(0.762±0.062)明显增高(P<0.05);在离体培养7 d时,其α-SMA表达量为(1.752±0.053),证实原代HSC经离体培养4 d时已呈初始活化状态,并随时间延长而进一步活化(图4A)。PAO可以剂量依赖性下调α-SMA蛋白表达,在50 nmol/L和100 nmol/L浓度时,α-SMA表达量分别为(0.63±0.078)和(0.41±0.09),显著低于对照组(1.53±0.039),P<0.05(图4B),而在25nmol/L PAO处理组,HSC α-SMA蛋白表达(1.25±0.07)与对照相比无显著性差异(P<0.05),表明PAO可使活化的HSC发生逆转分化。
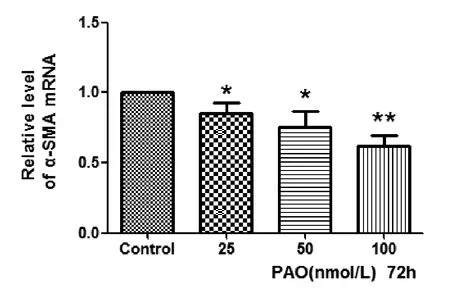
图3 PAO对离体培养4 d的HSC α-SMA mRNA水平的影响各浓度PAO处理组HSC α-SMA mRNA水平呈浓度依赖性显著下降*P<0.05;**P<0.01
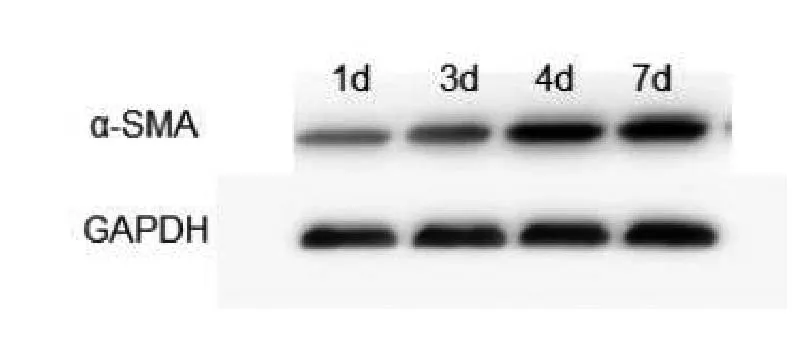
图4 A离体培养的HSC α-SMA蛋白表达的变化随着培养时间的延长,HSC表达α-SMA逐渐增强
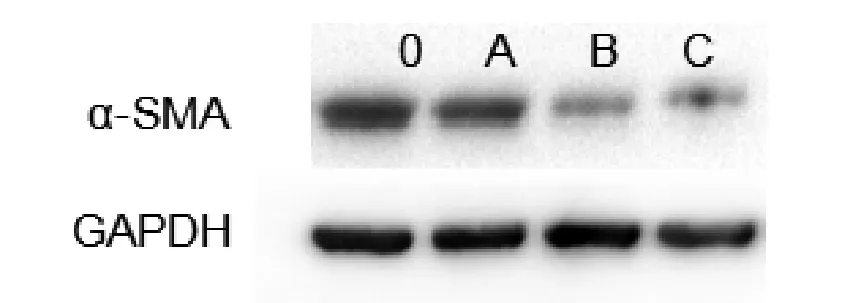
图4 BPAO对离体培养4 d的原代HSC α-SMA蛋白表达的影响PAO可以剂量依赖性下调α-SMA蛋白表达0:Control;A:25 nmol/L;B:50 nmol/L;C:100 nmol/L
2.4PAO可显著下调活化的HSC I型胶原mRNA水平与对照比,各浓度PAO对HSC I型胶原mRNA水平均有显著的下调作用,且呈浓度依赖性增强(P<0.01,图5),结果表明PAO对初始活化的HSC具有逆转活化作用。
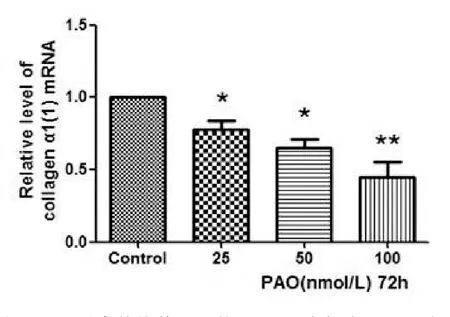
图5 PAO对离体培养4 d的HSC I型胶原mRNA水平的影响与对照比,各浓度PAO对HSC I型胶原mRNA水平均有显著的下调作用,且呈浓度依赖性增强与对照组比,*P<0.05;**P<0.01
3 讨论
活化的HSC清除障碍是肝纤维化持续进展的主要原因。因此,诱导活化的HSC凋亡或逆转为静止的HSC是防治肝纤维化的有效策略[7,8]。业已证实,砷制剂具有诱导白血病细胞逆转分化和凋亡的双重作用,并已应用于临床治疗急性早幼粒细胞性白血病(Acute promyelocytic leukemia,APL)[9,10]。PAO是磷脂酰肌醇-4激酶抑制剂,可调控磷脂酸肌醇信号(PI3K/Akt)通路,从而调控细胞分化(表型转化)、增殖或凋亡[11,12]。PI3K/Akt信号通路与HSC分化(激活)及增殖调控密切相关,提示PAO可能对HSC活化具有调控作用[13~16]。
接种于塑料器皿中的原代HSC可自发培养激活,是体外研究HSC生物学特性的经典细胞模型[17,18]。我们的研究发现离体培养4 d时HSC处于初始活化状态,7 d时为完全活化状态。为了动态评估PAO对HSC激活过程的影响,我们测试了25~200 nmol/L浓度PAO对活化的HSC的细胞毒作用。研究发现,在150 nmol/L以下时,PAO对活化的HSC无细胞毒性。因此,确定25~100 nmol/L范围为PAO的有效工作浓度。由于PAO具有细胞毒性,因此我们选择离体培养4 d的初始活化的HSC作为干预细胞。研究发现,在25~100 nmol/L浓度范围内PAO可浓度依赖性使活化的HSC逆转分化,表现为活化的HSC的特征性标志,即α-SMA mRNA及蛋白表达显著下调,活化的HSC合成I型胶原等细胞外基质的能力下降。
PAO诱导肿瘤细胞逆转分化或凋亡已有较多的研究报道。除血液系统肿瘤外,砷制剂治疗实体肿瘤的临床试验也在积累中[19]。我们的合作者黄福德教授课题组最近发现PAO亦有防治帕金森病的潜力,但迄今尚无PAO在肝纤维化防治相关领域的研究报道。我们的研究首次证实PAO对活化的HSC具有逆转分化作用,并筛选到PAO治疗作用的有效浓度范围,提示PAO有潜力成为一类新型抗肝纤维化药物。
[1]Alcolado R,Arthur MJ,Iredale JP.Pathogenesis of liver fibrosis. Clin Sci(Lond),1997,92(2):103-112.
[2]Roth-Eichhorn S,Kuhl K,Gressner AM.Subcellular localization of(latent)transforming growthfactorbetaandthelatent TGF-beta binding protein in rat hepatocytes and hepatic stellate cells.Hepatology,1998,28(6):1588-1596.
[3]Cardoso CC,Paviani ER,Cuma FC,et al.Effect of pentoxifylline on arachidonic acid metabolism,neutral lipid synthesis and accumulation during induction of the lipocyte phenotype by retinolinmurinehepaticstellatecell.MolCellBiochem,2003,254(1-2):37-46.
[4]Murphy FR,Issa R,Zhou X,et al.Inhibition of apoptosis of activated hepatic stellate cells by tissue inhibitor of metalloproteinase-1 is mediated via effects on matrix metalloproteinase inhibition:implications for reversibility of liver fibrosis.J Biol Chem,2002,277(13):11069-11076.
[5]Zhang LJ,Zheng WD,Chen YX,et al.Antifibrotic effects of interleukin-10 on experimental hepatic fibrosis.Hepatogastroenterol ogy,2007,54(79):2092-2098.
[6]Ji J,Zhang J,Huang G,et al.Over-expressed microRNA-27a and 27b influence fat accumulation and cell proliferation during rat hepatic stellate cell activation.FEBS Lett,2009,583(4):759-766.
[7]Reeves HL,Friedman SL.Activation of hepatic stellate cells--a key issue in liver fibrosis.Front Biosci,2002,7:d808-826.
[8]Bataller R,Brenner DA.Liver fibrosis.J Clin Invest,2005,115 (2):209-218.
[9]Ruchaud S,Duprez E,Gendron MC,et al.Two distinctly regulatedevents,primingandtriggering,duringretinoid-induced maturation and resistance of NB4 promyelocytic leukemia cell line.Proc Natl Acad Sci U S A,1994,91(18):8428-8432.
[10]Grignani F,Testa U,Roqaia D,et al.Effects on differentiation by the promyelocytic leukemia PML/RARalpha protein depend on the fusion of the PML protein dimerization and RARalpha DNA binding domains.EMBO J,1996,15(18):4949-4958.
[11]Gutierrez-Ruiz MC,Gomez-Quiroz LE.Liver fibrosis:searching for cell model answers.Liver Int,2007,27(4):434-439
[12]Sancho-Bru P,Juez E,Moreno M,et al.Hepatocarcinoma cells stimulate the growth,migration and expression of pro-angiogenic genes in human hepatic stellate cells.Liver Int,2010,30(1):31-41.
[13]Coelho RP,Yuelling LM,Fuss B,et al.Neurotrophin-3 targets the translational initiation machinery in oligodendrocytes.Glia,2009,57(16):1754-1764.
[14]Carracedo A,Pandolfi PP.The PTEN-PI3K pathway:of feedbacks and cross-talks.Oncogene,2008,27(41):5527-5541.
[15]Fruman DA,Bismuth G.Fine tuning the immune response with PI3K.Immunol Rev,2009,228(1):253-272.
[16]He W,Shi F,Zhou ZW.A bioinformatic and mechanistic study elicits the antifibrotic effect of ursolic acid through the attenuation of oxidative stress with the involvement of ERK,PI3K/Akt,and p38 MAPK signaling pathways in human hepatic stellate cells and rat liver.Drug Des Devel Ther,2015,9:3989-4104.
[17]Friedman SL.Molecular regulation of hepatic fibrosis,an integratedcellularresponsetotissueinjury.JBiolChem,2000,275(4):2247-2250.
[18]Gressner AM.The cell biology of liver fibrogenesis-an imbalance of proliferation,growth arrest and apoptosis of myofibroblasts.Cell Tissue Res,1998,292(3):447-452.
[19]Ni B,Ma Q,Li B,et al.Phenylarsine oxide induces apoptosis in Bax-and Bak-deficient cells through upregulation of Bim. Clin Cancer Res,2012,18(1):140-151.
(收稿:2015-12-09)
(本文编辑:陈从新)
Objective To investigate the inhibition of primary cultured hepatic stellate cell(HSC)activation by phenylarsine oxide(PAO)in vitro.Methods Primary cultured HSCs were isolated from rat 1iver by Nycodenz density-gradient centrifugation.The morphological features of the cells were observed under inverted microscope.The cytotoxicity of PAO on HSCs-T6 was determined by MTT after treated with 5 different PAO concentrations(25,50,100,150 and 200 nmol/L)for 24 h.We chose proper concentration of PAO(<100 nmol/L)in this experiment,and t hen we divided primary cultured HSCs at day 4 into four groups receiving PAO at concentration of 0,25,50 and 100 nmol/L respectively.The expressions of α-SMA and type I collagen were measured by Western blot and Real-time PCR respectively.Results Expression of α-SMA was up-regulated as HSCs activation at primary culture(the expression of α-SMA increased significantly at day 4(1.51±0.045)as compared with at day 1[(0.762±0.062),P<0.05】;PAO at 25 to 100 nmol/L concentration range had no obvious cytotoxicity to activated HSCs,and down-regulated and inhibited α-SMA mRNA and collagen type I mRNA levels and their protein expression of HSCs in a concentration-dependent manner.Conclusion The HSCs is initially activated at day four in vitro culture,and PAO at 25 to 100 nmol/L range can inhibit the spontaneous activation of HSCs in vitro.
Hepatic fibrosis;Hepatic stellate cells;Phenylarsine oxide;In vitro肝纤维化是各种慢性肝病进展至肝硬化的必经阶段[1,2],肝纤维化的发生与活化的肝星状细胞(Hepatic stellate cell,HSC)密切相关[3]。因此,诱导活化的HSC凋亡或逆转为静止期HSC将是防治肝纤维化的重要工作[4,5]。有研究发现氧化苯砷(Ph enylarsine oxide,PAO)可抑制多能干细胞向肌成纤维细胞分化,提示PAO可能具有抗肝纤维化潜能。本研究主要探讨了PAO对HSC活化的逆转作用。
10.3969/j.issn.1672-5069.2016.04.008
国家自然科学基金资助项目(81070344/81400631);中国肝炎基金会王宝恩肝纤维化研究基金资助项目(200090007)
200092上海市交通大学医学院附属新华医院消化内科(仝艳艳,李光明,石翠翠,邓怡林,范建高);上海科学院高等研究院神经生物学研究组(黄福德)
仝艳艳,女,24,硕士研究生。主要从事肝损伤与肝纤维化的防治研究。E-mail:tyanyan1991@163.com
李光明,E-mail:ligm68@126.com
Inhibitionof primary culturedhepaticstellate cell activationby phenylarsineoxideinvitro Tong Yanyan,Li Guangming,Deng Yilin,et al.Department of Gastroenterology,Xinhua Hospital Affiliated to JiaoTong University School of Medicine,Shanghai 200092

