妊娠期不同阶段给予替比夫定阻断乙型肝炎病毒宫内母婴传播的研究
邱波,朱玲,陈艳,吴晓丽,刘秀丽,王堂明,严世春,刘星妤
妊娠期不同阶段给予替比夫定阻断乙型肝炎病毒宫内母婴传播的研究
邱波,朱玲,陈艳,吴晓丽,刘秀丽,王堂明,严世春,刘星妤
目的探讨妊娠不同阶段给予替比夫定治疗阻断乙型肝炎病毒母婴传播的效果和安全性。方法选择血清HBsAg阴性父亲,血清HBsAg和HBV DNA阳性孕妇180例,干预1组60例,在孕前口服替比夫定,直至HBV DNA阴性后受孕并继续服药至新生儿出生;干预2组60例,在孕24 w时口服替比夫定至新生儿出生;对照组60例不进行抗病毒处理。观察婴儿0 w、24 w和48 w时血清HBsAg和HBV DNA阳性情况。结果干预1组婴儿出生时、24 w、48 w血清HBsAg和HBV DNA阳性率均为0.0%,干预2组出生时、24 w、48 w时HBV DNA阳性率为5.0%、3.3%、3.3%,两组有统计学差异(P<0.01);对照组出生时、24 w、48 w血清HBV DNA阳性率为20.0%、18.3%、16.7%,与干预2组比有统计学差异(P<0.05);干预组未发现与应用替比夫定相关的不良反应;三组新生儿胎龄、体质量、身长和Apgar评分比较无统计学差异(P>0.05)。结论口服替比夫定至HBV DNA阴性时受孕可以完全阻断乙型肝炎病毒母婴宫内传播,且有较好的孕妇和新生儿安全性。
乙型肝炎;替比夫定;宫内感染;母婴传播;安全性;
在我国肝硬化和HCC患者中,由HBV感染引起的比例分别为60%和80%[1~4]。HBV主要经血、母婴和性接触传播[5]。由于对献血员实施了严格的HBsAg筛查,经输血或血液制品引起的HBV感染已较少发生。我国HBV感染者多为围产期或婴幼儿时期感染。感染HBV时的年龄是影响感染慢性化最主要的因素。在围产期和婴幼儿时期感染HBV者中,分别有90%和25%~30%将发展成慢性感染,而5岁以后感染者仅有5%~10%发展为慢性感染[6]。母婴传播主要发生在围产期,大多在分娩时接触HBV阳性母亲的血液和体液而感染,母婴传播途径感染乙型肝炎病毒的新生儿约90%~95%会发展为慢性肝炎,其中20%~25%患者将进展为肝硬化,甚至肝癌[7]。随着乙肝疫苗联合乙肝高价免疫球蛋白(HBIG)的应用,母婴传播已明显减少[8]。该法主要阻断了分娩时接触HBV阳性母亲的血液和体液感染,但仍有10%~30%阻断失败,国内外学者均认为与胎儿在宫内感染有关[9,10]。所以,当前宫内感染成了母婴传播的一个最重要的方式。我们在妊娠不同时期应用替比夫定防治HBsAg阳性伴血清HBV DNA高载量孕妇,以评价其阻断HBV母婴宫内传播的效果和安全性,现将结果报告如下。
1 资料与方法
1.1对象选择2009年6月~2014年6月在四川省攀枝花市第四人民医院(传染病医院)肝病中心就诊检查并在攀枝花市中心医院妇产科完成分娩,血清HBsAg阳性、HBV DNA载量>1.0×106copies/ml的育龄期妇女180例,平均年龄27.5±5.2岁。所有配偶丈夫血清HBV标记物阴性或者仅HBsAb阳性,HBV DNA<500copies/ml。排除标准:(1)合并急慢性肝炎及其他肝病或肝癌者;(2)同时感染HIV、HCV、HDV、梅毒螺旋体者;(2)有先兆流产史者;(3)合并糖尿病、高血压、肾病、营养不良和其他严重疾病史者;(4)妊娠后出现不适合继续妊娠等产科情况或不配合随访观察的其他情况。
1.2干预方法在自愿接受替比夫定(北京诺华制药有限公司)抗病毒治疗的120例孕妇中,将60例列为干预1组,另60例列为干预2组,拒绝接受替比夫定治疗,但愿意接受随访的60例孕妇列为对照组。三组孕妇的孕前HBV DNA载量、年龄、孕产次、妊娠结束时间和分娩方式等资料均无统计学差异(P>0.05)。180例孕妇肝功能均正常,B超检查肝脾形态无异常,此前均未接受过任何抗病毒治疗。在充分知情后自愿签署知情同意书。干预1组在受孕前(至少>12 w)给予替比夫定600 mg/d口服,每月检查,直至血清HBV DNA载量<500 copies/ml
时才妊娠,妊娠后继续服药,至分娩后即刻停药;干预2组在妊娠24 w时开始服用替比夫定600 mg/ d,至分娩后即刻停药;对照组不用任何抗病毒药物。所有孕妇在胎儿足月时行剖宫产术(充分知情并签署同意书),在新生儿出生后12 h内注射HBIG(四川远大蜀阳药业股份有限公司)200 IU,同时在不同部位接种重组酵母乙肝疫苗(大连汉信生物制药有限公司)10μg,并在1 m和6 m时分别接种第2针和第3针乙肝疫苗。
1.3检测血清乙型肝炎病毒标记物采用ELISA法检测(上海科华生物工程股份有限公司试剂,郑州安图Autolumo A2000型全自动化学发光测定仪);血清乙型肝炎病毒脱氧核糖核酸检测采用荧光定量基因扩增法(上海科华生物工程股份有限公司,上海枫岭生物技术有限公司生产的FTC-2000A型荧光定量基因扩增仪);磷酸肌酸激酶(CK)的检测采用N-乙酰半胱氨酸法(上海科华生物工程股份有限公司,卓越260全自动生化分析仪)。
1.4观察指标胎儿出生后立即抽血检测产妇和新生儿血清乙型肝炎病毒标记物和HBV DNA,并于24 w和48 w时再次检测。记录3组新生儿出生时Apgar评分(根据呼吸、心率、肤色、肌张力以及对刺激反应等五项体征进行评分)[11]。
1.5统计学分析应用SPSS 13.0统计软件,计数资料的比较采用x2检验,计量资料以(±s)表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1三组孕妇不同时期血清HBV DNA水平比较三组孕妇在干预前HBV DNA水平无统计学差异(P<0.05);干预1组受孕时、孕24w、分娩时HBV DNA水平与干预2组比有统计学差异(P<0.01);干预2组在分娩时HBV DNA水平与对照组比有统计学差异(P<0.05,表1)。
表1 3组孕妇分娩前后血清HBV DNA水平(lg copies/ml±s)比较
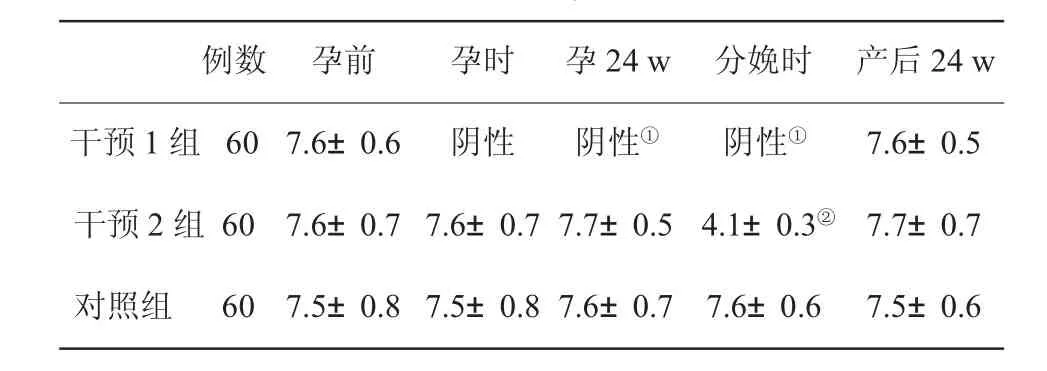
表1 3组孕妇分娩前后血清HBV DNA水平(lg copies/ml±s)比较
与其他两组比,①P<0.01;与对照组比,②P<0.05
例数孕前孕时孕24 w分娩时产后24 w干预1组607.6±0.6阴性阴性①阴性①7.6±0.5干预2组607.6±0.7 7.6±0.7 7.7±0.54.1±0.3②7.7±0.7对照组607.5±0.8 7.5±0.8 7.6±0.77.6±0.67.5±0.6
2.2三组孕妇分娩的婴儿不同时期HBV感染情况比较见表2。
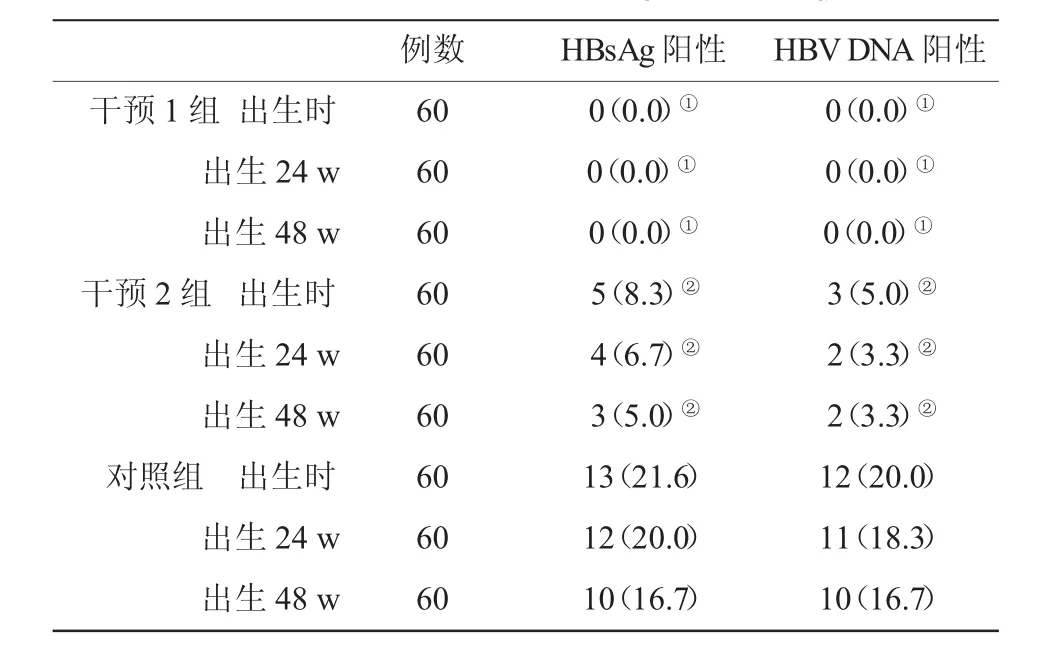
表2 3组新生儿HBV感染率(%)比较
2.3三组新生儿出生时情况比较三组新生儿胎龄、身长、体质量和Apgar评分比较无统计学差异(P>0.05,表3)。
表3 3组新生儿出生时有关指标(±s)比较

表3 3组新生儿出生时有关指标(±s)比较
例数胎龄(w)身长(cm)体质量(kg)Apgar评分干预1组6039.5±1.050.4±1.43.3±0.39.97±0.26干预2组6039.4±1.250.7±1.53.5±0.49.96±0.28对照组6039.6±1.150.6±1.33.4±0.39.95±0.25
2.4不良反应干预组孕妇在应用替比夫定期间,36%出现血清CK轻度升高,但未发生肌肉、骨骼不良事件,未观察到相关恶心、腹泻、疲劳、肌无力等不良反应,未发生停药情况。干预组120例孕妇在停药后观察48 w未发现肝功能指标异常情况。
3 讨论
我们对HBV感染尤其是HBV DNA阳性孕妇实行剖宫产分娩以缩短产程,尽量让新生儿避免、减少接触HBV阳性母亲血液和体液的机会,减少感染机会,同时按方案在出生后12 h内注射HBIG和重组酵母乙肝疫苗,在1个月和6个月时分别接种第2和第3针乙肝疫苗,显著提高了阻断母婴传播的效果[12,13],减少了母婴传播的机率。虽然慢性乙型肝炎防治指南指出,在预防注射后可接受HBsAg阳性母亲的哺乳[3],但我们认为仍有一定的风险。首先,HBV阳性母亲的血液和体液含有病毒,动物实验也证实乳汁中可以有病毒存在,新生儿注射HBIG也只能中和血循环中的病毒,其是否能完全中和所有病毒需要研究证明;其次,疫苗从注射到产生有效保护性抗体也需要一定的时间(至少2~4 w),故主张早期人工喂养,避免母乳传播,除非每月监测,在连续6个月后婴儿血清HBsAb阳性者才可以考虑接受母乳喂养。
本研究除外父亲HBV感染者,主要是排除父婴传播的干扰因素。乙型肝炎病毒的父婴传播也不容忽视。有研究报道父亲精液可以传播乙型肝炎病毒,甚至精液洗涤液也有病毒阳性情况。动物实验和临床观察均证明HBV父婴垂直传播的存在,而且往往被忽视,说明父婴传播也许是未来研究的热点。2015版慢性乙型肝炎防治指南指出,应用核苷类(NAs)抗病毒治疗的男性患者,尚无证据表明NAs治疗对精子有不良影响[3]。生育前口服B类抗病毒药物,阻断父婴HBV传播,也有一些成功的范例。
HBV DNA水平是影响HBV母婴传播的关键因素。HBV DNA高载量(>1×106copies/ml)母亲所生的新生儿更易发生母婴传播。乙肝疫苗的接种对象主要是新生儿[12],单用乙肝疫苗阻断母婴传播的阻断率为87.8%[13],联合HBIG的阻断率可达90%~95%。本研究在剖宫产和注射疫苗联合HBIG的方案下,使得HBV阳性孕妇母婴传播的最主要途径仅剩宫内感染。宫内感染的诊断标准是新生儿出生24 h内或1月龄检出HBsAg并持续至6月龄,HBV通过胎盘、生殖细胞或外周血单个核细胞(PBMC)感染胎儿是发病的原因[14]。
近年研究显示,对HBV阳性母亲在妊娠中后期应用妊娠B级抗病毒核苷类药物可使孕妇产前血清HBV DNA水平降低,提高新生儿的母婴病毒传播阻断成功率[15]。我们曾在2005年报道拉米夫定(LAM)阻断HBV母婴传播的一项研究,阻断效果和安全性较好[16],以后随访未发现有远期不良事件,但当时拉米夫定在美国食品和药品管理局(FDA)被列为C类药物(现已列为B类),后未继续扩大研究。
目前研究较多的是另一妊娠B类药物替比夫定[17]。在一项国内III期临床试验的52周结果,以及全球多中心研究的104周结果均表明,替比夫定抗病毒活性优于LAM,且耐药发生率低于LAM[18],对人类DNA聚合酶无影响。毒理学研究表明,其无致畸性、无致癌性、无致突变性、也无线粒体毒性[19]。对年龄在30岁以下女性患者可获得较高的HBeAg血清学转换率,可能与女性或年轻患者的机体免疫状态有关[20],说明替比夫定是目前用于阻断年轻女性HBV母婴传播的首选药物。我们的研究也显示替比夫定在妊娠中后期有较好的乙型肝炎病毒母婴传播阻断效果,观察未发现有近期已知的生育毒性和发育毒性,有较高的安全性,结果与国内多项研究报道相似[21~23]。本研究重要的结果是孕前应用替比夫定治疗至HBV DNA阴性时再受孕可完全阻断宫内HBV感染,即所谓的提前干预有效。
对于妊娠期治疗方案的确认,如何时开始干预、药物选择、剂量、疗程及成本效果分析以及母婴长期安全性的影响等问题是今后开展卫生经济学研究和探索提高治疗可行性的重要问题。
[1]Ott JJ,Stevens GA,Groeger J,et al.Global epidemiology of hepatitis B virus infection:new estimates of age-specific HBsAg seroprevalence and endemicity.Vaccine,2012,30:2212-2219.
[2]Lozano R,Naghavi M,Foreman H,et al.Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010:a systematic analysis for the global burden of disease study 2010.Lancet,2012,380:2095-2128.
[3]中华医学会肝病学分会和感染病学分会.慢性乙型肝炎防治指南(2010年版).实用肝脏病杂志,2011,14(2):81-89.
[4]Wang FS,Fan JG,Zhang Z,et al.The global burden of liver disease:ThemajorimpactofChina.Hepatology,2014,60:2099-2108.
[5]Liaw YF.Natural history of chronic hepatitis B virus infection andlong-teenoutcomeundertreahnent.LiverInt,2009,29 (Suppl 1):100-107.
[6]MastEE,MargolisAS,FioreAE,etal.Acomprehensive immunization strategy to eliminate transmissionof hepatitis B virusinfectionintheUnitedStates:recommendationsof the Advisory Committee on Immunization Practices(ACIP)part 1:immunizationofinfants,children,andadolescents.MMWR Recomm Rep,2005,54:1-31.
[7]Guo Z,Shi XH,Feng YL,et al.Risk factors of HBV intrauterine transmission among HBsAg positive pregnant women.J Viral Hepat,2013,20(5):317-321.
[8]SunH,Tang X,Wang B,et al.A preliminary study onthe molecularevolutionofthetworoutesofintrauterine transmission of HBV.Arch Virol,2012,157(1):155-164.
[9]Singh AE,Plitt SS,Osiowy C,et al.Factors associated with vaccine failure and vertical transmission of hepatitis B among a cohortofCanadianmothersandinfants.JViralHepat,2011,18:468-473.
[10]Tran TT.Management of hepatitis B in pregnancy:weighing the options.Cleve Clin J Med,2009,76(Suppl 3):S25-S29.
[11]周勤,姚珍薇.精子洗涤对精液中HBV DNA含量的影响.重庆医科大学学报,2003,28(2):189-191.
[12]赵世印,谭华炳.基于乙型肝炎病毒宫内感染的抗病毒治疗研究进展.湖北医药学院学报,2013,32(6):546-548.
[13]夏国良,龚健,王继杰,等.重组乙肝疫苗阻断乙型肝炎病毒母婴传播方案的保护效果评价.中华流行病学杂志,2003,24:362-365.
[14]魏俊妮,王素萍,冯丽萍,等.母-儿细胞转运在HBV宫内感染机制中的作用.卫生研究,2005,34(4):466-468.
[15]贾智勇,张玲.阻断孕妇乙型肝炎病毒母婴传播的研究进展.川北医学院学报,2014,29(4):411-413.
[16]王堂明,邱波,陈艳,等.拉米夫定阻断乙型肝炎病毒母婴传播的临床研究.中国优生与遗传杂志,2005,13(12):68-69.
[17]Hou J,Yin YR,Xu D,et al.Telbivudine versus lamivudine in Chinese patients with chronic hepatitis B:Results at 1 year of a randomized,double-blind trial.Hepatology,2008,47:447-454.
[18]Liaw YF,Gane E,Leung N,et al.2-Year GLOBE trialresults:telbivudine is superior to lamivudine in patients with chronic hepatitis B.Gastroenterology,2009,136:486-495.
[19]汪朝晖,何长伦.替比夫定持续治疗HBeAg阳性慢性乙型肝炎患者病毒学应答随访报告.实用肝脏病杂志,2015,18(5):485-489.
[20]任娜,胡善雷.替比夫定阻断慢性乙型肝炎母婴传播研究及其安全性分析.中国医药科学,2015,5(16):7-9.
[21]张先华.替比夫定阻断血清HBV高载量孕妇母婴传播的疗效和安全性观察.实用肝脏病杂志,2015,18(4):411-412.
[22]彭保安,赵轶,杨小福,等.替比夫定阻断乙型肝炎病毒母婴传播的疗效和安全性研究.中国药学杂志,2012,47(11):855-857.
[23]杨秀珍,徐洪涛,沈美龙,等.替比夫定阻断孕晚期HBV母婴传播的疗效及安全性Meta分析.中华实验和临床感染病杂志(电子版),2013,7(6):830-833.
(收稿:2016-01-20)
(本文编辑:陈从新)
ObjectiveTo explore the efficacy and safety of telbivudine(LDT)in blocking mother-to-child hepatitis B virus(HBV)transmission before or after pregnancy in human.Method180 serum HBsAg-positive young women whose husbands were HBsAg-negative were recruited in this study.The women in group A(n=60)received oral administration of telbivudine before and throughout their pregnancy,and the pregnancy began not until their serum HBV DNA turned negative;the women in group B(n=60)received oral administration of telbivudine from 24-week gestation to the delivery,and the in control group(n=60)received no anti-viral treatment.The positive rates of serum HBsAg and HBV DNA in children after birth,at 24 w and at 48 w were recorded.ResultsThe positive rates of serum HBsAg and HBV DNA in intervention group A were both 0.0%at birth,aged at 24-week or 48-week;the positive rates of serum HBV DNA in group B were 5.0%,3.3%and 3.3% at birth,24-week and 48-week ages,respectively,and there was a significant difference between group A and group B(P<0.01);the positive rates of serum HBV DNA in control group were 20.0%,18.3%and 16.7%,respectively,at birth,24-week and 48-week age,and there was a significant difference between group B and group control(P<0.05);no women reported telbivudine discontinuation due to adverse reaction;the gestational age,weight,bodylengthandApgar'sscoreofnewbornbabiesinthreegroupshadnostatisticaldifference. ConclusionOral administration of telbivudine before pregnancy can result in complete interruption of intrauterine mother-to-child HBV transmission with favorable safety for both pregnant women and newborns.
Hepatitis B;Telbivudine;Intrauterine transmission;Mother-to-infant transmission;Safety
10.3969/j.issn.1672-5069.2016.04.011
617000四川省攀枝花市疾病预防控制中心(邱波,朱玲);中心医院妇产科(陈艳,吴晓丽,刘秀丽);第四人民医院肝病治疗中心(王堂明,严世春,刘星妤)
邱波,女,36岁,医学学士,主治医师。主要从事感染性疾病的预防和治疗研究。E-mail:1660638733@qq.com
王堂明,E-mail:wtm2908600@sina.cn
Applicationoftelbivudinebeforeorafterpregnancyinblockingintrauterinemother-to-child transmission of hepatitis B virus in human Qiu Bo,Zhu Ling,Chen Yan,et al.Centers for Disease Control and Prevention,Panzhihua 617000,Sichuan Province,China

