《丙型肝炎防治指南》2015年更新版
中华医学会肝病学分会、中华医学会感染病学分会
《丙型肝炎防治指南》2015年更新版
中华医学会肝病学分会、中华医学会感染病学分会
2015年10月22日北京
为规范丙型肝炎的预防、诊断和抗病毒治疗,中华医学会肝病学分会和感染病学分会根据丙型肝炎病毒感染的特点,国内外的循证医学证据和药物的可及性,于2015年组织国内有关专家更新了《丙型肝炎防治指南》。
完善的病毒学检测是慢性丙型肝炎病毒(hepatitis C virus,HCV)感染筛查、监测、诊断和治疗的基础。根据我国社会和经济发展情况,还需要积极发展适宜于资源有限地区HCV RNA定量和HCV基因分型的检测试剂。政府、社会组织、学术团体、制药企业共同努力以确保新型抗病毒治疗的可及和可负担。
本指南旨在帮助医生在丙型肝炎诊断、治疗和预防工作中做出合理决策,但不是强制性标准,也不可能包括或解决丙型肝炎诊治中的所有问题。因此,临床医生在面对具体患者时,根据自己的专业知识、临床经验和可利用的医疗资源,制定全面合理的诊疗方案。
我们将根据国内外的有关进展情况,继续对本指南进行不断更新和完善。
本指南中的证据等级分为A、B、C三个级别,推荐等级分为1和2级别(表1,根据GRADE分级修订)

表1 推荐意见的证据等级和推荐等级
一、术语
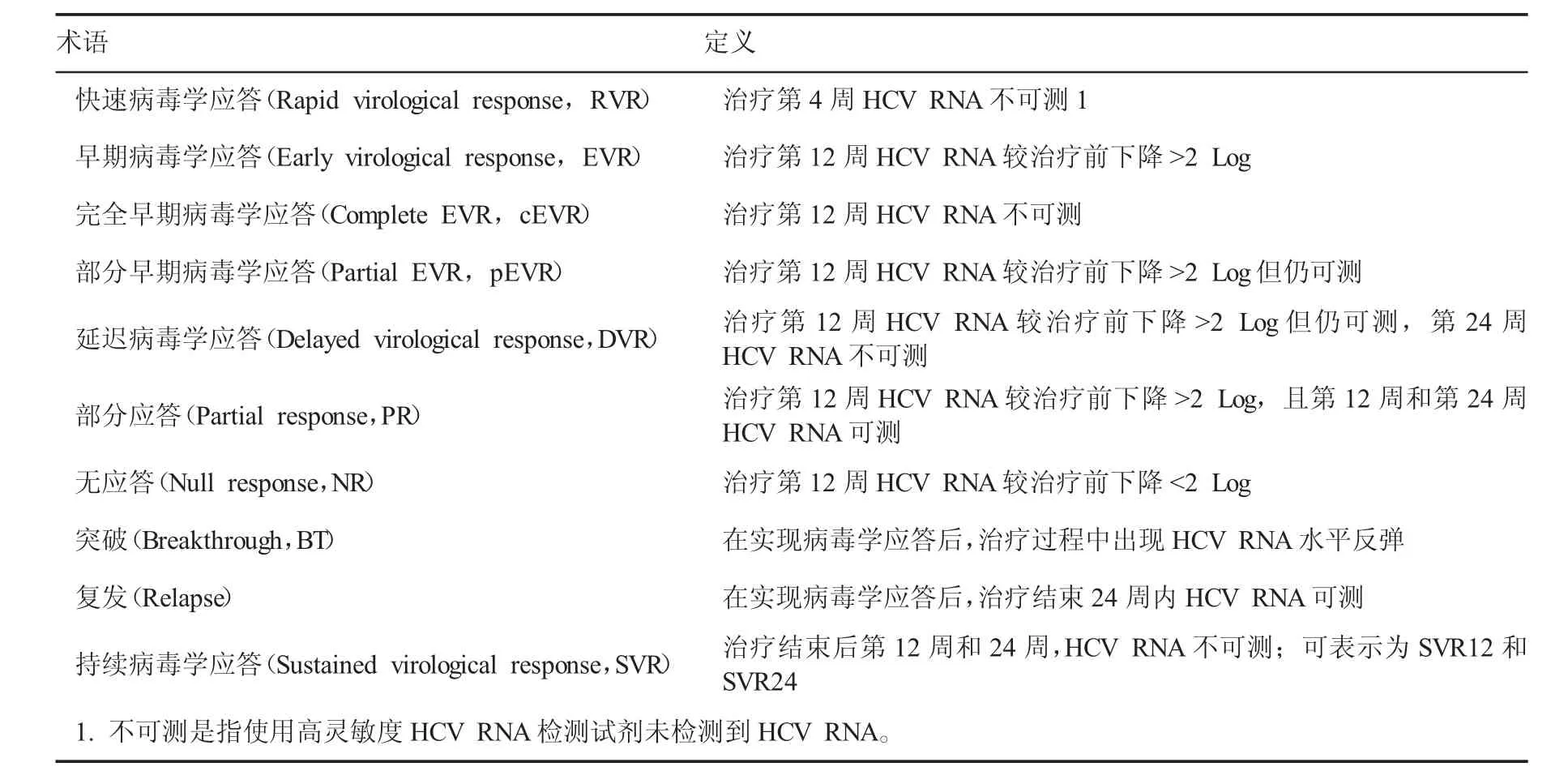
术语定义快速病毒学应答(Rapid virological response,RVR)治疗第4周HCV RNA不可测1早期病毒学应答(Early virological response,EVR)治疗第12周HCV RNA较治疗前下降>2 Log完全早期病毒学应答(Complete EVR,cEVR)治疗第12周HCV RNA不可测部分早期病毒学应答(Partial EVR,pEVR)治疗第12周HCV RNA较治疗前下降>2 Log但仍可测延迟病毒学应答(Delayed virological response,DVR)治疗第12周HCV RNA较治疗前下降>2 Log但仍可测,第24周HCV RNA不可测部分应答(Partial response,PR)治疗第12周HCV RNA较治疗前下降>2 Log,且第12周和第24周HCV RNA可测无应答(Null response,NR)治疗第12周HCV RNA较治疗前下降<2 Log突破(Breakthrough,BT)在实现病毒学应答后,治疗过程中出现HCV RNA水平反弹复发(Relapse)在实现病毒学应答后,治疗结束24周内HCV RNA可测持续病毒学应答(Sustained virological response,SVR)治疗结束后第12周和24周,HCV RNA不可测;可表示为SVR12和SVR24 1.不可测是指使用高灵敏度HCV RNA检测试剂未检测到HCV RNA。
二、流行病学和预防
流行病学
丙型肝炎呈全球性流行,不同性别、年龄、种族、民族人群均对HCV易感。据世界卫生组织统计,全球HCV的感染率约为2.8%,估计约1.85亿人感染HCV,每年因HCV感染导致的死亡病例约35万例1-3。但是,由于HCV感染具有隐匿性,多数感染者并不知道感染HCV,因此,全球确切的慢性丙型肝炎发病率尚不清楚4。
2006年全国血清流行病学调查显示,我国1~59岁人群抗-HCV流行率为0.43%,在全球范围内属HCV低流行地区,由此推算,我国一般人群HCV感染者约560万,如加上高危人群和高发地区的HCV感染者,约1000万例。各地抗-HCV阳性率有一定差异,以长江为界,北方(0.53%)高于南方(0.29%)。抗-HCV阳性率随年龄增长而逐渐上升,1~4岁组为0.09%,50~59岁组升至0.77%。男女间无明显差异5。
HCV 1b和2a基因型在我国较为常见,其中以1b型为主(56.8%),其次为2型(24.1%)和3型(9.1%),未发现基因4型和5型,6型相对较少(6.3%);在西部以及南部区域,基因1型比例低于全国平均比例,西部基因2型和3型比例高于全国平均比例,南部(包括香港和澳门地区)和西部基因3型和6型比例高于全国平均比例。混合基因型少见(约2.1%),多为基因1型混合2型。我国HCV感染者IL-28B基因型以rsl2979860 CC为主(84.1%),而该基因型对干扰素抗病毒治疗应答较好6。
HCV主要经血液传播,主要有:(1)经输血和血制品、单采血浆返输血细胞传播。我国自1993年对献血员筛查抗-HCV,2015年开始对抗-HCV阴性献血员筛查HCV RNA,经输血和血制品传播已很少发生。但是,目前就诊的患者中,大多有1993年以前接受输血或单采血浆返输血细胞的历史;(2)经破损的皮肤和黏膜传播。这是目前最主要的传播方式。包括使用非一次性注射器和针头、未经严格消毒的牙科器械、内镜、侵袭性操作和针刺等。在某些地区,因静脉注射毒品导致HCV传播占60%~90%。。一些可能导致皮肤破损和血液暴露的传统医疗方法也与HCV传播有关;共用剃须刀、共用牙刷、纹身和穿耳环孔等也是HCV潜在的经血传播方式。
与HCV感染者性接触和有多个性伴侣者感染HCV的危险性较高。同时伴有其他性传播疾病者,特别是感染人类免疫缺陷病毒(HIV)者,感染HCV的危险性更高。
抗-HCV阳性母亲将HCV传播给新生儿的危险性约2%,若母亲在分娩时HCV RNA阳性,则传播的危险性可高达4%~7%;合并HIV感染时,传播的危险性增至20%。HCV病毒高载量可能增加传播的危险性。
接吻、拥抱、喷嚏、咳嗽、食物、饮水、共用餐具和水杯、无皮肤破损及其他无血液暴露的接触一般不传播HCV。
预防
目前尚无有效的预防性丙型肝炎疫苗可供预防。丙型肝炎的预防主要采取以下措施。
(一)严格筛选献血员
严格执行《中华人民共和国献血法》,推行无偿献血。通过检测血清抗-HCV、丙氨酸氨基转移酶(ALT)和HCV RNA,严格筛选献血员。
(二)预防经皮肤和黏膜传播
推行安全注射和标准预防,严格执行《医院感染控制规范》和《消毒技术规范》,使用一次性注射器。对牙科器械、内镜等医疗器具应严格消毒。医务人员接触患者血液及体液时应戴手套。对静脉吸毒者进行心理咨询和安全教育,劝其戒毒。不共用剃须刀及牙具等,理发用具、穿刺和纹身等用具应严格消毒。
(三)预防性接触传播
对男男同性和有多个性伴侣者应定期检查,加强管理。建议HCV感染者使用安全套。对青少年应进行正确的性教育。
(四)预防母婴传播
对HCV RNA阳性的孕妇,应避免羊膜腔穿刺,尽量缩短分娩时间,保证胎盘的完整性,减少新生儿暴露于母血的机会。
(五)对高危人群筛查
根据中华人民共和国卫生行业标准《丙型肝炎筛查及管理》对丙型肝炎高危人群进行筛查及管理。
三、病原学
HCV属于黄病毒科(flaviviridae)肝炎病毒属(hepacivirus genus),其基因组为单股正链RNA,由约9.6×103核苷酸组成。HCV基因组含有一个开放读框(ORF),编码10余种结构和非结构(NS)蛋白(NS2,NS3,NS4A,NS4B,NS5A和NS5B),NS3/4A、NS5A和NS5B是目前直接抗病毒(Direct-acting antiviral agent,DAA)的主要靶位。HCV基因易变异,目前可至少分为6个基因型及多个亚型7,按照国际通行的方法,以阿拉伯数字表示HCV基因型,以小写的英文字母表示基因亚型(如1a、2b、3c等)。HCV基因型与干扰素的治疗应答存在相关性,针对NS3/4A、NS5A和NS5B的DAA可能具有基因型特异性。因为HCV易变异,感染宿主后,经一定时期,HCV感染者体内同时存在的、由多种不同序列组成的、具有很高同源性的HCV变异株群体称为准种(quasispecies),具有某些特定位点变异的准种可能影响DAA治疗的敏感性,并可能和治疗失败有关8。
HCV对一般化学消毒剂敏感;100℃5min或60℃10h、高压蒸气和甲醛熏蒸等均可灭活HCV。
四、自然史及发病机制
自然史
暴露于HCV后1~3周,在外周血可检测到HCV RNA9。急性HCV感染者出现临床症状时,仅50%~70%抗-HCV阳性,3个月后约90%患者抗-HCV阳转。大约最高50%的急性HCV感染者可自发清除病毒,多数发生于出现症状后的12周内10。病毒血症持续6个月仍未清除者为慢性感染,丙型肝炎慢性化率为55%~85%。不论是否清除病毒,抗-HCV可长期存在。HCV感染慢性化的预测指标11:男性、感染时年龄>25岁、感染后无明显症状、种族(非洲裔美国人)、HIV感染者、免疫抑制患者。宿主的一些遗传背景可能影响慢性化,IL-28B基因、人类白细胞抗原1类分子HLA B57、Ⅱ类分子HLA DRB1和DQB1的等位基因多态性可影响HCV清除12-14。例如,IL-28B基因在rs12979860位点CC单倍体有利于病毒清除,而TT型病毒清除率则很低。
HCV感染进展多缓慢,感染后20年,儿童和年轻女性肝硬化发生率为2%~4%15;中年因输血感染者18%~30% 16;单采血浆返输血细胞感染者约1.4%~10.0%17,18;一般人群为5%~15%16。感染HCV时年龄在40岁以上、男性、嗜酒(男性50g/d以上,女性)、合并感染HIV并导致免疫功能低下者可促进疾病进展19,20。肥胖、胰岛素抵抗、合并HBV感染、非酒精性脂肪肝、肝脏高铁载量、合并血吸虫感染、肝毒性药物和环境污染所致的有毒物质、遗传因素等也可促进疾病进展21-23。基线时肝组织炎症坏死程度,以及纤维化分期是进展为肝硬化的最佳预测因素。
HCV相关HCC发生率在感染30年后为1%~3%,主要见于肝硬化和进展期肝纤维化患者,一旦发展成为肝硬化,HCC的年发生率为2%~4%24。上述促进丙型肝炎疾病进展的因素及糖尿病均可促进HCC的发生。输血后丙型肝炎患者的HCC发生率相对较高。
肝硬化和HCC是慢性丙型肝炎患者的主要死因。肝硬化发生失代偿年发生率为3%~4%。一旦发生肝硬化,10年生存率约为80%,如出现失代偿,10年的生存率仅为25% 。HCC在诊断后的第1年,死亡的可能性为33%25。
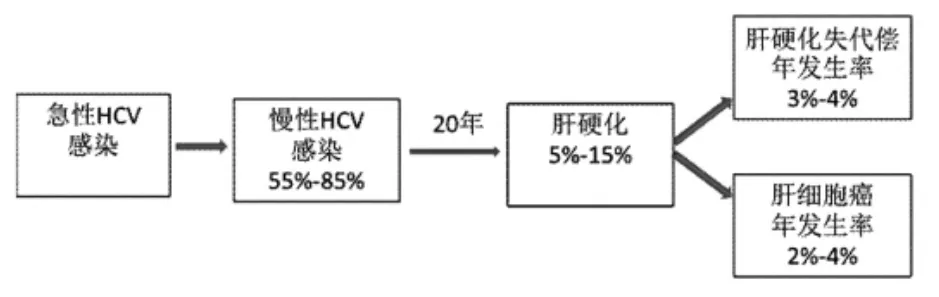
图1.丙型肝炎的自然史
发病机制
丙型肝炎肝损害的主要原因是HCV感染后引起的免疫学反应,其中细胞毒性T淋巴细胞(CTL)起重要作用26。CTL通过其表面的T细胞受体识别靶细胞的MHCI类分子和病毒多肽复合物,杀伤病毒感染的靶细胞,引起肝脏病变。
丙型肝炎慢性化机制还尚未阐明,考虑是宿主免疫、遗传易感性和病毒共同作用的结果。早期的固有免疫应答是机体抗病毒的第一道防线27,后期HCV特异性T细胞免疫应答在决定感染结局方面有重要作用。丙型肝炎患者每天可产生和清除1012个病毒28,在能检测到免疫应答几周之前,病毒载量就可达到最大值29。HCV可破坏固有免疫应答,其复制能力超过了CD8+T细胞的清除能力,容易发展为慢性感染。
体液免疫在保护和清除HCV中作用微弱。HCV包膜糖蛋白E2的高变异区域1(HVR1)易导致抗原表位改变,产生变异株逃避体液免疫30。慢性HCV感染者肝脏、骨髓、外周血中都可以看到B细胞克隆性扩增,这与混合性冷球蛋白血症、非霍奇金淋巴瘤有关31。
五、实验室检查
(一)HCV血清学检测
1.抗体检测:
抗-HCV检测(化学发光免疫分析法CIA,或者酶免疫法EIA)可用于HCV感染者的筛查。快速诊断测试(RDTs)可以被用来初步筛查抗-HCV32。对于抗体阳性者,应进一步进行HCV RNA检测,以确定是否为丙型肝炎患者。血清抗-HCV滴度越高,HCV RNA检出的可能性越大33,34。一些血液透析和自身免疫性疾病患者可出现抗-HCV假阳性,免疫功能缺陷或合并HIV感染者可出现抗-HCV假阴性,急性丙型肝炎患者可因为抗-HCV检测处于窗口期出现抗-HCV阴性。因此,HCV RNA检测有助于确诊这些患者是否合并感染HCV。
2.抗原检测:
在缺乏HCV RNA检测条件时,可考虑进行HCV核心抗原的检测,用于慢性HCV感染者的实验室诊断35。
(二)HCV RNA、基因型和变异检测
1.HCV RNA定量检测
HCV RNA定量检测应当采用基于PCR扩增、灵敏度和精确度高并且检测范围广的方法,其检测结果采用IU/ml表示。HCV RNA定量检测适用于HCV现症感染的确认、抗病毒治疗前基线病毒载量分析、以及抗病毒治疗过程中及治疗结束后的应答评估。在应用聚乙二醇干扰素联合RBV治疗方案时,高灵敏度的HCV RNA检测试剂有助于更准确鉴定RVR,从而为确定抗病毒治疗疗程提供更可靠的依据36。在应用DAA的治疗方案中,绝大多数患者在短期治疗后,HCV RNA迅速降低甚至低于检测水平。在这样情况下,高灵敏度的HCV RNA检测试剂的临床预测价值(如预测治疗失败)的重要性还需要进一步研究37。
2.HCV基因分型
HCV基因分型的方法有分子生物学和血清学两大类,前者包括DNA测序法、型特异性引物扩增法、基因芯片、探针杂交等,后者是合成HCV特异性多肽来检测其特异性的抗体从而区分基因型,但不能区分亚型。分子生物学分型方法主要是基于5'-UTR,但5'-UTR可以用于检测1-5型,不适合用于亚型的检测及1型与6型的区分38。如果其它试剂不能区分亚型,可以采用基于核心区或NS5B区的DNA测序法39。HCV基因分型应当在抗病毒治疗前进行。
在聚乙二醇干扰素联合利巴韦林治疗基因1型、2/3型患者中,不同基因型患者利巴韦林的用量不同,RGT的调整策略也不一样3,40;在DAA治疗方案中,HCV基因型及亚型的检测是现有DAA方案的基础,同样具有重要意义,但随着泛基因型DAA及DAAs组合的应用,基因型对治疗应答的影响需要更多的证据41。
3.HCV耐药相关基因检测
DAA的单药治疗容易导致耐药的发生,目前检测耐药相关基因突变的方法有DNA测序法,包括PCR产物直接测序法、新一代深度测序方法39,42,以及体外表型分析法,即测定抑制病毒复制所需的药物浓度如EC50或EC90。目前已确认的耐药相关突变位点主要有:①NS3/4A靶点相关:V36M、T54A、Q80K、R155K、A156T和D168V;②NS5A靶点相关:M28T、Q30E/H/R、L31M、H58D和Y93H/N;③NS5B靶点相关:S282T、C316N/H/F、M414T、A421V、P495L/S和S556G等43。
1a型HCV感染患者如果在基线时存在Q80K耐药突变株,对Simeprevir联合干扰素和利巴韦林治疗应答不佳44。因此对于1a型HCV感染者采用上述联合治疗时建议在治疗前检测耐药突变的存在45,但对于非采用上述治疗1a型HCV感染者及其他基因型感染者目前认为没有必要在抗病毒治疗前进行病毒的耐药检测,因为即使有预存耐药株的存在也不会影响治疗疗效46。
4.宿主IL28B基因分型:
宿主IL28B基因编码IFN-λ3,为Ⅲ型干扰素。编码IL28B基因附近有一些单核苷酸多态位点与HCV病毒自发清除能力及对干扰素的应答有关。常用的IL28B基因分型方法包括DNA直接测序、TaqManSNP探针法等。在干扰素治疗方案中宿主IL28B基因的多态性与持续病毒学应答(SVR)相关,特别是在感染了基因1型或4型病毒的患者中更加明显,但在基因2和3型病毒感染者中的作用还存有争议47。IL28B的rs12979860的CC基因型、rs8099917的TT基因型以及rs12980275的AA基因型与HCV感染的自发清除和干扰素治疗应答良好具有相关性48。在DAA治疗方案中,宿主IL28B基因的多态性对治疗应答反应没有预测价值。
六、肝纤维化非侵袭性诊断
目前常用的无创诊断方法包括血清学和影像学两大类。血清学方法通常是指包括多种临床指标的模型。其中APRI 和FIB-4简单易行,但敏感性和特异性不强49。APRI为天冬氨酸氨基转移酶(AST)和血小板(PLT)比率指数(aspartate aminotransferase-to-platelet ratio index,APRI),可用于肝硬化的评估50。成人中APRI评分>2,预示患者已经发生肝硬化。APRI计算公式为[(AST/ULN)×100/PLT(10^9/L)]。基于丙氨酸转氨酶(ALT),AST、PLT和患者年龄的FIB-4指数可用于患者肝纤维化的诊断和分期。FIB4=(年龄×AST)÷(血小板×ALT的平方根)。
影像学方法包括瞬时弹性成像(TE)、声辐射力脉冲成像/点的剪切波弹性成像(ARFI/pSWE)、二维剪切波弹性成像(2D-SWE)和核磁下弹性成像(MRE)等。
TE是近年开始广泛使用的的一种新的影像学无创诊断方法,对HCV肝纤维化分期的诊断较为可靠,对肝硬化的诊断更准确。已有较多的研究报道TE和血清学标志物用于诊断HCV和HIV-HCV合并感染者的显著肝纤维化/肝硬化,帮助筛选出需优先治疗的患者1。两者联合检测可以提高诊断准确性51。ARFI/pSWE、2D-SWE还需要更多的研究。
推荐意见1:可以采用血清学和/或瞬时弹性成像等影像学等无创诊断方法帮助判断是否存在丙型肝炎肝硬化或纤维化。目前的无创方法对于肝硬化的诊断效能优于显著肝纤维化。(A1)
推荐意见2:血清学和瞬时弹性成像等影像学无创指标联合应用,可以提高显著肝纤维化的诊断准确率。当两者结果不一致时,建议进行肝活检明确诊断。(A1)
七、影像学诊断
目前常用的影像学诊断方法包括腹部超声检查、电子计算机断层成像(CT)和磁共振(MRI或MR)等,可以帮助监测慢性丙型肝炎的临床进展、判断有无肝硬化及其并发症、发现和鉴别HCC等占位性病变。
八、病理学诊断
肝组织活检对丙型肝炎的诊断、炎症活动度和纤维化分期评价、疗效和预后判断等方面至关重要。丙型肝炎的组织病理学与其他病毒性肝炎相似,可有小叶内及汇管区炎症等多种病变。其病理学特征包括:肝窦内可见单个核细胞串珠样浸润;汇管区可见淋巴细胞聚集性浸润,甚至淋巴滤泡样结构形成;可见小胆管损伤,甚至小胆管结构破坏,CK19免疫组化染色有助于鉴别;可见肝细胞大小泡混合或大泡性脂变,区带分布不明显,基因3型、1型和4型较易见52-54。急性丙型肝炎无肝纤维化,肝细胞脂变较轻或无,一般无界面炎(旧称碎屑样坏死),临床上除非与其他肝病相鉴别通常不行肝活检。
慢性丙型肝炎病变活动及进展差异较大,且与肝脏酶学变化关系欠密切,肝活检意义重要55,56。可见不同程度的汇管区周围界面炎,汇管区内较常见淋巴细胞聚集性浸润及淋巴滤泡形成,较易见小胆管损伤,往往存在不同程度的肝纤维化,包括汇管区纤维性扩大、纤维间隔形成等,Masson三色染色及网状纤维染色有助于肝纤维化程度的评价。明显的(significant fibrosis,METAVIR分期≥F2)和进展期肝纤维化(advanced fibrosis,METAVIR分期≥F3)进一步发展,可出现小叶结构失常,肝细胞结节性再生,假小叶结构形成,即肝硬化。肝细胞及汇管区内铁颗粒沉积增加可能与HCV进展及干扰素治疗反应相关57。病毒清除或抑制,炎症病变消退,组织学上肝纤维化及肝硬化可呈现不同程度的逆转58-60。
慢性丙型肝炎肝组织炎症坏死的分级(G)、纤维化程度的分期(S),推荐采用国际上常用的METAVIR评分系统61。组织学上肝硬化评价可分为活动期和静止期,建议采用Laennec肝硬化评分系统,即依据纤维间隔的宽窄、硬化结节的大小,将METAVIR肝纤维化分期中的F4细分为F4A、F4B和F4C 62。此外,采用计算机辅助数字化图像分析测定肝组织胶原面积比例(collagen proportionate area,CPA)用于肝纤维化定量评价,在判断临床预后、与肝纤维化无创检测相关性等方面可能优于METAVIR肝纤维化半定量分期63,64。
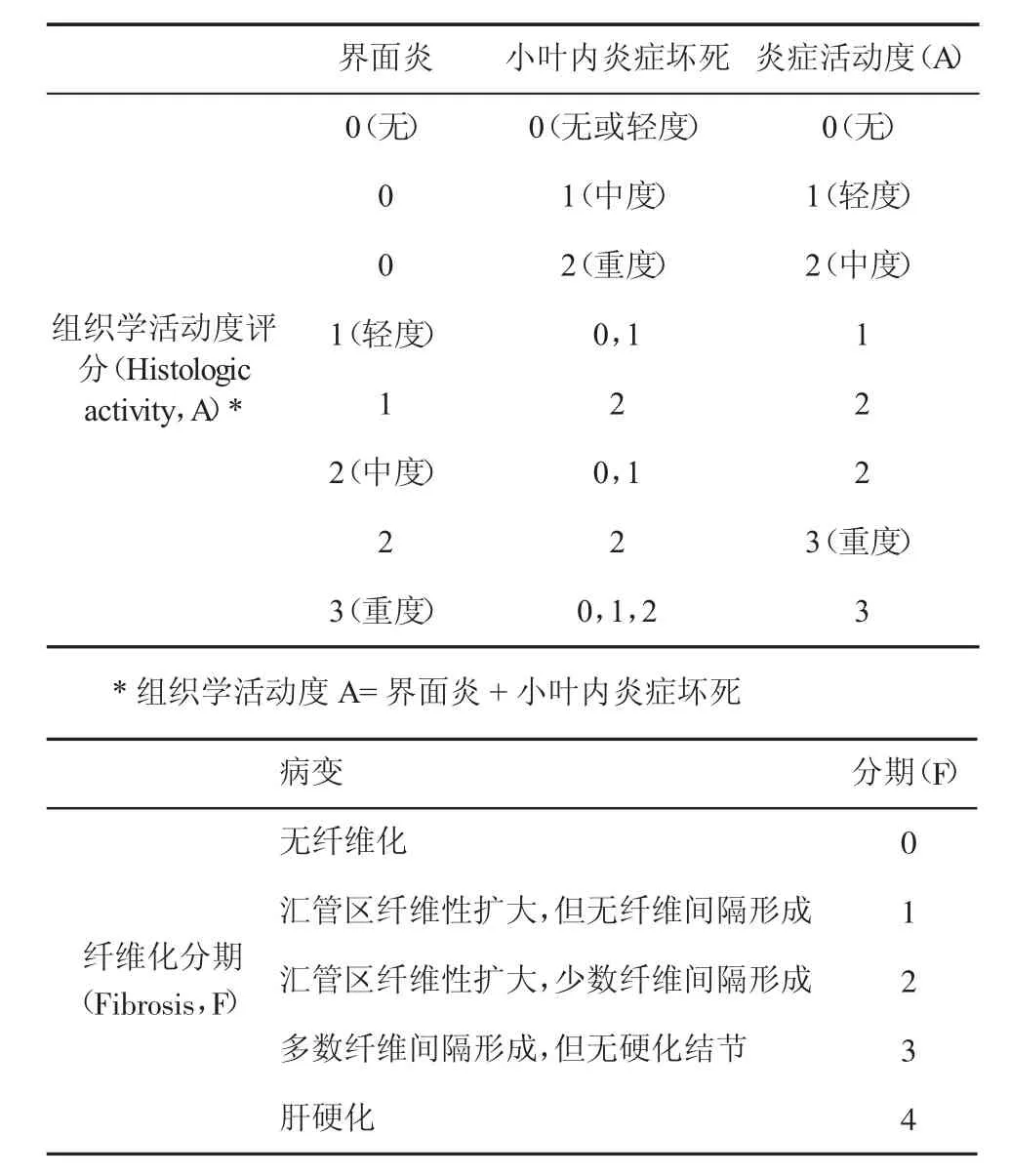
表2 METAVIR病理组织学评分系统
九、临床诊断
(一)急性丙型肝炎的诊断
1.流行病学史:有明确的就诊前6个月以内的流行病学史,如输血史、应用血液制品史或明确的HCV暴露史。
2.临床表现:可有全身乏力、食欲减退、恶心和右季肋部疼痛等,少数伴低热,轻度肝肿大,部分患者可出现脾肿大,少数患者可出现黄疽。部分患者无明显症状,表现为隐匿性感染。
3.实验室检查:ALT多呈轻度和中度升高,也可在正常范围之内,有明确的6个月以内抗-HCV和/或HCV RNA检测阳性结果的检测史。HCV RNA常在ALT恢复正常前转阴,但也有ALT恢复正常而HCV RNA持续阳性者。有上述1+2+3或2+3者可诊断。
(二)慢性丙型肝炎的诊断
1.诊断依据:HCV感染超过6个月,或有6月以前的流行病学史,或发病日期不明。抗-HCV及HCV RNA阳性,肝脏组织病理学检查符合慢性肝炎。或根据症状、体征、实验室及影像学检查结果综合分析,亦可诊断。
2.病变程度判定:肝活检病理诊断可以判定肝脏炎症分级和纤维化分期。HCV单独感染极少引起重型肝炎,HCV重叠HIV、HBV等病毒感染、过量饮酒或应用肝毒性药物时,可发展为重型肝炎。
3.慢性丙型肝炎肝外表现:肝外临床表现或综合征可能是机体异常免疫反应所致,包括类风湿性关节炎、眼口干燥综合征、扁平苔藓、肾小球肾炎、混合型冷球蛋白血症、B细胞淋巴瘤和迟发性皮肤卟啉症等。
十、治疗目标
抗病毒治疗的目标是清除HCV,获得治愈,清除或减轻HCV相关肝损害,阻止进展为肝硬化、失代偿期肝硬化、肝衰竭或肝癌,改善患者的长期生存率,提高患者的生活质量66。其中进展期肝纤维化及肝硬化患者HCV的清除可降低肝硬化失代偿的发生,可降低但不能避免HCC的发生,需长期监测肝癌的发生情况;失代偿期肝硬化患者HCV的清除有可能降低肝移植的需求,对该部分患者中长期生存率的影响需进一步研究;肝移植患者移植前抗病毒治疗可改善移植前的肝功能及预防移植后再感染,移植后抗病毒治疗可提高生存率45。
十一、抗病毒治疗的适应证
1.聚乙二醇化干扰素联合利巴韦林(PR)治疗的适应证
DAAs上市之前,PR方案仍是我国现阶段HCV感染者接受抗病毒治疗的主要方案,可应用于所有基因型HCV现症感染,同时无治疗禁忌证的患者48。该方案的治疗禁忌证包括绝对禁忌证和相对禁忌证(表3)。如患者具有绝对禁忌证,应考虑使用以直接抗病毒药物(DAAs)为基础的方案。如患者具有相对禁忌证,而DAAs药物获取困难,则应充分考虑患者的年龄,对药物的耐受性,所患非HCV感染相关的其他疾病的严重程度,患者的治疗意愿及HCV相关肝病进展情况等综合因素,全面衡量后再考虑是否应用PR方案。

表3 聚乙二醇化干扰素与利巴韦林的绝对禁忌证和相对禁忌证
2.直接抗病毒药物(DAAs)治疗的适应证
DAAs在多个国家已有多种药物获批上市,部分DAAs在我国尚处于临床试验阶段,但不久将获批应用于临床。以DAAs为基础的抗病毒方案包括1个DAA联合PR,DAAs联合利巴韦林,以及不同DAA联合或复合制剂45。目前的临床研究暂未有关于DAAs药物绝对禁忌证的报道,因此上述DAAs的三种方案可以涵盖几乎所有类型的HCV现症感染者的治疗。这些含DAAs的方案尤其适用于PR治疗后复发或是对PR应答不佳的患者。初治患者也可考虑使用含DAAs的方案,以缩短疗程,增加耐受性,提高SVR率。当患者有干扰素治疗禁忌证时,可考虑使用无干扰素方案;当患者有利巴韦林禁忌证时,可考虑使用不同DAAs联合或复合制剂。不同类型DAAs有不同的联合方案,某一DAA与不同药物联合后适用的感染者人群受病毒基因型的影响。有的DAAs联合方案适用于所有基因型HCV感染的人群,有的仅适用于某些基因型。DAAs的适应证同时受疾病状态与药物相对禁忌证的影响。部分DAAs的代谢产物对肾功能的影响暂未确定,严重肾功能受损患者的使用需慎重66。DAAs药物是否适宜在儿童中应用也暂不确定,尚需要进一步的研究数据67。
治疗人群:所有HCVRNA阳性的患者,只要有治疗意愿,无治疗禁忌证,均应接受抗病毒治疗。但在医疗资源有限的情况下,应在考虑患者意愿,患者病情及药物可及性的基础上,让部分患者优先得到治疗。
具有重度肝纤维化或肝硬化的患者68-72、合并HIV73、HBV感染74、同时存在其他肝病(如NASH)的患者75,76、实体器官移植指针的移植前HCV感染者,或器官移植后出现HCV复发的患者77,78,存在病情加重的高风险,通过采用适宜的抗病毒方案进行治疗能缓解病情,及时获益。这部分患者应优先治疗。
有显著的HCV感染相关肝外表现的患者(包括HCV感染相关冷球蛋白血症及其导致的系统性血管79,80、HCV免疫复合物相关的肾炎81、非霍奇金B细胞淋巴瘤等82、合并2型糖尿病的患者83,84、合并迟发性皮肤卟啉病85以及疲劳虚弱的患者86,发生了严重并发症,通过采用适宜的方案进行治疗,可以改善肝外症状,降低并发症进一步加重的风险。也应优先治疗。
活动性静脉用药者87、有高危性行为者88、处于育龄有怀孕意愿的女性89、血液透析患者90、服刑人员等91以及进行暴露性操作的医务人员存在传播HCV感染高风险,这部分患者采用适宜方案治疗后,自身有较大获益的同时也具有控制病毒传播的价值,同样应优先治疗46。
上述优先治疗人群,如果存在干扰素和利巴韦林的禁忌证或者不能耐受干扰素和利巴韦林的治疗,需要尽早获得DAAs进行治疗。
有研究显示在重度纤维化发生之前启动抗病毒治疗能更大程度地降低肝硬化失代偿等终末期事件发生率92,因此中度肝纤维化的慢性丙型肝炎患者也应积极考虑治疗。轻度肝纤维化或无纤维化的慢性丙型肝炎患者为避免肝病进一步发展,更应积极考虑治疗。但如果该类患者因药物可及性或经济等客观因素考虑延迟治疗,也要通过评估患者年龄,疾病的自然病程和相关并发症的发生风险,考虑患者的意愿及权益,知情同意后再作出是否延迟治疗的决定,并应定期随访评估93。
推荐意见3:所有HCV RNA阳性的患者,只要有治疗意愿,无治疗禁忌证,均应接受抗病毒治疗。
推荐意见4:PR方案是我国现阶段HCV现症感染者抗病毒治疗的主要方案,可应用于所有基因型HCV感染同时无治疗禁忌证的患者。
推荐意见5:以DAAs为基础的抗病毒方案包括DAA联合PR,DAAs联合利巴韦林,以及不同DAAs联合或复合制剂,三种方案可涵盖几乎所有类型的HCV感染者。即使医疗资源有限,也要在考虑患者意愿,病情及药物可及性的基础上,再决定优先接受抗病毒治疗的患者。
十二、聚乙二醇化干扰素α联合利巴韦林治疗初治患者及监测
一旦确诊为慢性丙型肝炎且血液中检测到HCV RNA,即应进行规范的抗病毒治疗。治疗前应根据病毒载量、基因分型、肝纤维化分期以及有无抗病毒治疗禁忌证等综合评估94。
目前我国批准用于慢性丙型肝炎的治疗药物为聚乙二醇化干扰素α(PEG IFN-a)、普通干扰素和利巴韦林95。PEG IFN-2a给药剂量为180μg,每周1次皮下注射,按中国国家处方集PEGIFNα-2b推荐剂量为1.5μg/kg每周1次皮下注射96。
国外临床试验结果显示,PEGIFNα联合利巴韦林治疗48周,停药后24周持续病毒学应答(SVR)(54%~56%)明显优于普通干扰素联合利巴韦林(44%~47%)97。国外研究数据表明HCV基因2或3型接受PEG IFN a-2a联合利巴韦林或PEG IFN a-2b联合利巴韦林治疗24周,其SVR为76%和82%。基因3型SVR略低于基因2型98。
在DAA上市前,PEG IFN a联合利巴韦林仍然是我国目前慢性丙型肝炎主要的抗病毒治疗方案,其次是普通IFN a与利巴韦林联合疗法,均优于单用IFN。国家十一五重大传染病专项丙型肝炎的临床研究结果表明,对于基因1b型或高病毒载量(HCV RNA≥4×105IU/ml)的初治患者,采用PEGIFNα2a联合利巴韦林治疗48周,在治疗12周时HCV RNA<15 IU/mL的患者,90.8%的患者可以获得SVR;若未达到cEVR者,PEGIFNα2a联合利巴韦林治疗72周和96周,其SVR率差异无显著性意义100。对基因2/3型患者治疗24周,SVR率为90.0%,基因6型患者SVR率为100%(10/10)。因此,如无利巴韦林的禁忌证,均应采用联合治疗。
1.治疗方案
在接受PEG IFN a联合利巴韦林治疗过程中应根据治疗中病毒应答进行个体化治疗(Response-guided therapy,RGT)。治疗前、治疗4周、12周、24周应采用高灵敏度方法监测HCV RNA以评估病毒应答指导治疗。
(1)基因1型或基因6型的治疗方案
①首先推荐使用聚乙二醇化干扰素联合利巴韦林治疗,基本疗程为48周。在治疗过程中应根据不同应答给予相应处理,见图2 47,94,100。
②普通IFNα联合利巴韦林治疗方案:IFNα3~5MU,隔日1次肌肉或皮下注射,联合口服利巴韦林1000mg/d,建议治疗48周。
③不能耐受利巴韦林不良反应者的治疗方案:可单用普通IFNα或PEGIFN-a,方法同上。或在医生指导下使用DAAs治疗。
(2)基因2型、3型治疗方案
①聚乙二醇化干扰素联合利巴韦林的治疗方案:这是HCV基因2型或3型的首先推荐方案。利巴韦林给药剂量为每天800mg。但若患者存在低应答的基线因素,如胰岛素抵抗、代谢综合征、重度肝纤维化或肝硬化、年龄较大),利巴韦林则应根据体重给药47,94,100。在接受PEG IFNα联合利巴韦林治疗过程中应根据不同应答给予相应处理,见图3 47,94,100。
②普通IFNα联合利巴韦林治疗方案:IFNα3MU每周3次肌肉或皮下注射,联合应用利巴韦林800~1000mg/d,治疗24~48周。
③不能耐受利巴韦林不良反应者的治疗方案:可单用普通IFNα或PEGIFNα。或在医生指导下使用DAAs治疗。
2.接受干扰素联合利巴韦林治疗过程中患者的随访和监测
(1)治疗前监测:治疗前应检测肝肾功能、血常规、甲状腺功能、自身抗体、血糖、尿常规、眼底,可检测IL-28B基因分型。
(2)生化学检测:治疗期间每个月检查ALT,治疗结束后6个月内每2月检测1次。即使患者HCV未能清除,也应定期复查ALT。
(3)病毒学检查:在治疗过程中采用敏感、准确的HCV RNA检测方法监测疗效。在基线、治疗4周、12周、24周、48周以及治疗结束后24周,检测血HCV RNA水平有助于监测疗效并指导疗程的决策。
(4)不良反应的监测:所有患者在每次随访中都应评估不良反应包括严重乏力、抑郁、失眠、皮肤反应和呼吸困难等。干扰素和利巴韦林对血液学的不良反应包括中性粒细胞减少、贫血、血小板降低和淋巴细胞减少。在开始治疗后的第1个月内应每周检查1次血常规,以后间隔4~8周检查1次直至6个月,然后每3个月检查1次,如遇血细胞明显减低者,可以增加血常规的检测频率。所有患者在治疗过程中每12周、治疗结束后每3~6个月检测甲状腺功能,如治疗前就已存在甲状腺功能异常,则应每月检查甲状腺功能。对于老年患者,治疗前应做心电图检查和心功能判断。应定期评估精神状态,对出现明显抑郁症和有自杀倾向的患者,应停药并密切防护,给予相应治疗47,94,95,100。
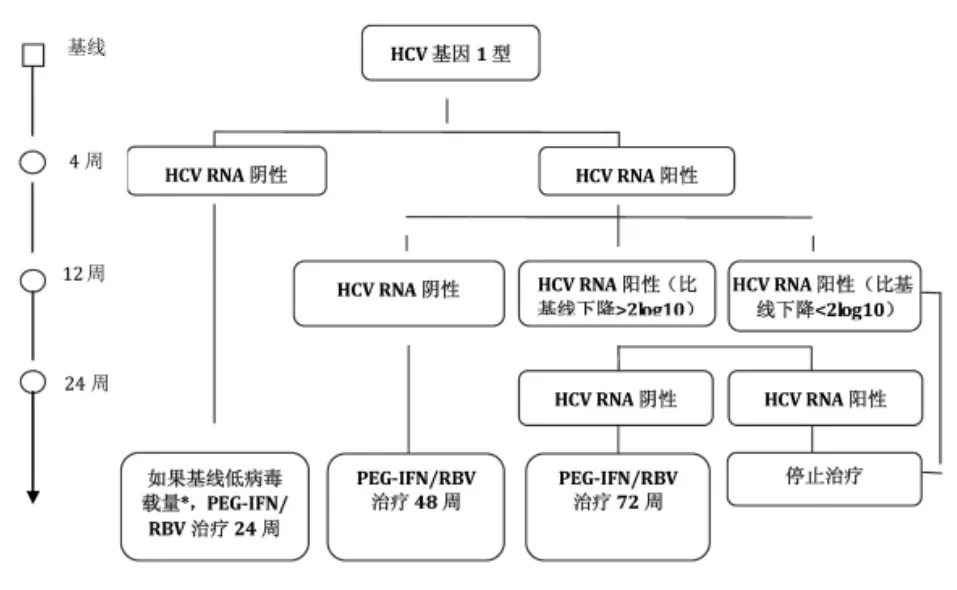
图2:HCV基因1型患者接受PEG-IFN联合利巴韦林过程中根据病毒学应答指导治疗。

图3:HCV基因2/3型患者接受PEG-IFN联合利巴韦林过程中根据病毒学应答指导治疗。
建议在0周、4周、12周和24周采用高灵敏度方法检测HCV RNA(最低检测下线:<15IU/mL)。
低应答因素:胰岛素抵抗、代谢综合征、重度肝纤维化或肝硬化、年龄较大。
推荐意见6:一旦确诊为慢性丙型肝炎且血液中检测到HCV RNA,即应进行规范的抗病毒治疗。治疗前应根据病毒载量、基因分型、肝纤维化分期以及有无抗病毒治疗禁忌证等综合评估。(A1)
推荐意见7:在DAA上市前,PEG IFNα联合利巴韦林仍然是我国目前治疗慢性丙型肝炎主要的抗病毒治疗方案。(A1)
推荐意见8:在接受PEGIFNα联合利巴韦林治疗过程中应根据治疗中病毒应答进行个体化治疗。治疗前、治疗4周、12周、24周应采用高灵敏度方法监测HCV RNA评估病毒应答以指导治疗。(B1)
推荐意见9:无论何种基因型,如治疗12周HCV RNA下降幅度<2 log,或24周仍可检测到,则考虑停药。(B1)
推荐意见10:在治疗过程中应定期监测血液学、生化学和HCV RNA以及不良反应等。(B1)
十三、聚乙二醇化干扰素α联合利巴韦林治疗经治未获得持续病毒学应答患者
经过抗病毒治疗后仍有部分患者不能获得SVR,尤其是既往抗病毒治疗方案不规范,如单用普通IFN-α或Peg-IFN-α;使用普通IFN-α联合利巴韦林或使用Peg-IFN-α联合利巴韦林,但是普通IFN-α、Peg-IFN-α 和/或利巴韦林的剂量不够、疗程不足。抗病毒治疗未获得SVR的患者可根据病毒应答情况分为以下两类:(1)病毒复发(virological relapse):治疗结束时HCV RNA未检测到,但是停药后24周内出现HCV RNA阳转。(2)病毒无应答(virological non-response):治疗中从未出现过HCV RNA未检测到,其中部分患者治疗12周HCV RNA下降<2 log IU/ml,称为病毒无应答(virological null response)。
1.复发患者的再次治疗
应该首先考虑DAAs治疗方案。在DAAs不可及的情况下,既往单用普通IFN-α或Peg-IFN-α治疗复发的患者,再次给予Peg-IFN-α联合利巴韦林治疗48周,其SVR率为93%;既往使用普通IFN-α联合利巴韦林治疗复发的患者,再次给予Peg-IFN-α联合利巴韦林治疗48周,其SVR率为85%。既往经过规范Peg-IFN-α联合利巴韦林治疗复发的患者,再次给予Peg-IFN-α联合利巴韦林治疗48周,SVR率为71%。cEVR是SVR的重要预测因子,获得cEVR的患者,86.4%获得SVR101。国外的荟萃分析共入选18个RCT研究,对基因1型复发患者,应用高剂量的Peg-IFN或普通IFN联合利巴韦林延长治疗可改善SVR率为43-69% 102。如果复发患者,不存在迫切治疗的需求,例如没有以下情况:显著肝纤维化或肝硬化(F3 F4)、HIV或HBV合并感染等、等待肝移植、肝移植后HCV复发、明显肝外表现、传播HCV的高危个体等,可以选择等待更多的药物,获得更多可选的治疗方案后再治疗。
2.无应答患者的再次治疗
应该首先考虑DAAs治疗方案。在DAAs不可及的情况下,既往单用普通IFN-α或Peg-IFN-α治疗无应答的患者,再次给予Peg-IFN-α联合利巴韦林治疗72周,其SVR率为75%;既往使用普通IFN-α联合利巴韦林治疗无应答的患者,再次给予Peg-IFN-α联合利巴韦林治疗72周,其SVR率为76%。既往经过规范Peg-IFN-α联合利巴韦林治疗无应答的患者,再次给予Peg-IFN-α联合利巴韦林治疗72周,SVR率为47%。12周能获得cEVR的患者91%获得SVR 103。国外的一项荟萃分析共入选18个RCT研究,对基因1型无应答患者,应用高剂量的Peg-IFN联合利巴韦林治疗SVR率≤18%102。另一项荟萃分析的结果提示无应答患者再次Peg-IFN-α联合利巴韦林治疗SVR仅为16.3%,但是无超体重或基因2/3型患者SVR率则高。无应答患者再次治疗时,24周仍未出现应答则应停止治疗104。
推荐意见11:既往PR治疗复发或无应答的患者应首先考虑DAAs治疗。(A1)
推荐意见12:既往治疗未采用Peg-IFN-α联合利巴韦林,或者治疗的剂量不够、疗程不足导致复发的患者,可给予Peg-IFN-α联合利巴韦林再次治疗,疗程48周,治疗监测及停药原则同初治患者。(B2)
推荐意见13:既往治疗复发的患者,如果不存在迫切治疗的需求,例如没有以下情况:显著肝纤维化或肝硬化(F3 F4)、HIV或HBV合并感染等、等待肝移植、肝移植后HCV复发、明显肝外表现、传播HCV的高危个体等,可以选择等待获得可及适合的药物再治疗。(A2)
推荐意见14:既往治疗未采用Peg-IFN-α联合利巴韦林,或者治疗的剂量不够、疗程不足无应答的患者,可给予Peg-IFN-α联合利巴韦林再次治疗,疗程延长至72周,治疗监测及停药原则同初治患者。(B2)
推荐意见15:既往规范治疗无应答患者,可等待获得可及适合的药物再治疗,但是有迫切治疗需求的患者应尽早进行直接抗病毒药物的治疗。(A2)
十四、直接抗病毒药物治疗初治及经治患者
我国目前HCV感染的标准治疗方案是Peg-IFN-α联合利巴韦林,按此治疗仍有相当一部分患者不能治愈或者不能耐受该治疗方案。针对HCV生活周期中病毒蛋白靶向特异性治疗的许多小分子化合物得到了迅速发展,提高了抗病毒的疗效。这些药物统一命名为抗HCV的直接抗病毒药物(directlyactingantivirals,DAAs),包括非结构蛋白(non-structural,NS)3/4A蛋白酶抑制剂、NS5A抑制剂和NS5B聚合酶抑制剂等。2011年以来,这类药物中的多种药物已经陆续在美国和欧洲等地上市,上市的药物如下表4所示。
不同HCV基因型患者,采用的DAA治疗方案以及疗程不同。因此,患者进行DAA抗病毒治疗前,一定要检测HCV基因型,甚至针对基因1型患者,需要区分为是1a型还是1b型。
如果患者能够获得DAA,可以考虑采用以下的治疗方案。
1.基因1型初治或者PR治疗失败的患者
(1)Peg-IFN-α Qw、利巴韦林(<75 kg 1000mg Qd,≥75 kg 1200mg Qd)、simeprevir 150 mg Qd,先联合治疗12周,之后,对于初治和既往复发的患者再单独应用Peg IFN-α和利巴韦林治疗另12周(总疗程24周),对于既往部分应答或无应答者应治疗另36周(总疗程48周)。经直接测序检测到基线存在NS3蛋白酶序列Q80K变异的基因1a型感染者,不采用该联合方案,但是国内基因1a型患者比例仅为1.4%左右6。我国和韩国的数据显示初治基因1型患者采用该方案的SVR率为91%,并且耐受性良好。IL28B CC患者SVR率为94%,非CC患者为79%;METAVIR评分为F4的5例患者均获得了SVR 105。在治疗4周,12周或24周时。HCV RNA≥25 IU/ml,应该停止治疗。
(2)Peg-IFN-αQw、利巴韦林、sofosbuvir 400 mg Qd,治疗12周。国外数据显示初治患者采用该方案,总体SVR率为89%,基因1a型患者为92%,而基因1b型患者为82% 106,既往Peg-IFN-α联合利巴韦林治疗失败的患者SVR率预计为78%107。
(3)Sofosbuvir 400 mg和ledipasvir 90 mg复合片剂,1 片Qd。无肝硬化患者疗程12周,甚至无肝硬化的基线低病毒载量(HCV RNA<6×10^6IU/mL)的初治患者可考虑缩短疗程至8周;代偿期肝硬化患者应联合利巴韦林疗程12周;代偿期肝硬化患者如有利巴韦林禁忌或不耐受,则不使用利巴韦林,但是疗程延长至24周;如果为代偿期肝硬化经治患者以及存在不利于应答因素,应联合利巴韦林并且疗程延长至24周。国外数据显示使用该方案治疗患者总体SVR率为93%-99%108-110。
(4)Ombitasvir(75 mg)、paritaprevir(12.5 mg)和ritonavir (50 mg)复合单片药(2片Qd,与食物同服)以及dasabuvir 250 mg Bid,基因1b型无肝硬化患者疗程12周;基因1b型肝硬化患者疗程12周,并且联合利巴韦林;基因1a型无肝硬化患者疗程12周,并且联合利巴韦林;基因1a型肝硬化患者疗程24周,并且联合利巴韦林。国外数据显示使用该方案治疗患者总体SVR率为91%-100%111-115。
(5)Sofosbuvir 400 mg Qd和simeprevir 150 mg Qd,疗程12周。肝硬化患者加用利巴韦林,对于利巴韦林禁忌的肝硬化患者,需将疗程延长至24周。国外数据显示该方案SVR率为93%-96%44。
(6)Sofosbuvir 400 mg Qd和daclatasvir 60 mg Qd,疗程12周。肝硬化患者加用利巴韦林,对于利巴韦林禁忌的肝硬化患者,需将疗程延长至24周。国外一项IIb期临床试验的数据显示SVR率为95%-100%116。
(7)Asunaprevir 100 mg Bid和daclatasvir 60 mg Qd,疗程24周。日本的一项开放III期临床试验数据显示,基因1b型患者SVR24为87.4%(干扰素不合适/干扰素不耐受),80.5%(无应答或部分应答),肝硬化患者和非肝硬化患者SVR相似,分别为90.9%和84.0%117。
2.基因2型初治或者PR治疗失败的患者
(1)sofosbuvir 400 mg Qd和利巴韦林(<75 kg 1000mg Qd,≥75 kg 1200mg Qd),疗程12周。肝硬化患者,特别是肝硬化经治患者,疗程应延长至16~20周。该方案总体SVR 率95%,无肝硬化患者可达97%,而肝硬化患者为83%118。
(2)肝硬化和/或经治患者可应用Peg-IFN-α QW、利巴韦林和sofosbuvir 400 mg Qd,疗程12周,或者sofosbuvir 400 mg Qd和daclatasvir 60 mg Qd,疗程12周。
3.基因3型初治或者PR治疗失败的患者
(1)Peg-IFN-α Qw、利巴韦林(<75 kg 1000mg Qd,≥75 kg 1200mg Qd)和sofosbuvir 400 mg Qd三联治疗,疗程12周。
(2)利巴韦林和sofosbuvir 400 mg Qd,疗程24周。非肝硬化初治患者采用此方案SVR率为94%,非肝硬化经治患者为87%,而肝硬化经治患者SVR率仅为60%,因此肝硬化经治患者不建议选择此方案119。
(3)Sofosbuvir 400 mg Qd和daclatasvir 60 mg Qd,无肝硬化患者疗程12周,有肝硬化患者,联合利巴韦林疗程为24周。
4.基因4型初治或者PR治疗失败的患者
对于基因4型患者,含IFN和DAA的两个三联方案同基因1型患者。使用无IFN方案Sofosbuvir 400 mg和ledipasvir 90 mg复合片剂,或者sofosbuvir 400 mg Qd和simeprevir 150 mg Qd,或者sofosbuvir 400 mg Qd和daclatasvir 60 mg Qd的方案,同基因1型。采用ombitasvir (75 mg)、paritaprevir(12.5 mg)和ritonavir(50 mg)复合单片药(2片Qd,与食物同服)治疗时,需要联合利巴韦林,但是不联合dasabuvir,无肝硬化患者疗程12周,肝硬化患者疗程24周120。
5.基因5/6型初治或者PR治疗失败的患者
(1)Peg-IFN-α Qw、利巴韦林(<75 kg或≥75 kg的患者剂量分别为1000或1200 mg/d)和sofosbuvir 400 mg Qd,疗程12周。
(2)Sofosbuvir 400 mg和ledipasvir 90 mg固定剂量联合片剂,1片Qd,具体方案同基因1型121。
(3)Sofosbuvir 400 mg Qd和daclatasvir 60 mg Qd,疗程12周。肝硬化患者加用利巴韦林,利巴韦林禁忌的肝硬化患者需将疗程延长至24周。
患者治疗过程中应进行疗效监测和安全性监测。疗效监测主要是检测HCV RNA,应采用灵敏度高的实时定量PCR试剂(检测下限<15 IU/ml),在治疗的基线、第4周、12周、治疗结束时、治疗结束后12或24周应检测HCV RNA。采用Peg-IFN-α、利巴韦林和simeprevir三联治疗的患者,如果治疗第4周、12周或24周时的HCV RNA用灵敏试剂能检测到,应停止治疗,更换为包括另一种DAA的含IFN的治疗方案,或者不包括蛋白酶抑制剂的无IFN治疗方案。育龄期妇女和/或她们的男性伴侣必须在使用利巴韦林时以及停药后6个月采用有效的避孕措施;接受sofosbuvir治疗的患者,应定期监测肾功能;皮疹和间接胆红素升高但不伴ALT升高,可能与simeprevir相关。使用DAA治疗,应了解药品说明书中指出的具有相互作用的其他药物,如果可能的话,HCV治疗期间应停止有相互作用的合并用药,或者转换为具有较少相互作用的合并用药。
治疗方案
十五、特殊人群抗病毒治疗推荐意见
1.儿童的治疗和管理
儿童HCV感染的诊断及评价与成人一样,但一般来说儿童感染时间相对较短,疾病进展缓慢,治疗指征与成人相比应该更严格,即有明显肝纤维化时(F2以上)开始治疗。HCV感染母亲所生的新生儿诊断依赖HCV RNA的检测。

表4 2015年美国、欧盟及部分亚太国家批准上市的治疗丙型肝炎药物

表5 初治以及既往PR治疗失败的无肝硬化患者的治疗方案
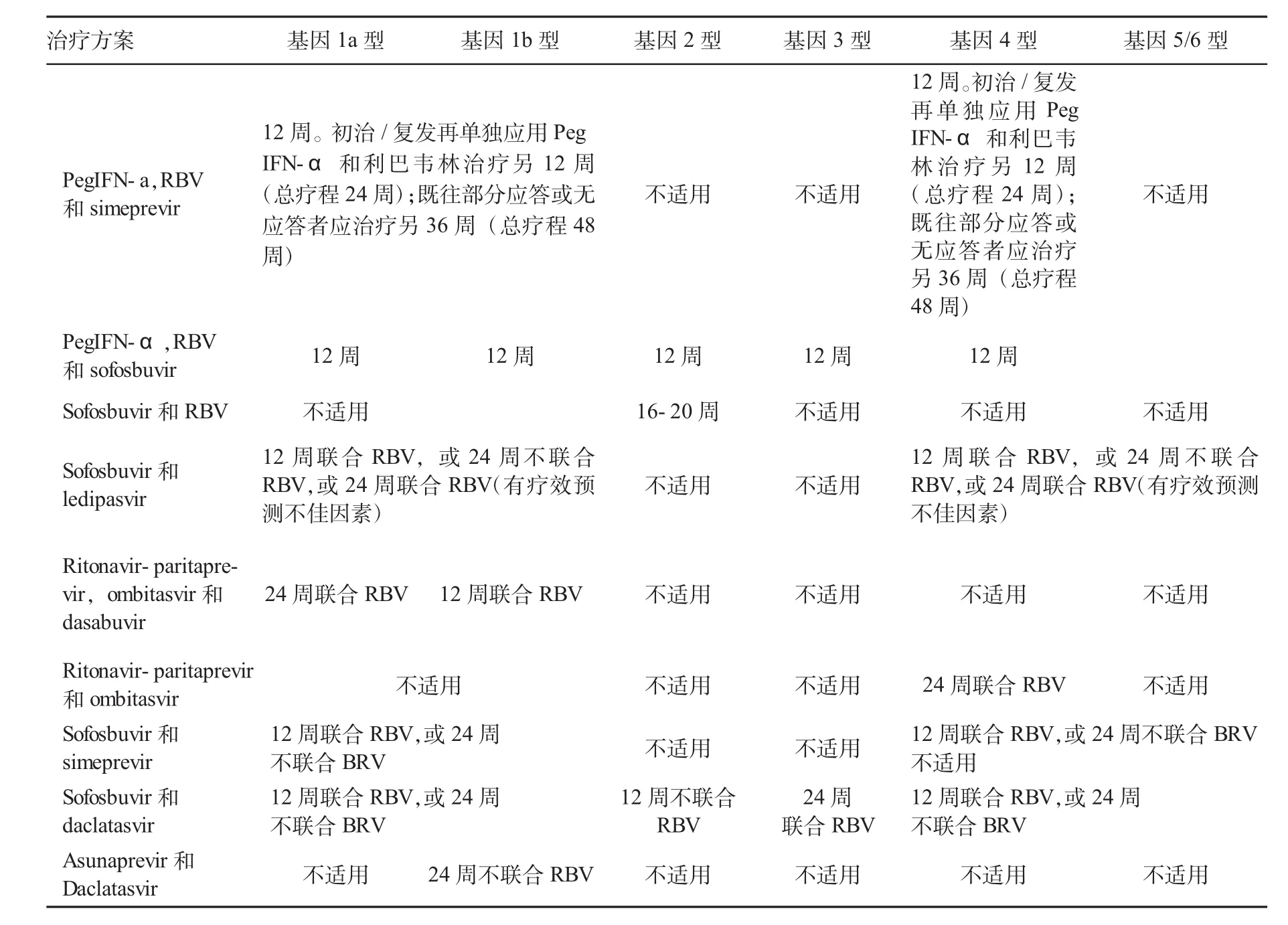
表6 初治以及既往PR治疗失败的肝硬化患者的治疗方案
2014年WHO指南指出,尽管在儿童中开展的临床研究比较少,但结果显示儿童抗病毒治疗疗效与成人相似。目前被批准的儿童抗病毒治疗药物为干扰素(普通和聚乙二醇干扰素),适合2岁以上的儿童。
临床研究显示儿童CHC应用PEG-IFN/RBV联合治疗总的SVR为50-70%,与成人的SVR相似。主要的不良反应是流感样症状和白细胞减少122,123。同时研究结果也显示,在不同基因型中,IFN联合RBV与IFN单药治疗的SVR不同,其中基因2和3型的SVR明显高于基因1型(90%和50%),联合治疗明显高于单药治疗目前DAA均未做儿童的临床研究,尚无儿童用药指征。
2.肾损害患者的治疗和管理
HCV感染合并慢性肾损害包括慢性肾病、血液透析及肾衰竭的患者。治疗前应该评估两种疾病的风险及疾病的严重程度,然后决定是否进行抗病毒治疗及选择何种治疗方案。肾衰竭等待肾移植的患者应该尽早抗病毒治疗,因为移植后应用的免疫抑制剂可以加重、加快肝病进展。
合并肾损害患者首选的治疗是无IFN和无RBV的DAAs方案,药物选择与单纯慢性丙型肝炎患者相同。如果患者的GFR>60mL/min,DAAs无需调整剂量,如果患者的GFR<30mL/min或终末期肾病一般不能应用DAAs,因为以Sofosbuvir为代表的DAAs药物都是在肾脏排泄,目前还没有关于其在肾功不全患者中应用的安全性资料。如果一定要应用需在专家指导下,调整剂量后应用46。
其次也可以选择PEG-IFNα联合RBV的治疗方案,但RBV和PEG-IFNα都需要调整剂量。如果患者的GFR在20~40 mL/min之间,应该将PEG-IFNα-2a的剂量降至135 μg/周,PEG-IFNα-2b的剂量降至1ug/kg/周,同时RBV的剂量也应该调整为每天200 mg或200 mg隔日1次124-126。
3.肝移植患者的治疗和管理
对于肝移植后患者HCV再感染或复发,及时进行抗病毒治疗与患者的全因死亡密切相关127。移植后由于需要长期应用免疫抑制剂,HCV复发或再感染后可以明显加速肝脏纤维化,导致移植肝发生肝硬化甚至肝衰竭。因此,肝移植的患者一旦出现HCV RNA阳性,应该及时抗病毒治疗。首选无IFN的DAAs联合治疗方案,肝移植超过3月的患者也可以应用PEG-IFN联合RBV的治疗方案。等待肝移植的患者至少应该在移植前30天进行抗病毒治疗,以防止移植肝感染。如果肝功能为Child-Pugh A级可以选择RBV(1000或1200 mg,体重<75 kg或>75 kg)联合sofosbuvir(400 mg),直到肝移植。如果是HCC准备移植的患者,且肝功能为Child-Pugh A级,也可以选择PEG-IFN-α/RBV/Sofosbuvir的治疗方案,治疗至少12周。如果肝功能为Child-Pugh B 和C级,选择sofosbuvir/RBV或sofosbuvir+ledipasvir或sofosbuvir/daclatasvir/RBV方案治疗12周,但要密切观察药物的不良反应45,46。
4.肝硬化患者的治疗和管理
大量的队列研究和系统综述显示,伴有明显肝纤维化和肝硬化的患者获得SVR后临床上出现失代偿和HCC的几率明显降低128,129。然而有明显肝纤维化或肝硬化的患者获得SVR的几率,即使采用新的DAAs治疗方案也低于轻、中度纤维化的患者。同时对于肝硬化患者治疗时,还应该密切观察药物的不良反应。因为这组患者一般来说年龄相对较大,容易伴发其他疾病,或者同时应用其他药物,患者的依从性也相对较低。此外,对于肝硬化患者即使清除了病毒,仍然需要监测HCC及门脉高压等相关的并发症130。
一般来说,对于肝功能代偿较好的肝硬化患者,根据病毒基因型的不同,可以选择12-24周以IFN为基础的“二联”或“三联”治疗方案。如果可以获得DAAs的情况下,应该首先选择无IFN的DAAs联合治疗方案。应该强调的是对于Child-Pugh B/C级的失代偿肝硬化患者,首选治疗是尽早进行肝移植。如果不能进行肝移植,抗病毒治疗的目的就是要改善肝功能和提高生存期。由于患者处于疾病的晚期,多伴有其他器官受累,抗病毒治疗需要在专家指导下进行129,130。尽管失代偿肝硬化患者应用sofosbuvir/RBV48周的治疗已经取得了较好的疗效并在一定程度上改善肝功能,但长期预后和是否改善门脉高压还需要进一步观察。
5.吸毒患者的治疗和管理
主要指静脉吸毒患者。应该关注吸毒与疾病进展、吸毒与疗效的关系。重点强调吸毒人群HCV感染的监测,同时治疗期间必须戒毒。由于吸毒人群应用PEG-IFNα治疗的依从性差且疗效低于一般人群,因此如果可以获得DAAs,最好选择无IFN的治疗方案,并强调个体化治疗。
6.血友病/地中海贫血等血液疾病患者的治疗和管理
对于血友病等血液系统疾病患者合并HCV感染时,早期予以干扰素联合利巴韦林治疗HCV总体清除率达53%,其中基因2/3型为86%;而基因1/4型为30%131。血友病等凝血功能紊乱的患者合并HCV感染时,其抗HCV治疗的方案与非凝血功能紊乱患者相同,但要注意补充相应凝血因子,同时针对疾病进展的监测建议选用纤维弹性成像等无创性检查更安全。抗HCV的DAAs可用于该类患者的HCV治疗45。
地中海贫血、镰刀细胞贫血的患者合并HCV感染时,聚乙二醇干扰素a联合利巴韦林抗病毒治疗可能引起贫血进一步加重,因此针对该类患者建议选用无干扰素和无利巴韦林的DAAs联合治疗方案。若必须含有RBV的联合方案是,要注意定期监测血常规,必要时予以输血等支持治疗。
7.精神疾患患者的治疗和管理
慢性HCV感染可引起中枢或外周神经系统神经、精神异常,常见为焦虑、抑郁、失眠等,应与肝性脑病鉴别132,133。既往有精神病史的患者,为聚乙二醇干扰素α治疗禁忌,针对该类患者条件许可可考虑予以无干扰素的DAAs抗HCV治疗。若治疗期间出现精神症状,可予以抗精神类药物治疗。在使用抗精神药物和抗HCV药物治疗时,要注意药物间的相互作用,如simeprevir可增加咪达唑仑的血药浓度,对于这类患者应注意定期复查。
8.HBV合并感染患者的治疗和管理
合并HBV感染时,患者HBV DNA多处于低复制水平或低于检测值,而HCV多为肝病进展的主要因素45。因此对于该类患者要注意检测HBV和HCV的活动状态,以决定如何选择抗病毒治疗方案134。如果患者HCV RNA阳性且HBV DNA低于检测值时,应根据HCV基因型选用抗HCV药物;该类患者在经治疗HCV获得SVR后,HBVDNA有再次活动的风险,因此在治疗期间和治疗后要注意监测HBV DNA水平,若HBV DNA水平明显升高应加用核苷(酸)类似物抗HBV治疗134。若HBV DNA阳性而HCV RNA也阳性,可考虑现予以聚乙二醇干扰素a联合利巴韦林抗HCV治疗,但在治疗期间注意监测HBV DNA水平,若HBV DNA活动可考虑加用核苷类似物抗HBV治疗。若HCV RNA阴性而HBV DNA阳性,可考虑予以干扰素或核苷类似物抗HBV治疗。若HBV DNA和HCV RNA均低于检测值,可定期复查肝功能、肿瘤标记物、肝脏B超、HBV DNA和HCV RNA等,暂缓予以抗病毒治疗135。
9.HIV合并感染患者的治疗和管理
合并HIV感染时可能引起病情进展,尤其是伴有免疫功能不全或CD4+细胞明显降低的患者,因此所有合并HIV感染患者均需要评估是否抗HCV治疗。治疗前可予以肝脏穿刺活检或非侵入性检查评估肝脏严重情况。当合并HIV感染患者伴免疫力低下,合并CD4+细胞<200个/ul时予以抗HCV治疗可以增加CD4+细胞水平。予以聚乙二醇干扰素a联合利巴韦林抗病毒治疗时,应尽量避免使用去羟肌苷,司他夫定和齐多夫定等药物。
针对合并HIV感染的慢性丙型肝炎患者,其治疗方案与慢性HCV患者相同。对于合并HIV感染的患者,若HIV处于非活动性复制状态,仍可予以聚乙二醇干扰素α治疗。针对基因2/3型患者,可考虑予以聚乙二醇干扰素α联合固定剂量的利巴韦林抗病毒治疗;针对基因1型患者,聚乙二醇干扰素a联合以体重为基础的利巴韦林剂量抗病毒治疗。但目前有部分学者认为以体重为基础的利巴韦林剂量与传统800mg qd剂量相比,疗效无明显增加136。同时增加利巴韦林剂量可能引起贫血等潜在风险。对于早期应答理想的患者疗程为24周,对早期应答效果不佳的患者疗程应为48周。
对于合并HIV感染而且HIV活动的HCV基因1型的患者,无论是丙型肝炎初治或经治,均建议予以ledipasvir/sofosbuvir加利巴韦林治疗12周,若存在利巴韦林禁忌或代偿期肝硬化患者可予以ledipasvir/sofosbuvir治疗24 周46。
10.急性丙型肝炎患者的治疗和管理
急性丙型肝炎患者的慢性化率高达50-90%,因此对于这类患者应积极处理。但针对急性HCV患者何时开始抗HCV治疗目前观点不统一。部分学者认为若伴有ALT升高,无论有无其他临床症状均建议抗HCV治疗137;而其他学者建议每4周复查一次HCV RNA,对持续12周HCV RNA阳性患者才考虑抗病毒治疗138。
单用干扰素治疗获得持续病毒清除率高达90%;但合并HIV感染时,单用聚乙二醇干扰素α其SVR较低。若早期抗HCV治疗病毒应答佳,则建议持续单用聚乙二醇干扰素α治疗12周;若应答不佳则考虑联合或不联合利巴韦林抗病毒治疗,疗程持续48周。对于HIV患者合并急性HCV感染时,可考虑予以聚乙二醇干扰素α联合利巴韦林治疗,其疗程为24周。针对慢性HCV的无干扰素、无利巴韦林治疗方案也可用于急性HCV患者,但目前数据较为有限。HCV暴露后预防性予以抗HCV治疗目前缺乏有效数据。
推荐意见16:PEG-IFNα-2a 104ug/M2体表面积,PEG-IFNα-2b 60ug/M2体表面积,每周1次皮下注射,联合RBV 15mg/kg/d,治疗时间同成人。
推荐意见17:Simeprevir,daclatasvir,及ritonavir boosted paritaprevir,ombitasvir和dasabuvir均在肝脏代谢,可以用于合并肾功不全的患者,而eGFR<30 ml/min/1.73 m2和终末期肾病的患者使用Sofosbuvir目前没有证据。DAAs治疗方案,无肝硬化患者治疗12周,肝硬化患者治疗24周。PEG-IFNα联合RBV应根据eGFR调整剂量。
推荐意见18:肝移植前至少30天应该开始抗病毒治疗,防止移植后HCV再感染。Sofosbuvir+RBV(基因2型),sofosbuvir+ledipasvir(基因1、4、5、6型)或sofosbuvir+ daclatasvir+RBV(所有基因型)。
推荐意见19:肝移植后复发或再感染的患者,首选sofosbuvir+RBV或sofosbuvir+ledipasvir或sofosbuvir+daclatasvir+RBV,疗程12周。肝移植超过3月的患者也可以PEG-IFNα+RBV,疗程24-48周或PEG-IFNα+sofosbuvir+RBV,疗程12周。
推荐意见20:代偿肝硬化(Child-Pugh A级),根据不同基因型应用标准剂量PEG-IFNα联合RBV的治疗方案,疗程48-72周,PEG-IFNα+sofosbuvir+RBV,疗程12-24周;sofosbuvir+daclatasvir,疗程12-24周,优先推荐无IFN的治疗方案。
推荐意见21:失代偿肝硬化(Child-Pugh B/C级),选择无IFN和无RBV的治疗方案,所有基因型均可以采用sofosbuvir+daclatasvir联合治疗,疗程24周。选择sofosbuvir+Ledipasvir,基因1/4/5/6型:疗程24周。基因2/3型:疗程16-20周,IFN为基础的治疗是禁忌证,DAAs均不需要调整剂量。
推荐意见22:所有肝硬化患者获得SVR后仍然需要每6月做肝脏超声来监测HCC。
推荐意见23:首选无IFN或PEG-IFN为基础的新“三联”治疗方案,但仍需要评估其安全性和有效性。获得SVR后,仍需通过HCV RNA检测监督其再感染及重新吸毒。
推荐意见24:血友病等凝血功能紊乱的患者合并HCV感染,针对HCV的治疗方案与不合并血友病的患者方案相同(B2)。
推荐意见25:地中海贫血、镰刀细胞贫血等患者合并HCV感染时,抗HCV治疗方案与非贫血患者相同,但建议选用无干扰素和无利巴韦林的DAAs联合治疗方案,必须选用利巴韦林治疗时,注意监测血常规等,必要时予以输血治疗(B2)。
推荐意见26:有精神病史的HCV患者,条件允许可考虑予以无干扰素的DAAs抗HCV治疗(B2)。抗HCV治疗前应评估精神状态,治疗期间注意监测精神状态,必要时予以抗精神类药物治疗(C2)。在使用抗精神药物和抗HCV药物治疗时,要注意药物间的相互作用(B2)。
推荐意见27:合并HBV感染时,针对HCV的治疗与单纯HCV感染治疗的方案相同(B1)。
推荐意见28:在抗HCV治疗的同时注意监测HBV DNA,若HBV DNA明显活动时可予以核苷类似物抗HBV治疗(B1)。
推荐意见29:合并HIV感染时,针对HCV的治疗与单纯HCV感染治疗的方案相同(B1)。
推荐意见30:合并HIV感染时,若HIV不活动而HCV活动,针对基因2、3型HCV患者,即使干扰素早期应答不佳仍可考虑予以聚乙二醇干扰素a延长疗程治疗(B1)。
推荐意见31:合并HIV感染时,若HCV基因1型患者,可考虑予以ledipasvir/sofosbuvir治疗(A1)。
推荐意见32:急性感染HCV感染患者,推荐单用聚乙二醇干扰素a治疗(A1)。
推荐意见33:HIV患者合并急性HCV感染时可考虑予以聚乙二醇干扰素a联合利巴韦林治疗,疗程24周(B1)。
十六、监测和随访
(一)、对于未治疗或治疗失败的患者
对于因某种原因未进行抗病毒治疗者,应该明确未治疗的原因、以及未治疗原因对于丙型肝炎疾病进展的可能影响。根据未治疗的具体原因和疾病状态,首先治疗对于总体生存影响最重要的疾病,积极治疗禁忌证和并发疾病,寻找抗病毒治疗时机。对于肝硬化失代偿和HCC患者,首先应该考虑肝移植。如果确实目前不能治疗,推荐以无创诊断方式每年复查、评价一次肝纤维化的进展情况;对于有肝硬化基础的患者,推荐,每6个月复查一次腹部超声和AFP。
对于既往抗病毒治疗失败者,应该明确既往治疗的方案以及治疗失败的临床类型(无应答,或复发,或突破)、有无肝硬化,根据药物可及性和DAA的靶点不同选择没有交叉靶点的DAA组合方案。并推荐以无创诊断方式每年复查、评价一次肝纤维化的进展情况;对于有肝硬化基础的患者,推荐每6个月复查一次腹部超声和AFP。每年复查一次胃镜,观察食管胃底静脉曲张情况。
(二)肝硬化患者的监测和管理
对于肝硬化患者,无论抗病毒治疗是否获得SVR,均应该每6个月复查一次腹部超声和AFP。每年复查一次胃镜,观察食管胃底静脉曲张情况。
推荐意见34:未治疗或治疗失败的患者,以无创诊断方式每年复查、评价一次肝纤维化的进展情况;
推荐意见35:对于有肝硬化基础的患者,无论是否获得SVR,每6个月复查一次腹部超声和AFP。
十七、待解决的问题
1.慢性丙型肝炎进展至肝硬化,肝硬化失代偿和HCC过程中具有预警作用的生物学标志物的研究。
2.DAA治疗丙型肝炎的新方案的探索,特别是适合全基因型的标准方案的研究。
3.对DAA与PR治疗策略进行药物经济学评价。
4.DAA治疗慢性丙型肝炎获得SVR后长期有效性和安全性问题。
5.DAA治疗丙型肝炎肝硬化及其失代偿患者,获得SVR后改善疾病并发症及预后研究。
6.DAA治疗对预防肝硬化及其并发症和HCC的长期影响。
7.DAA的耐药及药物相互作用,特别需要关注DAA与中草药相互作用的问题。
8.进一步深入研究DAA在特殊人群:妊娠、儿童、合并HIV感染、肾功能障碍及肾衰竭、肝移植等丙型肝炎患者中的有效性和安全性问题。
9.开展卫生经济学研究、探索降低药物价格、提高治疗可及性的有效途径。
[1]Mohd Hanafiah K,Groeger J,Flaxman AD,et al.Global epidemiology of hepatitis C virus infection:new estimates of age-specific antibody to HCV seroprevalence[J].Hepatology,2013,57(4):1333-42.
[2]Lavanchy D.The global burden of hepatitis C[J].Liver Int,2009,29 Suppl 1:74-81.
[3]WHO.Guidelines for the screening,care and treatment of persons with hepatitis infection.
[4]LemoineM,NayagamS,ThurszM.Viralhepatitisinresource-limitedcountries and access to antiviral therapies:current and future challenges[J].Future Virol,2013,8(4):371-380。
[5]陈圆生,李黎,崔富强,等.中国丙型肝炎血清流行病学研究J.中华流行病学杂志,2011,32(9):888-891.。
[6]Rao H,Wei L,Lopez-Talavera JC,et al.Distribution and clinical correlates of viral and host genotypes in Chinese patients with chronic hepatitis C virus infection[J].J Gastroenterol Hepatol,2014,29(3):545-53.
[7]Simmonds P,Bukh J,Combet C,et al.Consensus proposals for a unified system of nomenclature of hepatitis C virus genotypes. Hepatology 2005;42:962-973.
[8]Lontok E,Harrington P,Howe A,et al.Hepatitis C virus drug resistance-associatedsubstitutions:Stateoftheartsummary. Hepatology.2015;Jun 10.doi:10.1002/hep.27934.
[9]Farci P,Alter HJ,Wong D,et al.A long-term study of hepatitis C virus replication in non-A,non-B hepatitis[J].N Engl J Med,1991,325(2):98-104.
[10]Corey KE,Mendez-Navarro J,Gorospe EC,et al.Early treatment improvesoutcomesinacutehepatitisCvirusinfection:a meta-analysis[J].J Viral Hepat,2010,17(3):201-207.
[11]ChenSL,Morgan TR.The natural history of hepatitis C virus (HCV)infection[J].Int J MedSci,2006,3(2):47-52.
[12]Tillmann HL,Thompson AJ,Patel K,et al.A polymorphism near IL28Bisassociatedwithspontaneousclearanceofacute hepatitis C virus and jaundice[J].Gastroenterology,2010,139 (5):1586-1592.
[13]Kim AY,Kuntzen T,Timm J,et al.Spontaneous control of HCV is associated with expression of HLA-B 57 and preservation of targeted epitopes[J].Gastroenterology,2011,140(2):686-696.
[14]Thursz M,Yallop R,Goldin R,et al.Influence of MHC class II genotype on outcome of infection with hepatitis C virus[J]. Lancet,1999,(9196):2119-2124.
[15]Kenny-Walsh E.Clinical outcomes after hepatitis C infection from contaminated anti-D immune globulin[J].N Engl J Med,1999,340(16):1228-1233.
[16]Freeman AJ,Dore GJ,Law MG,et al.Hepatology.Estimating progression to cirrhosis in chronic hepatitis C virus infection[J]. Hepatolgy,2001,34(4 Pt 1):809-816.
[17]Li JF,Liu S,Ren F,et al.Fibrosis progression in interferon treatment-naive Chinese plasma donors with chronic hepatitis C for 20 years:a cohort study[J].Int J Infect Dis,2014,27:49-53.
[18]Rao HY,Sun DG,Yang RF,et al.Outcome of hepatitis C virus infection in Chinese paid plasma donors:a 12-19-year cohort study[J].J Gastroenterol Hepatol,2012,27(3):526-532.
[19]Poynard T,Bedossa P,Opolon P.Natural history of liver fibrosis progression in patients with chronic hepatitis C[J].Lancet,1997,349(9055):825-832.
[20]Barreiro P,Pineda JA,RallónN,etal.Influence of interleukin-28B single-nucleotide polymorphisms on progression to livercirrhosisinhumanimmunodeficiency virus-hepatitisC virus-coinfected patients receiving antiretroviral therapy[J].J Infect Dis,2011,203(11):1629-1636.
[21]Ohki T,Tateishi R,Sato T,et al.Obesity is an independent risk factorforhepatocellularcarcinomadevelopmentinchronic hepatitis C patients[J].Clin Gastroenterol Hepatol,2008,6(4):459-464.
[22]Milner KL,van der Poorten D,Trenell M,et al.Chronic hepatitis C is associated with peripheral rather than hepatic insulin resistance[J].Gastroenterology,2010,138(3):932-941.
[23]Kamal SM,Turner B,He Q,et al.Progression of fibrosis in hepatitisC withandwithoutschistosomiasis:correlationwithserum markers of fibrosis[J].Hepatology,2006,43(4):771-779.
[24]El-Serag HB,Rudolph KL.Hepatocellular carcinoma:epidemiologyandmolecularcarcinogenesis[J].Gastroenterology,2007,132(7):2557-2576.
[25]Huang YW,Yang SS,Fu SC,et al.Increased risk of cirrhosis and its decompensation in chronic hepatitis C patients with new-onset diabetes:a nationwide cohort study[J].Hepatology,2014;60(3):807-814.
[26]Irshad M,Mankotia DS,Irshad K.An insight into the diagnosis and pathogenesis of hepatitis C virus infection[J].World J Gastroenterol,2013,19(44):7896-7909.
[27]Heim MH.Innate immunity and HCV[J].J Hepatol,2013,58 (3):564-574.
[28]NeumannAU,LamNP,DahariH,etal.HepatitisCviral dynamics in vivo and the antiviral efficacy of interferon-alpha therapy[J].Science,1998,282(5386):103-107.
[29]Thimme R,Oldach D,Chang KM,et al.Determinants of viral clearanceandpersistenceduringacutehepatitisCvirus infection[J].J Exp Med,2001,194(10):1395-1406.
[30]Dowd KA,Netski DM,Wang XH,et alSelection pressure from neutralizing antibodies drives sequence evolution during acute infection with hepatitis C virus[J].Gastroenterology,2009,136 (7):2377-2386.
[31]Dammacco F,Sansonno D,Piccoli C,et al.The lymphoid system inhepatitisCvirusinfection:autoimmunity,mixed cryoglobulinemia,and Overt B-cell malignancy[J].Semin Liver Dis,2000,20(2):143-157.
[32]European Association for the Study of the Liver.EASL recommendationsontreatmentofhepatitisC2015.JHepatol. 2015,63(1):199-236.
[33]Long L,Shen T,Gao J,et al.Effectiveness of HCV core antigen and RNA quantification in HCV-infected and HCV/HIV-1-coin fected patients.BMC Infect Dis.2014 Nov 5;14:577.
[34]龙璐,刘媛,段昭君,等.抗HCV抗体水平在不同HCV感染人群中的临床意义评价.中华肝脏病杂志.22(4):244-250.
[35]Omata M,Kanda T,Yu ML,et al.APASL consensus statements andmanagementalgorithmsforhepatitisCvirusinfection. Hepatol Int.2012,6(2):409-435.
[36]Sarrazin C,Shiffman ML,Hadziyannis SJ,et al.Definition of rapid virologic response with a highly sensitive real-time PCR-based HCVRNAassayinpeginterferonalfa-2aplusribavirin response-guided therapy[J].J Hepatol,2010,52(6):832-8.
[37]Sarrazin C,Wedemeyer H,Cloherty G,et al.Importance of very early HCV RNA kinetics for prediction of treatment outcome of highlyeffectivealloraldirectactingantiviralcombination therapy[J].J Virol Methods,2015,214:29-32.
[38]Simmonds P,Bukh J,Combet C,et al.Consensus proposals for a unified system of nomenclature of hepatitis C virus genotypes [J].Hepatology,2005,42(4):962-73.
[39]Yang R,Cong X,Du S,et al.Performance comparison of the versant HCV genotype 2.0 assay(LiPA)and the abbott realtime HCV genotype II assay for detecting hepatitis C virus genotype 6[J].J Clin Microbiol,2014,52(10):3685-92.
[40]Thu Thuy PT,Bunchorntavakul C,Tan Dat H,et al.A randomized trial of 48 versus 24 weeks of combination pegylated interferon and ribavirin therapy in genotype 6 chronic hepatitis C[J].J Hepatol,2012,56(5):1012-8.
[41]NelsonDR,CooperJN,LalezariJP,etal.All-oral12-week treatmentwithdaclatasvirplussofosbuvirinpatientswith hepatitis C virus genotype 3 infection:ALLY-3 phase III study [J].Hepatology,2015,61(4):1127-35.
[42]Abe H,Hayes CN,Hiraga N,et al.A translational study of resistanceemergenceusingsequentialdirect-actingantiviral agents for hepatitis C using ultra-deep sequencing[J].Am J Gastroenterol,2013,108(9):1464-72.
[43]Larrat S,Vallet S,David-TchoudaS,etal.Naturally Occurring Resistance-Associated Variants of Hepatitis C Virus Protease Inhibitors in Poor Responders to PegylatedInterferon-Ribavirin.J ClinMicrobiol.2015 Jul;53(7):2195-202.
[44]LawitzE,SulkowskiMS,GhalibR,etal.Simeprevirplus sofosbuvir,with or without ribavirin,to treat chronic infection with hepatitis C virus genotype 1in non-responders to pegylated interferonandribavirinandtreatment-naivepatients:the COSMOS randomised study.Lancet.2014 Nov 15;384(9956):1756-65.
[45]European Association for the Study of the Liver.EASL Recommendations on Treatment of Hepatitis C 2015[J].J Hepatol,2015,63(1):199-236.
[46]AASLD/IDSA HCV Guidance Panel.HepatitisC Guidance:AASLD-IDSARecommendationsforTesting,Managing,and Treating Adults Infected with Hepatitis C Virus[J].Hepatology,2015;62(3):932-954.
[47]Masao Omata,Tatsuo Kanda,Ming-Lung Yu,etal.APASL consensusstatementsandmanagementalgorithmsforhepatitisC virus infection.Hepatol Int,2012 Apr,6(2),409-435.
[48]Geneva:World Health Organization.Guidelines for the Screening,Care and Treatment of Persons with Hepatitis C Infection. 2014 Apr(ISBN:978 92 4 154875 5).
[49]EASL-ALEH Clinical Practice Guidelines:Non-invasive tests for evaluation of liver disease severity and prognosis.J Hepatol. 2015;63(1):237-64.
[50]Wai CT,Greenson JK,Fontana RJ,et al.A simple noninvasive index canpredictbothsignificantfibrosisandcirrhosisin patients with chronic hepatitis C.Hepatology 2003;38:518-26.
[51]Castéra L,Sebastiani G,Le Bail B,de Lédinghen V,Couzigou P,Alberti A.Prospective comparison of two algorithms combining non-invasive methods forstaging liver fibrosis in chronic hepatitis C.J Hepatol.2010;52(2):191-8.
[52]Martini A,Fattovich G,Guido M,et al.HCV genotype 3 and squamous cell carcinoma antigen(SCCA)-IgM are independentlyassociated with histological features of NASH in HCV-infected patients[J].J Viral Hepat,2015 Jan 22,doi:10.1111/jvh.12394. [Epub ahead of print].
[53]Macaluso FS,Maida M,Cammà C,et al.Steatosis affects the performanceofliverstiffnessmeasurementforfibrosis assessment in patients with genotype 1 chronic hepatitis C[J].J Hepatol,2014,61(3):523-9.
[54]MoucariR,RipaultMP,Martinot-PeignouxM,etal.Insulin resistance andgeographicalorigin:majorpredictorsof liver fibrosis and response to peginterferon and ribavirin in HCV-4 [J].Gut,2009,58(12):1662-9.
[55]Poynard T,Moussalli J,Munteanu M,et al.Slow regression of liver fibrosis presumed by repeated biomarkers after virological cure in patients with chronic hepatitis C[J].J Hepatol,2013,59 (4):675-83.
[56]Mohan P,Barton BA,Narkewicz MR,et al.Evaluating progression of liver disease from repeat liver biopsies in children with chronic hepatitis C:a retrospective study[J].Hepatology,2013,58(5):1580-6.
[57]Lambrecht RW,Sterling RK,Naishadham D,et al.Iron levels in hepatocytesandportaltractcellspredictprogressionand outcomesof patientswithadvancedchronichepatitisC[J]. Gastroenterology,2011,140(5):1490-500.
[58]D'Ambrosio R,Aghemo A,Fraquelli M,et al.The diagnostic accuracyofFibroscanforcirrhosisisinfluencedbyliver morphometryinHCVpatientswithasustainedvirological response[J].J Hepatol,2013,59(2):251-6.
[59]Akhtar E,Manne V,Saab S.Cirrhosis regression in hepatitis C patientswithsustainedvirologicalresponseafterantiviral therapy:a meta-analysis[J].Liver Int,2015,35(1):30-6.
[60]D'Ambrosio R,Aghemo A,Rumi MG,et al.A morphometric and immunohistochemical study to assess the benefit of a sustained virological response in hepatitis C virus patients with cirrhosis [J].Hepatology,2012,56(2):532-43.
[61]Badossa P,Poynard T.An algorithm for the grading of activity in chronic hepatitis C[J].Hepatology,1996,24:289-93.
[62]Kim SU,Oh HJ,Wanless IR,et al.The Laennec staging system forhistologicalsub-classificationofcirrhosisisusefulfor stratification of prognosis in patients with liver cirrhosis[J].J Hepatol,2012,57(3):556-63.
[63]Huang Y,de Boer WB,Adams LA,et al.Image analysis of liver biopsy samples measures fibrosis and predicts clinical outcome. J Hepatol,2014,61(1):22-7.
[64]Ding H,Ma JJ,Wang WP,et al.Assessment of liver fibrosis:the relationshipbetweenpoint shearwave elastography and quantitativehistologicalanalysis.JGastroenterolHepatol,2015,30(3):553-8.
[65]John-BaptisteAA,TomlinsonG,HsuPC,etal.Sustained responders have betterquality of life and productivity compared with treatment failures long afterantiviral therapy for hepatitis C[J].Am J Gastroenterol,2009,104(10):2439-48.
[66]BunchorntavakulC,ManeerattanapornM,ChavalitdhamrongD. Management of patients with hepatitis C infection and renal disease[J].World J Hepatol,2015,7(2):213-25.
[67]El-Shabrawi M,Hassanin F.Treatment of hepatitis B and C in children[J].Minerva Pediatr,2014,66(5):473-89.
[68]Morgan RL,Baack B,Smith BD,et al.Eradication of hepatitis C virus infection and the development of hepatocellular carcinoma:a meta-analysis of observational studies[J].Ann Intern Med,2013,158(5 Pt 1):329-37.
[69]BackusLI,BoothroydDB,PhillipsBR,etal.ASustained Virologic Response Reduces Risk of All-Cause Mortality in Patients With Hepatitis C[J].Clin Gastroenterol H,2011,9(6):509-U145.
[70]van der Meer AJ,Veldt BJ,Feld JJ,et al.Association Between Sustained Virological Response and All-Cause Mortality Among PatientsWithChronicHepatitisCandAdvancedHepatic Fibrosis[J].Jama-J Am Med Assoc,2012,308(24):2584-93.
[71]Nakamoto S,Kanda T,Shirasawa H,et al.Antiviral therapies for chronic hepatitis C virus infection with cirrhosis[J].World J Hepatol,2015,7(8):1133-41.
[72]Boccaccio V,Bruno S.ManagementofHCVpatientswith cirrhosis with direct acting antivirals[J].Liver Int,2014,34 Suppl 1:38-45.
[73]Konerman MA,Mehta SH,Sutcliffe CG,et al.Fibrosis progression in human immunodeficiency virus/hepatitis C virus coinfected adults:prospective analysis of 435 liver biopsy pairs[J]. Hepatology,2014,59(3):767-75.
[74]Konstantinou D,Deutsch M.The spectrum of HBV/HCV coinfection:epidemiology,clinicalcharacteristics,viralinteractionsand management[J].Ann Gastroenterol,2015,28(2):221-8.
[75]Michelotti GA,Machado MV,Diehl AM.NAFLD,NASH and liver cancer[J].Nat Rev Gastroenterol Hepatol,2013,10(11): 656-65.
[76]Monje-Agudo P,Castro-Iglesias A,Rivero-Juarez A,et al.Impactof HIV infectiononsustainedvirologicalresponseto treatment against hepatitis C virus with pegylated interferon plus ribavirin[J].Eur J Clin Microbiol Infect Dis,2015,Jul 9. [Epub ahead of print].
[77]Marino Z,Londono MC,Forns X.Hepatitis C treatment for patients post liver transplant[J].Curr Opin Organ Transplant,2015,20(3):251-8.
[78]Charlton M,Gane E,Manns MP,et al.Sofosbuvir and ribavirin fortreatmentofcompensatedrecurrenthepatitisCvirus infection after liver transplantation[J].Gastroenterology,2015,148 (1):108-17.
[79]Agnello V,Chung RT,Kaplan LM.A role for hepatitis C virus infectionintypeIIcryoglobulinemia[J].N EnglJMed,1992,327(21):1490-5.
[80]CacoubP,TerrierB,SaadounD.HepatitisC virus-inducedvasculitis:therapeutic options[J].Ann Rheum Dis,2014,73(1):24-30.
[81]Johnson RJ,Gretch DR,Yamabe H,et al.Membranoproliferative glomerulonephritis associated with hepatitis C virus infection[J]. N Engl J Med,1993,328(7):465-70.
[82]Paydas S.Hepatitis C virus and lymphoma[J].Crit Rev Oncol Hematol,2015,93(3):246-56.
[83]Desouky DE,Kasemy Z,Abdel-Hamid AE,et al.Insulin ResistanceandPrediabetesinHepatitisCVirusPatients:A Cross-SectionalCase-ControlStudy[J].AmJMedSci,2015,350(2):77-80.
[84]Zornitzki T,Malnick S,Lysyy L,et al.Interferon therapy in hepatitis C leading to chronic type 1 diabetes[J].World J Gastroenterol,2015,21(1):233-9.
[85]GisbertJP,Garcia-Buey L,PajaresJM,etal.Prevalenceof hepatitis C virus infection in porphyria cutanea tarda:systematic review and meta-analysis[J].J Hepatol,2003,39(4):620-7.
[86]Racciatti D,Gorgoretti V,Sepede G,et al.An Italian study on health-relatedqualityoflifeandfatigueinpatientswith chronic fatigue syndrome and patients with chronic HCV virus infection:similaritiesanddifferences[J].IntJImmunopathol Pharmacol,2011,24(3):673-81.
[87]Xu CJ,Zhang CP,Luo BF,et al.Prevalence and characterization of hepatitisB andC virusinfectionsina needle-sharing population in Northern China[J].Bmc Public Health,2015,15:460.
[88]Zou X,Chow EP,Zhao P,et al.Rural-to-urban migrants are at
high risk of sexually transmitted and viral hepatitis infections in China:a systematic review and meta-analysis[J].Bmc Infect Dis,2014,14:490.
[89]Lambert J,Jackson V,Coulter-Smith S,et al.Universal antenatal screening for hepatitis C[J].Ir Med J,2013,106(5):136-9.
[90]FissellRB,Bragg-Gresham JL,WoodsJD,etal.Patternsof hepatitis C prevalence and seroconversion in hemodialysis units fromthreecontinents:TheDOPPS.KidneyInternational[J]. 2004,65(6):2335-42.
[91]Post JJ,Arain A,Lloyd AR.Enhancing assessment and treatment of hepatitis C in the custodial setting[J].Clin Infect Dis,2013,57 Suppl 2:S70-4.
[92]Leidner AJ,Chesson HW,Xu F,et al.Cost-effectiveness of hepatitis C treatment for patients in early stages of liver disease[J]. Hepatology,2015,61(6):1860-9.
[93]Puoti C,Bellis L,Guarisco R,et al.HCV carriers with normal alanine aminotransferase levels:healthy persons or severely ill patients Dealing with an everyday clinical problem[J].Eur J Intern Med,2010,21(2):57-61.
[94]EASL Clinical Practice Guideline.Management of hepatitis C virus infection[J].J Hepaology,2011,55(2):245-264.
[95]中华医学会肝病学分会、中华医学会传染病与寄生虫病学分会.
丙型肝炎防治指南[J].中华内科杂志,2004,43(7):551-555.
[96]中国国家处方集编委会。《中国国家处方集》人民军医出版社2010年.
[97]魏来主编.《丙型肝炎-临床诊断与治疗手册》[M].科学出版社2012年.
[98]AwadT,ThorlundK,HauserG,et al.Proceedwithcaution peginterferon alpha-2a versus peginterferon alfa-2b in chronic hepatitis C[J].Hepatology,2010,52(6):2241-2242.
[99]陈新月,尚佳,杨瑞锋,等.难治性慢性丙型肝炎初治患者优化治疗后的高病毒学应答率[J].中华肝脏病杂志,2015,23(6):412-417.
[100]EASL Clinical Practice Guideline.Management of hepatitis C virus infection[J].J Hepaology,2014,60(2):392-420.
[101]饶慧瑛,杨瑞锋,尚佳,等.不同疗程聚乙二醇干扰素联合利巴韦林治疗慢性丙型肝炎复发患者的疗效比较及影响因素.中华内科杂志.2015,54(8):699-704.)
[102]SingalAG,WaljeeAK,ShiffmanM,etal.Meta-analysis:re-treatmentofgenotypeIhepatitisCnonrespondersand relapsersafterfailinginterferonandribavirincombination therapy[J].Aliment Pharmacol Ther,2010,32(8):969-983.)
[103]尚佳,徐小元,陈新月,等.聚乙二醇干扰素α-2a联合利巴韦林治疗慢性丙型肝炎无应答患者的疗效及影响因素.中华临床感染病杂志.2015,8(3):232-237.)
[104]CammàC,CabibboG,BronteF,etal.Retreatmentwith pegylatedinterferonplusribavirinofchronichepatitisC non-responders to interferon plus ribavirin:a meta-analysis[J].J Hepatol,2009,51(4):675-81.
[105]Wei L,Han T,Yang D,et al.Simeprevir plus peginterferon/ribavirin in treatment-naive patients with chronic hepatitis C virus genotype 1 infection:Results from the Phase III TIGER study conducted in East Asian patients living in China and Korea[J]. Hepatol Int,2015,9(S1):S61.
[106]Lawitz E,Mangia A,Wyles D,et al.Sofosbuvir for previously untreated chronic hepatitis C infection[J].N Engl J Med,2013,368(20):1878-1887.
[107]Mishra P,Florian J,Qi K,et al.FDA perspective on sofosbuvir therapy for patients with chronic hepatitis C virus genotype 1 infectionwho didnotrespondto treatmentwithpegylated interferonandribavirin[J].Gastroenterology,2014,147(6):1196-1200.
[108]Afdhal N,Zeuzem S,Kwo P,et al.Ledipasvir and sofosbuvir for untreated HCV genotype 1 infection[J].N Engl J Med,2014,370(20):1889-1898.
[109]AfdhalN,ReddyKR,NelsonDR,etal.Ledipasvirand sofosbuvir for previously treated HCV genotype 1 infection[J].N Engl J Med,2014,370(16):1483-1493.
[110]KowdleyKV,GordonSC,ReddyKR,etal.Ledipasvirand sofosbuvir for 8 or 12 weeks for chronic HCV without cirrhosis [J].N Engl J Med,2014,370(20):1879-1888.
[111]Feld JJ,Kowdley KV,Coakley E,et al.Treatment of HCV with ABT-450/r-ombitasvir and dasabuvir with ribavirin[J].N Engl JMed,2014,370(17):1594-1603.
[112]Ferenci P,Bernstein D,Lalezari J,et al.ABT-450/rombitasvirand dasabuvir with or without ribavirin for HCV[J].N Engl J Med,2014,370(21):1983-1992.
[113]Zeuzem S,Jacobson IM,Baykal T,et al.Retreatment of HCV with ABT-450/r-ombitasvir and dasabuvir withribavirin[J].N Engl J Med,2014,370(17):1604-1614.
[114]Andreone P,Colombo MG,Enejosa JV,et al.ABT-450,ritonavir,ombitasvir,and dasabuvir achieves 97%and 100%sustained virologic response with or without ribavirin in treatmentexperiencedpatientswithHCVgenotype1binfection[J]. Gastroenterology,2014,147(2):359-365.
[115]Poordad F,Hezode C,Trinh R,et al.ABT450/r-ombitasvirand dasabuvir with ribavirin for hepatitis C with cirrhosis[J].N Engl J Med,2014(21),370:1973-1982.
[116]SulkowskiMS,GardinerDF,Rodriguez-TorresM,etal. Daclatasvir plus sofosbuvir for previously treated or untreated chronic HCV infection[J].N Engl J Med,2014,370(3):211-221.
[117]Kumada H,Suzuki Y,Ikeda K,Toyota J,Karino Y,Chayama K,et al.Daclatasvir plus asunaprevir for chronic HCV genotype 1b infection.Hepatology,2014;59:2083-91.
[118]Lawitz E,Mangia A,Wyles D,et al.Sofosbuvir for previously untreated chronic hepatitis C infection[J].N Engl J Med,2013,368(20):1878-1887.
[119]ZeuzemS,DusheikoGM,SalupereR,etal.Sofosbuvirand ribavirin in HCV genotypes 2 and 3[J].N Engl J Med,2014,370(21):1993-2001.
[120]Pol S,Reddy KR,Baykal T,et al.Interferon-free regimens of ombitasvir and ABT-450/r with or without ribavirin in patients withHCVgenotype4infection:PEARL-Istudyresults[J]. Hepatology,2014,60:1129A.
[121]Gane EJ,Hyland RH,An D,et al.High efficacy of LDV/SOF regimens for 12 weeks for patients with HCV genotype 3 or 6 infection[J].Hepatology,2014;60:1274A.
[122]Hu J,Doucette K,Hartling L,et al.Treatment of hepatitisC in children:a systematic review[J].PloS One,2010,5(7):e11542.
[123]HartwellD,CooperK,FramptonGK,etal.Theclinical effectivenessandcost-effectivenessofpeginterferonalfaand ribavirin for the treatment of chronic hepatitis C in children and young people:a systematic review and economic evaluation [J].Health Technol Assess,2014,18(65):i-xxii,1-202.
[124]Sulkowski MS,Thomas DL,Mehta SH,et al.Hepatotoxicityassociatedwithnevirapineorefavirenz-containingantiretroviral therapy:Role of hepatitis C and B infections[J].Hepatology,2002,35(1):182-189.
[125]Nunez M.Clinical syndromes and consequences of antiretroviral-related hepatotoxicity[J].Hepatology,2010,52(3):1143-55.
[126]Fabrizi F,Dixit V,Messa P,et al.Antiviral therapy(pegylated interferon and ribavirin)of hepatitis C in dialysis patients:meta-analysis of clinical studies[J].Journal of Viral Hepatitis,2014,21(10):681-689.
[127]Scott DR,Wong JK,Spicer TS,et al.Adverse impact of hepatitis Cvirusinfectiononrenalreplacementtherapyandrenal transplantpatientsinAustraliaandNewZealand[J]. Transplantation,2010,90(11):1165-1171.
[128]Singal AG,Volk ML,Jensen D,et al.A sustainedviral response is associated with reduced liver-related morbidity and mortality in patients with hepatitis C virus[J].Clin Gastroenterol Hepatol,2010,8(3):280-288.
[129]van der Meer AJ,Veldt BJ,Feld JJ,et al.Association between sustainedvirologicalresponseandall-causemortalityamong patients with chronic hepatitis C and advanced hepatic fibrosis [J].JAMA,2012,308(24):2584-2593.
[130]Afdhal N,Everson G,Calleja JL,et al.Sofosbuvir and ribavirin for the treatment of chronic HCV with cirrhosis and portal hypertensionwithandwithoutdecompensation:earlyvirologic response and safety[J].J Hepatol 2014,60:S28.
[131]Kevans,D,Farrell G,Hopkins S,et al.Haematological support during peg-interferon therapy for HCV-infected haemophiliacs improvesvirologicaloutcomes[J].Haemophilia,2007,13(5):593-8.
[132]Monaco S,Ferrari S,Gajofatto A,et al.HCV-Related Nervous System Disorders[J].Clinical&Developmental Immunology,2012,2012:236148.
[133]vanderMeer,A.J.Achieving sustainedvirologicalresponse:what's the impact on further hepatitis C virus-related disease [J]Expert Review of Gastroenterology&Hepatology,2015,9(5):559-566.
[134]Papatheodoridis G,Buti M,Cornberg M,et al.EASL Clinical Practice Guidelines:Managementof chronic hepatitisB virus infection.Journal of Hepatology.Jul 2012;57(1):167-185.
[135]Liu,C.J.Treatment of patients with dual hepatitis C virus and hepatitis B virus infection:Resolved and unresolved issues[J]. Journal of Gastroenterology and Hepatology,2014,29(1):26-30.
[136]Rodriguez-Torres M,Slim J,Bhatti L,et al.Peginterferon alfa-2a Plus Ribavirin for HIV-HCV Genotype 1 Coinfected Patients:A Randomized International Trial[J].Hiv Clinical Trials,2012,13 (3):142-152.
[137]Micallef JM,Kaldor JM,Dore GJ.Spontaneous viral clearance following acutehepatitisCinfection:asystematicreview of longitudinal studies[J].Journal of Viral Hepatitis,2006,13(1):34-41.
[138]Hofer H,Watkins-Riedel T,Janata O,et al.Spontaneous viral clearance in patients with acute hepatitis C can be predicted by repeated measurements of serum viral load[J].Hepatology,2003,37(1):60-64.
10.3969/j.issn.1672-5069.2016.04.039

