1,25(OH)2D3通过STAT5抑制Th17细胞分化的调控作用研究*
周鸿,顾磊,蒋春晖,孙隆慈,刘晔,许春杰,徐庆
1,25(OH)2D3通过STAT5抑制Th17细胞分化的调控作用研究*
周鸿,顾磊,蒋春晖,孙隆慈,刘晔,许春杰,徐庆
目的研究1.25二羟基维生素D3[1,25(OH)2D3]抑制辅助性T细胞17(Th17)的分化与STAT5调控的关系。方法通过分选出的CD4+T细胞,在1,25(OH)2D3和/或STAT5抑制剂的作用下,采用ELISA法检测抑制剂处理后细胞培养上清液Th17细胞因子(IL-17A、IL-22)水平的变化;采用细胞免疫荧光技术检测STAT5的磷酸化水平,采用Western blot技术检测STAT5蛋白表达水平。结果1,25(OH)2D3组细胞培养上清IL-17A和IL-22水平(12.5±0.5 ng/ml,48.5±0.9 pg/ml)明显低于对照组(22.7±0.5 ng/ml,73.8±1.9 pg/ml),而STAT5抑制剂组IL-17A 和IL-22水平明显升高(33.5±0.7 ng/ml,89.1±1.4 pg/ml),1,25(OH)2D3与STAT5抑制剂联合作用细胞IL-17A和IL-22水平(18.5±0.7 ng/ml,54.1±1.6 pg/ml)显著高于1,25(OH)2D3组,但低于STAT5抑制剂组,差异有统计学意义(P<0.01);1,25(OH)2D3组细胞p-STAT5表达显著强于对照组,1,25(OH)2D3联合STAT5抑制剂组p-STAT5表达量低于对照组,而STAT5抑制剂组细胞p-STAT5表达量最低;1,25(OH)2D3组STAT5蛋白表达明显升高,而1,25(OH)2D3联合STAT5抑制剂组或STAT5抑制剂组STAT5蛋白表达明显降低,以STAT5抑制剂组细胞表达最弱,差异均具有统计学意义(P<0.01)。结论1,25(OH)2D3通过STAT5信号通路能抑制Th17细胞分化。
辅助性T细胞17;1,25-二羟基维生素D3,STAT5;细胞分化;小鼠
JNK/STAT通路是主要的细胞因子受体介导的信号通路[1~4]。STAT5是IL-2重要的下游通路转录因子,促进T细胞分化和增殖[5,6]。IL-2基因敲除或是应用抗IL-2抗体阻断都会促进体内Th17细胞的分化。敲除STAT5也会促进Th17细胞的分化,可能是由于敲除STAT5导致IL-2的抑制效应消失,进而STAT3促进RORγt表达和Th17细胞分化[7,8]。STAT5的竞争效应有可能与STAT3竞争同一个编码IL-17的基因座IL-17A有关[9]。Pandiyan et al[10]发现,IL-15通过促进STAT5表达来抑制IL-15的产生和抑制Th17细胞所介导的炎症反应。生长激素(Growth hormone,GH)-生长激素受体轴(Growth hormone receptor axis,GHR)是引起STAT5活化的最主要的路径。GHR主要位于肝细胞,当GH分泌不足和GHR表达下降时,STAT5的活性亦随之降低[11~13]。本研究主要是在脾淋巴细胞Th17诱导分化过程中加入1.25二羟基维生素D3[1,25(OH)2D3]或/ 和STAT5抑制剂,来探究1,25(OH)2D3是否可以通过促进STAT5的表达来抑制Th17细胞的分化。
1 材料与方法
1.1实验动物和主要试剂8 w龄健康C57小鼠30只,购于常州卡文斯实验动物有限公司,由我院实验动物中心适应性喂养7 d后进入实验阶段。1,25(OH)2D3购于国药集团化学试剂有限公司;刺激剂混合物(PMA/Ionomycin/Brefeldin A/Monensin)和Percoll分离液(以色列ProSpec公司);RPMI1640培养液(美国Hyclone公司);10%FBS(美国Gibco公司);固定破膜剂、0.01%Triton-X、抗原修复液(BIOSH公司);抗p-STAT5、抗STAT5、抗CD4、抗IFN-γ、抗IL-17A、抗IL-4和辣根过氧化物酶标记山羊抗小鼠IgG(HRP标记)、异硫氰酸荧光素标记山羊抗小鼠IgG(FITC标记)均购于英国Abcam公司;检测IL-22和IL-17A的ELISA试剂盒(BIOSH公司);RIPA组织细胞快速裂解液和STAT5抑制剂(上海碧云天生物科技有限公司);BCA蛋白定量试剂盒(南京凯基生物技术有限公司);CD4+T细胞分选试剂盒(美国Selleck公司)。
1.2诱导Th17细胞分化无菌条件下,取小鼠脾脏组织,研磨,通过200目尼龙网过滤,收集细胞;加PBS 8 ml,重悬细胞沉淀。将细胞悬液与40% Percoll分离液混合,缓慢加到70%Percoll分离液上,离心;吸取两层溶液之间的白细胞,获得淋巴细胞;采用磁珠分选初始CD4+T细胞(按试剂盒说明书操作);用含10%胎牛血清RPMI 1640培养CD4+T细胞,分别加入抗人CD3/CD28单抗(2 mg/ml)、抗人IL-2(1.28 mg/ml)、抗IFN-γ单抗(1mg/ml)和重组人细胞因子(TGF-β、IL-6、IL-1β);将细胞分为4组:第1组加1,25(OH)2D3(10-8 mol/L)、第2组加STAT5抑制剂、第3组加1,25(OH)2D3(10-8 mol/L)和STAT5抑制剂、第4组为对照组,加等量的PBS液;5 d后,收集细胞及培养上清、备用。
1.3细胞上清细胞因子水平检测采用ELISA法检测IL-22和IL-17A水平。
1.4细胞表面STAT5免疫荧光检测收集各组的细胞,分别涂片后,经4%多聚甲醛固定、灭活内源性过氧化物酶、3%H2O2/PBS洗涤、浸入抗原修复液(柠檬酸三钠缓冲液)等过程。10%FBS封闭,室温15 min;加入抗p-STAT5,4℃孵育过夜;加入FITC标记的二抗,每片1滴。37℃孵育30 min;封片,在荧光显微镜下观察。STAT5活化后被磷酸化成为p-STAT5,通过p-STAT5的表达量来衡量STAT5活性。
1.5细胞STAT5蛋白检测采用Western Blot法,分别提取各组细胞总蛋白,采用Bradford法进行蛋白定量;上样前,水浴煮沸15 min;上样20 μl;进行12%SDS-PAGE凝胶电泳,转移至硝酸纤维素膜,5%脱脂牛奶封闭1 h;稀释抗STAT5,加入一抗后与硝酸纤维素膜4℃孵育过夜;次日,按照1:1000稀释HRP标记的二抗,加入二抗后37℃孵育2 h;DAB显色,用红外扫描仪扫描,分析蛋白条带灰度值。
2 结果
2.1Th17细胞细胞因子表达情况经1,25(OH)2D3处理细胞后,上清IL-17A和IL-22水平(12.5±0.5 ng/ml和48.5±0.9 pg/ml)均比对照组明显降低【(22.7±0.5 ng/ml和73.8±1.9 pg/ml,P<0.01),而STAT5抑制剂组(33.5±0.7 ng/ml和89.1± 1.4 pg/ml)均明显升高(P<0.01);当1,25(OH)2D3与STAT3抑制剂联合作用时,IL-22和IL-17A水平(18.5±0.7 ng/ml和54.1±1.6 pg/ml)均明显高于1,25(OH)2D3组,而明显低于STAT3抑制剂组,均具有统计学意义(P<0.01,图1)。以上结果表明,1,25 (OH)2D3降低细胞IL-17A和IL-22表达,相反,STAT5抑制剂则促进IL-17A和IL-22的表达,对Th17细胞分化具有各自的调节作用。
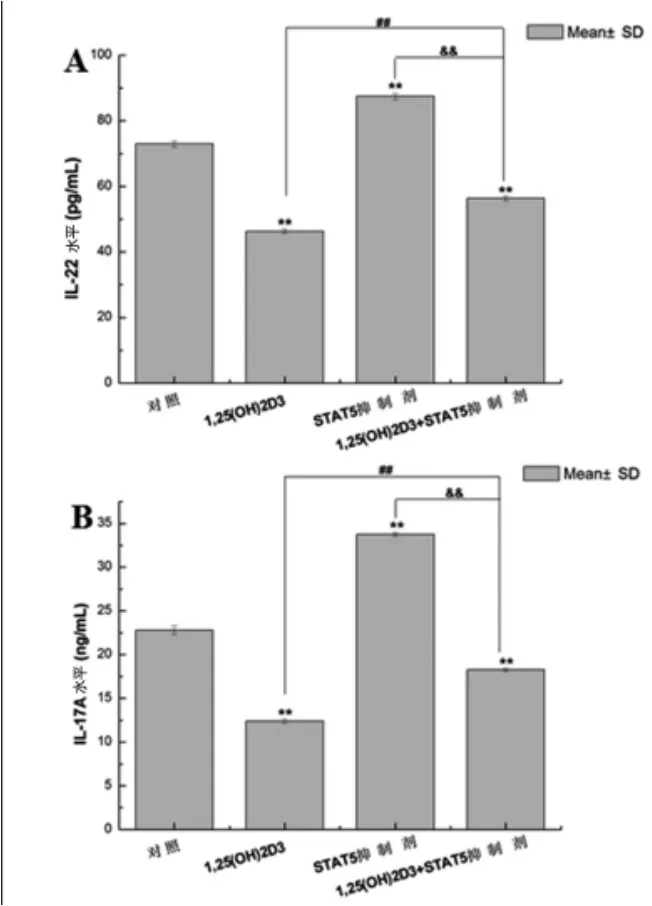
图1 各组培养细胞上清细胞因子水平比较
2.2各组细胞p-STAT5表达情况STAT5活化后被磷酸化成为p-STAT5,通过检测p-STAT5表达量可以衡量STAT5的活性。与对照组比,1,25(OH)2D3处理细胞p-STAT5表达量最高,而STAT5抑制剂组p-STAT5表达量明显减少,联合作用组p-STAT5表达量高于抑制剂组,但明显弱于1,25(OH)2D3组,表明1,25(OH)2D3具有增强STAT5表达活性的作用(图2)。
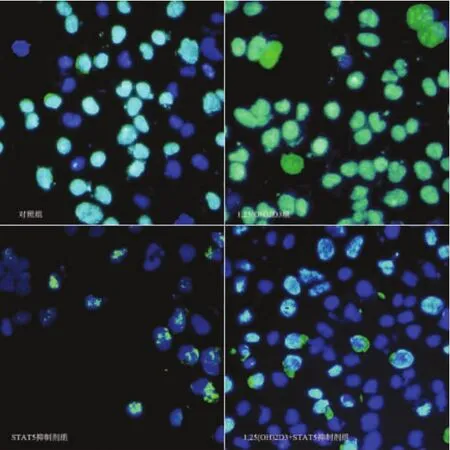
图2 脾淋巴细胞p-STAT5表达情况(蓝色为Hochest染核,绿色为p-STAT5表达部位)
2.3各组细胞STAT5蛋白表达情况与对照组比,1,25(OH)2D3组STAT5蛋白表达最高,STAT5抑制剂组STAT5蛋白表达最低,而联合作用组STAT5表达低于单独1,25(OH)2D3组,但高于STAT5抑制剂组,并且具有显著性差异(P<0.01,图3),表明在诱导Th17细胞分化过程中,1,25(OH)2D3具有促进STAT5表达的作用。
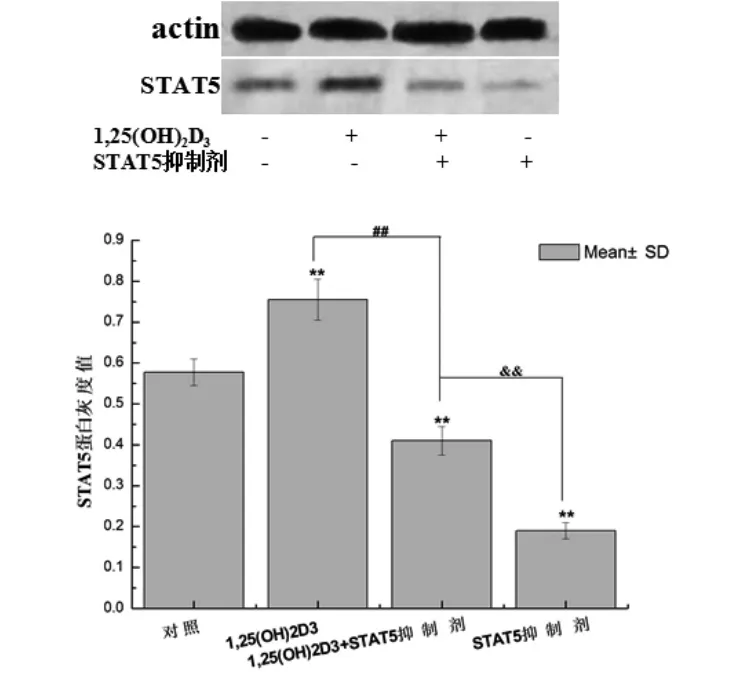
图3 各组细胞STAT5蛋白表达情况
3 讨论
辅助性T淋巴细胞是机体重要的免疫调节细胞。根据其产生细胞因子的不同,辅助性CD4+T细胞可分为调节性T细胞(regulatory T cells,Treg)、辅助性T细胞17(T helper cells 17,Th17)、Th1和Th2等细胞亚群,他们之间相互调节,在分化发育上相互制约,在功能上存在着拮抗或协同的复杂关系,影响免疫应答的格局。Treg是一类具有免疫调节功能的T细胞亚群,在维持免疫稳态和阻止自身免疫病的发生上发挥着关键的作用,这些细胞的缺失或者调节功能失调会导致免疫功能紊乱及自身免疫病的发生。这些细胞有效的应用将有可能治疗自身免疫病以及阻止器官移植中的移植物排斥反应。而在维持免疫耐受的同时保证有效防御反应的关键就是Treg和Th17细胞之间的平衡[14]。IL-2是体内重要的T细胞生长因子,不仅能促进Treg细胞分化,也能通过SATA5介导的信号途径抑制Th17细胞的分化[15]。SATA5是IL-2信号途径中重要的转录因子,介导IL-2对Treg的诱导功能以及对Th-17细胞的抑制作用。SATA5被激活后聚集并结合IL-17基因启动子,通过竞争性抑制SATA3等IL-17活化因子结合IL-17基因,或者通过募集抑制复合物干预IL-17表达环路,抑制IL-17A基因的转录,进而抑制IL-17的分化以及IL-17的表达[16]。SATA5同时也是FOXP3表达必不可少的转录因子,通过与FOXP3基因直接结合,增加FOXP3基因的转录,促进FOXP3的表达,从而增强Treg的调节功能。IL-2基因敲除小鼠或SATA5缺陷小鼠体内Treg产生都减少,而Th17细胞产生增加,表明IL-2可通过SATA5途径影响FOXP3与RORγt的平衡,降低RORγt的表达,抑制Th17细胞分化,增强TGF-β1诱导的FOXP3表达和Treg的功能[17]。
目前,STAT5对Th17细胞的调控研究较少。Yang et al[18]发现过表达活性STAT5不影响Th17细胞的分化,但Laurence et al[19]发现STAT5参与介导IL-2对Th17分化的抑制效应。有很多研究显示抑癌基因p53在抑制炎症的发生发展方面具有重要作用。Park发现p53-/-小鼠T细胞STAT5的活性降低,STAT5磷酸化程度降低。p53蛋白和STAT5直接结合,随着p53的活性增强,STAT5的活性也增强。在炎症条件下,p53可以通过STAT5信号级联放大抑制Th17细胞分化并促进T细胞向Treg细胞转化,从而抑制炎症。p53通过对STAT5的促进,进而在炎症和自身免疫性疾病中充当一个保护者的角色[20]。
STAT5和1,25(OH)2D3都在抑制Th17细胞活化的同时,它们相互之间是否存在某种联系或相互作用却未可知。本研究通过在Th17细胞诱导分化过程中加入STAT5抑制剂或/和1,25(OH)2D3,研究和探索1,25(OH)2D3是否可以以类似抑制STAT3的作用方式来促进STAT5的表达,进而抑制Th17细胞分化。结果显示,1,25(OH)2D3可以促进STAT5的表达及其磷酸化作用,STAT5抑制剂的加入能促进Th17细胞特异细胞因子IL-17A和IL-22的表达和分泌,表明STAT5在某种程度上可以抑制Th17细胞的分化,初步表明1,25(OH)2D3可以通过上调STAT5的表达及促进STAT5的活化来抑制Th17细胞的分化。
[1]Jason S,Raw lings,Kristin M.The JAK/STAT signaling pathway.Cell Sci,2004,117(Pt8):1281-1283.
[2]Schindler C,Levy DE,Decker T.JAK-STAT signaling:from interferons to cytokines.J Biol Chem,2007,282(28):20059-20063.
[3]Lee CK,Smith E,Gimeno R,et al.STAT1 affects lymphocyte survivalandproliferationpartiallyindependentofitsrole downstream of IFN-γ.J Immunol,2000,164(3):1286-1292.
[4]Kaplan MH,Sun YL,Hoey T,et al.Impaired IL-12 responses and enhanced development of Th2 cells in Stat4-deficient mice. Nature,1996,382(6587):174-177.
[5]Ho IC,Glimcher LH.Transcrition:Tantalizing times for T cells. Cell,2002,109(suppl l):S109-S120.
[6]张诗赟,徐亚明,宋一超,等.Stat5:多功能的转录因子.生命化学,2012,32(2):180-184.
[7]McGeachy MJ,Chen Y,Tato CM,et al.The interleukin 23 receptor is essential for the terminal differentiation of interleukin 17-producing effector T helper cells in vivo.Nat Immunol,2009,10(3):314-324.
[8]Zhou L,Ivanov II,Spolski R,et al.IL-6 programs T(H)-17 cell differentiation by promoting sequential engagement of the IL-21 and IL-23 pathways,Nat Immunol,2007,8(9):967-974.
[9]Yang XP,Ghoreschi K,Steward-Tharp SM,et al.Opposing regulation of the locus encoding IL-17 through direct,reciprocal actions of STAT3 and STAT5.Nat Immunol,2011,12(3):247-254.
[10]Pandiyan P,Yang XP,Saravanamuthu SS,et al.The role of IL-15 in activating STAT5 and fine-tuning IL-17A production in CD4 T lymphocytes.J Immunol,2012,189(9):4237-4246.
[11]Chilton BS,Hewetson A.Prolactin and growth hormone signaling.Curr Top Dev Biol,2005,68(1):1-23.
[12]WatersMJ,Hoang HN,FairlieDP,etal.New insightsinto growth hormone action.J Mol Endocrinol,2006,36(1):1-7.
[13]Lang CH,Hong-BrownL,FrostRA.Cytokineinhibitionof JAK-STAT signaling:a new mechanism of growth hormone resistance.Pediatr Nephrol,2005,20(3):306-312.
[14]武华栋,王新华,周荣斌.不调节性T细胞与Th17细胞之间平衡作用的机制.中国热带医学,2011,11(9):1164-1166.
[15]LiMO,WanYY,FlavellRA.T cell-producedtransforming growth factor beta1 controls T cell tolerance and regulates Th1 and Th17-cell differentiation.Immunity,2007,26:579-591.
[16]王晨宇,王星,王琳,等.Th17细胞分化调节机制及与自身免疫性疾病关系研究进展.细胞与分子免疫学杂志,2014,30(6):660-662.
[17]Eberl G,Marmon S,Sunshine MJ,et al.An essential function for the nuclear receptor RORγt in the generation of fetal lymphoid tissue inducer cells.Nat Immunol,2004,5:64-73.
[18]Yang XO,Panopoulos AD,Nurieva R,et al.STAT3 regulates cytokine-mediated generation of inflammatory helper T cells.J Biol Chem,2007,282(13):9358-9363.
[19]Laurence A,Tato CM,Davidson TS,et al.Interleukin-2 signaling via STAT5 constrains T helper 17 cell generation.Immunity,2007,26(3):371-381.
[20]ParkJS,Lim MA,Cho ML,et al.p53controlsautoimmune arthritis via STAT-mediated regulation of the Th17 cell/Treg cell balance in mice.Arthritis Rheum,2013,65(4):949-959.
(收稿:2016-01-10)
(本文编辑:陈从新)
Objective Toexploretheroleof1,25-(OH)2D3ininhibitingThelpercell17(Th17)differentiation and the role of STAT5 in this process.Methods Sorted CD4+T cells were treated with 1,25-(OH)2D3and/or STAT5 inhibitors.The Th17 cytokines(IL-17A,IL-22)levels in supernatants weredetected by ELISA;the phosphorylation level of STAT5 was examined by cell immunofluorescence,and Western blot was used to detect STAT5 protein expression.Results The levels of IL-17A and IL-22 in 1,25-(OH)2D3-treated group were significantly lower than those in the control group[(12.5±0.5)ng/ml and(22.7±0.5)pg/ml vs.(48.5±0.9)ng/ml and(73.8±1.9)pg/ml,respectively,P<0.01],while in STAT5 inhibitor-treated group had higher levels of IL-17A[(33.5±0.7)ng/ml] and IL-22[(89.1±1.4)pg/ml,P<0.05];IL-17A[(18.5±0.7)ng/ml] and IL-22[(54.1±1.6)pg/ml] levels in cells treated with 1,25(OH)2D3combined with STAT5 inhibitor were significantly higher than those in 1,25-(OH)2D3-treated alone,whereas lower than those inSTAT5 inhibitor-treated cells(P<0.01 for both);the expression of p-STAT5 was higher in 1,25-(OH)2D3-treated cells and lower in 1,25-(OH)2D3combined with STAT5 inhibitor-treated cells,while in STAT5 inhibitor-treated cells had the lowest p-STAT5;the STAT5 protein expression was significantly higher in 1,25-(OH)2D3-treated cells,whereas lower in 1,25-(OH)2D3combined with STAT5 inhibitor-treated cells or in STAT5 inhibitor-treated cells had the lowest STAT5 protein expression(P<0.01 for all).Conclusion 1,25-(OH)2D3might inhibit Th17 cell differentiation via STAT5 signaling pathway.
T helper cell 17;1,25-(OH)2D3;STAT5;Cell differentiation;Mice
10.3969/j.issn.1672-5069.2016.04.006
上海市卫生和计划生育委员会科研课题(编号:20154Y0207)
200127上海市交通大学医学院附属仁济医院胃肠外科
周鸿,男,41岁,博士研究生,主治医师。主要从事消化内镜诊断与治疗学研究。E-mail:renjizhouhong@163.com通讯作者:徐庆,E-mail:renjixuqing@163.com
1,25-(OH)2D3inhibits Th17 cell differentiation via STAT5 signaling Zhou Hong,Gu Lei,Jiang Chunhui,et al.DepartmentofGastrointestinalSurgery,RenjiHospital,SchoolofMedicine,JiaoTongUniversity,Shanghai 200127,China

