丙型肝炎抗病毒治疗:口服药物改变了什么?
罗碧芬,魏来
丙型肝炎抗病毒治疗:口服药物改变了什么?
罗碧芬,魏来
丙型肝炎;直接抗病毒药物;进展
Hepatitis C;Direct-acting antiviral agents;Progress
慢性丙型肝炎抗病毒治疗的革命性变化是近几年来直接抗病毒药物(direct-acting antiviral agents,DAAs)进入临床,开辟了慢性丙型肝炎抗病毒治疗的新纪元。以DAA为基础的抗病毒方案包括1个DAA联合聚乙二醇干扰素alpha和利巴韦林(PR)、DAAs联合RBV,以及不同DAA联合或复合制剂的应用[1]。三种方案基本可以涵盖所有类型的HCV现症感染者的治疗。相比于经典的PR方案,不同DAA组成的多个DAAs方案的显著特点是:简单、安全、有效、短疗程和很少的副作用。DAA进入临床后,不同国家和地区的价格相差巨大,预计2016年中后期也会在我国大陆得到应用。目前还难以预测具体的价格以及市场供应情况。本文将仅介绍无干扰素(IFN-free)DAAs方案对于临床实践的10个主要影响(不包括联合聚乙二醇干扰素alpha和利巴韦林的方案),并试图简要归纳我国慢性丙型肝炎患者抗病毒治疗的简单流程。
1 治疗的目标进一步提高
由于DAAs在临床的应用,在主要的丙型肝炎指南中,抗病毒治疗的目标不再仅仅局限于原有的清除HCV,清除或减轻HCV相关肝损害,而是要逆转肝纤维化,阻止进展为肝硬化、失代偿期肝硬化、肝衰竭或肝细胞癌(HCC),提高患者的长期生存率和生活质量,预防HCV传播。甚至更提出了,对于进展期肝纤维化和肝硬化患者,HCV的清除可降低肝硬化失代偿的发生率,可降低HCC的发生率;对于失代偿期肝硬化患者,HCV的清除有可能降低肝移植的需求;对于肝移植患者,移植前抗病毒治疗可改善移植前的肝功能及预防移植后再感染,移植后抗病毒治疗可提高生存率[1]。
2 治疗的应答率显著提高
DAAs应用于慢性丙型肝炎患者可以获得超过90%,甚至95%的SVR。最能显示其突破性进展的,不仅仅是多个DAAs方案在临床试验中获得超过90%的SVR,在真实世界中,也能获得甚至超过90%的SVR。
自2013年12月6日美国FDA批准了sofosbuvir应用于基因1~4型HCV感染的初治人群开始,至2014年,陆续报告了Harvoni(sofosbuvir联合ledipasvir的复合制剂)、Viekira Pak(含有ombitasvir,paritaprevir/ritonavir和dasabuvir),在基因1型HCV感染人群中的临床试验结果,覆盖了基因1型的初治和经治患者,伴有或不伴有肝硬化,乃至肝移植人群[2-7]。这些药物被美国FDA列为突破性治疗。随后又进行了针对其他基因型的研究。在不断提高不同的基因型感染者SVR的同时,基因3型感染者SVR也在不断提高(本期将有另外专家论述)。
在真实世界中,harvoni、sofosbuvir联合simepre vir、sofosbuvir联合daclatasvir、Viekira Pak在各个基因型、进展性肝纤维化和肝硬化、失代偿肝硬化患者中都能获得高水平的SVR,并且,失代偿肝硬化的再次失代偿发生率显著下降[8-14]。
因此,DAAs的出现显著提高了CHC患者的SVR,还可能改善了近期的临床结局。
3 治疗的安全性进一步改善,对副作用的监测显著减少
在PR时代,由于干扰素/利巴韦林的副作用发生率极高,有些副作用即使在抗病毒治疗后仍然长时间存在。因此,在抗病毒治疗启动前需要进行相关的检查以决定是否有治疗的禁忌证。在治疗期间进行监测便于及时调整药物剂量,或通过其他措施及时纠正副作用以保证治疗总剂量尽可能达到80%以上,或者及时终止治疗。需要监测的指标包括血液学、生化学、免疫学、内分泌功能等多个方面,监测的频率较高。在DAAs时代,由于DAA耐受性良好,不需要早期停药,各种实验室检查的监测需求显著减少。但是,对于肝硬化患者、合并其他疾病以及采用含有利巴韦林方案的患者仍然需要增加监测频率。使用含有asunaprevir的方案,需要在治疗的第1周至12周,每2周监测1次血生化指标,13周至24周每4周监测1次。除此之外,通常情况下,如果使用其他不含利巴韦林的无干扰素方案(IFN-free),则在治疗开始前、治疗4周时检查血常规、肝脏和肾脏生化学指标;如果采用含有利巴韦林的无干扰素DAAs方案,则需要在治疗开始前,治疗过程中1、2、4、8和12周以及停止治疗后12周检查血常规、肝脏和肾脏生化学指标。如果监测中出现异常,则需要增加监测频率并有可能需要调整DAA剂量。对于合并HIV感染以及有合并用药、存在肝硬化、肾脏损伤的患者,为防止潜在的药物相互作用,需要增加监测频率。使用含有蛋白酶抑制剂(simeprevir,paritaprevir和asunaprevir)的患者,特别是联合利巴韦林的患者,可能会出现间接胆红素增高,常常为一过性改变,需要监测,但继续治疗往往可自发缓解[15]。
4 疗程显著缩短,病毒学监测和应答指导的治疗(RGT)不再具有临床意义
目前,主要的丙型肝炎防治指南推荐的DAAs方案多为:对无肝硬化者12周,肝硬化患者如联合利巴韦林为12周,不联合利巴韦林则为24周。Daclatasvir联合asunaprevir在基因1b型为24周[1,15-17],显著短于PR治疗。而且,仅仅12周的治疗,多个基因型的多个DAAs方案都能获得超过90%,甚至95%的SVR。获得SVR的患者大多在治疗早期即达到HCV RNA低于检测水平。所以,不需要通过治疗早期的病毒载量改变来预测SVR。WHO在2016年4月更新的《慢性丙型肝炎病毒感染者筛查、关爱和指南》中更是将DAAs治疗的病毒学检查简化为,开始治疗前和停止治疗后12周检测HCV RNA,仅仅两个时间点[15]。
针对基因3型以外的其他基因型感染者也不需要通过早期的病毒学应答来调整治疗疗程。仅仅在基因3型感染者,有研究观察在治疗2周时HCV RNA阳性可能预测复发[18]。
此外,DAA应用中的停药原则仅仅适用于含有干扰素的方案,IFN-free DAAs并没有停药原则[16]。
5 治疗适应证更加扩大,更多的特殊人群获得更高的病毒学应答
除了部分DAAs将失代偿期肝硬化列为禁忌证外,目前的临床研究暂无关于DAAs药物绝对禁忌证的报道。DAAs的适应证同时受疾病状态和药物相对禁忌证的影响。部分DAAs的代谢产物对肾功能的影响暂未确定,但严重肾功能受损患者的使用需慎重[1]。
在PR时代,各种指南和聚乙二醇干扰素的说明书提出了聚乙二醇干扰素alpha的绝对禁忌证,包括妊娠或短期内有妊娠计划、具有精神分裂症或严重抑郁症等病史、未控制的神经系统疾病如癫痫、未控制的自身免疫性疾病、失代偿期肝硬化、哺乳期女性、伴有严重感染、视网膜疾病、心功能衰竭、慢性阻塞性肺病等基础疾病、未控制的高血压、未控制的糖尿病、除肝移植外的实体器官移植、对干扰素不良反应高度不耐受、2岁以下儿童、未戒断的酗酒或吸毒。在DAA时代,除了妊娠或短期内有妊娠计划、哺乳期女性、肝移植外的实体器官移植、2岁以下儿童、未戒断的酗酒或吸毒外,其他的临床情况都不再是DAAs治疗的禁忌证。Sofosbuvir对妊娠的安全性是B级。但是,目前daclatasvir、harvoni、sofosbuvir和Viekira Pak、ZEPATIER(elbasvir联合grazoprevir的复合制剂)在人类还没有对妊娠安全性影响的数据。这些药物及其代谢产物是否会分泌入乳汁以及对新生儿的可能影响也缺乏资料。asunaprevir则明确不能用于妊娠期和哺乳期。对于实体器官移植的患者,肝移植已经有较多的研究。2016年欧洲肝病年会报告1项sofosbuvir联合ledipasvir治疗基因1型和基因4型HCV感染的肾移植患者的安全性和有效性。12周和24周疗程SVR相似,均接近一半初治人群获得SVR,且耐受性好[19]。同时,会议还报告了1项对于青少年患者的sofosbuvir联合ledipasvir的临床试验,可以获得97%的SVR,安全性好。但是,这些研究还需要进一步的更多研究数据证实。
6 利巴韦林不再是必须联合的药物
在PR时代,在聚乙二醇干扰素alpha基础上加用利巴韦林,可以显著降低复发率,提高SVR。在DAAs时代,利巴韦林主要用于肝硬化患者,大多数DAAs方案应用于肝硬化患者时,或者联合利巴韦林,12周总疗程,或者不联合利巴韦林,24周总疗程。多数指南和利巴韦林的说明书中提出了利巴韦林的绝对禁忌证和相对禁忌证,包括妊娠或短期内有妊娠计划、严重心脏病、对利巴韦林不良反应高度不耐受和男性Hb<13 g/dL、女性Hb<12 g/dL、患有血红蛋白疾病、肾功能异常、血肌酐>1.5 mg/dL、未控制的冠状动脉疾病。因为DAAs方案在肝硬化患者中的可调节性,可以通过延长总治疗时间来避开利巴韦林的使用。
7 初治和经治的变化
在PR时代,既往含干扰素治疗方案的失败将影响再治疗的应答,治疗失败的形式,包括复发、部分应答、无应答等,对再治疗应答的影响也不同。但是,既往对含干扰素方案失败的患者在现有的IFN-free DAAs中,治疗的应答并没有显著性差异。因此,不需要按照是否对干扰素治疗失败来调整IFN-free DAAs的治疗方案。
随着DAAs方案在世界上其他地区的应用,已经有DAAs治疗失败的报道。对于DAAs治疗失败患者的处理一般可以遵循这样的方法[16],①根据序列分析发现耐药相关位点,选择没有交叉耐药突变位点的DAA组合;由于sofosbuvir的高耐药屏障,在DAA组合中应该含有sofosbuvir;②如果不能进行序列分析,可以选择与以往方案不重叠的2~3 个DAAs组成新的DAAs方案。但是,由于sofosbuvir的高耐药基因屏障,sofosbuvir仍然是新的DAAs方案中的一个;③如果疾病的发展不是很迫切需要治疗,可以等有更多的研究再确定方案。此外,也有少数人提出,可以选择1个DAA联合PR治疗。
8 药物相互作用成为方案选择的新考虑
在PR时代,干扰素作为生物大分子,代谢后从肾脏排出。DAA作为小分子,几乎都在肝脏代谢,这样就会发生与其他肝脏代谢药物的潜在的相互作用。药物相互作用的后果有可能是任何一个药物的血药浓度被提高,导致出现安全性问题;另一个可能的后果是导致血药浓度下降,影响治疗效果。因此,对于有可能发生药物相互作用的患者,首先应了解在服用治疗丙型肝炎药物期间,是不是可以暂停其他用药,因为丙型肝炎的抗病毒治疗仅仅12周。其次,如果不能停药,是否有替代的药物;第三,如果必须同时使用,且没有替代药物,必须在治疗前了解药物相互作用是否可以通过剂量调整来解决,或者制定明确的监测计划。与各个DAA有潜在药物相互作用的药物很多,并且,不断有新的被发现,可以通过英国利物浦大学药物相互作用网站http://www.hep-druginteractions.org/查询,或者通过北京大学肝病研究所建立的丙型肝炎虚拟社区(http://www.hepconline.org)来查询。
在我国的慢性丙型肝炎感染者中,约4%合并HBV感染,这是亚洲地区的特点。如果在DAAs治疗慢性丙型肝炎中出现HBV DNA的升高,并有ALT升高,符合慢性乙型肝炎抗病毒治疗的适应证,应该给予抗HBV治疗。在我国临床常用的抗HBV核苷(酸)类似物中,恩替卡韦和已经批准的DAA均没有相互作用。替诺福韦和sofosbuvir联合ledipasvir有潜在的相互作用。因此,可以首先考虑应用恩替卡韦,如果因既往拉米夫定耐药或者其他原因考虑使用替诺福韦,则有可能需要调整剂量,并需要监测药物的副作用,或者对于这部分患者先给予抗HBV治疗[20]。
9 耐药相关突变还需要更多研究
不同于核苷(酸)类似物抗病毒治疗慢性乙型肝炎患者的耐药突变,在DAAs用于慢性丙型肝炎抗病毒治疗中,有三个新的概念,1个是耐药相关变异株(resistance-associated variant,RAV),指替代突变降低了对每个药物的敏感性。但是,这个术语并不十分准确,应该以新的术语耐药相关替代突变(resistance-associated substitutions,RAS)取代之。携带RAS并对DAA敏感性降低的变异株称之为耐药变异株(resistant variants)[21]。2016欧洲肝病年会1项研究报告了欧洲HCV耐药相关变异株(resistance associated variants,RAVs)数据库中DAAs初治和经治患者RAVs发生率及其特点[22],分析了3305例欧洲HCV感染者直接测序的数据,主要位点包括NS3(36,43,54,55,56,80,122,155,156,158,168,170,175)、NS5A(24,28,30,31,58,92,93)和NS5B(159,282,321,316,368,411,414,448,553,554,556,558,559,56)。RAVs定义为与治疗失败相关或者显示与参考株相比增加2倍以上药物敏感性。38%初治患者具有预存RAVs,其中在telaprevir、boceprevir和PEG IFN/RBV治疗的人群中,分别占36%、26%和34%。但在SOF/RBV± PEG治疗失败人群中未发现RAVs。另外,还有1项研究报告了SOF联合VEL,联合或者不联合利巴韦林24周用于既往含NS5a方案治疗失败者的再治疗情况[23](PS024)和ABT-493联合ABT-530对于基因1型既往DAAs治疗失败者的再治疗[24](GS11)。59%基线有NS5A RAVs存在,再治疗后,95%在4周时达到HCV RNA低于定量下限。在ABT-493联合ABT-530再治疗人群中,55例被随机入组,84%为基因1a型,66%接受过含有2~3个DAA的DAAs方案治疗,基因测序显示,82%(41例)基线具有RAVs,15例在NS3,10例在HS5,16例在NS3和NS5两个区域都存在RAVs。在到达停药12周SVR(SVR12)时间点的患者中,不同剂量和联合利巴韦林再治疗组获得95%~100%的SVR12。可见,RAVs不是真正的耐药,RAVs的临床意义以及如何应用还需要进一步研究才能明确。
10 对长期预后还需要进一步研究
既往干扰素治疗的研究显示,慢性丙型肝炎经干扰素治疗获得SVR后,可使肝纤维化甚至肝硬化消退[25],还可降低肝脏相关的病死率[26],还可以延长HCC患者在肿瘤治疗后的生存期[27]。由于DAAs的应用历史还比较短,是否也能够达到改变疾病结局,而不仅仅是病毒清除,还需要更多的研究。此外,进展期肝纤维化及肝硬化患者HCV的清除可降低肝硬化失代偿的发生率,可降低HCC的发生率,但不能完全避免其发生,仍然需长期监测HCC的发生情况;对于失代偿期肝硬化患者HCV的清除有可能降低肝移植的需求,对该部分患者中长期生存率的影响也需进一步研究。
11 目前DAAs方案选择的简化流程
最后,我们试图根据目前批准的DAAs情况,将我国慢性丙型肝炎患者DAAs治疗简单地做一概括,见图1。
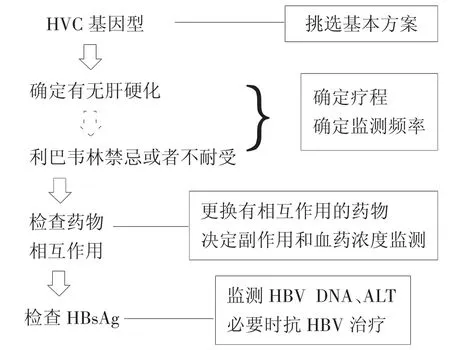
图1 DAAs治疗的简单流程
首先检测基因型,从而初步决定可供选择的DAAs方案;第二步,确定是否存在肝硬化和是否有应用利巴韦林禁忌证。如果没有肝硬化,可以选择现有DAAs方案的一种,治疗12周,如果有肝硬化,同时有应用利巴韦林禁忌证,则选择DAAs方案,治疗24周,如果有肝硬化但没有利巴韦林禁忌证,则根据患者具体情况,可以选择DAAs联合利巴韦林治疗12周,或者不联合利巴韦林治疗24周;第三步,了解是否有合并用药。如果合并用药不能在服用DAAs时暂停,则需要选择没有相互作用的DAAs方案,或者更换合并用药;最后,检测是否有HBV合并感染,如果存在HBV合并感染,则应在DAAs治疗中监测HBV DNA和ALT。
[1]中华医学会肝病学分会,中华医学会感染病学分会.丙型肝炎防治指南(2015更新版).中华肝脏病杂志,2015,23(12):906-923.
[2]KowdleyKV,GordonSC,ReddyKR,etal.Ledipasvirand sofosbuvirfor8or12weeksforchronicHCVwithout cirrhosis.N Engl J Med,2014,370(20):1879-1888.
[3]Afdhal N,Zeuzem S,Kwo P,et al.Ledipasvir and sofosbuvir for untreated HCV genotype 1 infection.N Engl J Med,2014,370 (20):1889-1898.
[4]Feld JJ,Kowdley KV,Coakley E,et al.Treatment of HCV with ABT-450/r-ombitasvir and dasabuvir with ribavirin.N Engl J Med,2014,370(17):1594-1603.
[5]Zeuzem S,Jacobson IM,Baykal T,et al.Retreatment of HCV withABT-450/r-ombitasviranddasabuvirwithribavirin.N Engl J Med,2014,370(17):1604-1614.
[6]Afdhal N,Reddy KR,Nelson DR,et al.Ledipasvir and sofosbuvir for previously treated HCV genotype 1 infection.N Engl J Med,2014,370(16):1483-1493.
[7]Poordad F,Hezode C,Trinh R,et al.ABT-450/r-ombitasvir and dasabuvir with ribavirin for hepatitis C with cirrhosis.N Engl J Med,2014,370(21):1973-1982.
[8]Brown RS Jr,O'Leary JG,Reddy KR,et al.Hepatitis C therapeuticregistryresearchnetworkstudygroup. Interferon-freetherapy forgenotype1hepatitisC inliver transplant recipients:Real-world experience from the hepatitis C therapeutic registry and research network.Liver Transpl,2016,22(1):24-33.
[9]Pillai AA,Wedd J,Norvell JP,et al.Simeprevir and sofosbuvir (SMV-SOF)for12weeksforthetreatmentofchronic hepatitis C genotype 1 infection:A real world(Transplant)hepatology practice experience.Am J Gastroenterol,2016,111 (2):250-260.
[10]Younossi ZM,Bacon BR,Dieterich DT,et al.Disparate access to treatment regimens in chronic hepatitis C patients:data from the TRIO network.J Viral Hepat,2016,23(6):447-454.
[11]Sulkowski MS,Vargas HE,Di Bisceglie AM,et al.HCV-TARGET Study Group.Effectiveness of simeprevir plus sofosbuvir,withorwithoutribavirin,inreal-worldpatientswithHCV genotype 1 infection.Gastroenterology,2016,150(2):419-429.
[12]BackusLI,BelperioPS,ShahoumianTA,etal.Realworld effectivenessof ledipasvir/sofosbuvirin4365treatment-naive genotype 1 hepatitis C infected patients.Hepatology,2016 Apr 26.doi:10.1002/hep.28625[ahead of print].
[13]ZuckermanE,AshkenasiE,Kovalev Y,etal.Tereal-world Israeli experience of treating chronic hepatitis C,genotype 1 patients with advanced fibrosis with paritaprevir/ritonavir/ombita svir,dasabuvirwithorwithoutribavirin:alargemulti-center cohort.J Hepatol,2016,64(supplement 2):s137.
[14]Cheung MCM,Foster GR,Irving WL,et al.Antiviral treatment in patients with advanced HCV cirrhosis using sofosbuvir and ledipasvir/daclatasvir with or without ribavirin6 and 12 month outcomes compared to untreated patients.J Hepatol,2016,64 (supplement 2):s185.
[15]http://www.who.int/hepatitis/publications/hepatitis-c-guidelines-20 16/en/16]European Association for Study of Liver.EASL recommendationsontreatmentofhepatitisC2015.JHepatol,2015,63(1):199-236.
[17]AASLD/IDSA HCV GuidancePanel.HepatitisC guidance:AASLD-IDSArecommendationsfortesting,managing,and treating adultsinfectedwithhepatitisC virus.Hepatology, 2015,62(3):932-954.
[18]Maasoumy B,Vermehren J,Welker MW,et al.Clinical value of on-treatment HCV RNA levels during different approved sofosbuvir-based antiviral regimens.J Hepatol,2016 Apr 13. pii:S0168-8278(16)30108-8.doi:10.1016/j.jhep.2016.04.006.
[19]Colombo M,Aghemo A,Liu L,et al.Ledipasvir/sofosbuvir for 12 or24weeksissafeandeffectiveinkidneytransplant recipients withchronic genotype 1or4HCV infection.J Hepatol,2016,64(supplement 2):s183.
[20]Wang C,Ji D,Chen J,et al.Hepatitis B reactivation in CHC Chinesetreatedwithpan-oralDAAs-aprospectivestudy. Hepatol Int,2016,10(Suppl 1):S51.
[21]Pawlotsky JM.Hepatitis C virus resistance to direct-acting antiviraldrugsininterferon-freeregimens.Gastroenterology,2016 Apr 11.pii:S0016-5085(16)30055-5.doi:10.1053/j. gastro.2016.04.003.
[22]Susser S,Dietz J,Vermehren J,et al.European RAVs database:frequency and characteristics of RAVs in treatment naive and DAA-experienced patients.J Hepatol,2016,64(supplement 2):s139.
[23]Gane EJ,Shiffman ML,Etzkorn K,et al.Sofosbuvir/velpatasvir in combination with ribavirin for 24 weeks is effective retreatment for patients who failed prior NS5A containing DAA regimens:resultsof theGS-US-342-1553study.JHepatol,2016,64 (supplement 2):s147.
[24]PoordadF,GordonSC,AsatryanA,etal.Highefficacyof ABT-493 and ABT-530 in HCV genotype 1 infected patients who have failed direct-acting antiviral-containing regimens:the magellan-I study.J Hepatol,2016,64(supplement 2):s160.
[25]Shiratori Y,Imazeki F,Moriyama M,et al.Histologic improvement of fibrosis in patients with hepatitis C who have sustained response to interferon therapy.Ann Intern Med,2000,132(7):517-524.
[26]YoshidaH,ArakawaY,SataM,etal.Interferontherapy prolonged life expectancy among chronic hepatitis C patients. Gastroenterology,2002,123(2):483-491.
[27]Shiratori Y,Shiina S,Teratani T,et al.Interferon therapy after tumorablationimprovesprognosisinpatientswith hepatocellular carcinoma associated with hepatitis C virus.Ann Intern Med,2003,138(4):299-306.
(收稿:2016-05-05)
(本文编辑:陈从新)
10.3969/j.issn.1672-5069.2016.04.001
100044北京市北京大学人民医院肝病研究所通讯作者:魏来,E-mail:weilai@pkuph.edu.cn
Is hepatitis C eradicated possible Luo Bifen,Wei Lai.Institute of Liver Diseases,People's Hospital,Beijing University,Beijing 100044

