抗增殖蛋白过表达对HepG2细胞增殖和凋亡的影响*
翟嵩,孙明珠,王文俊,李亚萍,张欣,李梅,党双锁
抗增殖蛋白过表达对HepG2细胞增殖和凋亡的影响*
翟嵩,孙明珠,王文俊,李亚萍,张欣,李梅,党双锁
目的探讨抗增殖蛋白(PHB)过表达对人肝癌细胞系HepG2细胞增殖和凋亡的影响。方法在已构建的PHB真核表达质粒pEGFP-N1-PHB瞬时转染HepG2细胞,采用四甲基偶氮唑盐比色法(MTT法)检测HepG2细胞增殖;使用流式细胞仪检测HepG2细胞周期和凋亡。结果转染pEGFP-N1-PHB细胞增殖明显低于pEGFP-N1空载转染细胞或未转染细胞(P<0.05);在转染后48 h,转染组G2/M期细胞比例为(27.84±0.47)%,显著高于空载转染组的(17.21±0.64)%或未转染组的(22.67±0.33)%(P<0.001);转染组细胞凋亡率为(31.72±0.35)%,显著高于空载转染组的(18.66±0.56)%或未转染组的(13.47±0.94)%(P<0.001)。结论PHB过表达可抑制人肝癌HepG2细胞增殖,诱导细胞进入G2/M期后被阻滞,并诱导细胞凋亡。
HepG2细胞;抗增殖蛋白;细胞凋亡;细胞增殖
抗增殖蛋白(Prohibitin)作为重要的细胞膜蛋白超家族成员之一,主要存在于线粒体内膜上,发挥着分子伴侣的作用[1]。近年来,越来越多的研究揭示抗增殖蛋白在新陈代谢、细胞增殖、免疫调节及其相关疾病中起作用[2~6]。在丙型肝炎病毒体外细胞培养系统(Hepatitis C virus in vitro cell culture system,HCV cc)抗增殖蛋白表达的研究发现Huh-7-HCV和Huh-7.5-HCV细胞抗增殖蛋白表达上调,提示其在HCV致病机制中起某些作用[7-12]。prohibitin高表达在肝脏疾病尤其是丙型肝炎的发病机制方面所发挥的作用尚不清楚。为了进一步阐明prohibitin的功能,诠释prohibitin表达上调在肝细胞损伤中所发挥的作用,本研究应用已构建的pEGFP-prohibitin真核表达系统,转染HepG2细胞,以探讨抗增殖蛋白表达上调对细胞增殖和凋亡的影响,并探讨抗增殖蛋白的作用机制,以期揭示抗增殖蛋白在HCV感染中的作用,进而为阐释HCV的致病机制提供理论依据。
1 材料与方法
1.1细胞与试剂人肝癌细胞系HepG2细胞由我校医学院生化教研室保存。TurboFect Transfection Reagent和预染蛋白质(Prestained Protein)Marker购自美国Thermo公司;HRP标记的羊抗兔IgG抗体购自德国Qiagen公司;兔抗人prohibitin多克隆抗体和兔抗人GAPDH多克隆抗体购自美国Santa公司;MTT细胞增殖检测试剂盒、细胞周期检测试剂盒和Annexin V-FITC细胞凋亡检测试剂盒均购自美国GenScript公司。
1.2细胞转染取HepG2细胞,使用含10%胎牛血清的DMEM培养基,置37℃、5%CO2细胞培养箱中培养;将对数生长期的HepG2细胞以5×105个/孔接种于六孔板,培养24 h,使细胞融合达90%~95%。实验分为3组,即pEGFP-prohibitin转染组、pEGFP-N1空载转染组和未转染空白对照组。参照TurboFectTransfectionRe agent说明书转染pEGFP-prohibitin,或转染空载体pEGFP-N1。
1.3细胞增殖检测分别取转染后24 h、48 h和72 h的细胞,用0.25%(w/v)胰蛋白酶消化、离心;将细胞重悬,以2×103个细胞/孔密度接种于96孔培养板,每组设3个复孔,加入RPMI 1640培养液至200 μl/孔,于37℃、5%(v/v)CO2培养箱内培养24 h。在避光条件下,向每孔加入MTT溶液10 μl,放置在细胞培养箱中继续孵育4 h。每孔加入Formazan溶解液100 μl,放置在细胞培养箱中继续孵育4 h,直到在普通光学显微镜下观察到Formazan全部溶解。使用酶标仪在570 nm波长处测定OD值。
1.4HepG2细胞周期检测分别收集转染48 h的细胞,制成单细胞悬液,用冷PBS(含有137 mM NaCl,2.7mMKCl,4.3mMNa2HPO4,1.4mM KH2PO4,pH 7.4)洗两遍,弃去上清液,缓慢加入70%(v/v)冰乙醇,4℃固定过夜,用PBS清洗细胞,去除乙醇,向每个样品管中加入PI染色液0.5 ml【每个样品染色缓冲液0.5 ml+PI染色液(20×)25 μl+RNase A(50×)10 μl】,充分并缓慢地重悬细胞,37℃下避光温浴30 min。使用Millipore guava easyCyte HT流式细胞仪(美国Millipore公司)在激发波长488 nm处检测红色荧光,并检测光散射情况。应用ModFit LT2.0软件(Verity Software House,USA)对光散射和细胞DNA水平进行分析。以上实验重复3次,取平均值。
1.5细胞凋亡检测[13]进行如下实验步骤:(1)细胞的收集:PBS洗涤细胞1次,胰酶消化细胞。1500 r/ m离心5 min,弃上清,收集细胞;(2)细胞与AnnexinⅤ-FITC结合:用PBS重悬细胞,并计数。1500 r/m离心5 min,弃上清,加入1×Binding Buffer 500 μl,加入AnnexinⅤ-FITC 5 μl,再加入Propidium lodide 10 μl,轻轻混匀。在室温下,避光反应15 min;(3)流式细胞仪检测:设定激发波长Ex=488 nm,发射波长Em=530 nm。FL1为Annexin Ⅴ-FITC的绿色荧光FITC通道;FL2为PI红色荧光通过的PI通道。使用未经凋亡诱导的正常细胞作为对照,进行荧光补偿调节。
1.6统计学分析应用SPSS 15.0软件(IBM,USA)进行统计学处理。计量资料以(±s)表示,采用Shapiro-Wilk检验确认数据呈正态分布。对数据不符合正态分布者,进行平方根反正旋变换,组间差异比较采用单因素方差分析(One-way ANOVA)和Dunnett-t检验,以P<0.05为有统计学上显著性差异。
2 结果
2.1抗增殖蛋白基因表达上调延缓了细胞的生长速度,抑制了细胞增殖本课题组在前期研究中发现抗增殖蛋白在pEGFP-prohibitin转染人肝癌细胞系HepG2中高表达(待发表)。为探讨其高表达对细胞增殖等的影响,我们进一步应用MTT法分别测定pEGFP-prohibitin转染组、pEGFP-N1空载转染组和未转染空白对照组在转染后24 h、48 h和72 h细胞的生长情况。如图1所示,pEGFP-prohibitin转染组细胞生长速度和增殖活性明显低于pEGFP-N1空载转染组或未转染空白对照组细胞(P<0.05),而pEGFP-N1空载转染组与未转染空白对照组细胞增殖速度差异不明显(P>0.05)。
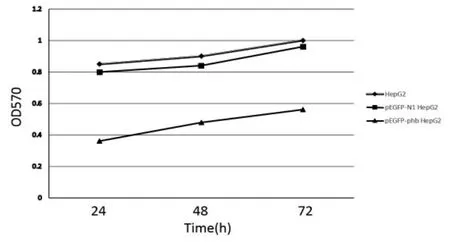
图1 转染后三组细胞生长曲线
2.2抗增殖蛋白表达上调对HepG2细胞周期的影响转染后48 h检测细胞周期发现(图2),在G0/G1期,pEGFP-prohibitin转染组细胞比例(55.83±0.14%)明显低于pEGFP-N1空载转染组(67.15±0.59%)或未转染空白对照组细胞【(60.61±0.66%),P<0.0001】;在G2/M期,pEGFP-prohibitin转染组细胞比例(27.84± 0.47%)明显高于pEGFP-N1空载转染组(17.21± 0.64%)或未转染空白对照组细胞【(22.67±0.33%),P<0.0001】,提示pEGFP-prohibitin转染组细胞出现了明显的G2/M期阻滞;在S期,pEGFP-prohibitin转染组细胞比例(14.67±0.49%)与pEGFP-N1空载转染组(13.77±0.34%)或未转染空白对照组(14.97± 0.32%)相比,无统计学差异(P>0.05)。由此证明了prohibitin表达上调使细胞发生G2/M期阻滞。
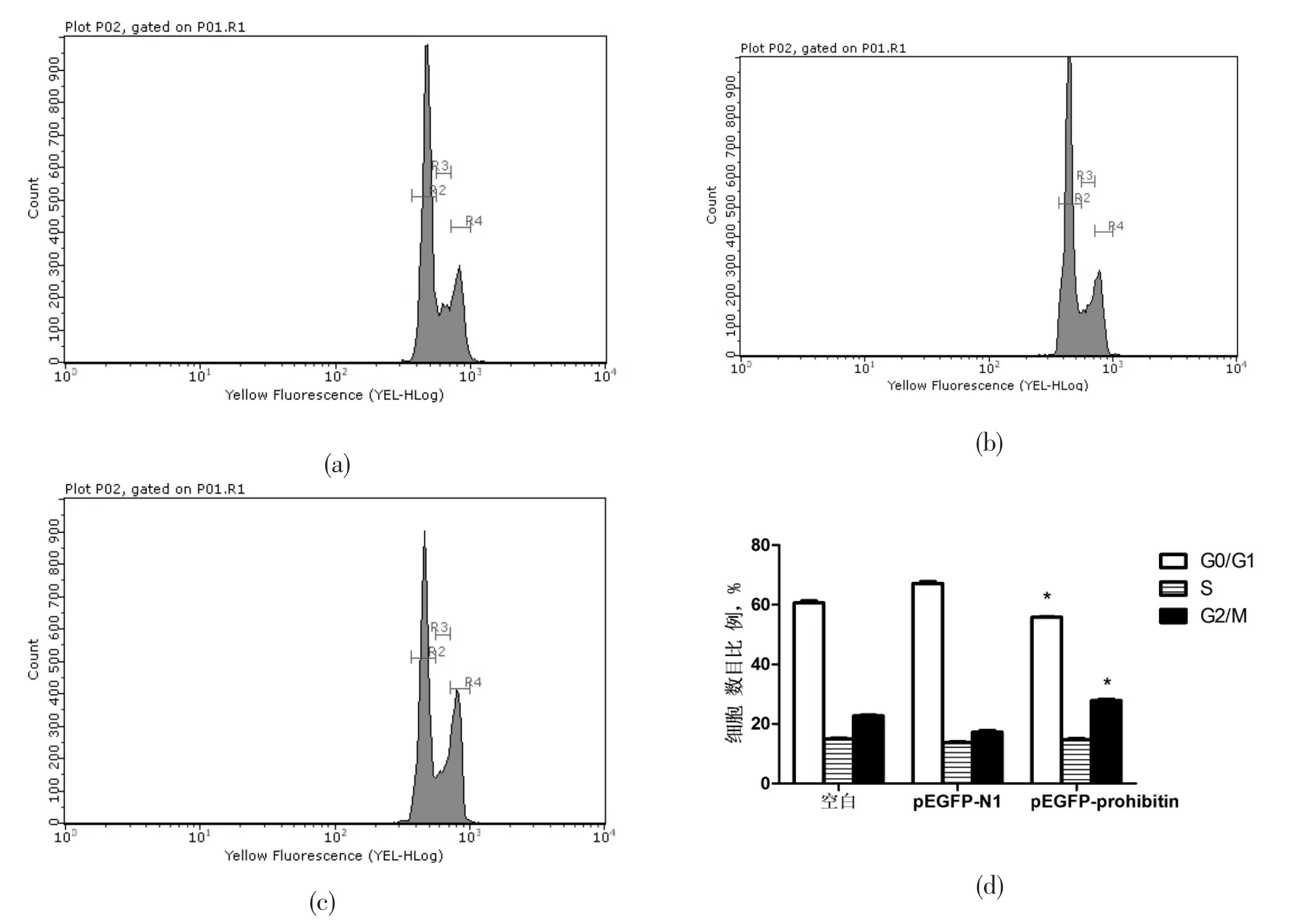
图2 转染48 h,prohibitin表达上调对HepG2细胞周期的影响
2.3抗增殖蛋白表达上调很可能诱导细胞凋亡的发生在转染48 h,使用Millipore guava easyCyte HT流式细胞仪检测pEGFP-prohibitin转染组、pEGFP-N1空载转染组和未转染空白对照组细胞凋亡情况。如图3所示,pEGFP-N1空载转染组和未转染空白对照组细胞出现少量的细胞凋亡,而pEGFP-prohibitin转染组细胞出现较高的凋亡峰(图3-c箭头所示),差异具有明显的统计学意义(P<0.05);如图4a~c所示,在散点图中,对于检测细胞凋亡有显著意义的是右下象限的细胞百分比,能反映凋亡细胞的数量多少;pEGFP-prohibitin转染组凋亡率(31.72±0.35%)显著高于未转染空白对照组(13.47±0.94%)或pEGFP-N1空载转染组(18.66±0.56%,图4-d),差异具有明显的统计学意义(P<0.001)。prohibitin基因转染后细胞凋亡明显增多,提示prohibitin表达上调很可能诱导了细胞凋亡的发生。
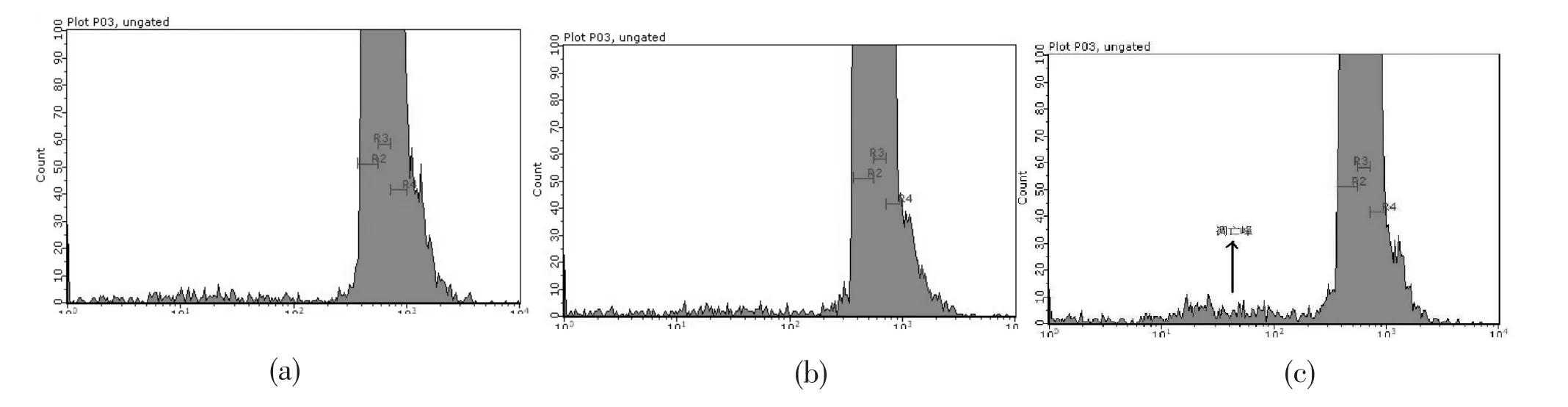
图3 转染48 h,3组细胞凋亡率直方图
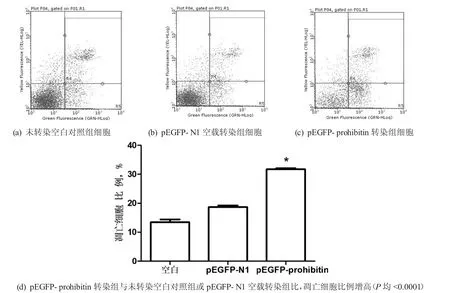
图4 转染48 h,3组细胞凋亡散点图及凋亡率比较
3 讨论
抗增殖蛋白属于细胞膜蛋白超家族,是一种正常人体细胞内广泛存在的多功能蛋白[14]。它是一种广泛表达的、进化上高度保守的基因,可能是一种抑癌基因[14]。在前期研究中,我们建立了稳定的HCV体外细胞培养模型,通过蛋白质组学的方法发现抗增殖蛋白在HCV感染细胞中较对照组细胞表达量明显增多[12]。但是,抗增殖蛋白高表达在肝脏疾病尤其是丙型肝炎的发病机制方面所发挥的作用尚不清楚。
在前期应用蛋白质组学技术研究丙型肝炎病毒体外细胞培养系统时发现抗增殖蛋白表达上调。抗增殖蛋白表达上调的报道还可见于其他学者的研究中。Xu[15]发现prohibitin在高转移肝癌细胞株MHCC97-L细胞中表达上调,并且导致细胞增殖受到抑制,抑制率达35%,癌细胞迁移率增加两倍。Jia[16]通过蛋白质组学研究促黄体激素(Luteinizing hormone,LH)相关性人卵巢上皮性肿瘤时发现抗增殖蛋白表达增高了2.5倍,prohibitin是一种LH相关性蛋白和LH的最新靶蛋白,抗增殖蛋白可能在人卵巢上皮癌变发生发展过程中发挥着保护性作用。进而学者们开始研究抗增殖蛋白的生物学功能。Sripathi et al[17]发现在氧化应激环境中,抗增殖蛋白在视网膜细胞和视网膜色素上皮细胞的线粒体和细胞核之间穿梭,发挥着抗凋亡和转录调控作用。He[18]发现prohibitin基因是一种雌激素调节基因,抗增殖蛋白在小鼠子宫内膜发育和性功能发育中发挥着非常重要的作用,而且在雌激素调节基因的表达中不可或缺。以上研究均提示,prohibitin可能具有重要的调控作用。Kathiria[19]通过RNA干扰技术降低抗增殖蛋白基因表达,发现人结肠上皮细胞中抗增殖蛋白表达减少后引起细胞自噬,最终导致线粒体损伤和细胞毒性反应。此外,抗增殖蛋白[20,21]还可能参与抑制细胞增殖、调控细胞周期、诱导细胞凋亡、调节细胞信号转导、抗衰老等细胞生命活动。但其确切功能尚存争议,具体作用机制亦不明确。本研究通过研究过表达抗增殖蛋白对人肝癌细胞系HepG2增殖和凋亡的影响,发现pEGFP-prohibitin转染组细胞生长速度、增殖活性明显落后于pEGFP-N1空载转染组及未转染空白对照组细胞;pEGFP-prohibitin转染组细胞的凋亡率明显高于pEGFP-N1空载转染组细胞和未转染对照组细胞,pEGFP-prohibitin转染组细胞发生了G2/M期阻滞和S期细胞减少,提示prohibitin表达上调抑制细胞增殖和促进细胞凋亡。我们在前期研究发现抗增殖蛋白在HCV体外细胞培养模型中明显高表达[12],提示其与肝脏疾病尤其是丙型肝炎的发生发展中有着某种作用,结合本研究结果可以推测HCV可能通过上调抗增殖蛋白参与抑制肝细胞的增殖和促进细胞凋亡,但目前在HCV体外细胞培养模型中HCV是如何引起抗增殖蛋白表达上调及其具体机制需要进一步深入研究。另外,高表达的抗增殖蛋白抑制细胞增殖、促进细胞凋亡的详细分子机制和途径不明,这些方面的问题仍需要在未来的研究中进行探讨。
[1]Rizwani W,Alexandrow M,Chellappan S.Prohibitin physically interactswithMCM proteinsandinhibitsmammalianDNA replication.Cell Cycle,2009,8:1621-1629.
[2]McClung JK,Danner DB,Stewart DA,et al.Isolation of a cDNA thathybridselectsantiproliferativemRNAfromratliver. Biochem Biophys Res Commun,1989,164:1316-1322.
[3]Nuell MJ,Stewart DA,Walker L,et al.Prohibitin,an evolutionarily conserved intracellular protein that blocks DNA synthesis in normal fibroblasts and HeLa cells.Mol Cell Biol,1991,11:1372-1381.
[4]Kang X,Zhang L,Sun J,et al.Prohibitin:a potential biomarker for tissue-based detection of gastric cancer.J Gastroenterol,2008,43:618-625.
[5]Nan Y,Yang S,Tian Y,et al.Analysis of the expression protein profiles of lung squamous carcinoma cell using shot-gun proteomics strategy.MedOncol,2009,26:215-221.
[6]Mishra S,Murphy LC,Murphy LJ.The prohibitins:emerging roles in diverse functions.J CellMolMed,2006,10:353-363.
[7]Rastogi S,Joshi B,Dasgupta P,et al.Prohibitin facilitates cellular senescence by recruiting specific corepressors to inhibit E2Ftarget genes.Mol Cell Biol,2006,26:4161-4171.
[8]Fusaro G,Dasgupta P,Rastogi S,et al.Prohibitin induces the transcriptional activity of p53 and is exported from the nucleus upon apoptotic signaling.J Biol Chem,2003,278:47853-47861.
[9]Joshi B,Ko D,Ordonez-Ercan D,et al.A putative coiled-coil domain of prohibitin is sufficient to repress E2F1-mediated transcriptionandinduceapoptosis.BiochemBiophysRes Commun,2003,312:459-466.
[10]党双锁,孙明珠,寻萌,等.抑制素在人肝癌细胞SMMC-7721 和Huh-7中的表达及其编码序列扩增.中国肝脏病杂志,2010,2(3):1-5.
[11]Liu T,Tang H,Lang Y,et al.MicroRNA-27a functions as oncogeneingastricadenocarcinomabytargetingprohibitin. Cancer Lett,2009,273:233-242.
[12]Dang SS,Sun MZ,Yang E,et al.Prohibitin is overexpressed in Huh-7-HCVandHuh-7.5-HCVcellsharboringinvitro transcribed full-length hepatitis C virus RNA.Virol J,2011,8:424.
[13]王军,李光明,仝艳艳,等.新型异喹啉类化合物12-4-Y对活化肝星状细胞凋亡的影响及其机制研究.实用肝脏病杂志,2015,18(4):344-347.
[14]邵明斌,覃远汉,彭单单,等.Prohibitin基因转染对肾小管上皮细胞表型转化的影响.实用儿科临床杂志,2012,5:324-326.
[15]Xu Z,Wu J,Zha X.Up-regulation of prohibitin 1 is involved inthe proliferationandmigrationof livercancercell.Sci China Life Sci,2011,54(2):121-127.
[16]Jia L,Yi XF,Zhang ZB,et al.Prohibitin as a novel target protein of luteinizing hormone in ovarian epithelial carcinogenesis. Neoplasma,2011,58(2):104-109.
[17]Sripathi SR,He W,Atkinson CL,et al.Mitochondrial-nuclear communication by prohibitin shuttling under oxidative stress. Biochemistry,2011,50(39):8342-8351.
[18]He B,Kim TH,Kommagani R,et al.Estrogen-regulated prohibitin is required for mouse uterine development and adult function.Endocrinology,2011,152(3):1047-1056.
[19]Kathiria AS,Butcher LD,Feagins LA,et al.Prohibitin 1 modulates mitochondrial stress-related autophagy in human colonic epithelial cells.PloSOne,2012,7(2):e31231.
[20]Ande SR,Nguyen KH,Padilla-Meier GP,et al.Prohibitin overexpression in adipocytes induces mitochondrial biogenesis,leads to obesity development,and affects glucose homeostasis in a sex-specific manner.Diabetes,2014,63:3734-3741
[21]Choi M,Chaudhari HN,Ji YR,et al.Effect of estrogen on expression of prohibitin in white adipose tissue and liver of diet-induced obese rats.MolCellBiochem.2015,[ahead of print].
[22]Zhou TB,Qin YH.Signaling pathways of prohibitin and its role in diseases.J Recept Signal Transduct,2013,33(1):28-36.
(收稿:2016-01-04)
(本文编辑:陈从新)
Objective To investigate the effect of prohibitin(PHB)over-expression on proliferation and apoptosis of human hepatocellular carcinoma cell line HepG2 cells.Methods The eukaryotic expression plasmid (pEGFP-N1-PHB)had been constructed and the HepG2 cells were transiently transfected with recombinant plasmid.Measurement of cell proliferation was performed by using MTT assay.Flow cytometry was carried out to detect cell cycle alterations and apoptosis.Results The cell growth curves showed that the proliferation of HepG2 cells were significantly decreased after transfection with pEGFP-N1-PHB as compared with pEGFP-N1 or controls(P<0.05);At 48 hours after transfection,the proportion of G2/M phase of HepG2 cells in pEGFP-N1-PHB-transfected group was(27.84±0.47)%,significantly higher than in pEGFP-N1-transfected group[(17.21± 0.64)%]or in the non-transfected group[(22.67±0.33)%,P<0.001];The percentage of apoptotic cells in pEGFPN1-PHB-transfected group was(31.72±0.35)%,much higher than(18.66±0.56)%in pEGFP-N1-transfected or non-transfected cells[(13.47±0.94)%,P<0.001].Conclusion PHB overexpression might inhibit the proliferation,induce G2/M phase arrest and apoptosis of HepG2 cells.
Hep G2 Cells;Prohibitin;Apoptosis;Cell cycle
10.3969/j.issn.1672-5069.2016.04.007
国家自然科学基金资助项目(81170393)
710004西安市西安交通大学医学院第二附属医院感染病科
翟嵩,女,38岁,医学博士,主治医师。主要从事感染性疾病发病机制研究。E-mail:zhaisongsong@189.cn
党双锁,E-mail:dang212@126.com
Effect of prohibitin over-expression on proliferation and apoptosis of human hepatocellular carcinoma cell line HepG2 cells Zhai Song,Sun Mingzhu,Wang Wenjun,et al.Department of Infectious Diseases,Second Affiliated Hospital,Medical School,Jiaotong University,Xi'an 710004,Shaanxi Province,China

