丙型肝炎直接抗病毒治疗研究进展
饶慧瑛
丙型肝炎直接抗病毒治疗研究进展
饶慧瑛
丙型肝炎;直接抗病毒药物;进展
Hepatitis C;Directly acting antiviral agents;Progress
目前,我国针对慢性丙型肝炎(chronic hepatitis C,CHC)的标准治疗方案(standard of care,SOC)仍然是聚乙二醇干扰素(pegylated interferon,PEGIFN)-α联合利巴韦林(ribavirin,RBV),简称PR治疗。但是近年来,针对HCV生活周期中病毒蛋白靶向特异性治疗的许多小分子化合物研究进展非常迅速,这些药物被统一命名为直接作用抗病毒药物(directly acting antivirals,DAAs)。在欧美地区,DAAs已经替代PR成为慢性丙型肝炎抗病毒的SOC方案,无干扰素和利巴韦林的DAAs治疗已成为现实。DAAs具有抗病毒强效、不良反应少、疗程短、口服给药、服用药片少等多种优点。
1 DAAs的分类
DAAs又称HCV特异性靶向抗病毒治疗药物,这类药物特异性作用于HCV复制周期,主要包括以下几类:非结构蛋白(non-structural,NS)3/4A蛋白酶抑制剂(protease inhibitors)、NS5A蛋白抑制剂和NS5B聚合酶抑制剂等[1]。
1.1NS3/4A蛋白酶抑制剂HCV NS3/4A是位于NS3 N端的NS3丝氨酸蛋白酶与NS4A形成的稳定二聚体,在HCV多聚蛋白NS3~NS5区域的翻译加工过程中发挥重要作用[2,3]。NS3/4A蛋白酶抑制剂能与酶的活性中心结合,干扰非结构蛋白的剪切,从而阻止病毒的复制。NS3/4A蛋白酶抑制剂还能恢复IFN调节因子3,从而更好地发挥先天性抗病毒免疫应答[4]。蛋白酶抑制剂抗病毒效果较强,为基因1型特异性,耐药屏障较低。
1.2NS5A蛋白抑制剂HCV的NS5A蛋白上存在IFN敏感决定区,且NS5A对HCV的复制和组装有调节作用。因此,NS5A也是特异性抗HCV的重要靶标。NS5A蛋白抑制剂抗病毒效果较强,可针对基因1型和4型,耐药屏障较低。
1.3NS5B聚合酶抑制剂NS5B RNA依赖的RNA聚合酶(RdRP)在HCV复制中起着重要作用。正常的哺乳动物细胞不表达与NS5B聚合酶功能相同的酶。作为抗病毒药物,针对NS5B RdRP的特定抑制剂包括核苷类似物和非核苷类似物NS5B聚合酶抑制剂[5]。核苷类似物抑制剂抗病毒效果作用中等,可针对多种基因型,耐药屏障较高。非核苷类似物抑制剂抗病毒活性为低至中等度,为基因1型特异性,耐药屏障较低。
2011年以来,以上三类药物中的多种药物已陆续在美国、欧洲和日本等地上市(表1)[6],在临床试验和治疗实践中都取得了比较好的疗效。
2 已上市DAAs的临床适应证
所有HCV感染初治或经治的代偿期或失代偿期肝病患者均需要抗病毒治疗,除非有非肝病原因所致的预期寿命有限患者不建议治疗。对于显著肝纤维化或肝硬化的患者(肝纤维化分期为F3~F4)应立即考虑启动抗病毒治疗。
含DAAs的方案尤其适用于既往聚乙二醇干扰素和利巴韦林治疗后复发或是对PR治疗无应答的患者。初治患者也可考虑使用含DAAs的方案,以缩短疗程、增加耐受性、提高持续病毒学应答率(sustainedvirologicresponse,SVR)。不同类型DAAs有不同的联合方案,某一DAA与不同药物联合后适用的感染者人群受病毒基因型的影响。

表1 美国和欧洲等地批准上市的治疗丙型肝炎药物
2.1SimeprevirSimeprevir必须与PR联合使用,或者与NS5B聚合酶抑制剂联合使用,且仅适用于基因1型和4型患者。具体的给药方案为:Peg-IFN α (1次/w)+利巴韦林(<75 kg和≥75 kg患者的剂量分别为1000 mg·d-1、1200 mg·d-1+Simeprevir(150 mg 1次/d)联合治疗12周,之后对于初治以及既往PR治疗复发的患者再单独应用PR治疗12周(总疗程24周);对于既往PR治疗部分应答或无应答者应再治疗36周(总疗程48周)。对于经直接测序检测到基线存在NS3蛋白酶序列Q80K变异的基因1a型患者,不采用该联合方案。不过,我国丙型肝炎患者中基因1a型仅占1.4%左右,因此受此变异影响的患者较少[7]。我国和韩国Ⅲ期临床试验数据显示,初治基因1型患者采用该方案治疗的SVR 为91%,且耐受性良好;白细胞介素28B基因型CC患者SVR为94%,非CC型患者为79%;METAVIR评分为F4的5例患者均获得了SVR[8]。
经以该三联方案治疗的患者如在治疗第4、12 或24周时,采用灵敏试剂检测HCV RNA(检测下限为15 IU/ml)为阳性,应停止治疗,更换为包括另一种DAAs在内的含干扰素的治疗方案,或者不包括蛋白酶抑制剂的无IFN的治疗方案。如患者出现皮疹和间接胆红素升高但不伴ALT升高,可能与应用Simeprevir有关。
2.2Asunaprevir在日本,Asunaprevir联合Daclatasvir已被批准用于基因1型合并或不合并代偿期肝硬化患者,这些患者不能耐受或不适用干扰素为基础的治疗方案,或者对含干扰素方案治疗后失败。给药方案为:Asunaprevir(100 mg,2次/d)+ Daclatasvir(60 mg,1次/d)联合治疗24周。日本的一项开放III期临床试验数据显示,基因1b型患者SVR为87.4%(干扰素不合适/干扰素不耐受)或80.5%(无应答或部分应答),肝硬化患者与非肝硬化患者SVR相似,分别为90.9%和84.0%[9]。我国的III期临床试验数据显示,基因1b型干扰素不合适/干扰素不耐受患者SVR为91.2%,其中肝硬化患者的SVR为90.4%,基线没有NS5A耐药变异(L31M或Y93H)的患者SVR可达98.6%,而中国大陆基线NS5A耐药变异的流行率较低,约为7.9%[10]。
2.3Sofosbuvir接受Sofosbuvir治疗的患者,应定期监测肾功能。(1)Sofosbuvir+PR联合治疗适用于所有基因型患者。给药方案为:Peg-IFN α(1次/w)+利巴韦林(<75 kg或≥75 kg患者的剂量分别为1000 mg·d-1、1200 mg·d-1+Sofosbuvir(400 mg,1次/ d),治疗12周。国外数据显示采用该方案治疗基因1型初治患者SVR为89%,基因1a型为92%,而基因1b型为82%[11]。对既往PR治疗失败的基因1型患者SVR预计为78%[12]。基因2型肝硬化和(或)经治患者可选择此方案治疗;(2)Sofosbuvir+利巴韦林联合治疗适用于基因2型和3型患者。给药方案为:Sofosbuvir(400 mg,1次/d)+利巴韦林(<75 kg或≥75 kg患者的剂量分别为1000 mg.d-1、1200 mg.d-1)。基因2型患者疗程为12周,但是肝硬化尤其是肝硬化经治患者,疗程应延长至16~20周。应用该方案治疗基因2型患者SVR为95%,无肝硬化患者可达97%,而肝硬化患者为83%[11]。基因3型患者疗程为24周。对于基因3型感染肝硬化经治患者,不建议选择此方案[13];(3)Sofosbuvir+Simepr evir联合治疗适用于基因1型和4型患者。给药方案为:Sofosbuvir(400 mg,1次/d)+Simeprevir(150 mg,1次/d)联合治疗12周。肝硬化患者加用利巴韦林,对利巴韦林禁忌的肝硬化患者须将疗程延长至24周。国外数据显示该方案治疗基因1型感染患者SVR为93%~96%[14];(4)Sofosbuvir+Daclatasvir联合治疗适用于所有基因型感染患者。给药方案为:Sofosbuvir(400 mg,1次/d)+Daclatasvir(60 mg,1 次/d)联合治疗12周。但是基因1、4、5和6型肝硬化患者加用利巴韦林,利巴韦林禁忌的肝硬化患者须将疗程延长至24周。基因3型肝硬化患者将疗程延长至24周的同时加用利巴韦林。国外一项Ⅱb期临床试验数据显示基因1型患者SVR为95%~100%。
2.4Sofosbuvir/Ledipasvir复合片剂该复合片剂适用于基因1、4、5和6型患者。给药方案为:Sofosbuvir(400 mg)/Ledipasvir(90 mg)复合片剂(1片,1次/d)。无肝硬化患者疗程12周,代偿期肝硬化患者应联合利巴韦林治疗12周。如利巴韦林禁忌或不耐受,则不使用利巴韦林,但是要将疗程延长至24周。如为代偿期肝硬化经治患者或存在不利于应答因素的患者,应联合利巴韦林且应将疗程延长至24周。基因1型无肝硬化且基线病毒载量较低的(HCV RNA<6×106IU/ml)初治患者可考虑缩短疗程至8周。国外数据显示该方案治疗基因1型患者SVR为93%~99%。
2.5Ombitasvir/Paritaprevir/Ritonavir复合片剂和Dasabuvir适用于基因1、4型患者。(1)Oombitasvir /Paritaprevir/Ritonavir复合片剂(2片,1次/d)联合利巴韦林用于基因4型患者,无肝硬化患者疗程12周,肝硬化患者疗程24周;(2)Ombitasvir/ Paritaprevir/Ritonavir复合片剂(2片,1次/d)+ Dasabuvir(250 mg,1次/d)联合治疗适用于基因1型患者。基因1b型无肝硬化患者疗程12周,不联合利巴韦林,基因1b型肝硬化患者疗程12周,且联合利巴韦林。基因1a型无肝硬化患者疗程12周,且需联合利巴韦林,基因1a型肝硬化患者疗程24周,也需要联合利巴韦林。国外数据显示使用该方案治疗基因1型患者SVR为91%~100%。
2.6Elbasvir/Grazoprevir复合片剂该药联合或不联合利巴韦林用于基因1、4型感染患者。给药方案为:Elbasvir/Grazoprevir复合片剂(1片,1次/d)。对于基因1b型初治或PR经治患者不联合利巴韦林治疗12周,对于基因1a型初治或PR经治患者,基线无NS5A耐药者,疗程12周,基线有NS5A耐药联合利巴韦林治疗16周,对于基因4型初治患者疗程12周,经治患者联合利巴韦林疗程16周。国外临床试验的数据显示使用该方案治疗基因1型患者停药12周SVR(SVR12)为94%~97%,治疗基因4型患者SVR12为97%~100%。对有任何程度的肾功能受损包括接受血液透析的患者,Elbasvir/ Grazoprevir的剂量无需调整,但是利巴韦林的剂量需要根据肌酐清除率进行调整。
在DAAs治疗过程中应对患者进行疗效和安全性监测。疗效监测主要检测HCV RNA,应采用灵敏度高的实时定量PCR试剂(检测下限<15 IU/ml),在治疗基线、第2周、第4周、第12周、治疗结束时、治疗结束后12周或24周检测HCV RNA。由于利巴韦林有致畸作用,育龄期妇女和(或)患者伴侣为育龄期妇女,必须在使用利巴韦林时和停药后6个月内采用有效的避孕措施。如果可能的话,在抗HCV治疗期间应停止有相互作用的合并用药,或者换为具有较少相互作用的合并用药。
多类别DAAs的上市引领了丙型肝炎抗病毒治疗的新格局,并获得了很好的疗效,且安全性良好,为难治性丙型肝炎、存在IFN和利巴韦林治疗禁忌证或不能耐受者提供了可以选择的治疗方案,也为失代偿期肝硬化、器官移植、免疫抑制状态等特殊人群的抗病毒治疗带来了新希望。不同的DAAs治疗方案需要根据患者感染病毒的基因型甚至基因亚型,以及患者肝纤维化程度、肝硬化状态来确定治疗的药物选择和确定疗程,具体的方案选择见表2。未来应用DAAs的策略将可能是两种或几种不同类的DAAs联合使用,短疗程,针对所有基因型,并且不同基因型的疗程相同,不同疾病阶段患者的疗程相同,而且患者几乎能获得治愈,使得慢性丙型肝炎的治疗简单化、短程化和全治愈。
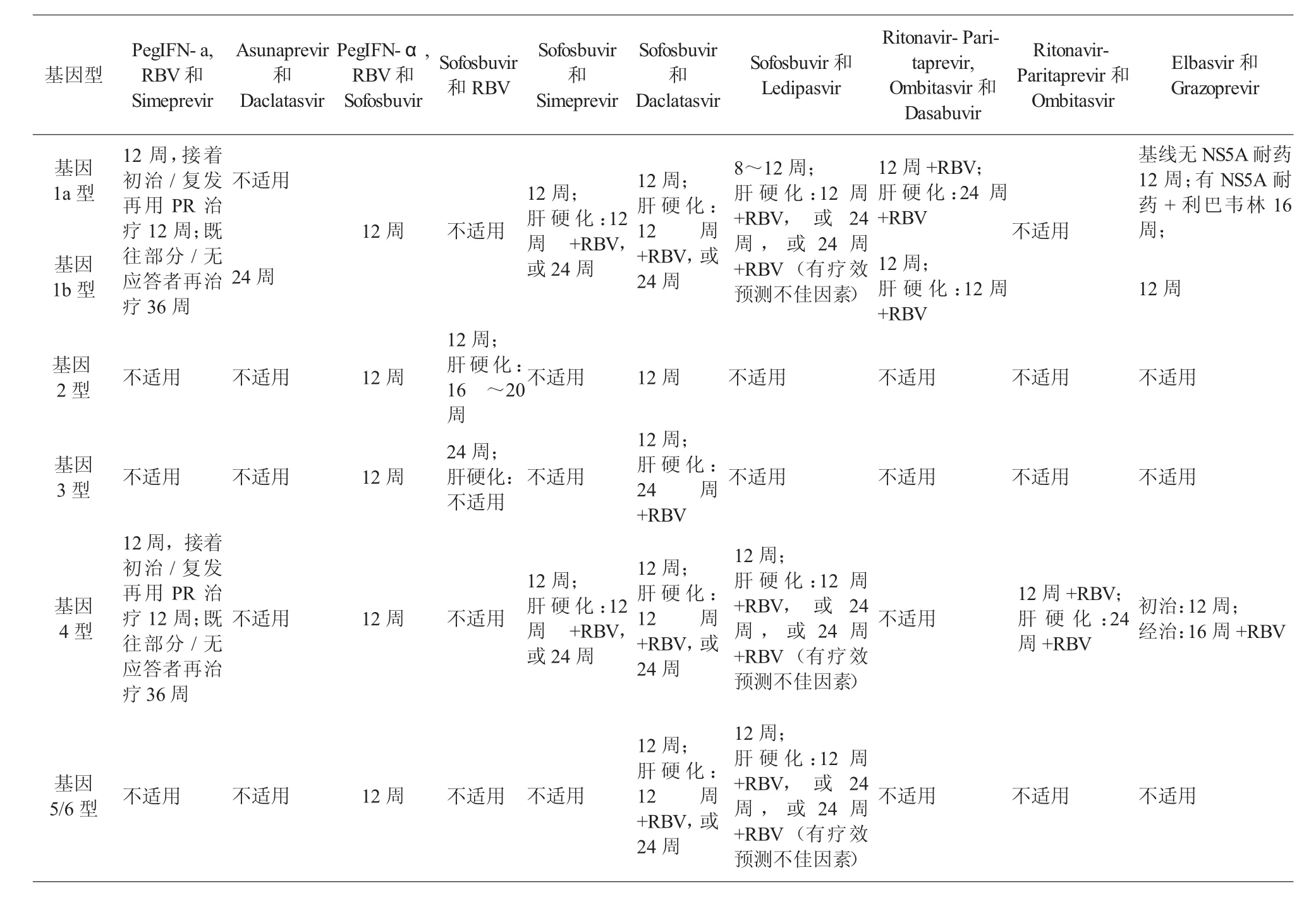
表2 初治和既往PR治疗失败的C H C患者接受D AAs治疗方案选择
[1]Fontanges T.Management of treatment with direct-acting antiviral(DAA)in clinical practice.Clin Res Hepatol Gastroenterol,2011,35(Suppl 2):S64-S68.
[2]Moradpour D,Penin F,Rice CM.Replication of hepatitis C virus. Nat Rev Microbiol,2007,5(6):453-463.
[3]Penin F,Dubuisson J,Rey FA,et al.Structural biology of hepatitis C virus.Hepatology,2004,39(1):5-19.
[4]Foy E,Li K,Wang C,et al.Regulation of interferon regulatory factor-3 by the hepatitis C virus serine protease.Science,2003,300(5622):1145-1148.
[5]Burton JR Jr,Everson GT.HCV NS5B polymerase inhibitors. Clin Liver Dis,2009,13(3):453-465.
[6]European Association for Study of Liver.EASL recommendations on treatment of hepatitis C 2015.J Hepatol,2015,63(1):199-236.
[7]Rao H,Wei L,Lopez-Talavera JC,et al.Distribution and clinical correlates of viral and host genotypes in Chinese patients with chronic hepatitis C virus infection.J Gastroenterol Hepatol,2014,29(3):545-553.
[8]Wei L,Han T,Yang D,et al.Simeprevir plus peginterferon/ribavirin for HCV genotype 1-infected treatment-naive patients in China and South Korea.J Gastroenterol Hepatol,2016,31(5):912-920.
[9]Kumada H,Suzuki Y,Ikeda K,et al.Daclatasvir plus asunaprevirforchronicHCVgenotype1binfection.Hepatology,2014,59(6):2083-2091.
[10]Wei L,Zhang M,Xu M,et al.A phase 3,open-label study of daclatasvirplusasunaprevirinAsianpatientswithchronic hepatitis C virus genotype 1b infection who are ineligible for or intolerant to interferon alfa therapies with or without ribavirin. J Gastroenterol Hepatol,2016,doi:10.1111/jgh.13379.
[11]Lawitz E,Mangia A,Wyles D,et al.Sofosbuvir for previously untreatedchronichepatitisCinfection.NEnglJMed,2013,368(20):1878-1887.
[12]Mishra P,Florian J,Qi K,et al.FDA perspective on sofosbuvir therapy for patients with chronic hepatitis C virus genotype 1 infection who did not respond to treatment with pegylated interferon and ribavirin.Gastroenterology,2014,147(6):1196-1200.
[13]ZeuzemS,DusheikoGM,SalupereR,etal.Sofosbuvirand ribavirin in HCV genotypes 2 and 3.N Engl J Med,2014,370 (21):1993-2001.
[14]LawitzE,SulkowskiMS,GhalibR,etal.Simeprevirplus sofosbuvir,with or without ribavirin,to treat chronic infection with hepatitis C virus genotype 1 in non-responders to pegylated interferonandribavirinandtreatment-naivepatients:the COSMOS randomised study.Lancet,2014,384(9956):1756-1765.
(收稿:2016-05-05)
(本文编辑:陈从新)
10.3969/j.issn.1672-5069.2016.04.002
100044北京市北京大学人民医院肝病研究所/丙型肝炎和肝病免疫治疗北京市重点实验室
饶慧瑛,E-mail:raohuiying@pkuph.edu.cn
Directly acting antiviral agents in hepatitis C Rao Huiying.Institute of Liver Diseases,People's Hospital,Beijing University,Beijing 100044

