非酒精性脂肪性肝病大鼠内生性乙醇和肝组织乙醇代谢相关酶的变化*
何崇信,徐正婕,潘勤,范建高
非酒精性脂肪性肝病大鼠内生性乙醇和肝组织乙醇代谢相关酶的变化*
何崇信,徐正婕,潘勤,范建高
目的观察高脂饮食和高果糖饮食对大鼠肝脏病理、内生性乙醇、乙醇代谢酶的影响。方法将SD大鼠18只随机分为正常组(n=6),予以普通饲料喂养,高果糖组(n=6)接受普通饲料和含20%果糖水喂养,高脂组(n=6)接受高脂饲料喂养。造模16 w后,取肝组织进行非酒精性脂肪性肝病活动性评分(NAS);采用Biovison试剂盒检测门静脉血乙醇水平;采用实时荧光定量PCR法检测大鼠肝组织乙醇脱氢酶(ADH1)和乙醛脱氢酶(ALDH2)mRNA水平;采用Western blot法测定肝组织ADH1和ALDH2蛋白表达水平;使用乙醇脱氢酶活性试剂盒测定肝组织匀浆乙醇脱氢酶活性。结果在16 w末,高果糖组大鼠肝组织表现为脂肪变性,高脂组大鼠肝组织主要表现为NASH;高脂组大鼠NAS评分为5.40±0.32,显著高于对照组【(1.10±0.25),P<0.05】和高果糖组【(2.94±0.40),P<0.05】;高脂组大鼠血清内生性乙醇水平【(1.30±0.15)nmol/μL】显著高于正常组【(1.00±0.10)nmol/μL,P<0.05)】和高果糖组【(1.04±0.23)nmol/μL,P<0.05)】;高脂组大鼠ADH1 mRNA水平显著高于正常组((1.30倍,P<0.05)和高果糖组(1.36倍,P<0.05);高脂组大鼠ALDH2mRNA水平显著高于正常组(1.55倍,P<0.05)和高果糖组(1.44倍,P<0.05);高脂组大鼠ADH1蛋白表达显著高于正常组(2.56倍,P<0.05)和高果糖组(2.52倍,P<0.05);高脂组大鼠ALDH2蛋白表达显著高于正常组(1.41倍,P<0.05)和高果糖组(1.57倍,P<0.05);高脂组大鼠肝脏乙醇脱氢酶活性为(175±28)μ/L,显著高于正常组【(72±13)μ/L,P<0.05)】和高果糖组【(78±9)μ/L,P<0.05)】。结论高脂饮食造模大鼠内生性乙醇浓度显著升高,乙醇脱氢酶和乙醛脱氢酶蛋白水平升高,乙醇脱氢酶活性显著升高。
非酒精性脂肪性肝病;高脂饮食;内生性乙醇;乙醇脱氢酶;乙醛脱氢酶;大鼠
非酒精性脂肪性肝病(Nonalcoholic fatty liver disease,NAFLD)与酒精性脂肪性肝病(Alcoholic fatty liver disease,AFLD)在肝组织病理学表现上具有很高的相似性,提示内生性乙醇在非酒精性脂肪性肝病的进展中可能扮演了一定的角色。内生性乙醇是指在无外来乙醇摄入的情况下,体内产生的乙醇。在无氧条件下,摄入的碳水化合物分解产生丙酮酸,后者由肠道细菌代谢产生乙醛后,再转变为乙醇[1]。低水平的内生性乙醇在正常人体内也是存在的,并在肝脏被清除。然而,在很多病理情况下,人体内的内生性乙醇水平会明显升高。Volynets et al在20例NAFLD患者,包括3例非酒精性脂肪性肝炎(Non-alcoholic steatohepatitis,NASH)患者呼吸测试乙醇浓度比10例健康人显著升高[2]。Zhu et al[3]报道,在未摄入酒精的情况下,患有NASH的肥胖儿童血清乙醇水平显著升高,而未患NASH的肥胖儿童与健康儿童呼气乙醇浓度相似。在动物实验方面,早在2000年就有报道,在没有乙醇摄入的情况下,瘦素缺陷的肥胖ob/ob小鼠呼气测试乙醇水平明显高于野生型对照小鼠[4]。不同饮食对内生性乙醇的影响尚未可知。本文采用正常饮食、高果糖饮食和高脂饮食持续喂养SD大鼠16周,观察三种饮食造模后大鼠内生性乙醇的水平差异,并检测了肝组织乙醇脱氢酶(Alcoholdehydrogenase1,ADH1)和乙醛脱氢酶(Aldehyde dehydrogenase 2,ALDH2)基因的变化。
1 材料与方法
1.1动物模型的制备18只清洁级雄性SD大鼠,体质量140~160 g,购自中国科学院实验动物中心【生产许可证为“SR×R(沪)2008-0016”】。饲养大鼠于我院动物实验中心动物房,随机分为3笼,每笼6只,室内温度维持在20℃~29℃,自由进食和饮用无菌水。给予普通饲料适应性喂养1 w,将大鼠随机分成3组,给予正常组(n=6)普通饲料和饮用无菌水;给予高果糖组(n=6)喂养普通饲料和20%果糖水;给予高脂组(n=6)喂养高脂饲料(88%普通饲料+10%猪油+2%胆固醇)+普通饮水。在造模16 w后,所有大鼠禁食12 h,应用3%戊巴比妥钠40 mg·kg-1麻醉,常规解剖,取门静脉血于无致热原试管中,室温静置30 min,4℃3000 r/m离心15 min,取血清,分装后置于-80℃冰箱保存。摘除肝脏,称量肝脏湿质量,切取肝右叶肝组织约1×1× 0.5 cm大小,置于4%中性甲醛液固定。取肝右叶适度大小组织块,分装于冻存管内,置于-80℃冰箱保存备用检。取肝组织,常规石蜡包埋、切片,HE染色。在200倍光镜下,根据非酒精性脂肪性肝病活动度积分(NAFLD activity score,NAS)标准,进行肝脂肪变性和炎症评分。NAS计分分为:(1)肝脂肪变性,0分:脂肪变细胞<5%;1分:5%~33%;2分:34%~66%;3分:>66%。(2)小叶内炎症,0分:无;1分:<2个;2分:2~4个;3分:>4个。(3)肝细胞气球样变,0分:无;1分:少量气球样变细胞;2分:多见。NAS=1+2+3(0~8分),NAS<3分排除NASH,NAS≥5分诊断为NASH,介于两者之间为NASH可能。
1.2血清内生性乙醇浓度检测采用Biovison试剂盒检测(Biovison,美国)。
1.3肝组织ADH1和ALDH2 mRNA水平检测采用实时荧光定量PCR法,提取大鼠肝组织总RNA(Trizol试剂,大连宝生物公司),合成cDNA第一链。设计并合成引物,序列见表1。使用ABI 7500实时PCR仪(ABI,美国)获得目的基因扩增曲线和CT值,采用2-△△ct法对各组CT值进行结果分析。
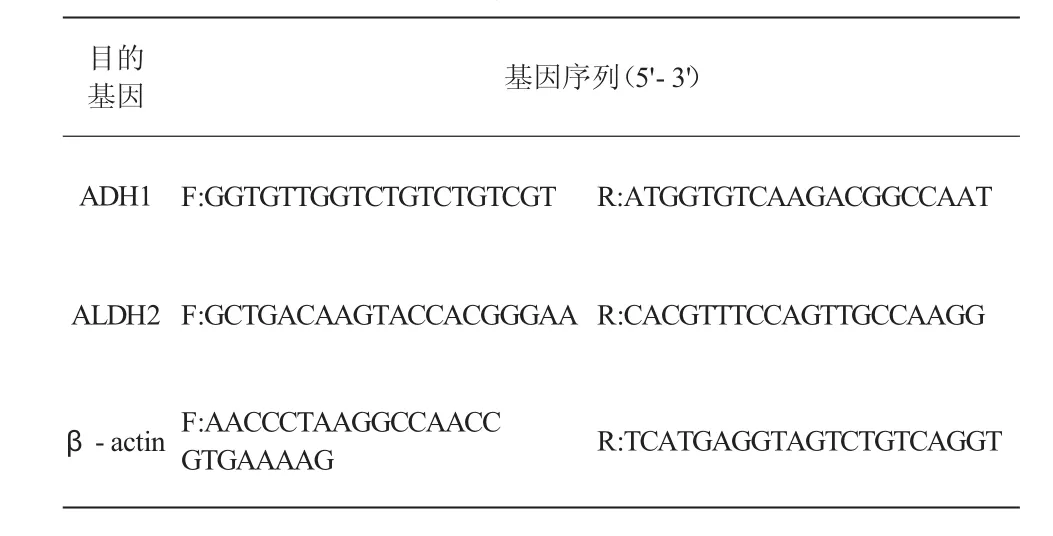
表1 目的基因的物序列
1.4肝组织ADH1和ALDH2蛋白表达检测采用Western blot法。
1.5肝组织乙醇脱氢酶活性检测首先使用磷酸钠缓冲液(Invitrogen,美国)漂洗肝脏组织,再取50 mg肝组织置于0.25 mol/L的磷酸钾缓冲液(上海古朵生物有限公司)200 μl中,使用匀浆器匀浆,4℃10000 r/m离心15 min,取上清检测。采用BioAssay Systems提供的乙醇脱氢酶活性检测试剂盒检测上清乙醇脱氢酶活性。
1.6统计学分析应用SPSS 19.0统计学软件,计量资料以(±s)表示,采用单因素方差分析进行多组间的比较,P<0.05为差异具有统计学意义。
2 结果
2.1各组大鼠肝组织病理学表现在光镜下,正常组大鼠肝组织未见异常,NAS评分为(1.10±0.25);高果糖组大鼠肝组织病理学变化以单纯性脂肪变为主要特征,大鼠肝组织出现轻到中度的脂肪变性,未观察到明显的小叶内炎性细胞浸润,无肝细胞气球样变,NAS评分为(2.94±0.40)分;高脂组大鼠也表现为肝组织中度脂肪变性,小叶内炎性细胞浸润较明显,出现肝细胞气球样变,NAS评分为(5.40± 0.32)分,6只大鼠均被诊断为NASH(图1)。
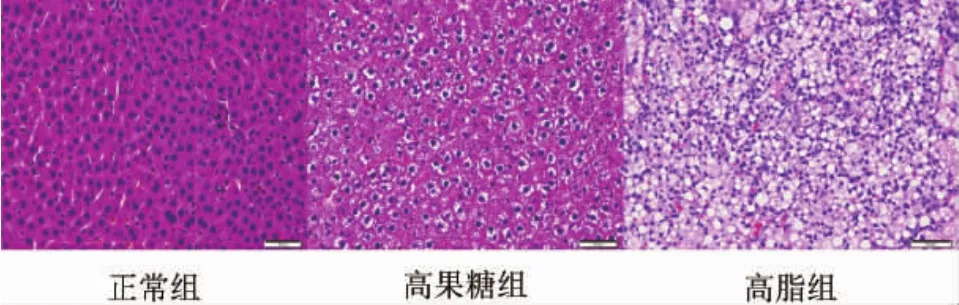
图1 大鼠肝组织病理学表现(HE,200×)
2.2大鼠门静脉血内生性乙醇水平比较与正常组【(1.00±0.10)nmol/μL】和高果糖组【(1.04±0.23)nmol/μL】大鼠比,高脂组大鼠血内生性乙醇水平【(1.30±0.15)nmol/μL】显著升高(P<0.05),而高果糖组与正常组无显著性差异(图2)。

图2 各组大鼠门静脉脉血内生性乙醇水平比较高脂组内生性乙醇水平较另2组明显升高(*P<0.05)
2.3各组大鼠肝组织ADH1和ALDH2 mRNA水平比较如图3a所示,高脂组ADH1 mRNA水平显著高于(1.30倍)正常组和高果糖组(1.36倍,*P<0.05);如图3b所示,高脂组ALDH2 mRNA水平显著高于(1.55倍)正常组和高果糖组(1.44倍,*P<0.05)。
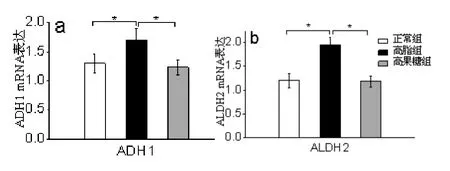
图3 各组大鼠肝组织ADH1和ALDH2 mRNA水平比较
2.4各组大鼠肝组织ADH1和ALDH2蛋白表达水平比较如图4a所示,高脂组ADH1蛋白水平显著高于(2.56倍)正常组和高果糖组(2.52倍,*P<0.05);如图4b所示,高脂组ALDH2蛋白表达水平显著高于(1.41倍)正常组和高果糖组(1.57倍,*P<0.05,图4)。
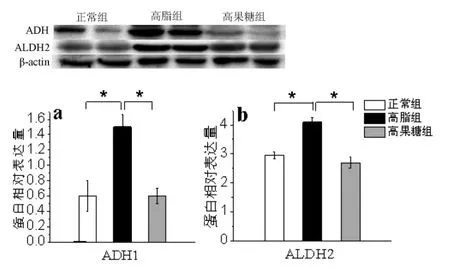
图4 各组大鼠肝组织ADH1和ALDH2蛋白水平比较
2.5高脂组大鼠肝组织ADH酶活性水平明显升高如图5所示,与正常组【(72±13)μ/L】和高果糖组【(78±9)μ/L】肝组织ADH酶活性比,高脂组ADH活性【(175±28)μ/L,P<0.05)显著增加。
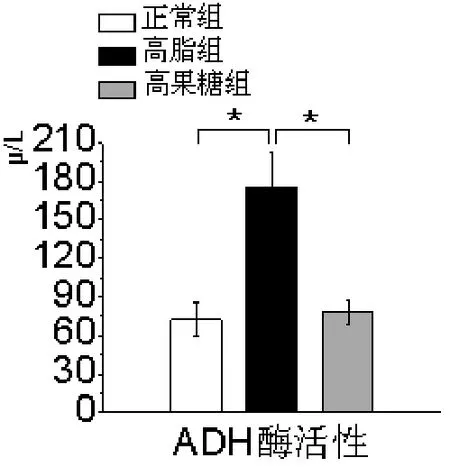
图5 各组大鼠肝组织ADH酶活性比较高脂组大鼠肝组织ADH酶活性较另2组明显升高(*P<0.05)
3 讨论
本研究观察了持续的高果糖饮食和高脂饮食对于大鼠肝脏病理、内生性乙醇、乙醇代谢酶蛋白表达及乙醇代谢脱氢酶活性的影响。结果显示,高果糖饮食16周并未引起大鼠肝脏显著的病理改变,而高脂饮食16周大鼠肝脏则表现为NASH,肝脏出现了肝细胞脂肪变性,小叶内炎症细胞浸润和肝细胞气球样变。长期高脂饮食大鼠是NASH比较成熟的造模方法[5-8]。我们既往的研究显示,高脂高胆固醇饮食可以导致肥胖和胰岛素抵抗,并且可以导致肝脏炎症的形成。理论上,果糖可以促进脂肪合成,导致脂质堆积;摄入过多的果糖可促进内脏肥胖,并有可能通过增加肝脏内甘油二酯的量引发胰岛素抵抗[9-11]。而动物研究显示长期单纯的高果糖饮食并不能引起脂肪性肝炎,仅可以导致轻微的脂肪变性或者细胞肿胀[12-14]。本研究也与之一致。
本研究中,内生性乙醇浓度在高脂饮食NASH组较正常组和高果糖组明显升高。既往研究也发现NAFLD患者较正常对照组呼吸测试测得的内生性乙醇浓度高。而且内生性乙醇在NASH肥胖者中较瘦弱者高。动物模型则发现肥胖的ob/ob小鼠呼气测试乙醇浓度是随着喂养时间的增长而升高的,而对照的瘦弱小鼠却没出现这种现象[4,15]。内生性乙醇是由肠道细菌发酵食物产生的。动物实验研究发现口服抗生素净化肠道后可以使乙醇水平降低。这也在研究NASH患者与肥胖对照组的细菌差异时有所体现。NASH患者与肥胖对照组的唯一细菌差异是产乙醇的肠杆菌属大肠杆菌科,而且两者的内生性乙醇有显著差异。有趣的是肠杆菌属属于产乙醇细菌,提示NASH患者肠道内细菌的改变导致的内生性乙醇升高可能促进NASH的生成[3]。所以,本研究中未摄入乙醇的SD大鼠内生性乙醇的升高可以被认为是高脂饮食引起的肠道产乙醇细菌增多所致。据此推测,高果糖未能引起内生性乙醇的升高可能是其未影响肠道产乙醇的细菌数量。
我们进一步观察了与肝脏乙醇代谢相关的酶。结果显示,高脂组大鼠肝脏乙醇代谢酶ADH1和ALDH2蛋白表达水平明显升高。既往也有研究显示,NASH患者与正常人相比,乙醇脱氢酶和乙醛脱氢酶的基因转录增多,且免疫印记检测显示乙醇脱氢酶表达增多[16]。与此同时,我们还观察到高脂NASH组肝脏ADH1酶活性较其他两组显著升高。肝脏乙醇代谢酶的蛋白表达和活性同时升高,进一步支持高脂饮食所致的内生性乙醇增高导致肝脏乙醇代谢增多。随着乙醇代谢的增多,肝脏NADH水平随之升高,肝脏脂肪酸的合成增加,脂肪酸的降解被抑制,进而导致肝脏实质细胞的脂肪堆积[17-18]。其次,肝脏乙醇代谢过程中产生的毒性乙醛和P450 4E1导致的过氧化物的产生增多,导致肝脏炎症[16]。乙醇还可以导致肠粘膜上皮细胞紧密连接破坏和大分子的细胞旁通透性升高,导致肠道内毒素通过肠-肝轴进入肝脏增多,激活炎症通路,引起肝脏炎症[19-20]。通过以上的种种机制,内生性乙醇促进了高脂饮食大鼠NASH的发生和发展。
本文的不足之处在于只进行了一个观察性的实验,未能通过对内生性乙醇相关的干预观察相关指标的变化。本实验也未分析各种饮食造成的肠道细菌的改变及其与内生性乙醇的关系。进一步的实验设想,我们可以通过注射病毒靶向抑制或者过表达肝脏的乙醇代谢酶基因如乙醇脱氢酶和乙醛脱氢酶,通过这种途径来加快或者抑制肝脏内乙醇的代谢速度,从而探讨内生性乙醇的升高是否影响肝脏的病理学改变以及肝脏的生化指标或者炎症通路蛋白的表达。我们还可以通过无菌小鼠肠道植入产乙醇细菌(如大肠杆菌)的方式来探究内生性乙醇增多导致肝脏相关指标的改变结果。由此来进一步深入的探究内生性乙醇在NASH发生发展过程中的角色,究竟是一个表观性的改变还是炎症进展中的帮凶。
总之,本研究观察了内生性乙醇在不同饮食SD大鼠造模16周的变化,并探究了各组内生性乙醇的差异、肝脏乙醇代谢酶蛋白表达水平和乙醇脱氢酶活性的变化。为进一步揭示内生性乙醇在NASH发生上所扮演的角色提供了实验数据。未来的研究可以通过控制内生性乙醇的量、针对性地控制产内生性乙醇的肠道细菌或者下游的代谢通路来进一步探究内生性乙醇在非酒精性肝病进展中的作用。
[1]McManus IR,Contag AO,Olson RE.Characterization of endogenous ethanol in the Mamml.Science,1960,131(3393):102-103.
[2]VolynetsV,KuperMA,StrahlS,etal.Nutrition,intestinal permeability,and blood ethanol levels are altered in patients with nonalcoholic fatty liver disease(NAFLD).Dig Dis Sci,2012,57(7):1932-1941.
[3]ZhuL,BakerSS,GillC,etal.Characterizationofgut microbiomes in nonalcoholic steatohepatitis(NASH)patients:a connection between endogenous alcohol and NSH.Hepatology,2013,57(2):601-609.
[4]Cope K,Risby T,Diehl A M.Increased gastrointestinal ethanol productioninobese mice:implications forfatty liverdisease pathogenesis.Gastoenterology,2000,119(5):1340-1347.
[5]范建高,徐正婕,王国良,等.大鼠NASH形成过程血清内毒素含量的改变.中华肝脏病杂志,2003,11(2):73-76
[6]徐正婕,范建高,王国良,等.小剂量内毒素导致非酒精性脂肪性肝炎大鼠急性肝功能衰竭.中华肝脏病杂志,2004,12(4):244-245.
[7]李楠,徐正婕,范建高,等.口服抗生素对NASH大鼠肝组织TLR4信号通路的影响.实用肝脏病杂志,2012,15(4):299-302.
[8]刘静,柳银兰,杨文君等.高脂高果糖饮食诱导NASH小鼠模型的建立和鉴定.中华肝脏病杂志,2014,22(6):445-450.
[9]Birkenfeld AL,Shulman GI.Nonalcoholic fatty liver disease,hepaticinsulinresistance,andtype2diabetes.Hepatology,2014,59(2):713-723.
[10]Stanhope KL,Schwarz JM,Keim NL,et al.Consuming fructose-sweetened,not glucose-sweetened,beverages increases visceral adiposity and lipids and decreases insulin sensitivity in overweight/obese humans.J Clin Invest,2009,119(5):1322-34.
[11]Pollock NK,Bundy V,Kanto W,et al.Greater fructose consumption is associated with cardiometabolic risk markers and visceral adiposity in adolescents.J Nutr,2012,142(2):251-257.
[12]Basaranoqlu M,Basaranoqlu G,Sabuncu T,et al.Fructose as a key player in the development of fatty liver disease.World J Gastroenterol,2013,19(8):1166-1172.
[13]Vos MB,Lavine JE.Dietary fructose in nonalcoholic fatty liver disease.Hepatology,2013,57(6):2525-2531.
[14]Jin R,Vos MB.Fructose and liver function-is this behind nonalcoholicliverdiseaseCurrOpinClinNutrMetabCare,2015,18(5):490-495
[15]Nair S,Cope K,Risby T H,et al.Obesity and female gender increase breath ethanol concentration:potential implications for the pathogenesis of nonalcoholic steatohepatitis.Am J astroenterol,2001,96(4):1200-1204.
[16]Baker SS,Baker RD,Liu WS,et al.Role of alcohol metabolism in non-alcoholic steatohepaitis.PLoS One,2010,5(3):e9570.
[17]LieberCS,SchmidR.The effectof ethanolonfatty acid metabolism;stimulation of hepatic fatty acid synthesis in vitro.J Clin Invest,1961,40:394-399.
[18]Galli A,Price D,Crabb D.High-level expression of rat class I alcohol dehydrogenase is sufficient for ethanol-induced fat accumulation in transduced hela cells.Hepatology,1999,29(4):1164-1170.
[19]Rao RK,Seth A,Sheth P.Recent advances in alcoholic liver disease I.Role of intestinal permeability and endotoxemia in alcoholic liver disease.Am J Physiol Gastrointest Liver Physiol,2004,286(6):G881-G884.
[20]Bode C,Bode JC.Activation of the innate immune system and?alcoholic liver disease:effects of ethanol per se?or enhancedintestinal translocation of bacterial toxins induced by ethanol Alcohol Clin Exp Res,2005,29(11 Suppl):166S-71S.
(收稿:2016-02-02)
(本文编辑:陈从新)
Objective To observe the effect of high-fat diet and high-fructose diet on hepatic histology,endogenous ethanol and related ethanol metabolic enzymes including alcohol dehydrogenase 1(ADH1)and aldehyde dehydrogenase 2(ALDH2)in rats.Methods Eighteen male Sprague Dawley rats were randomly divided into control group(n=6),high-fat diet group(n=6)and high-fructose diet group(n=6).At the end of 16th week,nonalcoholic fatty liver disease(NAFLD)activity score(NAS)of liver tissues was evaluated.The endogenous ethanol in portal venous blood were detected.The mRNA levels of hepatic ADH1 and ALDH2 were detected by real time PCR.The protein levels of hepatic ADH1 and ALDH2 were detected by Western blot.The activity of ADH1 was detected by ADH1 enzyme activity kits.Results At the end of 16th week,the liver tissues of rats in high-fructose group were simple steatosis and of rats in high-fat group presented severe hepatic inflammation.The NAS score in high-fat group was 5.40±0.32,significantly higher than in normal group【(1.10± 0.25),P<0.05】or in high-fructose group【(2.94±0.40),P<0.05】;Serum endogenous ethanol levels in high-fat group【(1.30±0.15)nmol/μL】was significantly higher than that in normal group【(1.00±0.10)nmol/μL,P<0.05)】or in high-fructose group【(1.04±0.23)nmol/μL,P<0.05)】;the mRNA levels of ADH1 in high-fat group was significantly 1.30 fold or 1.36 fold higher than that in high-fructose group and in normal group respectively(P<0.05);the mRNA level of ALDH2 in high-fat group was significantly 1.55 fold or 1.44 fold higher than that in high-fructose group and in normal group respectively(P<0.05);the protein expression levels of ADH1 in high-fat group was significantly 2.56 fold or 2.52 fold higher than that in high-fructose group and in normal group respectively(P<0.05),and the ALDH2 protein in high-fat group was significant 1.41 fold or 1.57 fold higher than that in high-fructose group and in normal group respectively(P<0.05);meanwhile,the activity of ADH enzyme in high fat group(175±28)μ/L was significant higher when compared with that in normal group【(72±13)μ/L,P<0.05)】and in high-frutose group【(78±9)μ/L,P<0.05)】.Conclusion High-fat diet can significantly increase the endogenous ethanol levels in the portal vein,and up-regulate the protein expression of ADH enzyme in the livers.
Nonalcoholic fatty liver disease;High-fat diet;Endogenous ethanol;Alcohol dehydrogenase 1;Aldehyde dehydrogenase 2;Rats
10.3969/j.issn.1672-5069.2016.04.009
国家重点研究发展计划973项目(2012CB517501);王宝恩抗肝纤维化基金项目(20110006)
200092上海市上海交通大学医学院附属新华医院消化科
何崇信,男,25岁,硕士研究生。主要研究方向为脂肪肝的基础与临床研究。E-mail:ashinalive@hotmail.com通讯作者:徐正婕,E-mail:ajanexu@163.com
Effect of high-fat diet or high-fructose diet on endogenous ethanol and hepatic ethanol metabolic enzymes in rats He Chongxin,Xu Zhengjie,Pan Qin,et al.Department of Gastroenterology,Xinhua Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200092

