顶空-气相色谱法测定舒肝宁注射液4种提取物中乙醇的残留量*
何 峰, 张 昀
(1.贵州医科大学, 贵州 贵阳 550004; 2.贵州瑞和制药有限公司, 贵州 贵阳 550004)
顶空-气相色谱法测定舒肝宁注射液4种提取物中乙醇的残留量*
何峰1, 张昀2**
(1.贵州医科大学, 贵州 贵阳550004; 2.贵州瑞和制药有限公司, 贵州 贵阳550004)
目的: 建立顶空-气相色谱法测定舒肝宁注射液中茵陈、栀子、板蓝根及灵芝提取物中乙醇残留量的方法。方法: 采用ZB-624石英毛细管柱(30.0 m×0.53 mm×3 μm),柱温采取程序升温的方法,载气为氮气,进样口温度为200 ℃,检测器温度为250 ℃,测定舒肝宁注射液上述4种提取物中乙醇残留量,探讨乙醇残留量检测的线性范围,回收率及最低检测限。结果: 乙醇在15.46~773 mg/L(r=0.999 3) 范围内线性关系良好,4种提取物的回收率均良好,最低检测限为 11 ng。结论: 所建立的方法简单、灵敏、准确,可用于舒肝宁4种提取物中乙醇残留量的测定。
色谱法,气相; 舒肝宁注射液; 乙醇; 残留量
[Abstract]Objective: To determine the residual quantity of ethanol in four extracts(wormwood,fructuscardeniae,radixisatidis,andganodermalucidum) in Shuganning injection by headspace gas chromatographic method. Methods: ZB-624 (30.0 m×0.53 mm×3 μm) column was used. The temperature programming was adopted for column temperature with carrying gas as nitrogen. Inlet temperature and FID detector were 200 ℃ and 250 ℃, respectively. The residual quantity of ethanol above-mentioned 4 extracts in Shuganning injection was detected, and he linear range, recovery rate and the lowest detection limit of ethanol residue were discussed. Results: The result showed good linearity in the ethanol content range of 15.46~773 μg·mL-1(r=0.999 3), recovery of four kinds of extracts were good and the detection limit was 11ng. Conclusion: This method is rapid, sensitive and accurate for detecting the residual ethanol in four extracts of Shuganning injection.
[Key words]chromatography,gas; Shuganning injection; ethanol; residual
近年来,中药注射剂等高风险产品中残存有机溶剂的毒性和致癌作用日益引起各方面的关注,因此对中药注射剂生产过程中引入有机溶剂残留物进行有机溶剂残留量测定变得非常必要。舒肝宁注射液是由茵陈、栀子、板蓝根、及灵芝等提取物为原料制备而成的纯中药注射剂,临床常用于治疗黄疸,急、慢性病毒性肝炎[1-2]。茵陈、栀子、板蓝根及灵芝这4种提取物的生产工艺均为水提取、两次乙醇醇沉,按《中国药典》2010年版规定, 乙醇为Ⅲ类有机溶剂。为了有效控制产品质量和保证用药安全,本研究尝试建立一种采用顶空-气相色谱法检测舒肝宁注射液中茵陈、栀子、板蓝根、及灵芝4种提取物中乙醇残留的分析方法,为舒肝宁注射液质量标准的提升提供可行的质检方法。
1 仪器与试药
Agilent 7820A气相色谱仪,氢火焰离子化检测器(FID),Agilent 7694E顶空进样器, MS d=0.01 mg电子天平(梅特勒-托利多仪器有限公司生产),无水乙醇(批号20101025,重庆川东化工有限公司),注射用水,茵陈提取物(批号T-Y20120524、T-Y20120823及T-Y20120829)、栀子提取物(批号T-Z20130114、T-Z20120807及T-Z20121212)、板蓝根提取物(批号T-B20121108、T-B20120118及T-B20121106)、灵芝提取物(T-L20121120、T-L20121112及T-L20121114),以上12批提取物均为贵州瑞和制药公司生产。
2 方法与结果
2.1对照品溶液及供试品溶液的制备
吸取1 mL恒温至25 ℃的无水乙醇置于100 mL容量瓶,定容至100 mL,摇匀,吸取1 mL转入50 mL容量瓶,定容至50 mL,摇匀,即得对照品溶液。吸取各提取物2 mL,置于25 mL容量瓶,定容至50 mL,摇匀,即得供试品溶液。
2.2色谱条件
色谱柱为Agilent ZB-624石英毛细管柱(30.0 m×0.53 mm×3 μm,美国安捷伦公司生产),柱温为程序升温:初始温度为40 ℃保持 7 min,以30 ℃/min的速率升温至240 ℃,保持5 min,进样口温度为200 ℃,检测器温度为250 ℃。分流进样,分流比为10∶1,载气为氮气,柱流速2.8 mL/min;检测器氢气流速30 mL/min,氧气流速300 mL/min。顶空条件:样品瓶温度80 ℃,样品环温度100 ℃,传输线温度120 ℃,样品瓶加热平衡时间10 min,进样时间0.3 min,顶空进样1 mL。
2.3专属性实验
精密量取对照样品、供试品溶液及空白溶液各5 mL分别置于顶空瓶中,加盖,密封,按2.2项下色谱条件测定,记录色谱图[3-6]。结果表明,供试品与对照品在相应的保留时间均显示相应色谱峰,空白试剂在与对照品出峰时间点上无吸收峰,方法专属性良好。见图1。

注:A为空白溶液, B为对照品溶液,C为茵陈提取物, D为栀子提取物,E为板蓝根提取物,F为灵芝提取物;a为乙醇峰图1 提取物中乙醇残留检测方法的专属性实验色谱结果Fig.1 Specific experimental results of the determination of ethanol residue in the extracts
2.4线性关系考察
精密吸取恒温至25 ℃的无水乙醇,置100 mL容量瓶中,依次逐级稀释,定容,制得浓度梯度依次为:0.773 00、0.309 20、0.154 60、0.077 30、0.038 65、0.015 46 g/L的6个对照品溶液,再分别精密量取上述各浓度对照品溶液5.0 mL,置于顶空进样瓶中,加盖,密封,按按2.2项下的色谱条件测定,以各溶液浓度为横坐标(X),峰面积为纵坐标(Y)进行线性回归分析,绘制线性关系图,计算回归方程及相关系数(r),得到回归方程为Y=5 713.7X-31.591,r=0.999 3。由线性关系图得出在15.46~773 mg/L的范围内呈良好的线性关系,最低检测限为11 ng。
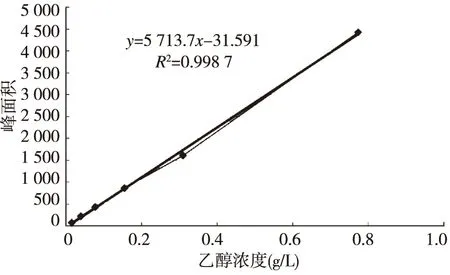
图2 提取物中乙醇残留检测方法的线性关系Fig.2 The linear relationship of the method for the determination of ethanol in the extract
2.5重复性实验
精密量取批号为T-Y20120524的茵陈提取物2 mL(2.069 6 g、2.069 2 g、2.069 2 g、2.069 5 g、2.069 3 g、2.069 6 g)共6份,按2.1项下要求,制备供试品,分别置于6支顶空进样瓶中进样分析[8-9],试验结果表明重复性良好,保留时间RSD为0.1%,峰面积RSD为0.7%。
2.6中间精密度试验
试验中由2名有资质的检验人员分别独立对同一批次茵陈提取物(T-Y20120524)平行进行2次检测,以考察随机变动因素、试验误差因素对精密度的影响。两人所测结果的RSD为5.0%,符合中间精密度的要求。
2.7稳定性试验
精密量取6份茵陈提取物2 mL(T-Y201205
24),按2.1项下程序制备供试品,分别精密量取5 mL置于6支顶空进样瓶中,密封,分别于0、1、2、3、4及5 h进行乙醇量测定,计算峰面积,结果不同时间点乙醇峰面积RSD为0.6%,样品溶液在5 h内稳定性良好。
2.8回收率试验
分别取1 mL已准确测定乙醇残留量的4种提取物(茵陈提取物T-Y20120524,栀子提取物T-Z20120807,板蓝根提取物T-B20121108,灵芝提取物T-L20121112)各6份,精密称定,加入1 mL 浓度为38.65 mg/L的乙醇溶液,按2.1项下程序制备样品,按上述色谱条件测定回收率[10]。测得乙醇平均回收率为:茵陈提取物99.85%(RSD=1.62%),栀子提取物 99.81%(RSD=1.01%),板蓝根提取物99.92%(RSD=1.12%),灵芝提取物99.65%(RSD=0.98%)。
2.9样品乙醇含量测定
分别精密吸取各提取物2 mL,按“2.1” 项下方法制备样品,按“2.4” 项下方法色谱条件进样分析,试验结果(表1)表明,样品中乙醇峰的理论塔板数均>8 000,乙醇含量均<0.5%(g/g)。

表1 样品乙醇含量测定结果
3 讨论
课题组前期研究参照《中国药典》2010年版附录ⅧP残留溶剂测定法[11],对舒肝宁注射液及其4种提取物中可能含有的溶剂进行了筛选,对其中的乙醇、三氯甲烷与正丁醇等残留溶剂进行测定,均未检出三氯甲烷和正丁醇,而甲醇的含量也很低,几乎未检出,由于各提取物的制备方法均为水提醇沉法,因此本研究仅将提取物的乙醇残留溶剂列入内控标准中。
根据本研究中采用顶空-样气相色谱法建立了舒肝宁注射液4种提取物中乙醇残留量的测定方法,结果发现乙醇在15.46~773 mg/L(r=0.999 3) 范围内线性关系良好,4种提取物的回收率均良好,最低检测限为 11 ng,成功建立了检测舒肝宁注射液4种提取物中乙醇残留量的测定方法,且利用此方法测定所测样品的乙醇残留量均<0.5%,符合ICH乙醇量不得超过0.5%的规定,进一步证实本研究所涉及的12批提取物样品中乙醇量未超标,但是考虑到注射液的安全性,因此建议企业将提取物的乙醇残留量作为企业内控质量标准,对其进行监控。
[1]关妮. 舒肝宁注射液临床应用进展[J].医学理论与实践, 2014 (10): 1291-1295.
[2]王云, 罗天永. 舒肝宁注射液治疗黄疸型肝炎的临床效果观察[J]. 护士进修杂志, 2010 (8): 744-745.
[3]田智慧, 田志磊, 赵菊梅, 等. 顶空毛细管气相色谱法测定头孢米诺钠中三种有机溶剂残留量[J]. 生化与医药, 2007(13):50.
[4]蒋晔, 徐智儒, 康丽娟, 等. 顶空气相色谱法测定阿德福韦酯中4种有机溶剂残留量[J]. 中国新药杂志, 2004 (12):1359-1361.
[5]姜玲黎, 吴明珲, 李高, 等. 顶空气相色谱法测定穿心莲注射液中氯仿残留量[J]. 医药导报, 2007 (3):295-296.
[6]方继辉, 李晨辉. 顶空气相色谱法测定佐匹克隆中有机溶剂残留量[J]. 广东药学, 2005 (5):1-3.
[7]程寿峰, 张明时, 夏品华. 30种黔产中药材饮片中11种有机氯农药残留的污染调查与研究[J]. 时珍国医国药, 2013 (9):2288-2290.
[8]郭波红, 程怡, 吴卫. 甘草次酸脂质体中乙醇残留量的顶空气相色谱法测定[J]. 时珍国医国药, 2012 (3):692-693.
[9]帅放文, 章家伟, 王向峰,等. 依达拉奉标准物质中乙醇残留的测定[J].广东化工,2014 (16):178-179.
[10]孔霁虹, 臧恒昌, 王彦厚. 气相色谱法测定阿莫西林克拉维酸钾片中的乙醇残留量[J].食品与药品,2014 (2):120-122.
[11]国家药典委员会. 中华人民共和国药典(一部)[S]. 北京:中国医药科技出版社,2010:附录Ⅷ.
(2016-02-31收稿,2016-06-30修回)
中文编辑: 吴昌学; 英文编辑: 刘华
Determination of Residual Ethanol in Four Extraction of Shuganning Injection by Headspace Gas Chromatography
HE Feng1, ZHANG Yun2
(1.SchoolofPharmacy,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China;2.GuizhouRuihePharmaceuticalCo.,Ltd,Guiyang550004,Guizhou,China)
贵州省科技重大专项项目[黔科合重大专项字(2011)6019号]
Email:838396231@qq.com
R917.7
A
1000-2707(2016)08-0911-04
10.19367/j.cnki.1000-2707.2016.08.011
**
网络出版时间:2016-08-23网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160823.1343.024.html

