一种改进的Aβ1-42寡聚体的制备与鉴定方法*
禹文峰, 孔 欣, 官志忠,**
(1.贵州医科大学 分子生物学重点实验室, 贵州 贵阳 550004; 2.贵州医科大学 病理学教研室, 贵州 贵阳 550004)
一种改进的Aβ1-42寡聚体的制备与鉴定方法*
禹文峰1, 孔欣2, 官志忠1,2**
(1.贵州医科大学 分子生物学重点实验室, 贵州 贵阳550004; 2.贵州医科大学 病理学教研室, 贵州 贵阳550004)
目的: 改进Aβ1-42寡聚体的制备与鉴定方式。方法: 以化学合成多肽Aβ1-42为原料在体外制备Aβ1-42寡聚体,用Western blotting进行鉴定;加入不同浓度Aβ1-42寡聚体后,用CCK-8法测定体外原代培养大鼠大脑皮质星形胶质细胞(AS)的存活率。结果: 化学合成的 Aβ1-42寡聚体分子量为4~188 kD,以64 kD最多,亦有少量4 kD单体存在;CCK-8法显示Aβ1-42寡聚体对AS有明显的神经毒性作用,并呈现剂量-效应关系。结论: 成功建立了一种改进的制备和鉴定Aβ1-42寡聚体的方法,为深入研究阿尔茨海默病提供了研究手段。
淀粉样蛋白; 阿尔茨海默病; 寡聚体; 星形胶质细胞; 免疫印迹法
[Abstract]Objective: To improve method for preparation and identification of Aβ1-42oligomer. Methods: Aβ1-42oligomer was prepared by using chemical synthetic Aβ1-42polypeptideinvitro. The prepared peptide was identified by the assay of Western blotting. In order to confirm the neurotoxicity of the peptide, primary cultured astrocytes from the cortex of rats were treated with different concentrations of Aβ1-42oligomer and the survival rates of the cells were detected via Cell Counting Kit-8(CCK-8) assay. Results: The results indicated that chemical synthetic Aβ1-42oligomer weighed from 4 to 188 kd, in which the points with 64 kd were the most. In addition, a few points with 4 kd, a monomer, was also found. Furthermore, the neurotoxicity of Aβ1-42oligomer on astroytes was significantly detected with a manner of dose-dependence. Conclusions: An improved method for preparation and identification of Aβ1-42oligomer has been successfully established, which is important in the research work of Alzheimer's disease.
[Key words]amyloid; Alzheimer disease; oligomer; astrocytes; immunoblotting
阿尔茨海默氏病(Alzheimer disease, AD)是一种常见的神经退行性疾病,AD患者表现出进行性记忆能力降低、行为和认知功能障碍。AD的主要病理改变有脑组织老年斑及神经纤维缠结形成,老年斑的主要成分是β-淀粉样蛋白(amyloid β-protein,Aβ)[1-2]。在AD的发病过程中,Aβ分子经历了从可溶态到不溶纤维状的转变。神经细胞内的Aβ生成后分泌到细胞外,累积到一定程度后就会自发聚合构成寡聚体、原纤维体及中间体,最后会形成成熟、老化的纤维状Aβ。目前认为,可溶性Aβ寡聚体是产生神经毒性作用的重要来源,比纤维状Aβ的毒性更强,在AD的发病机理中起着重要作用[3-6]。Aβ寡聚体的稳定性较差,易被转化为纤维体,引起毒性减弱,影响实验效果,目前国内对Aβ寡聚体的制备和鉴定方法较少。为此,本研究在原有Aβ寡聚体制备的基础上,对制备和鉴定方法的改进,并检测其神经细胞毒性作用,为AD的研究提供可靠的方法。
1 材料与方法
1.1材料
新生24~48 h 的SD(Sprague-Dawley)大鼠由贵州医科大学动物实验中心提供。DMEM培养基、胎牛血清、F12无酚红培养基购自Gibco公司(美国),0.25%胰蛋白酶、青—链霉素购自Hyclone公司(美国),GFAP兔抗牛多克隆抗体购自Dako公司(丹麦),Cyb3标记的羊抗兔IgG购自碧云天公司,Aβ1-42肽、六氟异丙醇、DMSO购自Sigma公司(美国),鼠抗Aβ多克隆抗体6E10购自Covance公司(美国),辣根过氧化物酶(HRP)标记的抗鼠二抗购自Santa Cruz公司(美国),预制胶、电泳槽、预染标准品、电泳液等购自life technologies公司(美国),聚乙烯二氟(PVDF)膜、ECL-Plus发光试剂购自Millipore公司(美国),高效显影胶片购自柯达公司(美国),肿囊收缩素-8(CCK-8)试剂盒购自日本同仁公司。电泳仪(上海六一仪器厂)、CO2培养箱(日本SANYO公司)、高速离心机(德国eppendorf公司)、真空浓缩离心机(中国Heto)、超净工作台(中国SPEG AIR TECH)、-80 ℃冰箱(美国Thermo公司)、恒温震荡摇床、手术器械(眼科剪刀、镊子等)经高压消毒。
1.2方法
1.2.1星形胶质细胞(astrocyte,AS)培养及鉴定参照Mc Carthy等[7-9]方法并改进,取24~48 h内大鼠乳鼠的大脑皮质,消化漂洗后,弃废液,加入含10%FBS的DMEM,吹打制成细胞悬液,接种至25 cm2培养瓶,放入37 ℃、5%CO2培养箱,24 h后换液1次;随后3~4 d用含10% FBS的DMEM换液,至细胞长满。培养7~9 d,纯化并传3~4代。传代后,以细胞免疫荧光的方法对AS 特征性标记物胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)进行染色鉴定[10]。
1.2.2体外制备Aβ1-42参照文献[11-14]在体外制备Aβ1-42寡聚体的方法,将HFIP置于冰上,在Aβ1-42粉末中加入充足的冷却的HFIP(HFIP是一种高腐蚀性、挥发性的试剂,操作时注意安全),使终浓度为1 mmol/L。充分用液体吹打瓶壁,使Aβ1-42粉末彻底溶解。室温孵育60 min,保持封闭。溶液必须是无色、清亮的。若是出现黄色、浑浊液体或是悬浮的肽,证明质量不好,不要使用。接着将其放在冰上静置5~10 min后转移并等量分装至各个离心管中,盖子打开,在通风橱内室温下过夜,使HFIP挥发完全。第2天观察挥发情况,使用真空浓缩离心机使HFIP完全蒸发,最终只可有清晰透明的薄膜留在离心管底部,不应为白色或是厚实的块状物。将干燥的肽膜存于-80 ℃冰箱保存,使用时将其放在冰上,用DMSO充分溶解,终浓度为5 mmol/L。接着用不含酚红的F12培养基来稀释,为得到最好的效果,最好不要超过100 μmol/L的浓度。4 ℃孵育24 h后,14 000 g冰冻高速离心机离心10 min,上清液即为寡聚体。
1.2.3Aβ1-42寡聚体的鉴定采用Western-blotting法。在不含血清的培养基内加入100、200、300、400及500 nmol/L的Aβ1-42寡聚体,37 ℃培养箱内孵育24 h后取出上清液。将样品变性后,加入至4%~12%的预制胶的孔中跑电泳。接着将胶上的条带转至PVDF膜上。转膜成功后,将膜封闭2 h。用稀释后的6E10-抗4 ℃孵育过夜后,再加入二抗在摇床上摇1 h。每进行下一步时,都要用含0.01%的吐温-20的TBST清洗干净。最后用ECL发光试剂观察表达情况。
1.2.4CCK-8细胞存活率测定每孔8 000~10 000个星形胶质细胞接种在96孔板上,长满后加入不含血清的DMEM高糖培养基培养,24 h后加入0.01、0.1、1.2及5 μmol/L Aβ1-42寡聚体,共同作用24 h后弃上清液,每孔加入培养基200 μL 及 CCK-8试剂20 μL避光共同孵育,待1 h后通过酶标仪测定450 nm处 OD值。重复3次。
1.3统计学方法
应用SPSS 21.0统计软件进行分析,计量资料的比较采用one-way ANOVA方法检验。
2 结果
2.1AS中GFAP免疫荧光鉴定
星形胶质细胞以GFAP免疫荧光的方式染色,以Cy3标记阳性细胞呈红色,在倒置显微镜下观察,细胞计数AS占所有细胞的95%以上,见图1。
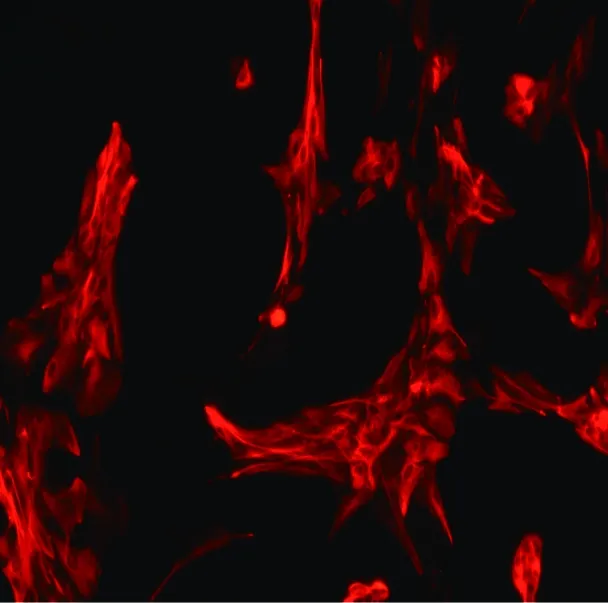
图1 原代培养AS中的GFAP免疫荧光显色(400×)Fig.1 GFA immunofluorescence of primary cultured astrocytes
2.2Aβ1-42寡聚体鉴定
经Western blotting鉴定,500 nmol/L浓度的Aβ寡聚体在4 kD和64 kD处比较明显,其余浓度不明显,见图2。

图2 Aβ1-42寡聚体的鉴定结果(Western blotting)Fig.2 Identification of Aβ1-42 oligomer with Western blotting
2.3Aβ1-42对AS细胞存活率的影响
不同浓度的Aβ1-42对AS均有损伤作用,实验结果呈现剂量-效应关系;自0.1 μmol/L浓度起,寡聚体的毒性作用更显著,差异有统计学意义(P<0.05)。见图3。

图3 Aβ1-42对AS存活率的影响Fig.3 effect of Aβ1-42 on cell survival of primary cultured astrocytes
3 讨论
Aβ级联假说是AD发病机制中重要的学说,是引起AD神经退行变和痴呆的主要致病因素[15]。Aβ是淀粉样蛋白前体蛋白(amyloid precursor protein,APP)经过蛋白酶水解后生成的氨基酸片段,Aβ分泌过多和异常积聚都会导致神经细胞的损伤[16]。Aβ的聚集和沉积会破坏神经细胞突触结构和功能,诱导神经细胞凋亡,是造成记忆和认知功能障碍的重要因素[17-19]。
本实验所采用的方法可以快速、成功的在体外制备Aβ1-42寡聚体,用Western blotting方法准确地鉴定其表达。实验过程应注意的问题有:(1)在Aβ寡聚体的粉末中加入HFIP后,一定要蒸发完全,如果在通风橱过夜后未干,可使用真空干燥器;(2)在寡聚体制作完成后,应尽快使用,因为其易变形,毒性易降低,如果长时间不用,在使用前应做不同浓度的Aβ寡聚体的鉴定,观察其分子量表达情况;(3)在用Western blotting鉴定时,由于Aβ寡聚体的表达可有多种形式,可以是单体、二聚体、或者是三聚体等不同的多聚体形式。因此,分离胶的浓度应选择4%~12%的梯度胶,这样可以使各种不同分子量的多肽获得清楚的分离效果,当其转移至PVDF膜后,可以准确观测到分子量的变化。
相较于以往对Aβ寡聚体的制备与鉴定的研究,本实验在此基础上加以改良,更为经济、快捷、易于操作。在Aβ寡聚体的鉴定方面,普遍采用的方法是原子力显微镜(atomic force microscope , AFM)鉴定、酶联免疫吸附法(enzyme-linked immunosorbent assay, ELISA)及免疫荧光检测等。AFM是研究生物医学样品的重要工具之一,但并不是实验室常规设备,使用不便。而ELISA法和免疫荧光的方法,操作耗时、花费较高。本研究采用的Western blotting 法是在无血清的培养基内加入不同浓度的Aβ寡聚体,37 ℃培养箱内孵育24 h后取出上清液进行鉴定,更为简便、快速、经济。
AS是神经系统表达最丰富的胶质细胞类型,在多种神经疾病的发生和发展过程中充当“双刃剑”的重要角色。在AD早期,AS可在局部吞噬病变的神经细胞,维护细胞微环境。但随着疾病的发展,AS释放各类有害因子,参与氧自由基形成及兴奋性毒性作用,加重神经细胞损伤。此外,Aβ的聚集和沉积能激活星形胶质细胞,使其释放炎性因子,导致脑组织出现炎症反应[20-21]。本实验中发现,不同浓度的Aβ寡聚体对AS有一定的损害作用,细胞存活率降低。当然,也可以使用神经细胞或其他胶质细胞来进行Aβ寡聚体的神经毒性作用鉴定。
总之,本实验提供了一种比较简单、直观、经济的体外提取Aβ寡聚体的改进方法及鉴定方式,为AD的研究提供了实用的研究手段。
[1]官志忠.阿尔茨海默病的病理学及生物膜结构与受体改变机制[J].中华病理学杂志, 2003(1):69-71.
[2]Kumar A, Singh A, Ekavali. A review on Alzheimer’s disease pathophysiology and its management: an update[J]. Pharmacological Reports, 2015(67): 195-203.
[3]刘文娟,戴雪伶,姜招峰.β-淀粉样蛋白神经毒性及其防治策略[J].生命科学, 2011(10):1023-1026.
[4]Anand R, Gill KD, Mahdi AA. Therapeutics of Alzheimer’s disease: past, present and future[J]. Neuropharmacology, 2014(76):27-50.
[5]Hardy J. The amyloid hypothesis for Alzheimer’s disease: a critical reappraisal[J]. J Neurochem, 2009(4): 1129-1134.
[6]Dal Pra I, Chiarini A, Gui L, et al. Do strocytes collaborate with neurons in spreading the ‘infectious’ Aβ and tau rivers of Alzheimer’s disease[J]. Neuroscientist, 2015(1): 9-29.
[7]Mc Carthy KD,Vellis JD.Preparation of separate astroglial and oligdendroglial cell cultures from rat cerebral tissue[J]. Cell Biol, 1980(85): 890-902.
[8]Schildge S, Bohrer C, Beck K, et al. Isolation and Culture of Mouse Cortical Astrocytes[J]. J Vis Exp, 2013(71): 1-7.
[9]汤婷婷,官志忠,禹文峰.SD大鼠大脑皮层星形胶质细胞的体外原代培养[J].贵阳医学院学报,2014(2):158-161.
[10]张敬军.星形胶质细胞的研究[J].中国药理学通报, 2006(7): 788-791.
[11]Klein WL. Aβ toxicity in Alzheimer’s disease: globular oligomers (ADDLs) as new vaccine an drug targets[J]. Neurochemistry International, 2002(41):345-352.
[12]官志忠,齐晓岚,欧阳凯,等.阿尔茨海默病发病中β淀粉样蛋白与胆碱能尼古丁受体的相互作用[C].第十三届全国诊断病理暨头颈部及内分泌系统疾病学术研讨会论文集, 2012:92-97.
[13]杨帆,李东风,徐书雯.Aβ1-42寡聚体与纤维体的制备及鉴定[J].中华老年学杂志, 2013(33):2076-2078.
[14]谭现伟.Aβ1-42寡聚体制备方法的研究[D].北京:北京交通大学, 2009:1-37.
[15]Galimberti D, Ghezzi L, Scarpini E. Immunotherapy against amyloid pathology in Alzheimer’s disease[J]. J Neurol Sci, 2013(1):50-54.
[16]Selkoe DJ. Alzheimer’s disease is a synaptic failure[J]. Science, 2002(298):789-791.
[17]Haass C, Selkoe DJ. Soluble protein oligomer in neurodegeneration: lessons from the Alzheimer's amyloid beta-peptide[J]. Nat Rev Mol Cell Boi, 2007(2):101-112.
[18]Shankar GM, Li S, Mehta TH, et al. Amyloid-beta protein dimers isolated directly from Alzheimer's brains impair synaptic plasticity and memory[J]. Nat Med, 2008(8):837-842.
[19]Butterfield DA. Amyloid β-peptide (1-42)-induced oxidative stress and neurotoxicity: implications for neurodegeneration in Alzheimer's disease brain[J]. Free Radical Research, 2002(12):1307-1313.
[20]Heneka MT, O'Banion MK. Inflammatory processes in Alzheimer's Disease[J]. J Neuroimmunol, 2007(1-2):69-91.
[21]王琦,周海霞.阿尔茨海默病中β淀粉样蛋白对星形胶质细胞的作用[J].中国老年学杂志, 2011(18):3643-3645.
(2016-06-13收稿,2016-07-30修回)
中文编辑: 周凌; 英文编辑: 赵毅
An Improved Method for Preparation and Identification of Aβ1-42Oligomer
YU Wenfeng1, KONG Xin2, GUAN Zhizhong1,2
(1.theKeyLabofMedicalMolecularBiology,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China;2.DepartmentofPathology,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China)
国家自然科学基金(81360199); 国家自然科学基金(81260173); 教育部科学技术研究项目(213032A); 贵州省科技厅国际合作项目 [黔科合外G字 (2011)7014号]; 贵州省科技计划 [黔科合重大专项字(2014)6008号]
Email:1457658298@qq.com
R34-33
A
1000-2707(2016)08-0878-04
10.19367/j.cnki.1000-2707.2016.08.003
**
网络出版时间:2016-08-23网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160823.1343.052.html

