一种检测帕金森患者血浆促进α-突触核蛋白寡聚体形成能力的方法
李 昕 杨巍巍 李 雁 于 顺*
(1.首都医科大学宣武医院神经生物学研究室,教育部神经变性病重点实验室,北京100053;2.北京市老年病医疗研究中心分子诊断实验室,北京100053)
黑质多巴胺神经元死亡是导致帕金森病(Parkinson’s disease,PD)运动障碍的主要原因。然而,以路易体(Lewy body,LB)为特征的PD病理变化不仅存在于黑质,也广泛见于神经系统的其他部位[1-2]。已知,LB的主要成分是聚集的 α-突触核蛋白(α-synuclein,α-Syn)[3-6]。证据[7-8]表明,聚集成寡聚体的 α-Syn对神经元具有毒性作用。虽然直接检测PD患者脑脊液和血浆中的α-Syn寡聚体水平被误认为有助于诊断PD患者的病理变化[9-10],然而检测PD患者体内促成α-Syn聚集的内在环境变化将从不同角度了解患者的发病机制。LB病理的广泛存在提示机体内环境的改变可能是促使α-Syn易于形成寡聚体的原因。因此检测血液促进α-Syn寡聚体形成的能力对了解PD患者的病理状况具有重要意义。
以下介绍一种检测PD患者血浆促进α-Syn寡聚体形成的方法,这种方法可以区别PD患者和正常对照血浆在影响α-Syn寡聚体形成上的差别。
1 材料和方法
1.1 血浆样本的收集和处理
PD患者血浆采自首都医科大学宣武医院神经内科确诊的原发性PD患者,并排除其他原因引起的帕金森综合征。患者年龄为50至70岁,H-Y分期为2至4级,并签订知情同意书。抽取患者空腹静脉血5 mL,置于含有抗凝剂的塑料管中,4℃、3 000 r/min离心20 min,取上层血浆分装于Eppendorf管中-80℃保存备用。对照组血浆来自首都医科大学宣武医院体检中心参加体检的受试者,年龄为50至70岁,并签订知情同意书。血浆样本的采集和存储与PD患者相同。
1.2 重组蛋白的表达和纯化
将含有α-Syn基因的pET重组质粒转化至大肠杆菌BL21感受态细胞中,在含氨苄青霉素的LB培养液中培养至适当密度(A600=0.4~0.6),加入异丙基-β-D-硫代吡喃半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG)诱导蛋白表达3 h,超声破碎获得 α-Syn蛋白,进一步用Duoflow中高压液相层析系统(DuoFlow 10/40,Bio-Rad 公司,美国),依次经过离子交换柱(TSK-gel SuperQ-5PW,TOSOH 公司,日本)、疏水层析柱(TSK-gel Phenyl-5PW ,TOSOH 公司,日本)及反相层析柱(TSK-gel Phenyl-5PW RP,TOSOH 公司,日本)纯化。纯化后的α-Syn蛋白经BCA法定量和Western blotting鉴定后,冷冻抽干-80℃分装保存。
1.3 α-突触核蛋白寡聚体标准的制备
将α-Syn以不同质量浓度溶于0.01 mol/L磷酸缓冲液(PBS,pH 7.4),经0.22 μm滤膜过滤除菌,37℃、280 r/min 振荡孵育 24、48、72、96 h。
1.4 α-突触核蛋白寡聚体的ELISA测试
参照文献[10]所描述的方法检测溶液中α-Syn寡聚体。简言之,用浓度为1 μg/mL的3D5单抗[11]包被96孔酶标板,用含2.5%明胶的PBST于37℃封闭2 h。加入α-Syn寡聚体,37℃孵育2 h,加入生物素标记3D5抗体(终质量浓度1 μg/mL),37℃孵育2 h。向各孔加入100 μL碱性磷酸酶标记的亲和素(3∶5 000),37℃孵育2 h。以上每一步骤之后用PBST冲洗各孔4次。最后加入100 μL对硝基酚磷酸显色液(pNpp),室温显色30 min。405 nm处测定吸光度值。
1.5 Western blotting 分析
将新鲜配制α-Syn及孵育后的α-Syn分别用15%SDS-PAGE分离后,半干法转移到PVDF膜。PVDF膜与单克隆抗体3D5(1∶10 000)室温孵育2 h,然后与辣根过氧化物酶标记的山羊抗小鼠IgG(1∶5 000)室温孵育1 h。ECL法检测辣根过氧化酶活性。
1.6 统计学方法
使用SPSS 17.0软件进行统计学分析。所有数据均用均数±标准差(ˉ±s)表示,各处理组与对照组数据比较用两独立样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 α-Syn寡聚体标准的Western blotting鉴定
将100 μmol/L 重组人 α-Syn 在 0.01 mol/L PBS(pH 7.3)中于37℃振荡孵育不同时间,所获样本进行Western blotting分析,结果如图1所示。在未经振荡孵育的α-Syn溶液中只有单体存在,而在振荡孵育的样本中,不仅存在单体,而且可见不同程度聚合的寡聚体,包括二聚体、三聚体、四聚体、六聚体等。随振荡时间的延长,α-Syn的聚合程度逐渐增加,而α-Syn单体则逐渐减少并最后消失。本课题组选用振荡120 h的样本作为α-Syn寡聚体标准。

图1 振荡孵育时间对α-Syn寡聚体形成的影响Fig.1 Effect of incubation time on α-Syn oligomerization
2.2 α-Syn寡聚体的酶联免疫吸附测定检测
用所建立的ELISA方法分别对α-Syn单体和寡聚体进行测试,结果如图2所示。该ELISA法特异性识别α-Syn寡聚体,不识别α-Syn单体。405 nm吸收值与α-Syn寡聚体质量浓度呈明显的线性关系,r2为0.9906。
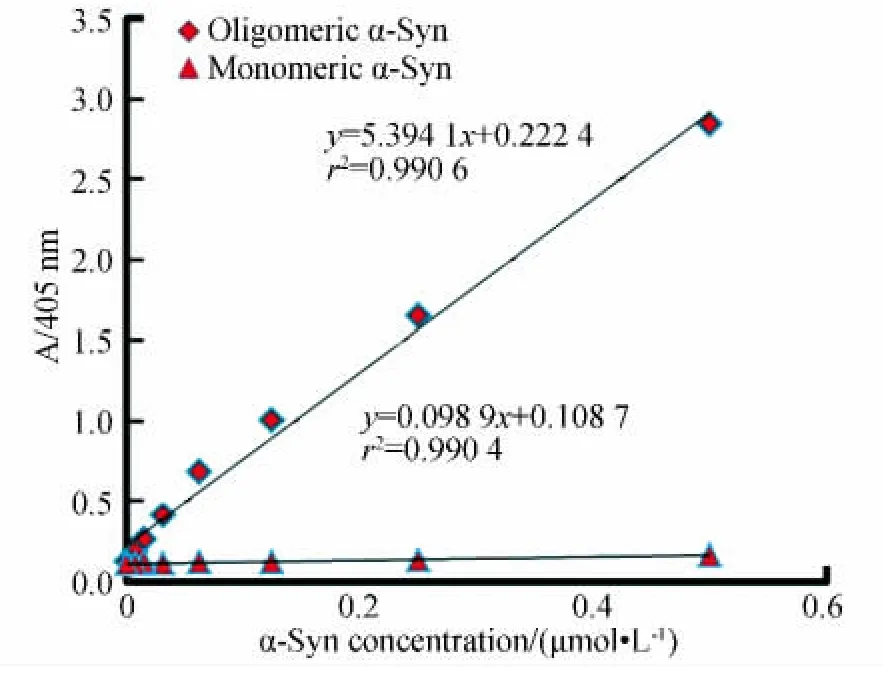
图2 α-Syn单体和寡聚体质量浓度对405 nm吸收值关系曲线Fig.2 Correlation curves between the concentrations of α-Syn monmers and oligomers versus the absorbance at 405 nm
2.3 血浆稀释倍数对α-Syn寡聚体形成的影响
用PBS稀释PD和对照血浆,将100 μmol/L重组人α-Syn溶解于不同稀释倍数的血浆,37℃振荡孵育120 h,ELISA测试α-Syn在PD血浆和对照血浆中的寡聚体形成情况。结果(图3)显示,α-Syn在血浆原液以及稀释倍数低于3倍的情况下可以形成较多的聚合体,而且聚合程度在PD和对照血浆之间有显著差异。进一步稀释血浆导致α-Syn的聚合程度明显降低,并且在PD和对照血浆之间的差异消失。
2.4 蛋白质量浓度、振荡时间对α-Syn寡聚体形成的影响
将不同质量浓度α-Syn在PBS稀释3倍的PD和对照血浆振荡孵育不同时间比较,寻找能够导致α-Syn在PD和对照血浆中形成寡聚体差异最大的蛋白质量浓度和孵育时间,结果如图4所示。从图中可以看出,在蛋白质量浓度为100 μmol/L,孵育时间为48 h条件下,α-Syn在PD和对照血浆中形成的寡聚体含量的差异最大。增大蛋白质量浓度和延长孵育时间虽然能够增加寡聚体的形成,但寡聚体在PD和对照血浆中的差异减少。
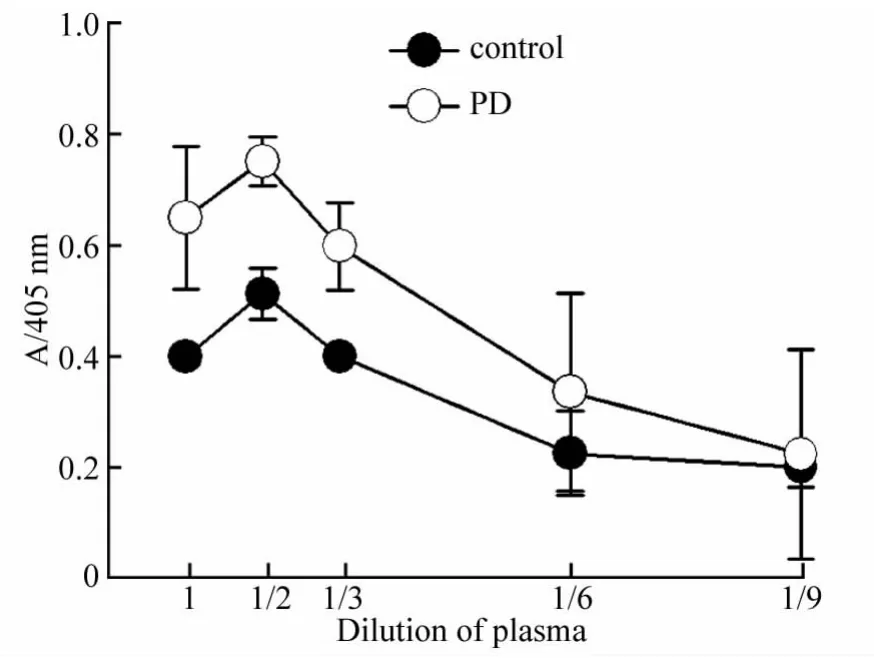
图3 血浆稀释倍数对α-Syn寡聚体形成的影响Fig.3 Effect of plasma dilution on α-Syn oligomerization

图4 蛋白质量浓度和振荡孵育时间对α-Syn寡聚体形成的影响Fig.4 Effect of protein concentration and incubation time on α-Syn oligomerization
2.5 α-Syn在PD患者和对照血浆中寡聚体形成的比较
根据以上研究,将100 μmol/L重组α-Syn在3倍稀释的PD和对照血浆中孵育48 h,测试了32例PD患者血浆和32例对照受试者血浆。统计结果显示,α-Syn在PD患者血浆中形成的寡聚体含量明显高于对照血浆(图5)。
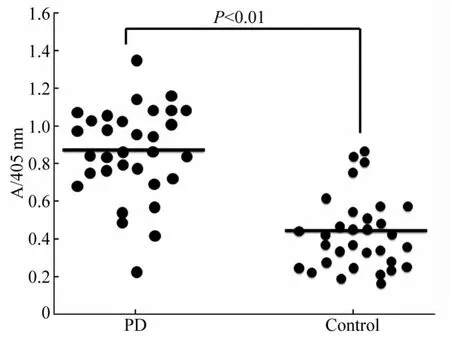
图5 α-Syn寡聚体形成在PD患者和对照受试者的差异Fig.5 Differentiation of α-Syn oligomerization in the plasma of PD patients and control subjects
3 讨论
本课题组建立了一种能够检测PD患者血浆促进α-Syn寡聚体形成能力的方法,该方法包括制备 α-Syn寡聚体标准,特异性识别α-Syn寡聚体的ELISA方法,以及有助于区别α-Syn在PD和对照血浆寡聚体形成差异的最佳血浆稀释倍数、α-Syn质量浓度和孵育时间。α-Syn是易于聚集的蛋白质。α-Syn不仅在PD患者体内可以形成寡聚体,而且在体外振荡孵育条件下也可以形成寡聚体[12]。无论体内病理情况下还是体外振荡孵育条件下形成的α-Syn寡聚体均对去污剂具有抵抗作用。根据这一特性,采用变性条件下的SDS-PAGE和Western blotting方法对体外振荡孵育的α-Syn样本进行鉴定。结果显示,在蛋白质量浓度为100 μmol/L、振荡频率为280 r/min、振荡孵育温度为37℃、振荡孵育时间为120 h条件下,样本中的α-Syn单体完全消失,并形成从二聚体至六聚体不等的不同程度聚合的α-Syn寡聚体。因此,将这一条件下形成的α-Syn寡聚体样本作为ELISA测试的α-Syn寡聚体标准蛋白。然后,根据文献[9]所描述的原理,利用本室自制的小鼠抗人α-Syn单克隆抗体建立了针对α-Syn寡聚体的ELISA检测方法。所建立的ELISA方法可以特异性识别α-Syn寡聚体,而对α-Syn单体不产生反应。为了寻找α-Syn在PD患者血浆形成寡聚体的最佳条件,并且在这一条件下形成的寡聚体可以最大程度地在含量上区分对照血浆形成的寡聚体,对血浆稀释度、振荡孵育时间以及α-Syn质量浓度进行了分析。结果表明,PD患者血浆在不低于原液1/3稀释的情况下对α-Syn在的聚合无明显影响,并且可以显著区分α-Syn在PD患者和对照血浆的聚合程度。而进一步增加血浆稀释倍数则使α-Syn的聚合量减少,并与对照血浆的差异消失。其原因可能与过度稀释导致血浆中影响α-Syn聚合的病理因素减弱有关。此外,100 μmol/L的蛋白质量浓度和48 h孵育可以最大程度地区分PD患者和对照血浆中α-Syn的聚合程度。进一步增加α-Syn质量浓度和延长孵育时间虽然可以增加α-Syn的聚合程度,但α-Syn在PD患者和对照血浆中的聚合程度的差异逐渐缩小。这可能与α-Syn在PD患者血浆中的聚合达到饱和有关。
本文所描述方法有助于判定PD患者机体内环境的变化,这种变化可以促进α-Syn的聚合,后者是引起PD患者神经元退变的重要原因。因此,利用本文所建立的方法检测PD患者血浆促进α-Syn的聚合能力可以在一定程度上了解PD患者的病理变化。
[1]George S,Rey N L,Reichenbach N,et al.α-Synuclein:the long distance runner[J].Brain Pathol,2013,23(3):350-357.
[2]Jellinger K A.Critical evaluation of the Braak staging scheme for Parkinson’s disease[J].Ann Neurol,2010,67(4):550.
[3]Spillantini M G,Schmidt M L,Lee V M,et al.Alpha-synuclein in Lewy bodies[J]. Nature, 1997,388(6645):839-840.
[4]Baba M,Nakajo S,Tu P H,et al.Aggregation of alphasynuclein in Lewy bodies of sporadic Parkinson’s disease and dementia with Lewy bodies[J].Am J Pathol,1998,152(4):879-884.
[5]Ferrer I,Martinez A,Blanco R,et al.Neuropathology of sporadic Parkinson disease before the appearance of parkinsonism:preclinicalParkinson disease[J]. JNeural Transm,2011,118(5):821-839.
[6]Sulzer D,Surmeier D J.Neuronal vulnerability,pathogenesis,and Parkinson’s disease[J].Mov Disord,2013,28(1):41-50.
[7]Kalia L V,Kalia S K,McLean P J,et al. α-Synuclein oligomers and clinical implications for Parkinson disease[J].Ann Neurol,2013,73(2):155-169.
[8]Danzer K M,McLean P J.Drug targets from genetics:alpha-synuclein[J].CNS Neurol Disord Drug Targets,201,10(6):712-723.
[9]Park M J,Cheon S M,Bae H R,et al.Elevated levels of α-synuclein oligomer in the cerebrospinal fluid of drug-naïve patients with Parkinson’s disease[J].J Clin Neurol,2011,7(4):215-222.
[10]El-Agnaf O M,Salem S A,Paleologou K E,et al.Detection of oligomeric forms of alpha-synuclein protein in human plasma as a potential biomarker for Parkinson’s disease[J].FASEB J,2006,20(3):419-425.
[11]Yu S,Li X,Liu G,et al.Extensive nuclear localization of alpha-synuclein in normal rat brain neurons revealed by a novel monoclonal antibody[J].Neuroscience,2007,145(2):539-555.
[12]程芙蓉,李昕,殷娟娟,等.过氧化氢和帕金森病患者血清促进α-突触核蛋白向线粒体与细胞核转运[J].首都医科大学学报,2010,31(6):732-736.

