羟基红花黄色素A对脑缺血再灌注大鼠MMP-9和claudin-5蛋白水平的影响
戚智锋 师文娟 闫 峰 罗玉敏 刘克建
(首都医科大学宣武医院脑血管病研究室,北京100053)
红花是传统的活血化瘀中药,羟基红花黄色素A(hydroxysafflor yellow A,HSYA)是中药红花的主要有效成分之一,存在于红花的水溶性提取部位,目前广泛用于心血管疾病的临床治疗[1]。近年来国内外基础研究[2-4]发现,HSYA具有抗氧化、抗炎、抑制血小板聚集、抗血栓形成等多种药理学功效,可以有效降低动物脑缺血损伤。红花黄色素不仅可有效降低缺血再灌注时ATP合成障碍,还可以增加腺苷酸储备,因而调节能量代谢,达到保护缺血心肌组织的作用[5]。红花黄色素可有效降低缺血再灌注时ATP合成障碍,增加腺苷酸储备,因而有利于能量代谢障碍的恢复,达到保护缺血心肌组织的作用。红花黄色素对自由基有显著的清除能力,随红花黄色素剂量加大,对自由基的消除作用逐步增强[6]。
血脑脊液屏障是脑微血管特有的屏障结构。微血管内皮细胞及微血管内皮细胞之间的紧密连接是形成屏障作用的最主要结构基础。紧密连接蛋白(包括claudin-5、occludin等)的水平直接影响血脑脊液屏障通透性;脑缺血时这些蛋白水平减少,表明血脑脊液屏障结构受到破坏,血脑脊液屏障通透性增加,加重脑水肿或出血。基质金属蛋白酶(matrix metalloproteinase-9,MMPs)是一组锌依赖的蛋白水解酶,其中MMP-9可以直接降解内皮细胞间紧密连接蛋白(如claudin-5),具有底物特异性。基础实验[7]显示,缺血再灌注促进MMP-9活性增强,破坏了神经血管基质,从而破坏了血脑脊液屏障的完整性。
研究[2]表明,HSYA可以减轻大鼠脑缺血引起的血脑脊液屏障通透性增加,如减少染料Evan’s blue的漏出等。但是,HSYA减轻血脑脊液屏障通透性的确切机制还不清楚。本研究将利用大鼠缺血1.5 h再灌注72 h模型,研究HSYA对脑缺血后半影区和核心区MMP-9和claudin-5蛋白水平的影响,探讨HSYA减轻血脑脊液屏障通透性的可能机制。
1 材料和方法
1.1 大脑中动脉阻塞模型制作
雄性SD大鼠,体质量290~310 g,购自北京维通利华实验动物技术有限公司,实验动物许可证号:SCXK(京)2012-0001。用线栓法制备大鼠大脑中动脉缺血1.5 h再灌注72 h模型。详细操作方法参见文献[8]。
1.2 给药治疗
HSYA由浙江永宁药业有限公司提供,其化学结构如图1。大鼠采用数字表法随机分为2组,HSYA治疗组和盐水对照组,每组3只。红花黄色素分4次尾静脉注射,每次2 mg/kg,浓度参考文献[3]。注射时间点为缺血后30 min、再灌注时、再灌注24 h、再灌注48 h。对照组(Saline):给予同体积0.9%氯化钠注射液,其余与HSYA组相同。在72 h后处死动物,进行后续检测。
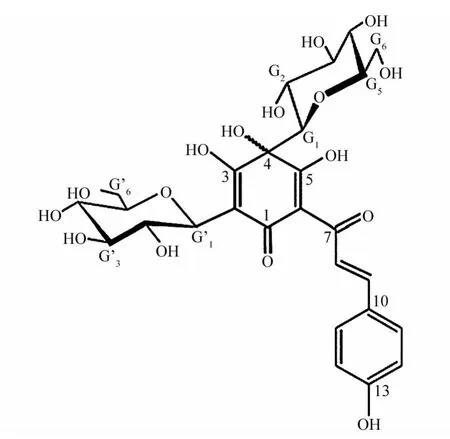
图1 HSYA的化学结构Fig.1 Structure of HSYA
1.3 TTC染色及取材
大鼠断头取脑后,自额叶后3 mm处开始连续切取脑片4片,每片厚度2 mm,用1.5%TTC染色10 min,拍照。半影区和缺血核心区的确定参考文献[9-10]。取材方法简述如下。半影区为尚未发生梗死区域,TTC染色显示为红色;缺血核心区为梗死区域,TTC显示为白色。每只大鼠均选取第2张脑片,分别取半影区和缺血核心区的皮质组织进行Western blotting检测,取材如图2。
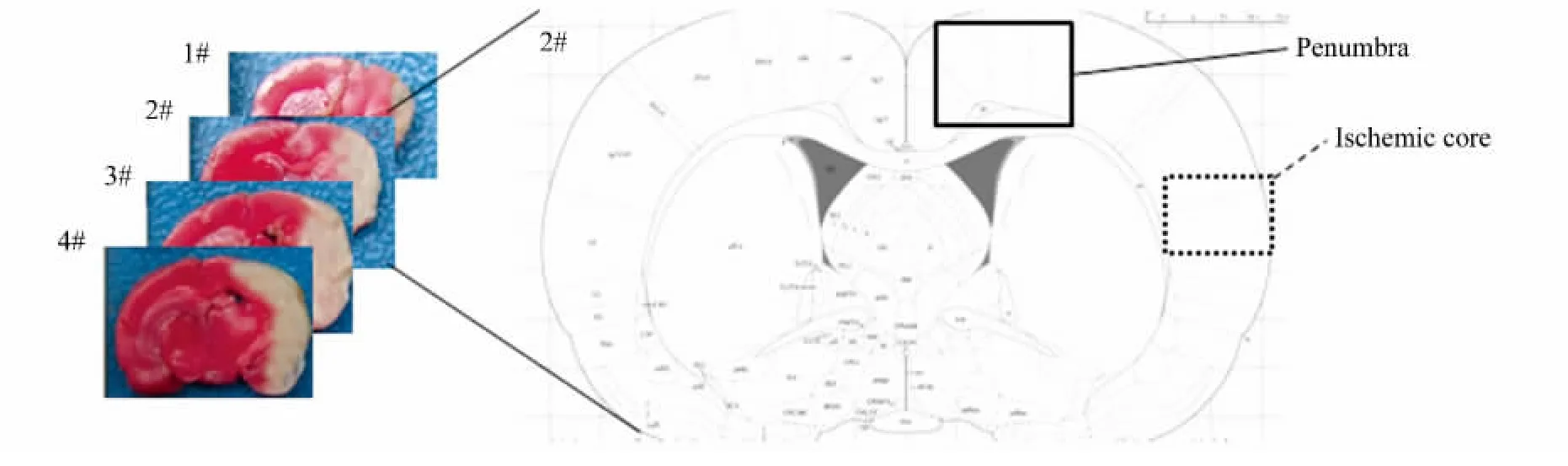
图2 半影区和缺血核心区的确定及取材示意图Fig.2 Definition of penumbra and ischemic core and illustration of tissue collection
1.4 Western blotting 检测
详细操作方法参见文献[8]。简述如下。脑组织中加入RAPI细胞裂解液(50 mmol/L Tris-Cl,pH 7.4,150 mmol/L sodium chloride,1% NP-40,0.1%SDS)中,按比例100∶1加入复合磷酸酶抑制剂和复合蛋白酶抑制剂。匀浆后超声,4℃,12 000 g,离心10 min,取上清,BCA法进行蛋白定量。总蛋白中加入Loading Buffer,95℃变性 5 min,进行 10%SDSPAGE电泳,转膜。10%牛奶封闭1 h,TTBS漂洗3次,每次10 min;分别加入羊抗小鼠MMP-9一抗(1∶1 000,Sigma公司,美国)、claudin-5一抗(1 ∶1 000,Sigma公司,美国)或羊抗兔 β-actin(1∶2 000,Sigma公司,美国),室温孵育4 h。吸出一抗孵育液,以TTBS漂洗3次,每次10 min;加入辣根过氧化物酶标记的山羊抗小鼠或山羊抗兔二抗,室温下与杂交膜孵育1 h。弃去二抗,TTBS漂洗3次,每次10 min;ECL化学发光剂显影,使用Gel-Del凝胶成像系统扫描分析。蛋白水平用目标蛋白条带灰度与β-actin的比值,以对照组的比值作为100%进行标准化。
1.5 统计学方法
采用SPSS 11.5进行统计分析。数据以均数±标准误(ˉx±SE)表示,组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 HSYA降低脑梗死面积
TTC染色结果显示,HSYA组的脑梗死面积小于Saline对照组,白色显示脑梗死区域,红色显示尚未发生梗死区域。典型TTC染色如图3所示。
2.2 HSYA降低半影区MMP-9蛋白水平,不影响核心区MMP-9蛋白水平
Western blotting检测HSYA组和Saline组半影区和核心区MMP-9蛋白水平,结果显示,与对照组相比,HSYA处理组MMP-9蛋白水平显著低于盐水对照组(Saline 组:100±0.00,HSYA 组:63.38±12.23,每组n=3,P<0.05,图 4);而在缺血核心区,HSYA 组和 Saline 组MMP-9蛋白水平没有明显变化(Saline组:100±0.00,HSYA 组:104.66±12.99,每组 n=3,P>0.05,图5)。
2.3 HSYA增加半影区claudin-5蛋白水平,不影响核心区claudin-5蛋白水平
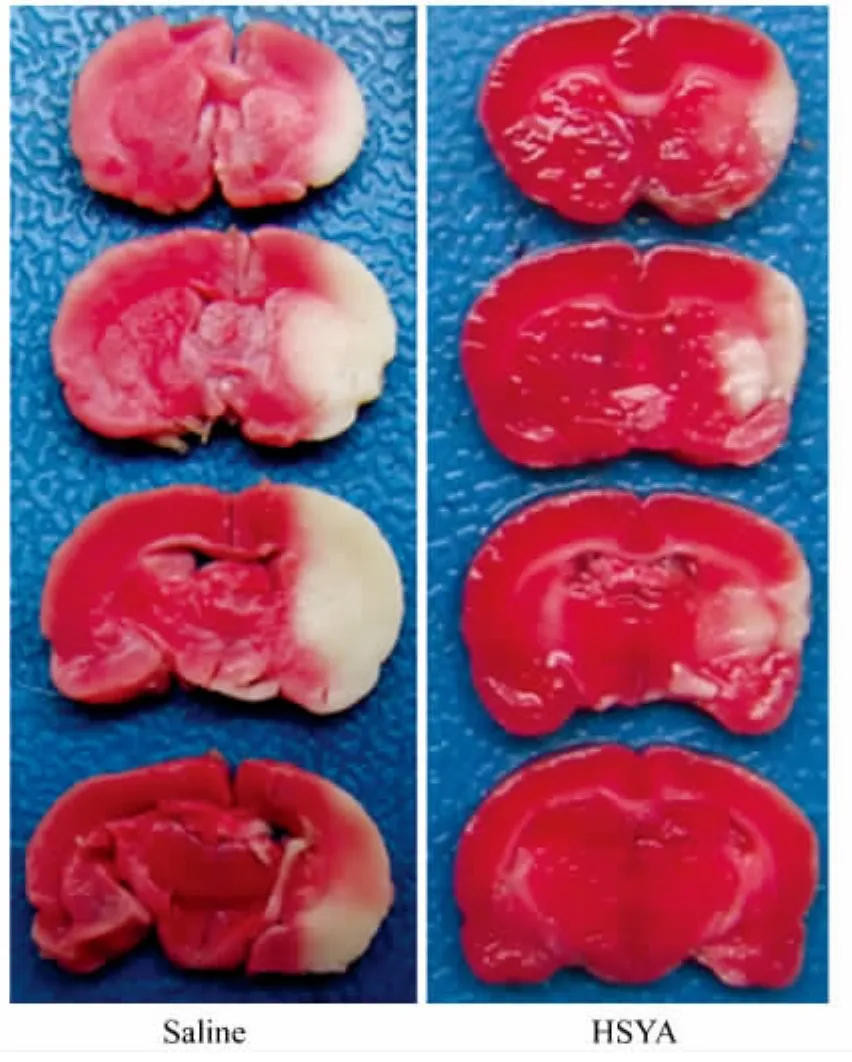
图3 TTC染色结果Fig.3 TTC staining
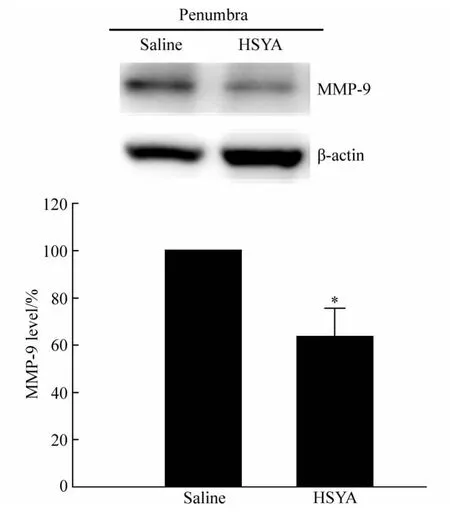
图4 Western blotting检测半影区MMP-9蛋白水平Fig.4 Results of Western blotting of MMP-9 in penumbra
Western blotting检测HSYA组和Saline组半影区和核心区claudin-5蛋白水平,结果显示与对照组相比,HSYA处理组claudin-5蛋白水平显著高于盐水对照组(Saline 组:100,HSYA 组:129±10.5,n=3,P<0.05,图6)。而在缺血核心区,HSYA组和Saline组claudin-5蛋白水平没有明显变化(Saline组:100,HSYA 组:95.47±15.47,n=3,P>0.05,图 7)。
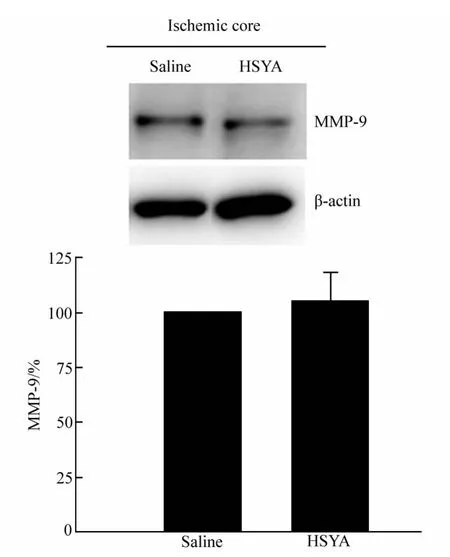
图5 Western blotting检测缺血核心区MMP-9蛋白水平Fig.5 Results of Western blotting of MMP-9 in ischemic core
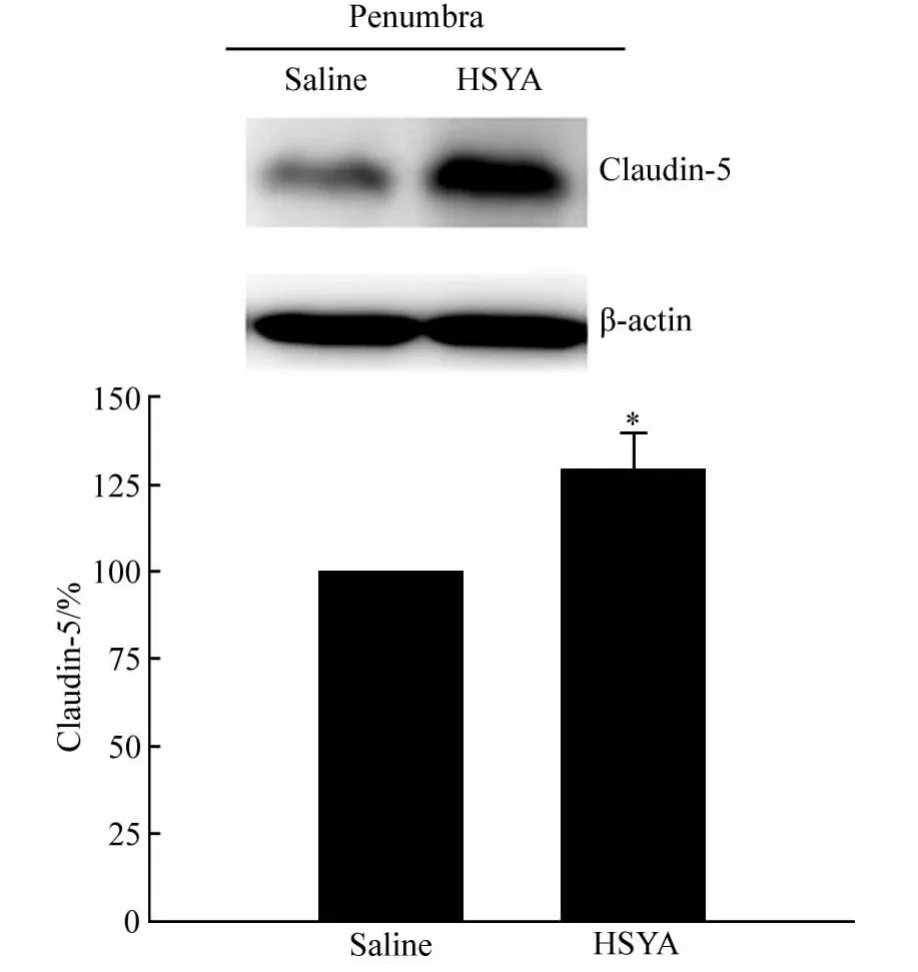
图6 Western blotting检测缺血核心区claudin-5蛋白水平Fig.6 Results of Western blotting of claudin-5 in penumbra

图7 Western blotting检测缺血核心区claudin-5蛋白水平Fig.7 Results of Western blotting of claudin-5 in ischemic core
3 讨论
中风以其高发病率和高致残率成为当前严重威胁人类健康的重要疾病。而水肿、出血等合并症是脑缺血疾病致死和致残的主要原因[11],因此如何降低脑缺血合并症的发生是降低脑缺血病死率和致残率的关键。人们对脑缺血继发水肿、出血发生机制的认识由宏观到微观,最终归于血脑脊液屏障结构和功能的破坏[12]。因此,探讨脑缺血早期血脑脊液屏障损伤的机制,有助于寻找防治血脑脊液屏障损伤的临床手段,从而降低脑缺血合并症的发生。
血脑脊液屏障主要是脑组织微血管屏障结构,以保持脑组织内环境的基本稳定,对维持中枢神经系统正常生理状态具有重要的生物学意义[13]。紧密连接蛋白为跨膜蛋白,是形成内皮细胞间屏障的主要结构蛋白,包括claudins等。这些蛋白与内皮细胞骨架蛋白相连接,与内皮细胞共同形成完整的屏障结构,阻碍水溶性分子及离子通过血脑脊液屏障[14-15]。如果这些蛋白水平下降、分布或功能异常将导致血脑脊液屏障通透性增高。而基质金属蛋白酶作为脑组织内重要的蛋白水解酶,可以直接降解紧密连接及血管基底膜、细胞基质等,破坏血脑脊液屏障结构、增加通透性[16-17]。
HSYA是传统活血化瘀中药红花的主要有效成分之一,可以有效减轻心脏缺血性损伤,在我国已经广泛用于心血管病的临床治疗(国药准字Z20050146)。近来国内外研究[4]显示,HSYA可以有效降低血栓形成、血小板聚集;降低急性缺血再灌注大鼠脑梗死体积,改善行为学评分[3]。HSYA还可以增加脑组织SOD活性和降低脂质过氧化,降低脑组织线粒体ROS水平,从而减轻脑组织氧化损伤[2,18]。研究[2]表明,HSYA可以减轻大鼠脑缺血引起的血脑脊液屏障通透性增加,如减少染料Evan’s blue的漏出等。但是,HSYA减轻血脑脊液屏障通透性的机制还不清楚。
研究[19-20]显示,脑缺血时MMPs活性与血脑脊液屏障通透性的时程变化密切相关。脑缺血1 h,血脑脊液屏障通透性就开始增加,在1~2 d后会出现更严重的二次开放,而动物实验[21-22]显示,脑缺血2~4 h,MMP-9前体表达及酶活性即明显增高,在24 h达高峰并持续5 d。应用MMP-9特异性抑制剂或MMP-9基因敲除动物,在一定程度上对缺血损伤的耐受能力增加,血脑脊液屏障的损伤程度也有所减轻。
本研究利用大鼠缺血1.5 h再灌注72 h模型,发现HSYA处理可以减少半影区MMP-9蛋白水平,增加claudin-5的蛋白水平,提示HSYA有可能通过降低半影区MMP-9蛋白水平,并减少MMP-9对其底物claudin-5的降解。在缺血半影区内,由于侧支循环存在,仍可获得部分血液供给,神经细胞功能虽受损但短期内尚存活,处于可逆状态,如在有效时间内及时恢复血液供应,则脑代谢障碍得以恢复,神经细胞以及血管内皮细胞可以存活并可恢复功能[9]。本实验中HSYA治疗方案可能有助于减轻半影区血脑脊液屏障损伤。
但是,本研究显示,HSYA对缺血核心区MMP-9和claudin-5的影响与半影区的影响有所不同,即HSYA并不显著改变缺血核心区MMP-9和claudin-5蛋白水平。笔者推测,这可能是由于缺血中心区脑血流量严重不足或完全缺血,导致中心区神经细胞或血管内皮细胞严重损伤,不可逆转地进入死亡程序。因此,即便给予干预措施,也不会产生如同半影区组织那样的保护效果。
总之,本研究用大脑中动脉阻塞模型证明,活血化瘀中药HSYA可能通过减少半影区MMP-9蛋白水平,提高claudin-5的水平,从而减少半影区血脑脊液屏障损伤,为深入的研究HSYA的血脑脊液屏障保护作用机制提供了参考。
[1]Nie P H,Zhang L,Zhang W H,et al.The effects of hydroxysafflor yellow A on blood pressure and cardiac function[J].J.Ethnopharmacol,2012,139(3):746-750.
[2]Sun L,Yang L,Xu Y W,et al.Neuroprotection of hydroxysafflor yellow A in the transient focal ischemia:inhibition ofprotein oxidation/nitration,12/15-lipoxygenase and blood-brain barrier disruption[J].Brain Res,2012,1473:227-235.
[3]Zhu H B,Wang Z H,Tian J W,et al.Protective effect of hydroxysafflor yellow A on experimental cerebral ischemia in rats[J].YaoXueXueBao,2005,40(12):1144-1146.
[4]Zang B X,Jin M,Si N,et al.Antagonistic effect of hydroxysafflor yellow A on the platelet activating factor receptor[J].YaoXueXueBao,2002,37(9):696-699.
[5]Liu Y N,Zhou Z M,Chen P.Evidence that hydroxysafflor yellow A protects the heart against ischaemia-reperfusion injury by inhibiting mitochondrial permeability transition pore opening[J].Clin Exp Pharmacol Physiol,2008,35(2):211-216.
[6]He H,Yang X,Shi M,et al.Protective effects of hydroxysafflor yellow A on acute and chronic congestive cardiac failure mediated by reducing ET-1,NOS and oxidative stress in rats[J].J Pharm Pharmacol,2008,60(1):115-123.
[7]Liu K J,Rosenberg G A.Matrix metalloproteinases and free radicals in cerebral ischemia[J].Free Radic Biol Med,2005,39(1):71-80.
[8]Qi Z F,Luo Y M,Liu X R,et al.AKT/GSK3beta-dependent autophagy contributes to the neuroprotection of limb remote ischemic postconditioning in the transient cerebral Ischemic rat model[J].CNS Neurosci Ther,2012,28:965-973.
[9]Fisher M,Bastan B.Identifying and utilizing the ischemic penumbra[J].Neurology,2012,79(13 suppl):S79-S85.
[10]Liu S,Shi H,Liu W,et al.Interstitial pO2 in ischemic penumbra and core are differentially affected following transient focal cerebral ischemia in rats[J].J Cereb Blood Flow Metab,2004,24(3):343-349.
[11]Aronowski J,Zhao X.Molecular pathophysiology of cerebral hemorrhage:secondary brain injury[J].Stroke,2011,42(6):1781-1786.
[12]Eltzschig H K,Eckle T.Ischemia and reperfusion-from mechanism to translation[J].Nat Med,2011,17(11):1391-1401.
[13]Shah K,Abbruscato T.The Role of Blood-brain barrier transporters in pathophysiology and pharmacotherapy of stroke[J].Curr Pharm Des,2013,Jun 19.[Epub ahead of print].
[14]Hawkins B T,Davis T P.The blood-brain barrier/neurovascular unit in health and disease[J].Pharmacol Rev,2005,57(2):173-185.
[15]Yang Y,Rosenberg G A.MMP-mediated disruption of claudin-5 in the blood-brain barrier of rat brain after cerebral ischemia[J].Methods Mol Biol,2011,762:333-345.
[16]Hernandez-Guillamon M,Martinez-Saez E,Delgado P,et al.MMP-2/MMP-9 plasma level and brain expression in cerebral amyloid angiopathy-associated hemorrhagic stroke[J].Brain Pathol,2011,22(2):133-141.
[17]Ramos-Fernandez M,Bellolio M F,Stead L G.Matrix metalloproteinase-9 as a marker for acute ischemic stroke:a systematic review[J].J Stroke Cerebrovasc Dis,2011,20(1):47-54.
[18]Tian J,Li G,Liu Z,et al.Hydroxysafflor yellow A inhibits rat brain mitochondrial permeability transition pores by a free radical scavenging action[J].Pharmacology,2008,82(2):121-126.
[19]Rosenberg G A,Estrada E Y,Dencoff J E.Matrix metalloproteinases and TIMPs are associated with blood-brain barrier opening after reperfusion in rat brain[J].Stroke,1998,29(10):2189-2195.
[20]Lakhan S E,Kirchgessner A,Tepper D,et al.Matrix metalloproteinases and blood-brain barrier disruption in acute ischemic stroke[J].Front Neurol,2013,4:32.
[21]Asahi M,Wang X,Mori T,et al.Effects of matrix metalloproteinase-9 gene knock-out on the proteolysis of bloodbrain barrier and white matter components after cerebral ischemia[J].J Neurosci,2001,21(19):7724-7732.
[22]Svedin P,Hagberg H,Savman K,et al.Matrix metalloproteinase-9 gene knock-out protects the immature brain after cerebral hypoxia-ischemia[J].J Neurosci,2007,27(7):1511-1518.

