老黑谷米中多酚化合物的提取及体外抗氧化活性研究
陆 洋,杨士花,黄佳琦,陶 亮,初雅洁,黄勇桦,李华君,李永强
(1 云南省高原特色农业产业研究院,昆明 650201;2云南农业大学外语学院,昆明 650201;3云南农业大学食品科学技术学院,昆明 650201;4云南农业大学植物保护学院,昆明 650201)
老黑谷米中多酚化合物的提取及体外抗氧化活性研究
陆洋1,杨士花2,黄佳琦3,陶亮4,初雅洁3,黄勇桦3,李华君3,李永强3
(1云南省高原特色农业产业研究院,昆明650201;2云南农业大学外语学院,昆明650201;3云南农业大学食品科学技术学院,昆明650201;4云南农业大学植物保护学院,昆明650201)
以老黑谷米面粉为原料,提取分离其中的可溶性多酚、游离多酚、酯化多酚、醚化多酚、键合多酚,利用比色法进行多酚和类黄酮含量测定,并采用DPPH自由基清除能力、铁离子还原/抗氧化能力测定(FRAP)、总抗氧化能力测定(TEAC)、还原能力测定(RP)和H2O2清除活性等5种不同的体外抗氧化测定体系进行抗氧化活性测定。结果表明:5种多酚中,可溶性多酚含量最高,酯化多酚含量次之,显著高于游离多酚、醚化多酚、键合多酚。多酚中类黄酮含量最高为键和多酚和可溶性多酚,显著高于其他3种多酚。5种多酚均有较高的体外抗氧化能力,键合多酚的DPPH自由基清除能力最高,可溶性多酚的H2O2清除能力、FRAP还原能力、RP还原能力和TEAC总抗氧化能力最高。本研究为老黑谷米的开发利用提供科学依据。
老黑谷米;多酚;提取;抗氧化活性
自由基在生命系统中天然存在,以活性氧的形式产生,大量的自由基能够氧化生物大分子,导致组织损伤,细胞死亡或退化,引发各种疾病[1]。多酚化合物作为膳食中最丰富的一类抗氧化物质,能够清除体内自由基[1,2]。20世纪90年代以来,流行病学研究表明,食物中摄入的多酚化合物能够促进人体健康,预防各种高发的慢性疾病[3]。酚类物质在高等植物组织中广泛存在,水果、蔬菜和谷物中均含有丰富的多酚化合物[4-8]。谷物中95%的多酚和细胞壁多糖紧密结合,研究者提出了“膳食纤维抗氧化剂”和“膳食纤维-多酚复合物”的概念,认为谷物膳食纤维是体内传送多酚化合物的天然功能成分[9-11]。
老黑谷米是云南省迪庆藏族自治州维西傈僳族自治县攀天阁特有的水稻品种,有近750多年的种植历史,是高原地区唯一能完全成熟的谷类物种。老黑谷米米壳呈黑,米粒润红饱满,煮熟后饭粒为红色,当地人认为吃了老黑谷米能够补足精气、强健体魄,具有较高的开发价值。目前,关于老黑谷米中多酚化合物的相关研究未见报道。本研究首次采用老黑谷米为原料,提取分离老黑谷米面粉中的可溶性多酚、游离多酚、酯化多酚、醚化多酚、键合多酚,对多酚含量、类黄酮含量进行测定,并采用5种不同的体外抗氧化测定体系进行抗氧化活性测定,为开发利用老黑谷米中多酚化合物提供科学依据,也为老黑谷米的深加工提供新的思路。
1 材料与方法
1.1材料与试剂
老黑谷米:云南省迪庆藏族自治州维西傈僳族自治县;2,2-联苯基-1-苦基肼基(DPPH)、三吡啶基三嗪(TPTZ)、六水三氯化铁(FeCl3·6H2O)、过氧化氢(H2O2)、2,2′-联氮-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)、七水硫酸亚铁(FeSO4·7H2O)、抗坏血酸:上海晶纯生化科技股份有限公司;Folin-Ciocalteu试剂、Trolox:sigam公司;阿魏酸、儿茶素:北京北纳创联生物技术研究院;无水氯化铝:山东西亚化学工业有限公司。
1.2仪器与设备
TDL-5-A离心机:上海安亭科学仪器厂;UV-1800CP紫外分光光度计:上海美谱达仪器有限公司;RE-52AA旋转蒸发仪:上海亚荣生化仪器厂;JFS-13A旋风式粉碎磨:杭州钱江仪器设备有限公司;ZWF-334多功能脱色摇床:上海智城分析仪器制造有限公司。
1.3方法
1.3.1老黑谷米中多酚化合物的提取[5,10]
(1)可溶性多酚的提取老黑谷米磨粉后过50目筛,脱脂后,准确称取1.5g,用70%丙酮避光振摇提取,料液比为1∶20,提取2h后,4 000g离心10min,提取3次,合并上清,30℃真空浓缩蒸干,用甲醇定容至25mL,得到可溶性多酚,4℃储存备用。
(2)游离多酚的提取可溶性多酚调节pH为2后,用乙醚萃取3次,合并有机相,于30℃真空浓缩蒸干,用甲醇定容至25mL,得到游离多酚,4℃储存备用。
(3)酯化多酚的提取游离多酚水相用2mol/L NaOH室温下水解4h,调节pH为2后,4 000g离心10min,上清用乙醚与乙酸乙酯(V∶V=1∶1)混合溶剂萃取3次,合并有机相,于30℃真空浓缩蒸干,用甲醇定容至25 mL,得到酯化多酚,4℃储存备用。
(4)醚化多酚的提取酯化多酚水相加入1mol/L HCl 20mL,90℃水浴45min,用乙醚萃取3次,合并有机相,于30℃真空浓缩蒸干,用甲醇定容至25mL,得到醚化多酚,4℃储存备用。
(5)键合多酚的提取提取可溶性多酚后得到的残渣加入4mol/L NaOH 40mL,室温下水解4h后,调节pH为2,4 000g离心10min,上清用乙醚与乙酸乙酯(V∶V=1∶1)混合溶剂萃取3次,合并有机相,于30℃真空浓缩蒸干,用甲醇定容至25mL,得到键合多酚,4℃储存备用。
1.3.2多酚化合物含量测定多酚含量采用Folin-Ciocalteau法进行测定[12],具体步骤如下:吸取多酚粗提液0.5mL,加入0.5mL Folin-Ciocalteau试剂,充分振摇,加入1mL饱和碳酸钠溶液,加蒸馏水使总体积至10mL,充分混匀,室温下避光反应35min,4 000g离心10min,在725nm波长处测定吸光度,用甲醇代替多酚粗提液作为空白。以阿魏酸为标准品,建立回归方程为:
y=0.006 6x-0.003 0(7.92-55.44μg /mL,R2=0.998 8)
(1)
(1)式中,y为吸光度、x为阿魏酸浓度(μg/mL),多酚含量以每g干燥面粉样品中阿魏酸当量(μg)表示。1.3.3类黄酮含量测定[2,5]采用AlCl3比色法进行测定,具体步骤为:吸取2mL多酚粗体液,依次加入4mL蒸馏水、0.3mL 5%亚硝酸钠溶液,室温下反应5min后;加入0.3mL 10%氯化铝溶液充分混合,室温下反应1min;再加入2mL 1mol/L NaOH溶液,并加蒸馏水至反应体系总体积为10mL,室温下反应15min;4 000g离心10min,上清于510nm处测定吸光度,用甲醇替代多酚溶液作为空白。用儿茶素制作标准曲线,建立回归方程为:
y=0.0027x-0.0114(7.92-55.44μg/mL,R2=0.999 8)
(2)
(2)式中,y为吸光度、x为儿茶素浓度(μg/mL),类黄酮含量以每g干燥样品中儿茶素当量(μg)表示。
1.3.4抗氧化能力测定
(1)DPPH自由基清除能力测定[13,14,17]:分别吸取0.5mL多酚粗提液,添加2mL 0.19mmol/L DPPH溶液,充分振摇后,室温下暗处放置10min,然后在517nm比色测定,用甲醇替代多酚溶液作为空白。用阿魏酸绘制标准曲线,建立回归方程为:
y=0.940 6x+28.698(23.2-139.2μg/mL,R2=0.969)
(3)
DPPH自由基清除能力(%)=[(A0-A1)/A0]×100
(4)
(4)式中,A0为空白吸光度、A1为样品吸光度。
(2)铁离子还原/抗氧化能力测定(FRAP)[14,18,19]FRAP溶液的配制:乙酸溶液(300mmol/L,pH为3.6)、六水三氯化铁(20mmol/L)和三吡啶基三嗪(10mmol/L)以10∶1∶1(V∶V∶V)充分混匀。
吸取100μL多酚粗提液加入3mLFRAP溶液充分混合,于37℃反应4min,在593nm测定吸光度,用甲醇替代多酚溶液作为空白。用硫酸亚铁绘制标准曲线,建立回归方程为:
y=6.24x+0.000 5(0.2-1.2mmol/L,R2=0.998 4)
(5)
(5)式中,y为吸光度、x为硫酸亚铁浓度(mmol/L),还原能力表示为每mL多酚粗提液中Fe2+当量(mmol)。
(3)总抗氧化能力测定(TEAC)[13-16]:ABTS·+工作液的配制:将ABTS(7mmol/L)和过硫酸钾(2.45mmol/L)两种溶液等体积混合,于4℃下反应16h,得到ABTS·+工作液。
吸取100μL多酚粗提液,加入3.8mLABTS·+工作液,室温下反应6min,于734nm测定吸光度,用甲醇替代多酚溶液作为空白。用Trolox绘制标准曲线,建立回归方程为:
2.在浦东开发区内,进口必要的建设用机器设备、车辆、建材,免征关税和工商统一税。区内的“三资”企业进口生产用的设备、原辅材料、运输车辆、自用办公用品及外商安家用品、交通工具,免征关税和工商统一税;凡符合国家规定的产品出口,免征出口关税和工商统一税。
y=5.382 7x+3.3472(7.488-37.44μg/mL,R2=0.999 7)
(6)
(6)式中,y为ABTS·+自由基清除能力、x为Trolox浓度(μg/mL),自由基清除能力表示为每g干燥样品中Trolox当量(μg)。
ABTS·+自由基清除能力(%)=[(A0-A1)/A0]×100
(7)
(7)式中,A0为空白吸光度、A1为样品吸光度。
(4)还原能力测定(RP)[5]:吸取1mL多酚粗提液,加入2.5mL磷酸盐缓冲溶液(0.2mol/L,pH6.6),加入2.5mL1%铁氰化钾溶液,充分混匀后于50℃水浴反应20min;再加入2.5mL10%TCA溶液,4 000g离心10min;吸取上清1mL,加入2.5mL蒸馏水和0.5mL0.1%FeCl3溶液,于700nm测定吸光度,用甲醇替代多酚溶液作为空白。用抗坏血酸(维生素C)绘制标准曲线,建立回归方程为:
y=0.045 5x-0.115(80-180μg/mL,R2=0.9916)(8)
(8)式中,y为吸光度、x为维生素C浓度(μg/mL)。还原能力表示为每g干燥样品中维生素C当量(μg)。
(5)H2O2清除活性测定[1,17]吸取0.6mL多酚粗提液,加入0.9mLH2O2(40mmol/L),加入磷酸钠缓冲溶液(45mmol/L,pH7.4),30℃反应40min,于230nm测定吸光度,用甲醇替代多酚溶液作为空白。用阿魏酸绘制标准曲线,建立回归方程为:y=0.657 1x-11.119(55-275μg/mL,R2=0.994 3)(9)
(9)式中,y为H2O2清除能力、x为阿魏酸浓度(μg/mL),自由基清除能力表示为每g干燥样品中阿魏酸当量(μg)。
H2O2清除活性(%)=[(A0-A1)/A0]×100(10)
(10)式中,A0为空白吸光度、A1为样品吸光度。
2 结果与分析
2.1多酚化合物与类黄酮含量测定
由老黑谷米面粉中各类多酚和类黄酮含量测定结果见可知,老黑谷米面粉中可溶性多酚含量最高,为7 876.72±195.82μg/g,显著高于其他各类多酚;酯化多酚含量为1 278.32±349.17μg/g;可溶性多酚和酯化多酚含量显著高于游离多酚、醚化多酚、键合多酚;游离多酚、醚化多酚、键合多酚含量差异不显著。5种多酚的类黄酮含量最高为键和多酚和可溶性多酚,分别为829.99±42.16、800.13±110.18μg/g,显著高于其他3种多酚;醚化多酚类黄酮含量最低,为62.82±14.77μg/g,显著低于其他4种多酚(表1)。

表1 老黑谷米面粉中各类多酚和类黄酮含量(μg/g面粉)
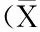
2.2多酚抗氧化能力测定
各类多酚5种体外抗氧化能力测定结果见表2。
2.2.1DPPH清除能力测定DPPH·是人工合成的能稳定存在的自由基,其乙醇溶液呈深紫色,在可见光区517nm处被吸收。当多酚加入DPPH溶液中时,溶液褪色,多酚含量与褪色程度呈正相关。由表2可知,键合多酚对DPPH自由基的清除能力最强,显著高于其他多酚,游离多酚和酯化多酚清除能力次之,醚化多酚和可溶性多酚的清除能力显著低于其他多酚。

表2 不同多酚的抗氧化能力测定(以每g面粉计)

2.2.2铁离子还原/抗氧化能力测定(FRAP)多酚将Fe3+还原为Fe2+,Fe2+与TPTZ结合生成蓝色络合物,在波长593nm处有最大吸收。吸光度越大,表明还原/抗氧化能力越强。由表2可知,可溶性多酚的还原/抗氧化能力显著高于其他多酚,Fe2+浓度当量为54.70±1.17mmol/L;醚化多酚还原/抗氧化能力次之,Fe2+浓度当量为11.35±0.59mmol/L;游离酚酸、醚化多酚、键合多酚还原/抗氧化能力最弱,Fe2+浓度当量分别为5.25±0.08、4.05±0.10、3.97±0.12mmol/L。
2.2.3还原能力测定(RP)由表2可知,5种多酚多酚还原能力为可溶性多酚>醚化多酚>游离多酚>酯化多酚>键合多酚,其中各种多酚维生素C当量分别为453.77±10.27、178.00±11.92、75.02±1.68、72.63±4.05、54.14±0.25μg/g,可溶性多酚和醚化多酚的还原能力显著高于其他3种多酚。
2.2.4H2O2清除能力测定由表2可知,可溶性多酚对H2O2清除能力显著高于其他多酚,阿魏酸当量为389 196.83±8 430.32μg;酯化多酚清除能力次之,阿魏酸当量为196 840.57±98 354.23μg;键合多酚和醚化多酚的清除能力最低,阿魏酸当量分别为55 617.11±6 344.29、51 045.31±8 979.84μg。
2.2.5总抗氧化能力测定(TEAC)ABTS·+为稳定的有机自由基,多酚抗氧化能力越强,其提供电子的能力也就越强,与该有机自由基反应量越大,反应速率也越快,通过测定反应液吸光度的变化,直接反应出样品抗氧化能力的大小。由表2可知,可溶性多酚总抗氧化能力最高,相当于505 287.97±80 123.49μgTrolox,显著高于其他4种多酚;其他4种多酚之间总抗氧化能力差异不显著。
3 结论
5种多酚中,可溶性多酚含量最高,酯化多酚含量次之,两者含量显著高于游离多酚、醚化多酚、键合多酚;多酚中类黄酮含量最高为键和多酚和可溶性多酚,显著高于其他3种多酚。5种多酚均有较高的体外抗氧化能力,键和多酚的DPPH自由基清除能力最高,可溶性多酚的H2O2清除能力、FRAP还原能力、RP还原能力和TEAC总抗氧化能力最高。◇
[1]ChandrasekaraA,ShahidiF.Inhibitoryactivitiesofsolubleandboundmilletseedphenolicsonfreeradicalsandreactiveoxygenspecies[J].J.Agric.FoodChem,2011,59:428-436.
[2]ChandrasekaraA,ShahidiF.Bioaccessibilityandantioxidantpotentialofmilletgrainphenolicsasaffectedbysimulatedinvitrodigestionandmicrobialfermentation[J].JournalofFunctionalFoods,2012,4:226-237.
[3]VisioliF,DeLaLastraCA,Andres-LacuevaC.Polyphenolsandhumanhealth:aprospectus[J].CriticalReviewsinFoodScienceandNutrition,2011,51:524-546.
[4]ChandrasekaraA,ShahidiF.DeterminationofantioxidantactivityinfreeandhydrolyzedfractionsofmilletgrainsandcharacterizationoftheirphenolicprofilesbyHPLC-DAD-ESI-MSn[J].JournalofFunctionalFoods,2011,3:144-158.
[5]ChandrasekaraA,ShahidiF.Contentofinsolubleboundphenolicsinmilletsandtheircontributiontoantioxidantcapacity[J].J.Agric.FoodChem.,2010,58:6706-6714.
[6]DengG.F.,etal.Determinationofantioxidantpropertyandtheirlipophilicandhydrophilicphenoliccontentsincerealgrains[J].JournalofFunctionalFoods,2012,4:906-914.
[7]ChamorroS,etal.Changesinpolyphenolandpolysaccharidecontentofgrapeseedextractandgrapepomaceafterenzymatictreatment[J].FoodChemistry,2012,133:308-314.
[8]AjilaCM,PrasadaRaoUJS.Mangopeeldietaryfibre:Compositionandassociatedboundphenolics[J].JournalofFunctionalFoods,2013,5:444-450.
[9]VitaglioneP,etal.Cerealdietaryfibre:anaturalfunctionalingredienttodeliverphenoliccompoundsintothegut[J].TrendsinFoodScience&Technology,2008,19:451-463.
[10]GuoWeiwei,BetaTrustPhenolicacidcompositionandantioxidantpotentialofinsolubleandsolubledietaryfibreextractsderivedfromselectwhole-graincereals[J].FoodResearchInternational,2013,51:518-525.
[11]ChandrasekaraA,ShahidiF.ContentofinsolubleantiproliferativepotentialandDNAscissioninhibitoryactivityofphenolicsfromwholemilletgrains[J].JournalofFunctionalFoods,2011,3:159-170.
[12]Singleton,CP,Rossi,JA.Colorimetryoftotalphenolicswithphosphomolybdic-phosphotungsticacidreagents[J].JournalofEnologyandViticulture,1965,16:144-158.
[13]MaldonadoPD,etal.Antioxidantactivityofa-typeproanthocyanidinsfromgeraniumniveum(geraniaceae)[J].J.Agric.FoodChem,2005,53:1996-2001.
[14]AkT,GulcinI.Antioxidantandradicalscavengingpropertiesofcurcumin[J].Chemico-BiologicalInteractions,2008,174:27-37.
[15]KimDO,JeongSW,etal.Antioxidantcapacityofphenolicphytochemicalsfromvariouscultivarsofplums[J].FoodChemistry,2003,81:321-326.
[16]Navarro-GonzálezI,etal.Chemicalprofile,functionalandantioxidantpropertiesoftomatopeelfiber[J].FoodResearchInternational,2011,44:1528-1535.
[17]ChandrasekaraA,NaczkM,ShahidiF.Effectofprocessingontheantioxidantactivityofmilletgrains[J].FoodChemistry,2012,133:1-9.
[18]FiruziaO,LacannaaA,PetruccibR,etal.Evaluationoftheantioxidantactivityofflavonoidsby“ferricreducingantioxidantpower”assayandcyclicvoltammetry[J].BiochimicaetBiophysicaActa,2005,1721:174-184.
[19]BenzieIFF,etal.Theferricreducingabilityofplasma(FRAP)asameasureof“antioxidantpower”:TheFRAPassay[J].AnalyticalBiochemistry,1996,239:70-76.
(责任编辑李燕妮)
Extraction of Polyphenols from Old Black Rice and Its Antioxidant Activity in Vitro
LU Yang1,YANG Shi-hua2,HUANG Jia-qi3,TAO Liang4,CHU Ya-jie3,HUANG Yong-hua3,LI Hua-jun3,LI Yong-qiang3(1Yunnan Plateau Characteristic Agricultural Industry Research Institute,Kunming 650201, China;2College of Foreign Languages,Yunnan Agricultural University,Kunming 650201, China;3College of Food Science and Technology,Yunnan Agricultural University,Kunming 650201, China;4College of Plant Protection,Yunnan Agricultural University,Kunming 650201, China)
Soluble,free,esterified,etherified,insolubleboundpolyphenolswereextractedfromoldblackriceandthecontentofphenoliccompoundsandflavonoidsweredeterminedusingcolorimetry.Antioxidantactivitiesofphenolicfractionswereestimatedusing2,2-diphenyl-1-picrylhydrazyl(DPPH)radicalscavengingactivity,ferricreducingantioxidantpower(FRAP),troloxequivalentantioxidantcapacity(TEAC),reducingpower(RP)andhydrogenperoxide(H2O2)scavengingactivityin vitro.Resultsshowedthatsolublepolyphenolhadthehighestcontent,esterifiedpolyphenolhadthesecondcontent,thetwofractionsweresignificantlyhigherthanothers.Boundpolyphenolandsolublepolyphenolhadthehighestflavonoidcontent,whereastheotherthreefractionspossessedthelower.Allpolyphenolsshowedhighantioxidantactivities.BoundpolyphenolhadhighestDPPHradicalscavengingactivity,solublepolyphenolhadthehighestferricreducingantioxidantpower(FRAP),troloxequivalentantioxidantcapacity(TEAC),reducingpower(RP)andhydrogenperoxide(H2O2)scavengingactivity.Theseresearchresultscouldbeusedasthebaseforfurtherresearchanddevelopmentofoldblackrice.
oldblackrice;polyphenols;extraction;antioxidantactivity
国家自然科学基金项目(项目编号:31360378);云南省自然科学基金项目(项目编号:2013FB042);云南省教育厅项目(云南省高校食品加工与安全控制重点实验室);国家大学生创新创业训练计划项目(项目编号:201510676001)。
陆洋(1984—),女,硕士,研究方向:功能食品。
李永强(1975—),男,博士,副教授,研究方向:功能食品与天然产物化学。

