复荣通脉胶囊对糖尿病大鼠视网膜白细胞介素-1β及肿瘤坏死因子-α水平的影响
王立新 王元松 田风胜 边 云 崔荣岗 贾彩霞 王庆凯
复荣通脉胶囊对糖尿病大鼠视网膜白细胞介素-1β及肿瘤坏死因子-α水平的影响
王立新王元松田风胜*边云崔荣岗贾彩霞王庆凯
目的:观察复荣通脉胶囊对糖尿病(DM)大鼠视网膜白细胞介素-1β(IL-1β)及肿瘤坏死因子-α(TNF-α)水平的影响。方法:60只Wistar大鼠随机留取10只作为正常对照组;另外50只经一次性腹腔注射1%链脲佐菌素(STZ)制备DM模型;40只成模大鼠随机分为DM模型组、复荣通脉低剂量组、复荣通脉中剂量组、复荣通脉高剂量组,每组10只。复荣通脉低、中、高剂量组分别给予0.7g、1.4g、2.8g/kg体重复荣通脉胶囊灌胃,其余两组给予等量纯净水灌胃,每日1次,连续8周。腹主动脉采血测定各组大鼠血糖(BG)及总胆固醇(TC)和甘油三酯(TG)水平,之后处死大鼠,摘取视网膜行组织病理切片及SP法免疫组化染色,观察各组IL-1β及TNF-α的水平。结果:与正常对照组比较,DM模型组BG明显升高(P<0.01),复荣通脉各剂量组BG、TC、TG水平与DM模型组差异均无统计学意义(P>0.05),DM模型组IL-1β和TNF-α水平较正常对照组明显增加(P<0.05),复荣通脉低剂量组IL-1β和TNF-α水平明显低于DM模型组(P<0.05),复荣通脉中、高剂量组较低剂量组明显降低(P<0.05),复荣通脉中、高剂量组间差异无统计学意义(P>0.05)。结论:复荣通脉胶囊可能通过降低炎性因子水平发挥抗炎和保护视网膜作用。
复荣通脉胶囊;糖尿病;视网膜;白细胞介素-1β;肿瘤坏死因子-α;大鼠
糖尿病视网膜病变(DR)是糖尿病(DM)常见慢性并发症之一,是DM患者失明的主要原因。寻找更有效治疗DR的药物(包括中成药)成为临床重要课题。我们前期采用复荣通脉胶囊治疗并发大血管病变及周围神经病变DM患者及DM动物均有很好疗效,同时在临床观察中发现,复荣通脉胶囊对DR也具有一定的治疗作用。因此,本文通过复制DM大鼠模型,观察复荣通脉胶囊对其血糖(BG)、胆固醇(TC)、甘油三酯(TG)和其视网膜炎性指标白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)水平的影响,初步探讨复荣通脉胶囊对DR的治疗作用及机制。
1 材料与方法
1.1实验动物、主要药物、试剂和仪器
1.1.1动物:清洁级健康成年雄性Wistar大鼠(体重 200±30g)60 只,由河北医科大学实验动物中心提供[合格证号:1405034,许可证号:SCXK(冀)2013-1-003]。
1.1.2主要药物和试剂:复荣通脉胶囊主要由水蛭、地龙、全蝎、黄芪、当归、玄参、葛根、穿山龙、首乌藤、川牛膝、甘草等组成,由本院中药制剂室监制生产(批准文号:冀药制字Z20070041,生产批号:140310),每粒0.5g,含生药2g,实验时加入蒸馏水制成混悬液灌胃。链脲佐菌素(STZ)粉剂和柠檬酸钠溶液购自美国Sigma公司(货号:STZ S0130);IL-1β及TNF-α免疫组化检测试剂由石家庄市淼森科技有限公司提供(批号:IL-1β Bs3506、TNF-α Bs1857);TC、TG检测试剂购自日本和光WAKO(批号:Ep334、Ep332)。
1.1.3主要仪器:德国罗氏血糖仪(罗康全活力型);日本日立7600-010型全自动生化分析仪;日本奥林巴斯BX51T-PHD-J11型光学显微镜及照相装置;病理组织漂烘处理仪(常州郝思琳,TEC2500);江苏太仓医用仪器厂DSHZ-300型恒温水浴箱;美国Media Cybernetics 公司多功能真彩色细胞图像分析系统。
1.2实验方法
1.2.1DM模型的建立:实验大鼠适应性喂养1周后,按照完全随机原则进行分组,正常对照组10只,造模组50只。造模组大鼠禁食12h后按文献[1,2]方法略作改进,一次性腹腔注射STZ 60mg/kg(临用前取STZ粉剂溶于0.1mmol/L、pH=4.2无菌柠檬酸钠溶液中);正常对照组腹腔注射等量柠檬酸钠溶液。72h后尾静脉取血测BG,其测值≥16.7mmol/L为DM大鼠造模成功[2]。本次造模有3只大鼠GB未达诊断标准,3只死亡,最后成模44只。1周后进入实验。
1.2.2分组与给药:44只成模大鼠按随机数字表法抽取40只分为DM模型组及复荣通脉低剂量组、中剂量组和高剂量组,每组各10只。另4只用作其它实验。参考文献[3]方法,按人体-大鼠体表面积比值表换算实验大鼠应用复荣通脉胶囊等效剂量,即低剂量组0.7g/kg体重、中剂量组1.4g/kg体重、高剂量组2.8g/kg体重,每天新鲜配制复荣通脉溶液,每天灌胃一次,灌胃容量10ml/kg,连续8周。DM模型组和正常对照组每日以同等剂量纯净水灌胃。实验期间大鼠自由进食、饮水,喂标准大鼠饲料,每天更换垫料,清理实验室。实验期间均未使用胰岛素和其它降糖药物。
1.2.3BG和血脂测定:连续灌胃8周后,各组大鼠隔夜禁食12h后称重,以3%戊巴比妥钠溶液(80mg/kg)腹腔注射麻醉,取尾尖血测BG后,迅速开腹分离腹主动脉,从腹主动脉采血,分离血清,按常规方法检测TC和TG浓度。
1.2.4视网膜炎性因子测定:关腹后,迅速摘取各组大鼠一侧眼球,于4%多聚甲醛溶液中固定48h以上,流水轻轻冲洗5min,于睫状体后部经锯齿缘环形剪开巩膜,去除眼前部分,将后眼杯以视乳头为中心桔瓣样切成3块,轻轻分离视网膜,用PBS(0.01mol/L,pH7.4)漂洗10min,甘氨酸缓冲液(0.15mol/L pH7.4)隔夜浸泡;再用3%胰蛋白酶37℃水浴孵化箱孵化2h后移入蒸馏水中震荡漂洗至仅剩一层透明视网膜血管网;将其平铺于载玻片上,置于37℃展片器5min,再置室温自然干燥。严格按照IL-1β及TNF-α说明书进行免疫组化SP染色。结果判断:显微镜下视细胞胞浆或胞核中出现棕色颗粒为阳性,采用彩色病理图像分析系统计算视网膜组织中IL-1β及TNF-α阳性染色面积与视窗面积的百分比进行定量分析。
1.3统计学处理
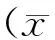
2 结 果
2.1各组大鼠存活情况
实验过程中DM模型组大鼠死亡1只(可能因注射STZ继发性腹部感染死亡),复荣通脉中剂量组死亡1只(可能因酮症酸中毒或高渗综合征死亡),复荣通脉高剂量组逃逸1只,其它组未出现死亡和逃逸。37只DM大鼠BG水平明显高于正常对照组(28.38±1.60mmol/L vs 4.86±0.20mmol/L,P<0.01)。
2.2各组大鼠BG、TC、TG水平比较
治疗8周后,各组大鼠BG、TC、TG水平差异均有统计学意义(F值分别为58.32、12.01和24.13,均P<0.01)。DM模型组BG、TC、TG水平均明显高于正常对照组(P<0.05或P<0.01);复荣通脉低、中、高剂量组与DM模型组BG、TC、TG水平差异无统计学意义(P>0.05)。见表1。
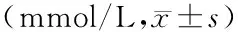
表1 复荣通脉治疗DM大鼠8周后血糖、血脂水平变化
注:与正常对照组比较,1)P<0.05,2)P<0.01
2.3各组大鼠视网膜IL-1β及TNF-α表达
正常对照组视网膜视细胞外节膜盘结构清晰,排列整齐且平行,内节椭圆体内线粒体沿周边排列,结构正常; 外核层由视细胞胞体和胞核组成,细胞排列整齐,视细胞胞浆、胞核中可见极少量棕色IL-1β和TNF-α阳性颗粒。DM模型组及复荣通脉低剂量组视网膜视细胞外节膜盘间隙明显扩大,结构模糊不清,断裂、溶解,可见空泡,外核层细胞核固缩; 内节椭圆体内线粒体水肿,排列不规则,视网膜视细胞胞浆、胞核中棕色IL-1β及TNF-α阳性面积较大。复荣通脉低剂量组棕色颗粒面积及强度低于DM模型组;复荣通脉中、高剂量组视网膜病变较复荣通脉低剂量组明显改善,视网膜视细胞胞浆、胞核中棕色颗粒面积及强度更低于DM模型组及复荣通脉低剂量组。见图1和图2。
定量分析显示,各组大鼠治疗8周后视网膜视细胞IL-1β及TNF-α水平差异有统计学意义(F=11.00及10.08,P均<0.01)。与正常对照组比较,DM模型组IL-1β及TNF-α水平明显增加(P<0.05);与DM模型组比较,复荣通脉低、中、高剂量组IL-1β及TNF-α水平均降低(P<0.05),复荣通脉中、高剂量组更低于复荣通脉低剂量组(P<0.05),但中、高剂量组间差异无统计学意义(P>0.05)。见表3。

表3 复荣通脉治疗DM大鼠8周后视细胞IL-1β及TNF-α水平
注:与正常对照组比较,1)P<0.05;与DM模型组比较,2)P<0.05;与复荣通脉低剂量组比较,3)P<0.05
[本文图1、图2见封2]
3 讨 论
DR属于DM性微血管病变,是DM慢性并发症之一,若发现和治疗不及时,最终可致盲,严重降低患者生活质量。随着T2DM患者逐年增多,DR的发病率也随之上升。因而对 DR 的防治成为临床至关重要的课题。有研究认为,炎症及免疫反应作用于 DR 始终[4],炎症反应相关细胞因子IL-1β 和 TNF-α 可能参与了 DR的发生发展过程 。
IL-1β 不仅能够调节细胞免疫,同时还作用于视网膜色素上皮细胞,促使其合成胶原,形成胶原沉积,参与增生性糖尿病视网膜病变(PDR) 的病理过程[5];IL- 1β还能促使粒细胞透过血-视网膜屏障,进入视网膜,引起炎症反应[6];IL-1β通过上调核因子-κB(NF-κB)水平,加速视网膜毛细血管内皮细胞凋亡[7]。TNF-α 具有激活单核巨噬细胞、成纤维细胞趋化作用,使视网膜间充质细胞形成胞外基质蛋白,为内皮细胞的移行提供支撑,以及引起其它微血管并发症。Gema等[8]在患者纤维组织血管壁、玻璃体和视网膜血管内皮细胞基质及胞外基质中均发现 TNF-α 表达增加;而TNF-α 拮抗剂可竞争性与其受体结合,阻断 TNF-α 效应,降低DM大鼠视网膜血管中的白细胞黏附作用;抑制 TNF-α 表达可使视网膜毛细血管周细胞、内皮细胞凋亡减少76%-80%[9]。
复荣通脉胶囊为本院自制复方中成药,以水蛭为君,地龙、全蝎为臣,佐以黄芪、当归、玄参、葛根、穿山龙、首乌藤,川牛膝及甘草为使。主要用于肢体麻凉、疼痛、感觉异常的血痹及DM周围神经和血管病变患者。其主要作用机制为传统医学的破血通络、益气养阴、安神止痛;以及现代医学的抗凝、抗血小板聚集、抗氧化、抗炎等多种途径。
本研究结果显示,DM大鼠视网膜视细胞IL-1β及TNF-α水平明显升高,表明炎症参与了DR的发生发展。低、中、高剂量复荣通脉干预能够明显抑制炎性因子IL-1β及TNF-α的表达,从而具有减轻炎症反应、保护视网膜的功效,中、高剂量组疗效更好。提示复荣通脉胶囊的作用可能有剂量依赖性,但非线性关系,因而从药物经济学角度考虑,使用中等剂量复荣通脉胶囊较好。文中复荣通脉胶囊对DM大鼠BG、TC、TG无明显影响的现象说明复荣通脉胶囊对DR的保护作用为非降糖、降脂依赖性。
综上所述,1.4g/kg体重复荣通脉胶囊可能通过下调DM大鼠视网膜组织炎性因子IL-1β及TNF-α的表达,抑制炎症,保护视网膜,该结果为临床应用该药物治疗DR提供了部分实验依据。
◀
本文第一作者简介:
王立新(1958-),男,汉族,主任医师,研究方向:中西医结合防治糖尿病合并心脏病
1张 均.现代药理实验方法学[M].北京:北京医科大学中国协和医科大学联合出版社,1998:981.
2于德民,吴锐,尹潍,等.实验性链脲佐菌素动物模型的研究[J].中国糖尿病杂志,1995,3(2):105-109.
3徐淑云,卞如濂,陈修.药理实验方法[M].北京:人民卫生出版社,2005: 202-204.
4Abu El-Asrar Am,Desmet S,Meersschaert A,et al. Expression of the inducible isoform of nitric oxide synthase in the retinas of human subjects with diabetes mellitus[J]. Am J Ophthalmol,2001,132(4):551-556.
5冯学峰,惠延年,王雨生. IL-1β 对人视网膜色素上皮细胞胶原合成的作用[J]. 第四军医大学学报,1999,20(8):656-658.
6Jung YD,Liu W,Reinmuth N,et al. Vascular endothelial growth factor is up regulated by interleukin21β in human vascular smooth muscle cells via the P38 mitogen-activated protein kinase pathway[J]. Angiogenesis,2001,4(2):155-162.
7Kowluru RA,Odenbach S. Role of interleukin21β in the pathogenesis of diabetic retinopathy[J]. Br J Ophthalmol,2004,88(10):1 343-1 347.
8Gema F,Javier GA,Fracisco JM,et al. To adiposite:a model for integration of endocrine and metabolic signaling in energy metabolism regulation[J]. Am J Physiol Endocrinol Metab,2001,280:E827-E847.
9Joussen AM,Poulaki V,Mitsiades N,et al. Nonsteroidal anti inflammatory drugs prevent early diabetic retinopathy via TNF-α supp ression[J]. The FASEB Journal,2002,16(3):438-440.
10Behl Y,Krothapalli P,Desta T,et al. Diabetes enhanced tumor necrosis factor-α production promotes apop tosis and the loss of retinal microvascular cells in type 1 and type 2 models of diabetic retinopathy[J]. Am J Pathol,2008,172(8):1 411-1 418.
Influence of FuRongTongMai Capsules on Sciatic Nerve Expression of IL-1β and TNF-α in Diabetes Mellitus Rats
WANG Li-xin,WANG Yuan-song,TIAN Feng-sheng*,BIAN Yun,CUI Rong-gang,JIA Cai-xia,WANG Qing-kai
Department of Endocrinology,Affiliated CangZhou Traditional-western Conbination Medical Hospital of Hebei Medical University,Cangzhou 061001,China;*Corresponding author
Objective:To observe the the influence of FuRongTongMai capsules on retinal capillary expression of IL-1β and TNF-α in diabetes mellitus(DM) rats.Method:10 of 60 rats were randomly divided into normal control group.Another 50 by injection of 1% STZ.After diabetes mellitus(DM) rats were made,40 of diabetes rats were randomly divided into DM group,FuRongTongMai capsules low dosage group(FRL),FuRongTongMai capsules middle dosage group(FRM),FuRongTongMai capsules high dosage group(FRH),every group has 10 rats.FRM was given the 1.4 g/(kg body weight) to fill the stomach,FRL was given 0.7 g/(kg body weight) ,FRH was given 2.8 g/(kg body weight) ,the rest of the two groups of daily to give the same dose of Purified water one time a day,eight weeks in a row.Blood glucose and blood lipid [total cholesterol (TC),triglyceride (TG)] level,executed gather the retinal tissue of rats after pathological and immunohistochemical staining SP method,and the expression of TNF-a and IL-1β were detected.Results:Compared with normal control group,model group significantly increased blood sugar,FRL,FRM,FRH groups blood sugar,TC,TG levels were significant difference in the DM group (P>0.05).The expression of IL-1β and TNF-α in DM group were significantly increased than normal group(P<0.05),which were decreased in FRL group compared with DM group(P<0.05) and FRM;FRH lower than FRI group.FRM and FRH group had no statistical significance (P>0.05).Conclusion:FuRongTongMai capsules could play a role of improving the diabetic retinopathy by reducing the inflammatory factors.
FuRongTongMai capsules;Diabetes;Retinal capillary;IL-1β;TNF-α;Rat
单位]河北省沧州中西医结合医院内分泌三科,沧州 061001;*
,E-mail:cztianfsh@sina.com
本文2016-01-26收到,2016-05-03修回
R285.5[文献标识码]A
1005-1740(2016)03-0007-04

