一种基于OmpA的分泌型原核表达载体的构建及应用*
蒋玉亮,兰 萍,李 艳,余 赟,毛明星,杨亚琼,杨 平△
1.成都医学院 生物医学系(成都 610500); 2.成都医学院 基础医学院(成都 610500)
一种基于OmpA的分泌型原核表达载体的构建及应用*
蒋玉亮1,兰萍1,李艳1,余赟2,毛明星1,杨亚琼2,杨平2△
1.成都医学院 生物医学系(成都610500); 2.成都医学院 基础医学院(成都610500)
目的构建大肠杆菌周质分泌型表达载体并验证其表达效果。方法以pUC18-lpp为基础载体,构建含有核糖体结合元件(RBS)、信号肽(OmpA)、多克隆位点(MCS)的分泌型表达载体pUC-OmpA;通过分子克隆获得含有密码子优化的人生长激素(hGH)编码序列的pUC-OmpA-hGH,转化大肠杆菌JM109菌株并验证周质分泌性质。结果经IPTG诱导后,SDS-PAGE、Western印迹分析结果显示周质空间有hGH重组表达产物,分子量约为22 kD,大小与预期一致,周质hGH约占菌体总hGH的43%。结论成功构建了基于OmpA信号肽的周质分泌型表达系统,为实现生物活性蛋白的原核表达奠定了基础。
原核表达;周质分泌;信号肽
大肠杆菌具有遗传背景清晰、成本低廉、周期短等优点,是目前生产多肽类药物的重要基因工程菌之一。但由于其缺乏完善的蛋白质翻译后修饰系统,致使胞内表达外源多肽时易形成包涵体沉淀,需经过繁琐过程才能获得生物活性多肽,增加了工艺难度和生产成本[1]。分泌性表达是简化工艺流程、降低成本和提高大肠杆菌多肽类基因工程产品活性的重要途径之一,目前已经开发了基于OmpT、CBD、DsbA等基因引导序列的分泌型原核表达系统,但因稳定性、通用性、低拷贝数等因素制约,目前在基因工程中实际应用的分泌型原核表达系统并不多见[2]。本研究在课题组前期构建的含有大肠杆菌强启动子lpp的表达载体pUC18-lpp基础上,在lpp后引入RBS核糖体结合元件、OmpA信号肽编码序列,尝试构建新的分泌型原核表达载体pUC-OmpA,并将密码子优化的人生长激素(hGH)编码序列克隆至新载体中,对pUC-OmpA的周质分泌性和分泌效果进行研究。
1 材料与方法
1.1材料
1.1.1质粒载体及菌株大肠杆菌JM109株为成都医学院科研实验中心保存,质粒pUC18-lpp由上述实验室构建保存。
1.1.2酶及主要试剂限制性核酸内切酶、T4 DNA连接酶和PrimeSTAR HS DNA polymerase购自日本TaKaRa公司;核酸、蛋白分子量标准、DNA凝胶回收试剂盒、质粒提取试剂盒均购于上海Sangon公司;兔抗人hGH多克隆抗体、山羊抗兔IgG-HRP购自Elabscience公司。
1.1.3核酸片段的合成和测序均委托上海Sangon公司完成,序列见表1。
1.2方法
1.2.1分泌型表达载体pUC-OmpA的构建设计并合成含有核糖体结合元件(RBS)、信号肽(OmpA)、多克隆位点(MCS)、His标签和终止序列的核酸片段Fragment(RBS-Terminator)。利用引物RBS-Terminator-F/RBS-Terminator-R,经PCR法扩增RBS-Terminator基因片段(热循环30次,扩增条件98 ℃变性10 s,56 ℃退火15 s,72 ℃延伸30 s)。按常规的分子生物学方法[3],经Kpn Ⅰ和Hind Ⅲ双酶切,定向克隆至pUC18-lpp,构建分泌型原核表达载体pUC-OmpA。
1.2.2分泌型重组表达载体pUC-OmpA-hGH的构建根据NCBI数据库中人生长激素序列(AAA72260.1、AAK69708.1和ADE06645.1)完成密码子优化(http://www.jcat.de/),并委托上海Sangon公司完成Fragment(hGH)的合成。利用引物hGH-F/ hGH-R,经PCR法扩增hGH基因片段(热循环30次,扩增条件98 ℃变性10 s,58 ℃退火15 s,72 ℃延伸45 s)。按常规的分子生物学方法[3],经BamHI和NheI双酶切,定向克隆至pUC-OmpA,构建重组分泌型原核表达载体pUC-OmpA-hGH。
1.2.3SDS-PAGE电泳检测重组分泌型原核表达质粒pUC-OmpA-hGH转化大肠杆菌JM109,挑单菌落于LB(Amp+)培养基中,37 ℃培养过夜;按1∶100扩种培养于LB(Amp++20%葡萄糖)培养基中,30 ℃培养过夜;再按1∶25扩种培养,菌液OD600值达0.6左右时加入IPTG诱导,30 ℃表达3 h后收获菌体。按渗透压休克法制备周质蛋白:加入20 mL Tris-HCl(pH 8.0)、1 mmol EDTA、20%蔗糖(pH 8.0)重悬菌体,冰水浴10 min,12 000 g离心收集沉淀;进一步加入5 mmol MgSO48 mL,冰水浴10 min,12 000 g离心10 min,分别收集沉淀(对照)和上清(周质蛋白),加入等量2×上样缓冲液混合后沸水煮5 min,进行12%的SDS-PAGE电泳分析。
1.2.4Western印迹分析诱导表达产物经SDS-PAGE分离后,转移到硝酸纤维膜上,封闭后按常规方法进行检测[3]。
2 结果
2.1分泌型表达载体pUC-OmpA的构建
以pUC18-lpp为基础载体,构建了含有核糖体结合元件(RBS)、信号肽(OmpA)、多克隆位点(MCS)的分泌型表达载体pUC-OmpA(图1),测序结果与预期一致。
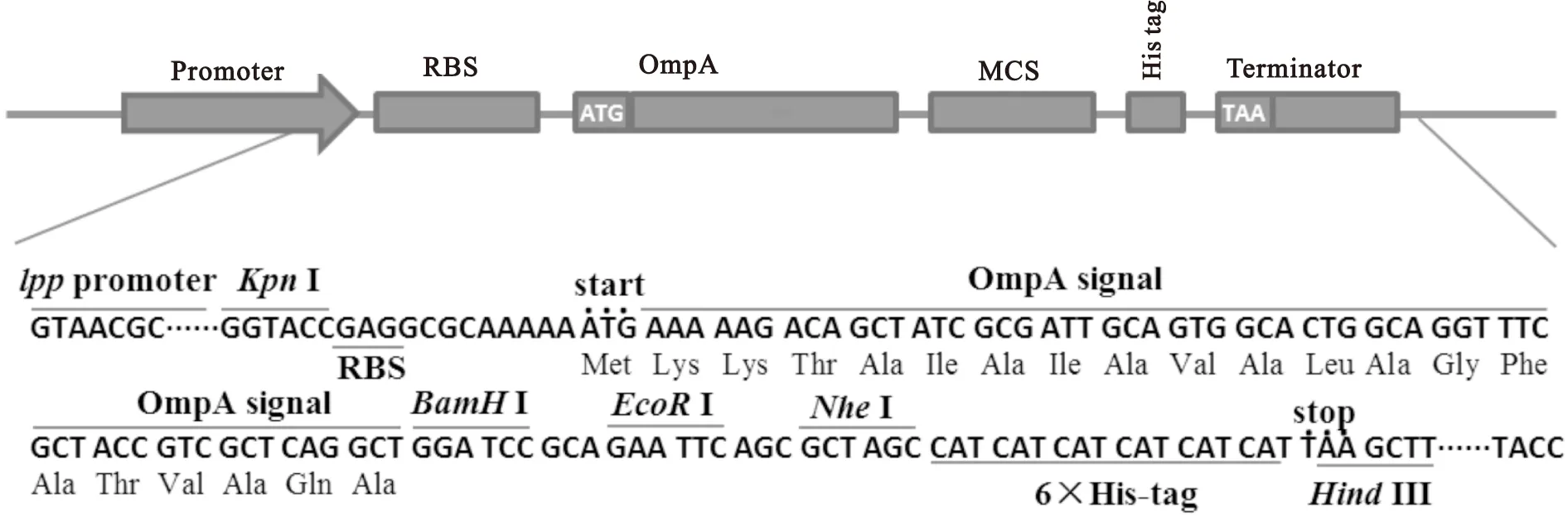
图1pUC-OmpA表达载体的克隆表达区
2.2SDS-PAGE分析
1pUC-OmpA-hGH/JM109经IPTG诱导后,大肠杆菌胞内和周质空间均检测到hGH(22 kD)表达产物,大小与预期一致;电泳结果用BandScan软件进行扫描分析,周质空间分泌性表达的hGH约占菌体hGH总蛋白的43%(图2)。
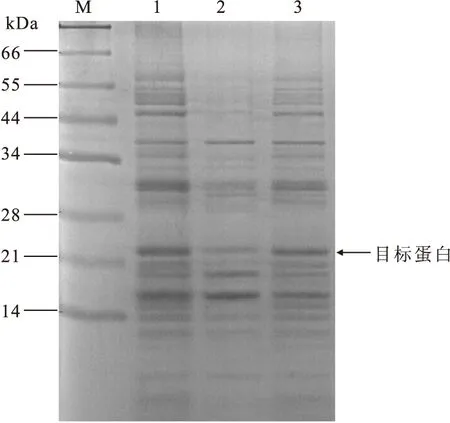
图2SDS-PAGE分析
注:M:蛋白质标准;1:pUC-OmpA-hGH/JM109诱导后总蛋白;2:pUC-OmpA-hGH/JM109诱导后周质分泌蛋白;3:pUC-OmpA-hGH/JM109诱导后胞内表达蛋白
2.3Western印迹分析
在PVDF膜上呈现出特异性的反应条带,分子量大小为22 kD,与预期结果一致(图3)。

图3Western印迹分析
注:1:pUC-OmpA-hGH/JM109诱导后周质分泌蛋白;2:pUC-OmpA-hGH/JM109诱导后胞内表达蛋白
3 讨论
大肠杆菌是常用的基因工程菌之一,但其胞内表达易形成包涵体沉淀,导致胞内表达型大肠杆菌工程菌多肽产物活性不高、工艺流程复杂且不稳定。与胞内表达相比,在大肠杆菌周质空间中表达多肽类药物具有多方面的优点,如周质空间内含有一系列的酶,有利于多肽的正确折叠,可提高活性多肽的产量;周质空间的蛋白酶活性比胞内低,有利于多肽稳定地存在于周质空间;此外,周质空间蛋白质种类少,有利于多肽的浓缩和纯化[4-5]。但是,大肠杆菌自身的周质分泌系统不够完善,分泌能力比真核生物低,因此获得重组蛋白的周质高效分泌性表达面临诸多困难,主要表现为多肽跨膜输出能力不强,周质分泌量很难达到实验或工业生产的需求。为解决上述问题,以往人们将研究的重点放在宿主菌的改造、共表达和培养条件的优化,近年,研究工作主要侧重在应用信号肽和表达系统本身的调控元件来构建高效通用的周质分泌表达载体[6-8]。
本研究在课题组前期构建的具有大肠杆菌强启动子lpp的表达载体pUC18-lpp基础上,利用大肠杆菌细胞内固有的天然信号肽OmpA,构建了具有lpp强启动子、RBS核糖体结合元件、OmpA信号肽编码序列的新型分泌型原核表达载体pUC-OmpA,并通过分子克隆获得含有密码子优化的生长激素编码序列的pUC-OmpA-hGH,转化大肠杆菌JM109菌株并验证了hGH的周质分泌性表达特质。SDS-PAGE、Western印迹分析结果显示,pUC-OmpA是1种较为高效的周质分泌型原核表达载体,基于该表达系统,hGH可以实现43%的周质分泌效率,为探索多肽类药物的周质分泌性表达创造了条件。
课题组下一步将基于pUC-OmpA周质分泌型原核表达载体,开展其他多肽类药物的原核表达研究,并优化诱导表达和纯化工艺条件,以求取得更高、更稳定的外源基因周质分泌性表达效率。
[1] Pournejati R, Karbalaei-Heidari HR, Budisa N. Secretion of recombinant archeal lipase mediated by SVP2 signal peptide in Escherichia coli, and its optimization by response surface methodology[J]. Protein Expression & Purification, 2014, 101(3):84-90.
[2] Suzuki MF, Arthuso FS, Oliveira JE,etal. Expression, purification, and characterization of authentic mouse prolactin obtained in Escherichia coli, periplasmic space[J]. Biotechnology & Applied Biochemistry, 2012, 59(3):178-185.
[3] 萨姆布鲁克, 拉塞尔. 分子克隆实验指南[M]. 3版. 黄培堂,译. 北京:科学出版社, 2008:26-137.
[4] Yoon SH, Kim SK, Kim JF. Secretory production of recombinant proteins in Escherichia coli.[J]. Recent Patents on Biotechnology, 2010, 4(1):23-29.
[5] Mergulhão FJ, Summers DK, Monteiro GA. Recombinant protein secretion in Escherichia coli[J]. Biotechnology Advances, 2005, 23(3): 177-202.
[6] Velaithan V, Chin SC, Yusoff K,etal. Novel synthetic signal peptides for the periplasmic secretion of green fluorescent protein in Escherichia coli[J]. Annals of Microbiology, 2013, 64(2):1-8.
[7] Reichow SL, Korotkov KV, Gonen M,etal. The binding of cholera toxin to the periplasmic vestibule of the type II secretion channel[J]. Channels(Austin), 2011, 5(3):215-218.
[8] Sockolosky JT, Szoka FC. Periplasmic production via the pET expression system of soluble, bioactive human growth hormone[J]. Protein Expression & Purification, 2013, 87(2):129-135.
Construction and Application of A Secretory Prokaryotic Expression Vector Based on OmpA Signal Peptide
JiangYuliang1,LanPing1,LiYan1,YuYun2,MaoMingxing1,YangYaqiong2,YangPing2△.
1.SchoolofBiomedicalSciences,ChengduMedicalCollege,Chengdu610500,China; 2.SchoolofBasicMedicalSciences,ChengduMedicalCollege,Chengdu610500,China
ObjectiveTo construct a secretory prokaryotic expression vector of the periplasmic space of Escherichia coli and to verify its expression effect. MethodsThe secretory expression vector pUC-OmpA was constructed by inserting the synthetic nucleic acid fragments which contain the ribosomal binding element (RBS), signal peptide (OmpA) and multiple clone sites (MCS) on the basis of the expression vector pUC18-lpp. The gene encoding hGH was synthesized according to the preferential codons of Escherichia coli and was cloned into pUC-OmpA to construct pUC-OmpA-hGH. Subsequently, the recombinant plasmid was transformed into Escherichia coli JM109 and the expression effect in the periplasmic space was analyzed. ResultsThe results of SDS-PAGE and Western blot analysis showed that the molecular weight of the recombinant hGH was about 22 kD, which was consistent with the expected result. The results of BandScan software analysis showed that the secretory expression of hGH in the peripheral space was about 43% of total hGH protein. ConclusionThe secretory expression vector pUC-OmpA can be constructed on the basis of OmpA signal peptide, which can facilitate the prokaryotic expression of bioactive proteins.
Prokaryotic expression; Periplasmic space secretion; Signal peptide
10.3969/j.issn.1674-2257.2016.04.004
四川省科技厅应用基础研究项目(No:2015JY0205);国家级大学生创新实验计划项目(No:201313705003);成都医学院大学生创新实验计划项目(No:CXJS201309)
杨平,E-mail:920192655@qq.com
R34
A
网络出版地址:http://www.cnki.net/kcms/detail/51.1705.r.20160728.1836.026.html

